随着国内第1代新能源车进入淘汰期,动力电池“退役潮”正在袭来。动力电池报废不可避免会带来回收处理问题。安全、环保、高效地对废旧锂离子动力电池进行梯级利用和拆解回收是亟待解决的研究课题[1-4]。
三元动力电池因富含高价值镍钴资源,其循环利用研究也更多聚焦在镍钴金属的分离提取,处理方法通常可以分为火法和湿法2大类[5-13]。湿法冶金回收技术因其相对低能耗、环保而受到了越来越多的关注。浸出往往是湿法分离手段的第一道关键工序[1, 3, 9-10]。常用的浸出剂包括无机酸如H2SO4、HNO3和H3PO4等,有机酸如醋酸、柠檬酸和草酸等,以及无酸浸出剂NaCl和Na2S2O8等。锂电池废料中往往含有高价态的钴或锰的化合物,需要添加还原剂才能将高价金属离子溶解分离。
电动汽车对动力电池能量、功率以及安全性能需求越来越高,迎合市场需求的同时为最大化降低成本,电池生产制造商将多种电池正极材料按不同需求搭配成混合电极(如钴酸锂+锰酸锂;钴酸锂+镍钴锰酸锂;锰酸锂+镍钴锰酸锂等)[14-19]。实际上回收厂家收集到的锂电池废料种类早就不再单一,成分各异。大多数锂电废料的浸出研究只针对单一种类的正极材料[1-3, 13],混合废料浸出工艺的报道不多。不同锂离子电池废料包含的有价金属成分各异,材料本身结构也不尽相同,所需浸出条件必然存在差异,传统的单一类型正极废料的浸出工艺不再适用[1-2, 20-21]。
本论文根据目前动力电池市场上常见的正极材料混合类型,按不同质量比例设置了“钴酸锂+三元废料”和“锰酸锂+三元废料”2种不同类型的混合废料,探讨不同类型混合废料浸出的适宜工艺参数。试验采用还原酸浸法对一系列混合废料进行系统研究,主要考察还原剂、硫酸浓度、浸出温度及液固比等因素对浸出过程的影响,找出混合电池废料在不同混合类型和不同混合比例条件下的浸出规律。本研究为混合锂离子电池正极废料回收工艺的广泛适应性提供了参考思路。
1 实验部分 1.1 实验原料实验原料为广东佛山邦普镍钴循环有限公司提供的锂离子电池三元正极废料。该正极废料预先用粉碎机粉碎、筛分至60目,并在马弗炉中400 ℃低温热处理1 h。预处理后的三元废料主要成分为三元正极材料活性物质LiNi1/3Mn1/3Co1/3O2、黏结剂与导电剂乙炔黑和少量已破碎成小颗粒的单质铝(来自正极材料中的集流体铝箔)。锂离子电池LiCoO2钴酸锂和LiMn2O4锰酸锂正极材料由北京当升材料科技股份有限公司提供。实验过程中用到的试剂和相关药品:硫酸(北京化工厂)、无水亚硫酸钠(西陇化工股份有限公司),均为分析纯。
1.2 实验设备实验过程中用到的相关仪器设备:DF-101S集热式恒温加热磁力搅拌器,河南省予华仪器有限公司;JJ-1精密增力电动搅拌器,金坛市医疗仪器厂;CAAM-2001原子分光度计,上海光谱仪器厂;DV2001等离子耦合发射光谱仪,PE公司;精密天平Mettler Toledo XS105,美国梅特勒。此外还需要四口烧瓶等玻璃仪器若干以及铁架台、铁夹、坩埚和玛瑙研钵等。
1.3 实验路线还原酸浸具体实验步骤如下:活性物质为LiNi1/3Mn1/3Co1/3O2的三元正极废料分别与LiCoO2、LiMn2O4正极材料均按比例9∶1、3∶1、1∶1(三元废料与正极材料的质量之比)于玛瑙研钵中研磨2 h,分别得到3个混合比例下的2种类型混合电池废料。将混合正极废料和硫酸按预先设定好的液固比及硫酸浓度依次放入反应烧瓶中,控制反应温度与搅拌速率,先恒温反应30 min后加入还原剂亚硫酸钠,结束浸出反应并抽滤,浸出液定容以便分析金属离子浸出率。
浸出率公式为:
| $E = \frac{{I{V_{\rm{L}}}}}{{S{w_{{\rm{Me}}}}}} \times 100\% $ | (1) |
式(1)中:E表示浸出率;I表示元素含量分析测定值;VL表示定容的滤液体积;S表示原料质量;wMe表示混合原料中该金属元素质量分数。
1.4 表征和检测微量元素含量采用CAAM-2001原子吸收分光光度计份分析;痕量元素含量采用DV2001等离子耦合发射光谱仪分析。
1.5 单因素浸出实验过程理论分析 1.5.1 还原剂的选择锂离子电池正极废料中含有的钴、锰高价金属元素很难溶于水和硫酸溶液,所以一般采用还原酸浸法处理。二氧化硫、亚硫酸钠、铁粉、亚铁离子、双氧水、亚硝酸钠和葡萄糖母液水等是工业上浸出常用的还原剂[22],双氧水还原浸出的产物是氧气和水,是绿色高效又无污染的良好还原剂,但价格颇高,为方便操作和规模化应用,综合考虑回收流程的经济性,本研究采用Na2SO3亚硫酸钠作为浸出正极废料适宜的还原剂,以期获得满意的浸出效果。实验过程具体考察无还原剂、添加还原剂、还原剂过量等情况下金属离子浸出率的变化规律。
1.5.2 浸取剂的选择酸是最常用的一种浸出剂。浸出研究中常见的酸有硫酸、盐酸和硝酸等。硫酸价廉,设备腐蚀问题易解决,对环境相对友好,且硫酸沸点高,可在常压高温下进行浸出,以获得较大的浸出速率和较高的浸出率。盐酸也是工业上经常采用的浸出剂。盐酸溶液中氯离子处于最低氧化态,具有一定的还原性,它能与多种金属化合物发生反应生成溶解度较大的氯化物。盐酸的反应能力比硫酸强,不过使用过程中会产生有毒氯气、操作劳动条件差、设备腐蚀严重,造成后续处理废气和维护设备成本高;与盐酸类似,硝酸作为浸出剂,同样会产生污染环境的氮氧化物。综合考虑回收工艺经济性和工业实践的可操作性,本论文选择硫酸体系作为混合电池废料的浸出剂。实验中硫酸浓度的范围是建立在H2SO4理论浓度的计算基础上(化学计量学和废料中主要金属元素成分),过高酸浓度不仅浸出率不会有明显提高,反而会降低浸出过程的经济指标。因此,在研究H2SO4浓度对正极废料还原酸浸的影响之前,首先根据电池废料的成分及化学计量计算了H2SO4理论浓度和,同时参考了文献中普遍使用的浓度区间以及课题组前期研究成果[1, 22-25],选取了单因素实验中一系列H2SO4浓度区间。
1.5.3 温度的选择对由化学反应速度控制的浸出过程而言,温度的影响更明显[1, 22, 25]。值得注意的是,温度提高到一定程度时金属浸出率的增加缓慢,而伴随温度的升高,通常杂质离子的溶解也会增加,因而热能消耗和浸出剂耗量也增加。对酸法浸出而言,温度升高设备的腐蚀加剧,因此温度的提高也宜适当。本研究考察了2种不同类型的混合废料,所以在温度区间的选取上稍有区别,大体上温度变化都是从接近室温到不超过90 ℃(超过90 ℃,水分蒸发过快,水浴过程较难控制恒温)。
1.5.4 液固比的选择在工业实践中,增大液固比是靠加大浸出槽容积达到的,这势必会增加设备投资,且浸出滤液中金属离子浓度太低不利于后续加工,液固比过大酸耗也大。为方便工业应用,浸出体系的液固比要尽可能小,以便增大设备处理能力和提高浸出滤液中有用金属浓度,同时降低浸出试剂的消耗,方便浸出滤液后续的中和处理。本研究液固比范围的选取主要参考了常见文献中的参数设置和课题组之前的研究基础。
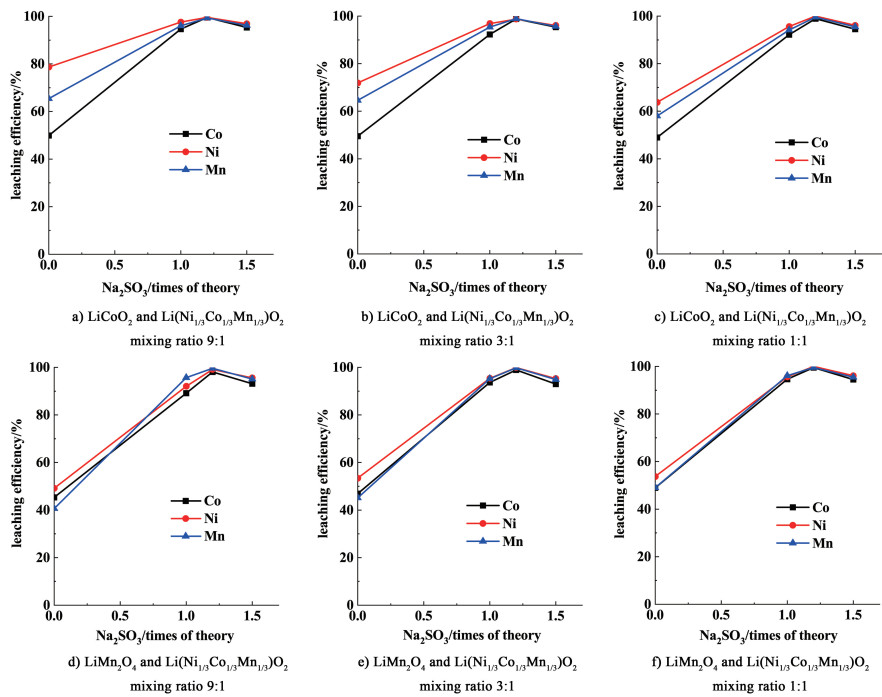
2 结果与讨论 2.1 还原剂用量对混合废料浸出的影响考察添加还原剂Na2SO3用量对2种类型的混合电池废料(混合废料中Li(Ni1/3Co1/3Mn1/3)O2三元废料与LiCoO2、LiMn2O4正极材料的质量之比分别为9∶1、3∶1、1∶1)浸出率的影响。在液固比R=8 mL·g-1、H2SO4浓度=2.3 mol·L-1、反应温度T=80 ℃、反应时间=90 min条件下,还原剂用量对混合废料浸出行为的影响见图 1,其中图 1a)~图 1c)表示的是LiCoO2与Li(Ni1/3Co1/3Mn1/3)O2混合废料,图 1d)~图 1f)则代表的是LiMn2O4与Li(Ni1/3Co1/3Mn1/3)O2混合废料。
|
| 图 1 还原剂Na2SO3用量对混合废料浸出过程的影响 Fig.1 Effect of the amount of reducing agent Na2SO3 on the leaching process of blended waste |
| |
从图 1可看出,还原剂Na2SO3的添加对有价金属浸出效果影响显著,各金属浸出率随Na2SO3加入量的增加而迅速增加。Na2SO3的还原作用使钴、锰容易与硫酸反应生成溶解度更大的低价态硫酸盐化合物,浸出率由此得到提高。一旦添加理论量还原剂,混合废料中Co的浸出率便可提高40%多,而Ni、Mn在理论量Na2SO3作用下的浸出率即可升高至95%左右。各金属浸出率在Na2SO3用量大于理论量后增幅减缓。Na2SO3在酸性环境中易分解出二氧化硫气体逸出,故还原剂Na2SO3的使用需过量,当还原剂用量超过理论量的1.2倍时,钴的浸出率反而开始降低,原因是Na2SO3溶解度有限,过量时便会析出不被溶解的部分钠盐,且被析出的这部分钠盐会在过滤时夹带走一部分金属离子而导致有价金属浸出率降低。所以,还原剂用量必须适中。在本实验条件下,2种混合类型正极废料还原浸出过程的比较适宜的用量均为理论用量的1.2倍,随着废料中LiCoO2和LiMn2O4正极材料比例的增加,Na2SO3还原剂的绝对用量增大。
2.2 硫酸浓度对混合废料浸出的影响浸出剂用量是浸出过程中非常重要的工艺参数,很大程度上决定工艺流程的经济合理性。电池废料酸浸时,浸出率随酸用量的增加而提高。但过量的酸并没有什么好处,有价金属浸出率在高酸度范围内变化并不明显,却很可能会增加铝铁铜等杂质离子的溶解,若此时再增加酸度,则有价金属离子浸出率改善有限只是增加试剂消耗,还会增大后面中和工序的碱用量。但剩余酸度太低又会使钴、镍、锰金属阳离子发生水解沉淀而降低浸出率,所以确定浸出工艺的最适宜酸度是非常必要的。
在液固比R=8 mL·g-1、还原剂Na2SO3用量=1.2倍理论量、反应温度T=60 ℃、反应时间=90 min条件下,以一系列浓度范围的H2SO4溶液浸出LiCoO2与Li(Ni1/3Co1/3Mn1/3)O2、LiMn2O4与Li(Ni1/3Co1/3Mn1/3)O2混合废料,考察H2SO4初始浓度对浸出过程的影响,结果如图 2中所示。图 2中图 2a)~图 2c)表示的是LiCoO2与Li(Ni1/3Co1/3Mn1/3)O2混合废料,图 2d)~图 2f)代表的是LiMn2O4与Li(Ni1/3Co1/3Mn1/3)O2混合废料。

|
| 图 2 H2SO4浓度对混合废料浸出过程的影响 Fig.2 Effect of H2SO4 concentration on the leaching process of blended waste |
| |
从图 2可看出,H2SO4浓度对不同类型和比例的混合电池废料浸出效果的影响较为一致:随着H2SO4浓度的增大,各金属浸出率也逐步提高,当H2SO4浓度为2.3 mol·L-1时,各混合比例下的2种类型的混合废料中镍钴锰3种金属离子的浸出率均超过98%。此时,继续增加H2SO4浓度对镍钴锰金属离子的浸出无较大影响;而当参与反应的酸量超出材料中镍钴锰等有价金属浸出所需要的酸量时,继续增加硫酸用量只会导致杂质浸出率增大,综合考虑后,2种混合类型的电池正极废料还原酸浸较适宜的H2SO4浓度设定为2.3 mol·L-1。
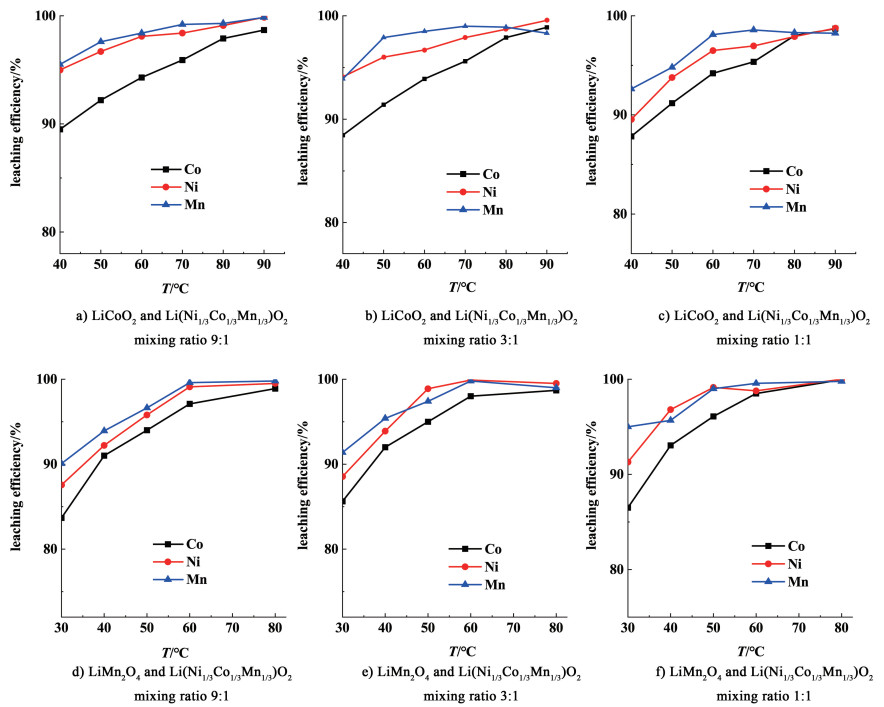
2.3 温度对混合废料浸出的影响伴随温度的升高,通常杂质离子的溶解也会增加,因而热能消耗和浸出剂耗量也增加。对酸法浸出而言,温度升高设备的腐蚀加剧,因此温度的提高也宜适当。在40~90 ℃温度区间内考察Li(Ni1/3Co1/3Mn1/3)O2与LiCoO2混合电池废料的浸出规律、在30~80 ℃温度区间内考察Li(Ni1/3Co1/3Mn1/3) O2与LiMn2O4混合电池废料的浸出规律,浸出率随浸出温度变化如图 3所示。其中图 3a)~图 3c)表示的是Li(Ni1/3Co1/3Mn1/3)O2与LiCoO2混合废料,图 3d)~图 3f)则代表的是Li(Ni1/3Co1/3Mn1/3)O2与LiMn2O4混合废料,其他条件为:液固比R=8 mL·g-1、还原剂Na2SO3用量=1.2倍理论量、H2SO4浓度=2.3 mol·L-1、反应时间=90 min。
|
| 图 3 温度对混合废料浸出过程的影响 Fig.3 Effect of temperature on the leaching process of blended waste |
| |
由图 3可知,各金属离子浸出率随温度升高而升高。当温度到达60 ℃后,温度继续升高只对Co的浸出影响较为明显:Ni和Mn浸出率在60 ℃后受温度影响较小,2种类型的混合电池废料中Ni和Mn的浸出率在温度60 ℃左右均可达96%以上。对于2种混合类型的电池废料而言,温度高于60 ℃后,再提高浸出温度,钴浸出率的增幅减缓,而继续升温不仅增加能耗而且还会促进铁、铝、铜和镁等杂质离子的溶出。
2.4 液固比对混合废料浸出的影响液固比与浸出物料中有价金属的含量及金属化合物在水溶液中的溶解度有关。浸出速率通常随着液固比增大而加快,然而,在工业实践中,增大液固比是靠加大浸出槽容积达到的,这势必会增加设备投资,且浸出滤液中金属离子浓度太低不利于后续加工,液固比过大酸耗也大。为方便工业应用,浸出体系的液固比要尽可能小,以便增大设备处理能力和提高浸出滤液中有用金属浓度,同时降低浸出试剂的消耗,方便浸出滤液后续的中和处理。但液固比太小则势必增加溶液黏度,不利于浸出反应体系液固界面间的接触,会使得浸出率偏低。所以,浸出体系液固比的大小必须根据具体情况来设计。
液固比R对混合废料浸出行为的影响见图 4。图 4反映了液固比对混合废料浸出的影响:浸出率随液固比增大而明显增大,液固比增大后,浸出溶液中金属离子浓度减小,增强了浸出系统的传质性能,浸出率从而得到提高。不过,条件实验结果表明当液固比大于8 mL·g-1后,混合废料中各金属离子浸出率增幅均开始减小。综合考虑浸出工艺经济性和预期回收率,选择8 mL·g-1作为较合适的液固比。

|
| 图 4 液固比R对混合废料浸出过程的影响 Fig.4 Effect of liquid-solid ratio on the leaching process of blended waste |
| |
表 1对比分析了3种单一正极材料的浸出规律。由表 1可知,尖晶石型LiMn2O4正极材料的适宜反应参数所需要的还原剂用量、硫酸浓度、温度及液固比都要小于LiCoO2正极材料。与LiCoO2材料类似,Li(Ni1/3Co1/3Mn1/3)O2三元材料具备相对稳定的α-NaFeO2层状结构,其中所含的Co元素也可以起到稳定结构的作用[26],尖晶石结构的LiMn2O4正极材料结构稳定性逊于Li(Ni1/3Co1/3Mn1/3)O2。所以相对易浸出的LiMn2O4越多,所需的反应条件相对温和。钴酸锂LiCoO2、锰酸锂LiMn2O4正极材料和镍钴锰酸锂三元废料彼此间成分和结构均存在差异,与LiMn2O4正极材料相比,LiCoO2正极材料因结构稳定性和3价钴离子的难浸出特性,其还原酸浸过程需要在更高的硫酸浓度和温度、更大的液固比及更多还原剂消耗量的条件下才能达到满意的浸出效果。
| 浸出原料 | 还原剂用量/理论量倍数 | 硫酸浓度/(mol·L-1) | 温度/℃ | 液固比/(mL·g-1) |
| NCM | 1.20 | 2.3 | 80 | 8 |
| C | 1.20 | 2.8 | 80 | 8 |
| M | 1.15 | 2.5 | 60 | 6 |
| 注:表1中:NCM代表的是三元正极材料、C代表的是钴酸锂正极材料、M代表的是锰酸锂正极材料。 | ||||
综合分析2种组成的混合电池正极废料在不同实验因素下的浸出规律,发现2种混合类型的电池废料虽然最适宜浸出条件有些许不同,但与混合比例关系不大。LiCoO2与Li(Ni1/3Co1/3Mn1/3)O2组成的混合废料的适宜浸出参数为:浸出温度80 ℃、反应时间90 min、H2SO4浓度2.3 mol·L-1、R=8 mL·g-1、还原剂Na2SO3用量=1.2倍理论量,在此条件下,钴镍锰3种金属离子的浸出率均可高达98%。LiMn2O4与Li(Ni1/3Co1/3Mn1/3)O2组成的混合废料的最适宜浸出实验参数为:浸出温度60 ℃、反应时间90 min、H2SO4浓度2.3 mol·L-1、R=8 mL·g-1、还原剂Na2SO3用量=1.2倍理论量,在此较适宜的条件下,钴镍锰3种金属离子的浸出率可接近99%。与含有LiMn2O4的混合废料相比,含LiCoO2混合废料完全浸出所需要的温度更高。
| [1] |
Yang Y, Okonkwo E G, Huang G Y, et al. On the sustainability of lithium ion battery industry-A review and perspective[J]. Energy Storage Materials, 2021, 36: 186-212. DOI:10.1016/j.ensm.2020.12.019 |
| [2] |
李金辉, 郑顺, 熊道陵, 等. 废旧锂离子电池正极材料有价资源回收方法[J]. 有色金属科学与工程, 2013, 4(4): 29-35. Li Jinhui, Zheng Shun, Xiong Daoling, et al. Methods for valuable resource recovery from cathode materials of spent lithium ion battery[J]. Nonferrous Metals Science and Engineering, 2013, 4(4): 29-35. (in Chinese) |
| [3] |
Lei S, Zhang Y, Song S, et al. Strengthening valuable metal recovery from spent lithium-ion batteries by environmentally friendly reductive thermal treatment and electrochemical leaching[J]. ACS Sustainable Chemistry & Engineering, 2021, 9(20): 7053-7062. |
| [4] |
Yi C, Yang Y, Zhang T, et al. A green and facile approach for regeneration of graphite from spent lithium ion battery[J]. Journal of Cleaner Production, 2020. DOI:10.1016/j.jclepro.2020.123585 |
| [5] |
Yang Y, Huang G, Xu S, et al. Thermal treatment process for the recovery of valuable metals from spent lithium-ion batteries[J]. Hydrometallurgy, 2016, 165: 390-396. DOI:10.1016/j.hydromet.2015.09.025 |
| [6] |
Wang W, Zhang Y, Zhang L, et al. Cleaner recycling of cathode material by in situ thermite reduction[J]. Journal of Cleaner Production, 2020. DOI:10.1016/j.jclepro.2019.119340 |
| [7] |
Yang Y, Lei S, Song S, et al. Stepwise recycling of valuable metals from Ni-rich cathode material of spent lithium-ion batteries[J]. Waste Management, 2020, 102: 131-138. DOI:10.1016/j.wasman.2019.09.044 |
| [8] |
Yang Y, Song S, Lei S, et al. A process for combination of recycling lithium and regenerating graphite from spent lithium-ion battery[J]. Waste Management, 2019, 85: 529-537. DOI:10.1016/j.wasman.2019.01.008 |
| [9] |
Yang Y, Sun W, Bu Y, et al. Recovering valuable metals from spent lithium ion battery via a combination of reduction thermal treatment and facile acid leaching[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(8): 10445-10453. |
| [10] |
Zhang Y, Wang W, Fang Q, et al. Improved recovery of valuable metals from spent lithium-ion batteries by efficient reduction roasting and facile acid leaching[J]. Waste Management, 2020, 102: 847-855. DOI:10.1016/j.wasman.2019.11.045 |
| [11] |
Li J, Li X, Hu Q, et al. Study of extraction and purification of Ni, Co and Mn from spent battery material[J]. Hydrometallurgy, 2009, 99(1/2): 7-12. |
| [12] |
Lei S, Cao Y, Cao X, et al. Separation of lithium and transition metals from leachate of spent lithium-ion batteries by solvent extraction method with Versatic 10[J]. Separation and Purification Technology, 2020. DOI:10.1016/j.seppur.2020.117258 |
| [13] |
Wang W, Zhang Y, Liu X, et al. A simplified process for recovery of Li and co from spent LiCoO2 cathode using Al foil as the in situ reductant[J]. ACS Sustainable Chemistry & Engineering, 2019. DOI:10.1021/acssuschemeng.9b01564 |
| [14] |
李小平, 佟健. 基于尖晶石锰酸锂混合材料的应用[J]. 电池, 2005, 35(1): 35-36. Li Xiaoping, Tong Jian. The application of mixed material based on spinel LiMn2O4[J]. Battery Bimonthly, 2005, 35(1): 35-36. (in Chinese) |
| [15] |
唐致远, 邓艳波, 张娜, 等. LiCoO2对LiMn2-xMxO4正极材料的混合改性研究[J]. 化学通报, 2006, 69(4): 287-289. Tang Zhiyuan, Deng Yanbo, Zhang Na, et al. Advantage of blending LiCoO2 into LiMn2-xMxO4 cathode[J]. Chemistry, 2006, 69(4): 287-289. DOI:10.3969/j.issn.0441-3776.2006.04.020 (in Chinese) |
| [16] |
Kim H S, Kim S I, Kim W S. A study on electrochemical characteristics of LiCoO2/LiNi1/3Mn1/3Co1/3O2 mixed cathode for Li secondary battery[J]. Electrochimica Acta, 2006, 52(4): 1457-1461. DOI:10.1016/j.electacta.2006.02.045 |
| [17] |
Liu X, Zhu G, Yang K, et al. A mixture of LiNi1/3Co1/3Mn1/3O2 and LiCoO2 as positive active material of LIB for power application[J]. Journal of Power Sources, 2007, 174(2): 1126-1130. DOI:10.1016/j.jpowsour.2007.06.184 |
| [18] |
Kitao H, Fujihara T, Takeda K, et al. High-temperature storage performance of Li-ion batteries using a mixture of Li-Mn spinel and Li-Ni-Co-Mn oxide as a positive electrode material[J]. Electrochemical and Solid-State Letters, 2005. DOI:10.1074/jbc.M313257200 |
| [19] |
Ma Z, Yang X, Liao X, et al. Electrochemical evaluation of composite cathodes base on blends of LiMn2O4 and LiNi0.8Co0.2O2[J]. Electrochemistry Communications, 2001, 3(8): 425-428. DOI:10.1016/S1388-2481(01)00195-3 |
| [20] |
Yang Y, Song S, Jiang F, et al. Short process for regenerating Mn-rich cathode material with high voltage from mixed-type spent cathode materials via a facile approach[J]. Journal of Cleaner Production, 2018, 186: 123-130. DOI:10.1016/j.jclepro.2018.03.147 |
| [21] |
Yang Y, Liu F, Song S, et al. Recovering valuable metals from the leaching liquor of blended cathode material of spent lithium-ion battery[J]. Journal of Environmental Chemical Engineering, 2020. DOI:10.1016/j.jece.2020.104358 |
| [22] |
《浸矿技术》编委会. 浸矿技术[M]. 北京: 原子能出版社, 1994.
|
| [23] |
Wu F, Xu S, Li L, et al. Recovery of valuable metals from anode material of hydrogen-nickel battery[J]. Transactions of Nonferrous Metals Society of China, 2009, 19(2): 468-473. DOI:10.1016/S1003-6326(08)60297-6 |
| [24] |
Li L, Xu S, Ju Z, et al. Recovery of Ni, Co and rare earths from spent Ni-metal hydride batteries and preparation of spherical Ni(OH)2[J]. Hydrometallurgy, 2009, 100(1/2): 41-46. |
| [25] |
孙晓玮, 徐盛明, 李林艳, 等. 失效二次电池资源再生利用研究进展[J]. 有色金属, 2008, 60(4): 99-104. Sun Xiaowei, Xu Shengming, Li Linyan, et al. Advances in recycling technology research for spent secondary batteries as resource[J]. Nonferrous Metals, 2008, 60(4): 99-104. (in Chinese) |
| [26] |
吴宇平, 袁翔云, 董超. 锂离子电池应用与实践[M]. 2版. 北京: 化学工业出版社.
|
 2021, Vol. 38
2021, Vol. 38





