对氯苯酚(p-chlorophenol,4-CP)在制药业,染织业以及煤化工业有着广泛的应用,其排放量较大、毒性较强且难以自然降解,处理不达标的废水会污染水生生物并致使附近居民肺水肿乃至死亡[1-3]。目前降解4-CP废水的方式有生物酶降解法[4]、膜分离法[5]、吸附萃取法[6]以及高级氧化法[7]。高级氧化技术(AOPs)是指利用体系产生的羟基自由基(·OH,氧化还原电位为2.80 eV)等强氧化粒子作为主要氧化组分,实现非选择性降解污染物。光催化氧化体系和臭氧氧化体系均属于AOPs,其中以TiO2作为催化剂的光催化体系在降解4-CP时由于电子-空穴的复合率较高无法实现高效率的降解[8]。O3作为主降解体系的优势是降解效率较高[9-10],且不需要对反应溶液进行后续操作,例如在Fenton法降解过程中,需要对铁离子进行额外分离操作。
促进臭氧氧化体系激发更多的自由基来参与反应是当前的研究热点。Qiu等[11]在降解硝基酚时将臭氧体系和电解体系结合来强化反应,反应60 min时,废液的TOC去除率为91%,有效提高了酚类废水的矿化速率。He等[12]在臭氧体系中加入了天然水镁石以及氧化镁2种非均相催化剂来降解苯酚,结果发现水镁石催化臭氧体系是以臭氧分子氧化机理为主,而氧化镁催化臭氧体系则是以·OH为主要氧化粒子[13]。Gema等[14]通过溶胶凝胶法制备了不同晶型的二氧化钛并与臭氧相结合来降解苯酚废水,结果表明臭氧光催化的结合能够在提高酚类废水降解效率的同时有效提升TOC去除率。Chen等[15]采用非均相催化剂联合低浓度臭氧体系降解对氯苯酚,当催化剂投加量为1.0 g ·L-1臭氧浓度为2.5 mg ·L-1时,其体系的一级动力学常数为单独臭氧氧化反应的4.8倍左右。光催化联合低浓度臭氧氧化体系能够有效促进氯酚类有机物的降解, 具有良好的应用前景。
降低臭氧尾气处理的成本以及促进臭氧体系产生更多的氧化自由基是当前需要解决的2大问题。本课题采用臭氧气路循环以降低原料成本减少尾气排放,并采用微量光催化辅助高浓度臭氧的方法来提高废水处理效率。旨在研究光催化辅助高浓度臭氧体系下的最适宜工艺参数及降解机理,为工业的废水降解提供可操作方法。
1 材料与方法 1.1 实验试剂与仪器所用的试剂均为分析纯,除二氧化钛(锐钛矿型,3~8 nm)采购于阿拉丁试剂有限公司外,其余均来源于国药集团化学制剂公司。
| 化学试剂种类 | 化学式 |
| 4-氯苯酚 | C6H5ClO |
| 二氧化钛 | TiO2 |
| 碘化钾 | KI |
| 硫代硫酸钠 | Na2S2O3 |
| 4-氨基安替比林 | C11H13N3O |
| 铁氰化钾 | K3[Fe(CN)6] |
| 氯化铵 | NH4Cl |
| 氨水 | NH3·H2O |
| 叔丁醇(TBA) | C4H10O |
| 三乙醇胺(TEA) | C6H15NO3 |
| 氢氧化钠 | NaOH |
| 重铬酸钾 | K2Cr2O7 |
| 浓硫酸 | H2SO4 |
| 氢氧化钠 | NaOH |
| 设备 | 型号/备注 | 生产厂家 |
| 臭氧发生器 | FL-820A | 深圳飞立电器有限公司 |
| 医用氧气罐 | φ=99.98% | 无锡太湖气体有限公司 |
| 紫外线灯管 | T5四针管 | 飞利浦电子公司 |
| 分光光度计 | UV 1800 | 日本岛津公司 |
| 台式离心机 | TGL-16C | 上海安亭科学仪器厂 |
| pH计 | El-20 | 梅特勒-托利多仪器(上海)有限公司 |
| 精密天平 | AR1140 | 梅特勒-托利多仪器(上海)有限公司 |
| 电热鼓风箱 | GZX-9146MBE | 上海博迅实业有限公司 |
| 气相-高通量飞行时间质谱仪 | Pegasus BT | 美国力可公司 |
实验装置由臭氧发生器、浮子流量计、多级调节气泵、反应罐(含有曝气盘,紫外线灯管以及气压传感器)、干燥管、三通阀、恒压阀以及紫外定波长检测仪等装置组成。氧气源为的医用氧气,出口压强调节为0.4(±0.05) MPa;反应罐的内径是172 mm,高为600 mm;干燥管内的活性炭以及硅胶颗粒用来吸收微量有机挥发产物和水蒸气;曝气盘为砂芯曝气盘(可产生微纳米级气泡)。
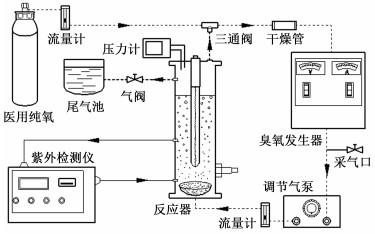
|
| 图 1 增压循环工艺装置原理图 Fig.1 Schematic of the supercharged-cycle reactor |
| |
先通入纯氧排除气路中的其他气体,然后维持0.2~0.4 L ·min-1的低流量的氧气供应,打开调节气泵,调节其循环流量。气体循环的路径为三通阀,干燥管,臭氧发生器,调节气泵,反应罐下端入口,反应罐顶部出口,然后再次流经三通阀进入到循环路径中。
1.3 降解过程表征以及分析方法调节4-CP的浓度为100 mg ·L-1,其初始pH值为6.7。根据需要使用2.0 mol ·L-1 NaOH调节pH值。固定反应温度为25(±1) ℃,在反应罐外围罩上铝箔做避光处理。反应罐中的液柱高约为350 mm,体积为8 L。对氯苯酚的浓度测定采用4-氨基安替比林法。酚类组分的降解过程采用一级动力学参数表示[16]。
| $ {\rm{ln}}({c_{\rm{0}}}/{c_{\rm{t}}}) = {\rm{ }}{k_{\rm{t}}} $ | (1) |
式(1)中:c0是指酚类物质的初始浓度,ct是指在某一时刻的酚类物质的浓度,mg ·L-1。kt为一级动力学系数,min-1。
通过扫描200~350 nm区间的紫外波谱的特征峰来判断相关中间产物的变化,并使用GC-MS对中间产物进行确认。苯醌类物质(对苯醌,邻苯醌)以及苯二酚类物质(对苯二酚,4-氯邻苯二酚,4-间苯二酚)是4-CP降解前期的主要中间产物[17-18]。对苯醌的特征峰波长为245 nm,本研究使用254 nm的紫外检测仪来定性测量对苯醌的生成趋势,水质COD指标采用重铬酸钾法测定。
2 结果与讨论 2.1 O3、TiO2/UV和O3/TiO2/UV对4-CP降解率的比较固定臭氧输出浓度为70 mg ·L-1,循环气体流量为2 L ·min-1,对O3、TiO2/UV和O3/TiO2/UV 3组降解体系进行试验。定时取样测定4-CP的浓度及pH值。
如图 2,O3/TiO2/UV体系对于4-CP的降解是较为高效的,且在前期具有显著的协同强化效果。如图 2所示,反应4 min时,O3、TiO2/UV和O3/TiO2/UV 3种体系的降解率分别为7.73%、54.36%和67.07%。He等[12]在降解同浓度的酚类废水时,催化剂投加量为5 g ·L-1臭氧浓度低于5 mg ·min-1时,催化臭氧体系耗时60 min时才能实现酚类废水的完全降解。4-CP在降解的过程中,会生成甲酸、果酸以及草酸等有机小分子[18],因此pH值的变化能够反映降解的状态。本实验中,O3/TiO2/UV体系的pH值下降幅度最大,在第28 min时维持在3.4左右,低于O3以及TiO2/UV体系的pH值,说明前者的降解效率要优于单独的O3体系以及光催化体系。
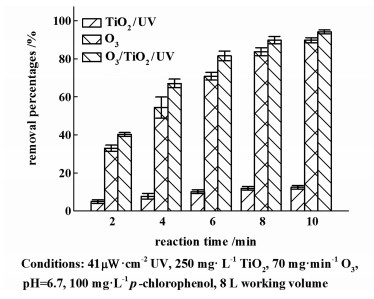
|
| 图 2 不同处理方式下的降解率 Fig.2 The removal percentage at different treatments |
| |
4-CP的降解过程基本符合一级动力学,光催化辅助臭氧体系的协同效应在反应常数上有着较为明显的体现。如图 3所示,本实验的O3/TiO2/UV体系的动力学常数为0.291 min-1,是O3体系的1.24倍。Gema等[14]通入20 mg ·L-1的臭氧并添加不同晶型的光催化剂二氧化钛来降解同浓度酚类废水,结果表明TiEt-A系列的臭氧光催化体系的动力学常数为0.0 301 min-1,仅为单独臭氧降解体系1.19倍。
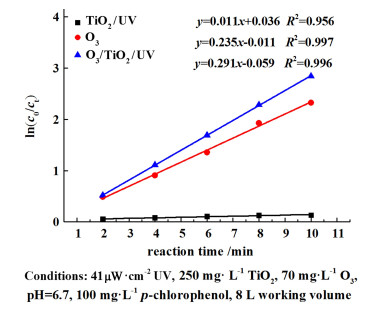
|
| 图 3 不同处理方式下的动力学拟合曲线 Fig.3 The kinetic fitting curve at different treatments |
| |
调节TiO2浓度为0、125、250、375和500 mg ·L-1,循环气体流量为2 L ·min-1,分组进行降解试验。定时取样并测定4-CP的浓度。间隔4 min在反应罐的取液处取反应液进行离心操作,并使用丙酮、甲醇清洗,最后进行干燥称量计算不同浓度的催化剂下的悬浮率。结果见图 4和图 5。
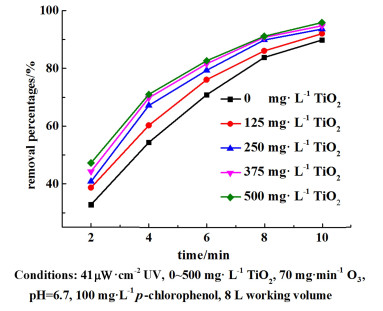
|
| 图 4 不同催化剂浓度下的降解率 Fig.4 The removal percentage at different catalyst concentrations |
| |
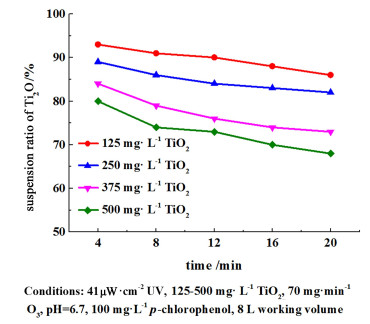
|
| 图 5 不同催化剂浓度下的悬浮率 Fig.5 Suspension properties at different catalyst concentrations |
| |
在0~500 mg ·L-1区间内TiO2浓度与降解效果呈正比,但是增长的趋势随着浓度的提升逐渐减弱,尤其是浓度大于250 mg ·L-1时。经激光粒度仪的测定,纳米二氧化钛在冷水中的中值粒径(DN50)为3~7 μm,该数值随着二氧化钛浓度的提高而增大。这是由于浓度提高会打破价键力和远程范德华力的受力均衡,进而加剧微细颗粒的团聚过程,导致体系的表面自由能总和降低[19]。同时浓度的提升会降低二氧化钛的悬浮率,从而造成了实际悬浮浓度的降低。如图 5,当浓度为250 mg ·L-1时,20 min的悬浮率保持在83%以上,而500 mg ·L-1时,其最终悬浮率仅为68%。本实验采用250 mg ·L-1作为试验标准投加量。
2.3 O3/TiO2/UV系统中臭氧循环流量对4-CP降解率的影响固定臭氧机功率不变,调节循环泵的循环流量为1.0、1.5、2.0、2.5和3.0 L ·min-1。记录臭氧机出口采气处的臭氧浓度和反应罐中的去离子水的臭氧浓度,臭氧水浓度采用靛蓝紫外分光法测定,气相臭氧浓度采用碘量法测定。同时测定循环流量为1.0、2.0和3.0 L ·min-1时,4-CP的降解率。结果见图 6和图 7。
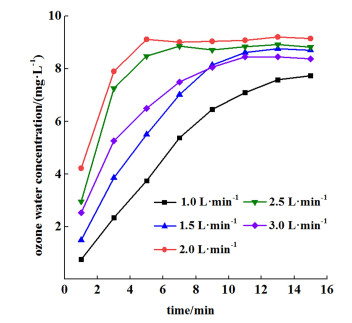
|
| 图 6 不同循环气量下的臭氧水浓度 Fig.6 Ozone water concentration at different circulating gas volumes |
| |
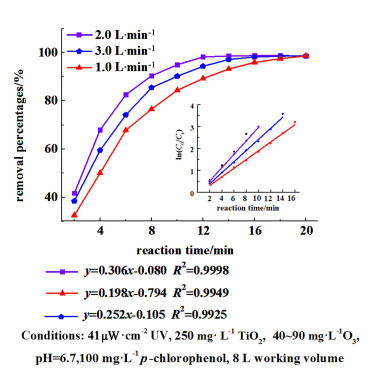
|
| 图 7 不同循环气量下的对氯苯酚降解率 Fig.7 The removal percentage of p-chlorophenol at different circulating gas volumes |
| |
如图 6所示,在臭氧机的气体流量为1~3 L ·min-1区间内,臭氧水浓度先升高在降低,在2 L ·min-1时,臭氧水的浓度最高也最快达到平衡状态。说明在2 L ·min-1时,气体的传质效果达到最佳。在1~3 L ·min-1区间内,循环流量与臭氧气体浓度呈反比,与臭氧总产量呈正比,2 L ·min-1时的臭氧浓度约为80 mg ·L-1。因为随着臭氧浓度的提高,具有热不稳定性的臭氧会急速衰减,造成电晕放电器的电能利用率迅速降低。
如图 7所示,4-CP的降解率在1~2 L ·min-1区间内递增,其中1 L ·min-1的循环流量下降解98.68%需要反应20 min,2 L ·min-1体系下降解98.22%仅需12 min。这是因为循环气量过低会导致气液传质的接触面积过少,其传质通量也随之降低。循环气量过高的话导致曝气盘生成的气泡体积过大,液体中的滞留时间急速降低。图 7附图所示,纵坐标的y为ln(c0/ct),横坐标x为时间;min。2 L ·min-1循环气量下的动力学方程为y=0.306x-0.080,其动力学系数为0.306 min-1,是1 L ·min-1以及3 L ·min-1时的1.5和1.2倍。接下来的实验中采用2.0 L ·min-1作为循环流量。
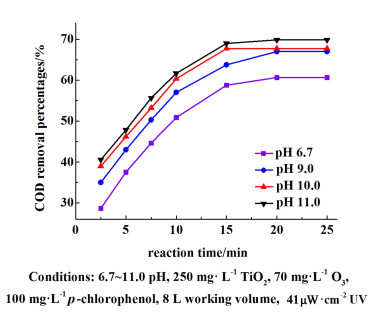
2.4 O3/TiO2/UV体系中初始pH值对4-CP降解效果的影响调节pH值为6.7、9.0、10.0和11.0,定时取样测定4-CP的降解率,并测定其COD指标。结果见图 8和图 9。
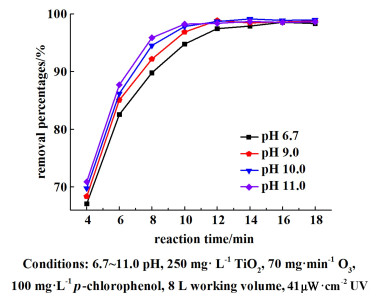
|
| 图 8 不同pH值下的对氯苯酚降解率 Fig.8 The removal percentage of p-chlorophenol at different pH |
| |
|
| 图 9 不同pH值下的COD解率 Fig.9 The COD removal percentage at different pH |
| |
pH值的变化对降解的影响较为显著,pH值在6.7~11.0区间内,降解率与pH值呈正相关。在反应的第10 min,pH值为11.0的降解率为98.21%,明显高于对照组的降解率。加入的氢氧根离子能够中和降解生成的有机酸,进而促进降解的正向反应。同时碱性环境也有利于臭氧体系产生更多的羟基自由基参与降解。
如图 9所示,pH值在6.7~11.0之间,COD的去除率与pH值呈正相关。当反应进行到10和25 min时,pH值为11反应体系的COD的降解率为61.68%和69.86%,比pH值为6.7时提高了10.82%和9.23%。该实验说明增大pH值能够一定程度提高O3/TiO2/UV体系对小分子有机物的降解效率。
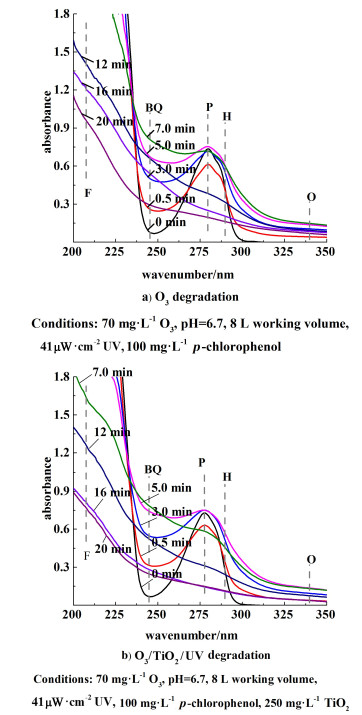
2.5 光催化辅助臭氧的中间产物分析 2.5.1 臭氧光催化的产物对0.5、3.0、5.0、7.0、12.0、16.0和20 min时O3以及O3/TiO2/UV体系的反应液进行扫频获取其吸光度, 扫频波谱为200~400 nm。结果见图 10。
|
| 图 10 降解过程的吸光度变化 Fig.10 The changes of absorbance during degradation |
| |
对氯苯酚(p-chlorophenol,P)的吸收峰在280 nm处。在210、245、289和340 nm左右出现的新的特征峰分别代表甲酸(formic acid,F,210 nm),苯醌(benzoquinone,BQ,245 nm),苯二酚(hydroquinone,H,289 nm)以及草酸(oxalic acid,O,340 nm)。这些特征峰部分出现了先增强再减弱的现象,说明在2个降解体系中,4-CP并非直接被分解为CO2和H2O,而是生成了一系列有机中间产物。如图 10,相比于单独的O3体系,O3/TiO2/UV体系在甲酸以及草酸的特征峰的衰减阶段更早达到稳定。这说明O3/TiO2/UV体系更有利于降解生成小分子有机酸产物的生成,也部分解释了碱性环境对4-CP以及COD降解的促进作用。此外,O3/TiO2/UV体系在降解苯醌时要比单独的O3体系更为迅速,也更早进入该物质的平衡。
GC-MS的结果显示,在反应的第2.5 min以及6.0 min时,除了4-CP之外,对苯醌和对苯二酚(表中的对二甲苯)以及4-氯邻苯二酚(表 3中的邻二甲苯)是最主要的中间产物。同时,同组数据内的对二甲苯和邻二甲苯的比值分别为2.24和2.30,这说明该体系下的降解路线倾向于生成对苯醌和对苯二酚。2, 6-二叔丁基对甲酚,2, 4-二叔丁基对甲酚和壬醛的出现说明在O3/TiO2/UV体系的降解过程中,苯环上的取代反应、开环反应是同步进行的,降解的主要中间产物有对苯醌和苯二酚类。
| Formula | Name | The components in 2.5th min | The components in 6.0th min | |||
| Area/% | CAS | Area/% | CAS | |||
| C8H10 | 对二甲苯 | 21.099 | 106-42-3 | 26.120 | 106-42-3 | |
| C8H10 | 邻二甲苯 | 9.797 | 95-47-6 | 11.321 | 95-47-6 | |
| C15H24O | 2,6-二叔丁基对甲酚 | 4.833 | 128-37-0 | 8.979 | 128-37-0 | |
| C14H22O | 2,4-二叔丁基苯酚 | 3.514 | 96-76-4 | 1.078 | 96-76-4 | |
| C9H18O | 壬醛 | 0.663 | 124-19-6 | 2.133 | 124-19-6 | |
| Note: Results only intra-group comparison. | ||||||
在4-CP的降解过程中由于苯醌类的产生和再降解会出现先变浅红色之后褪色的现象。作为主要的前置产物,BQ可以作为超氧阴离子自由基(·O2-)捕获剂进而反映出降解路线。因此本课题对反应液进行定波长(254 nm)测定以获取BQ的相对含量。
如表 4所示,与单独的O3体系相比,相同流量下的O3/TiO2/UV体系在降解BQ的过程中更为显著的。这说明催化剂表面的空穴效应产生的电子与水中的氧气分子反应生成了大量的·O2-。BQ在整个降解过程中是先累计之后再逐渐降解的,到达顶峰的时间(peaktime,PT)是由BQ生成的速率以及降解速率决定的, 降解顶峰的相对值(relative peak value,RPV)以及总降解时间(total removal time,TRT)均能够反映降解的过程。随着循环流量的增大,O3/TiO2/UV体系的PT逐渐缩短,RPV逐渐增大。2.0 L ·min-1的光催化辅助臭氧体系的TRT是最短的。这说明,在2.0 L ·min-1的循环流量下,BQ的降解效率较高。随着pH值的增大,BQ所需的PT逐渐下降,RPV逐渐增大,反应液的颜色从红色变为棕红色。pH值为11.0时,RPV达到最大,TRT变长,这说明碱性环境中的OH-的加入会促进·O2-的产生,进而造成BQ产物的浓度提升,但是pH值过高会破坏催化剂的凝聚状态以及表面活性,进而抑制BQ的降解过程。
| Treatments | pH | Circular flow/(L·min-1) | TiO2 dosage/(mg·L-1) | Quenchers dosage/(mg·L-1) | PT/min | RPV | TRT/min | |
| 1 | UV/TiO2 | 6.7 | 2.0 | 250 | NA | 52.0 | 0.471 | >30 |
| 2 | O3 | 6.7 | 2.0 | 250 | NA | 8.2 | 0.578 | 19.3 |
| 3 | O3/UV/TiO2 | 6.7 | 2.0 | 250 | NA | 6.5 | 0.668 | 16.5 |
| 4 | O3/UV/TiO2 | 6.7 | 10.0 | 250 | NA | 8.2 | 0.637 | 20.6 |
| 5 | O3/UV/TiO2 | 6.7 | 1.5 | 250 | NA | 6.9 | 0.689 | 17.9 |
| 6 | O3/UV/TiO2 | 6.7 | 3.0 | 250 | NA | 6.2 | 0.625 | 16.1 |
| 7 | O3/UV/TiO2 | 8.0 | 2.0 | 250 | NA | 5.9 | 0.640 | 16.0 |
| 8 | O3/UV/TiO2 | 9.0 | 2.0 | 250 | NA | 5.6 | 0.692 | 15.0 |
| 9 | O3/UV/TiO2 | 10.0 | 2.0 | 250 | NA | 4.8 | 0.775 | 13.4 |
| 10 | O3 | 10.0 | 2.0 | 250 | NA | 5.9 | 0.727 | 15.7 |
| 11 | O3/UV/TiO2 | 11.0 | 2.0 | 250 | NA | 4.6 | 1.000 | 14.8 |
| 12 | O3 | 11.0 | 2.0 | 250 | NA | 5.6 | 0.815 | 15.2 |
| 13 | O3/UV/TiO2 | 6.7 | 2.0 | 125 | NA | 7.8 | 0.603 | 18.5 |
| 14 | O3/UV/TiO2 | 6.7 | 2.0 | 375 | NA | 6.3 | 0.692 | 16.2 |
| 15 | O3/UV/TiO2 | 6.7 | 2.0 | 250 | 2.0 mmol·L-1 TBA | 6.9 | 0.732 | 16.8 |
| 16 | O3/UV/TiO2 | 6.7 | 2.0 | 250 | 4.0 mmol·L-1 TBA | 7.8 | 0.818 | 17.2 |
| 17 | O3/UV/TiO2 | 6.7 | 2.0 | 250 | 2.0 mmol·L-1 TEA | 8.9 | 0.640 | >30 |
| 18 | O3/UV/TiO2 | 6.7 | 2.0 | 250 | 4.0 mmol·L-1 TEA | 14.2 | 0.597 | >30 |
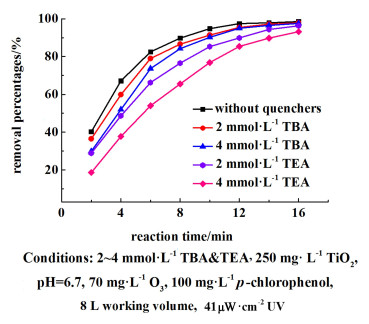
添加2和4 mmol ·L-1的羟基自由基猝灭剂叔丁醇(TBA),以及同浓度的电子给体牺牲剂三乙醇胺(TEA)来研究光催化辅助臭氧的降解机理,定时取样测定对氯苯酚的降解率。结果见图 11。
|
| 图 11 不同捕获剂下的对氯苯酚降解率 Fig.11 The removal percentage of p-chlorophenol at different quenchers |
| |
在反应的第4 min,2和4 mmol ·L-1 TBA的实验组的降解率相比对照组降低了7.28%和16.54%,其抑制效果随着时间而逐渐衰减,说明在反应前期由空穴效应产生的羟基自由基在降解过程中是占据主导的。随着反应的进行,pH值的逐渐降低,降解开始由臭氧分子主导,导致TBA的抑制效果减弱。加入牺牲剂TBE之后,4-CP降解率有着明显的下降,因为TBE在该体系中充当空穴消耗剂以及活性粒子消耗剂。在O3/TiO2/UV体系的降解过程中,高浓度O3是主要的降解源,TBE与4-CP一同被降解,造成4-CP降解率的大幅度降低。
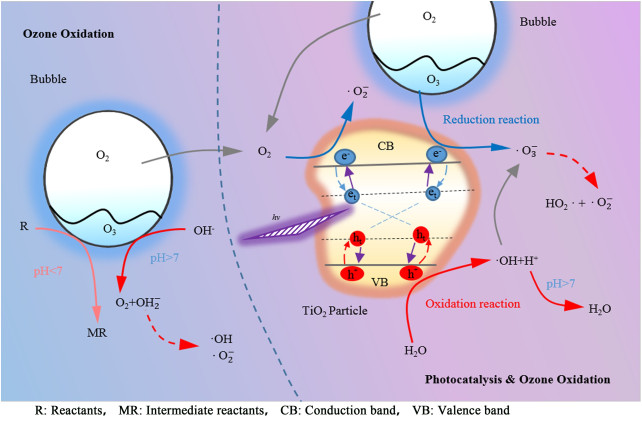
2.6.2 O3/TiO2/UV协同降解机理如图 12,O3/TiO2/UV的降解分为2部分:高浓度臭氧参与的主降解体系,光催化辅助臭氧的协同降解体系。臭氧降解4-CP前期,体系中pH值的偏向碱性或者弱酸性时,臭氧与OH-进行反应,产生了氧化还原电位更高的羟基自由基(·OH)以及超氧阴离子自由基(·O2-),但是在单独O3体系中,·OH产量有限。随着反应的进行,反应pH值呈酸性时,O3会倾向于以分子的形式降解4-CP及其中间产物。臭氧分子直接降解路线整体反应速率较慢,速率常数小于103 L ·mol-1 ·s-1[20]。本实验的O3/TiO2/UV体系中协同强化机理主要有2个方面:O2和O3分子直接参与电子消耗,降低了空穴-电子的复合率;空穴与水分子结合激发了羟基自由基,同时也促进了·O2-的产生。2个方面均能够促进反应体系产生更多的·OH以及·O2-。由纯氧作为气源进行降解时,O2和O3分子被电子还原,生成·O2-。在O2和O3还原生成·O2-的同时,也消耗电子降低了空穴-电子复合率,进而催生更多的空穴参与氧化反应。催化剂表面空穴促使水分子生成·OH以及氢离子。在空穴的氧化过程中,pH值的提高会以消耗氢离子的方式加速该反应的进行。
|
| 图 12 O3/TiO2/UV协同降解机理 Fig.12 O3/TiO2/UV synergistic degradation mechanism |
| |
1) 光催化辅助高浓度臭氧循环工艺的协同效果较为显著,一定条件下,其降解动力学系数为0.291 min-1,是单独O3体系的1.24倍;该工艺的降解效率较高,循环流量2.0 L ·min-1,pH值为11.0时反应10 min,4-CP和COD降解率分别为98.21%和61.68%。
2) 对苯醌和对苯二酚是本课题降解体系的主要中间产物。降解过程中,2, 6-二叔丁基对甲酚、2, 4-二叔丁基对甲酚和壬醛的出现说明在降解过程中,4-CP中苯环上的取代反应、开环反应是同步进行的。
3) 高浓度臭氧水是主降解体系,O2和O3分子消耗电子降低了空穴-电子的复合率来促进·OH以及·O2-的产生,进而提高4-CP、对苯醌和苯二酚类物质的降解。
| [1] |
Sprynskyy M, Lebedynets M, Namieśnik J, et al. Phenolics occurrence in surface water of the Dniester river basin (West Ukraine): Natural background and industrial pollution[J]. Environmental Geology, 2007, 53(1): 67-75. DOI:10.1007/s00254-006-0619-0 |
| [2] |
Imran M, Crowley D E, Khalid A, et al. Microbial biotechnology for decolorization of textile wastewaters[J]. Reviews in Environmental Science and Bio/Technology, 2015, 14(1): 73-92. DOI:10.1007/s11157-014-9344-4 |
| [3] |
Cheremisinoff N P. Agency for toxic substances and disease registry (ATSDR)[M]//Pollution Control Handbook for Oil and Gas Engineering. Hoboken, NJ, USA: John Wiley & Sons Inc., 2016
|
| [4] |
Ribeiro H B, Bampi J, Silva T C, et al. Study of phenol biodegradation in different agitation systems and fixed bed column: Experimental, mathematical modeling, and numerical simulation[J]. Environmental Science and Pollution Research, 2020, 27(36): 45250-45269. DOI:10.1007/s11356-020-10380-4 |
| [5] |
Yu Z, Feng X, Min X, et al. RGO/PDA/Bi12O17Cl2: TiO2 composite membranes based on Bi12O17Cl2: TiO2 heterojunctions with excellent photocatalytic activity for photocatalytic dyes degradation and oil: Water separation[J]. Journal of Materials Science: Materials in Electronics, 2019, 30(19): 18246-18258. DOI:10.1007/s10854-019-02179-y |
| [6] |
Fan X, Li S, Sun M, et al. Degradation of phenol by coal-based carbon membrane integrating sulfate radicals-based advanced oxidation processes[J]. Ecotoxicology and Environmental Safety, 2019. DOI:10.1016/j.ecoenv.2019.109662 |
| [7] |
王祥名, 吴松海, 王琮, 等. Cu2(NO3) (OH)3催化过硫酸盐降解苯酚[J]. 化学工业与工程, 2021, 38(1): 69-78. Wang Xiangming, Wu Songhai, Wang Cong, et al. Catalytic degradation of phenol by persulfate activation using Cu2(NO3)(OH)3[J]. Chemical Industry and Engineering, 2021, 38(1): 69-78. (in Chinese) |
| [8] |
Kondrakov A O, Ignatev A N, Frimmel F H, et al. Formation of genotoxic quinones during bisphenol A degradation by TiO2 photocatalysis and UV photolysis: A comparative study[J]. Applied Catalysis B: Environmental, 2014, 160/161: 106-114. DOI:10.1016/j.apcatb.2014.05.007 |
| [9] |
Ratnawati R, Enjarlis E, Husnil Y A, et al. Degradation of phenol in pharmaceutical wastewater using TiO2/pumice and O3/active carbon[J]. Bulletin of Chemical Reaction Engineering & Catalysis, 2020, 15(1): 146-154. |
| [10] |
Lee Y, Kovalova L, McArdell C S, et al. Prediction of micropollutant elimination during ozonation of a hospital wastewater effluent[J]. Water Research, 2014, 64: 134-148. DOI:10.1016/j.watres.2014.06.027 |
| [11] |
Qiu C, Yuan S, Li X, et al. Investigation of the synergistic effects for p-nitrophenol mineralization by a combined process of ozonation and electrolysis using a boron-doped diamond anode[J]. Journal of Hazardous Materials, 2014, 280: 644-653. DOI:10.1016/j.jhazmat.2014.09.001 |
| [12] |
He K, Dong Y, Li Z, et al. Catalytic ozonation of phenol in water with natural brucite and magnesia[J]. Journal of Hazardous Materials, 2008, 159(2/3): 587-592. |
| [13] |
Liotta L F, Gruttadauria M, Di Carlo G, et al. Heterogeneous catalytic degradation of phenolic substrates: Catalysts activity[J]. Journal of Hazardous Materials, 2009, 162(2/3): 588-606. |
| [14] |
Luna-Sanguino G, Tolosana-Moranchel A, Carbajo J, et al. Role of surrounding crystallization media in TiO2 polymorphs coexistence and the effect on AOPs performance[J]. Molecular Catalysis, 2020. DOI:10.1016/j.mcat.2020.111059 |
| [15] |
Chen J, Tian S, Lu J, et al. Catalytic performance of MgO with different exposed crystal facets towards the ozonation of 4-chlorophenol[J]. Applied Catalysis A: General, 2015, 506: 118-125. DOI:10.1016/j.apcata.2015.09.001 |
| [16] |
Kang Y, Kim M K, Zoh K D. Effect of nitrate, carbonate/bicarbonate, humic acid, and H2O2 on the kinetics and degradation mechanism of Bisphenol-A during UV photolysis[J]. Chemosphere, 2018, 204: 148-155. DOI:10.1016/j.chemosphere.2018.04.015 |
| [17] |
Akharame M O, Fatoki O S, Opeolu B O, et al. Comparative time-based intermediates study of ozone oxidation of 4-chloro- and 4-nitrophenols followed by LCMS-TOF[J]. Journal of Environmental Science and Health, Part A, 2020, 55(4): 385-401. DOI:10.1080/10934529.2019.1701340 |
| [18] |
王芳, 王雪芹, 程凯, 等. MoS2负载量对MoS2/TiO2光催化降解苯酚效率的影响及其作用机理研究[J]. 燃料化学学报, 2017, 45(8): 1001-1008. Wang Fang, Wang Xueqin, Cheng Kai, et al. Effect of MoS2 loading on the photocatalytic performance of MoS2/TiO2 nanocomposites in phenol degradation and the corresponding reaction mechanism analysis[J]. Journal of Fuel Chemistry and Technology, 2017, 45(8): 1001-1008. DOI:10.3969/j.issn.0253-2409.2017.08.014 (in Chinese) |
| [19] |
Murshed S M S, Leong K C, Yang C. Thermophysical and electrokinetic properties of nanofluids: A critical review[J]. Applied Thermal Engineering, 2008, 28(17/18): 2109-2125. |
| [20] |
Zhao L, Ma J, Sun Z. Oxidation products and pathway of ceramic honeycomb-catalyzed ozonation for the degradation of nitrobenzene in aqueous solution[J]. Applied Catalysis B: Environmental, 2008, 79(3): 244-253. DOI:10.1016/j.apcatb.2007.10.026 |
 2021, Vol. 38
2021, Vol. 38





