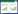自20世纪30年代菁染料的J-型聚集体被Jelly[1]和Schiebe[2]各自独立地发现以来,功能染料分子J-型聚集体的相关研究受到了广泛关注[3-8]。此类聚集体由于单体分子间的激子耦合作用,其吸收光谱和发射光谱的最大吸收峰和发射峰表现出大幅红移和锐化(相对于单体光谱),因而在感光化学、有机光导体和生物探针等领域有重要的应用价值。
功能分子形成J-型聚集体的主要驱动力是分子间的非共价相互作用,如π-π作用、氢键和静电作用等。文献表明,可以通过适当的分子设计对染料分子间的非共价相互作用进行调控,使其在自组装的过程中形成侧向滑移的堆积模式[9-11],从而形成J-型聚集体。例如,Zhang等设计合成了一类两亲性的酞菁染料分子,可形成高度有序的纳米管或带状J-聚集体[12-15]。在这些聚集体中,染料分子的堆积方式主要取决于疏水性烷基链和亲水性带电头基的相对大小。Würthner等则发展了一系列基于苝二酰亚胺染料分子的J-聚集体,其发色团“头-尾”相连的排列方式是通过分子2端酰亚胺基团之间的氢键相互作用实现的[16-18]。然而到目前为止,与菁染料J-聚集体具有相似性质的J-型聚集体,即形成的聚集体与单体相比,吸收光谱与发射光谱红移且吸收带锐化,并且荧光寿命降低,其实例依然非常少见。
氟硼二吡咯(BODIPY)和氮杂氟硼二吡咯(Aza-BODIP)类功能染料近年被广泛研究和报道,在有机凝胶[19-20]、溶液自组装[21-26]、荧光探针[27-29]、生物成像[30-33]等方面展现出重要的应用前景。本论文设计并合成了一种2, 6位具有尿嘧啶取代基的Aza-BODIPY染料,通过尿嘧啶基团之间的氢键相互作用,染料分子形成头尾相接排列的结构,使得分子的跃迁偶极矩呈现高度滑移的排列方式,从而使染料形成J-型聚集体。在此基础上,进一步对染料聚集体的光谱性质、聚集过程和机理以及聚集体形貌进行了研究。

|
| 图 1 尿嘧啶官能团修饰的Aza-BODIPY染料1的分子结构及其在双重氢键作用下的自组装示意图 红色箭头指示染料1分子的跃迁偶极矩 Fig.1 Molecular structure and double hydrogen bond directed self-assembly of uracil-functionalized Aza-BODIPY 1 (The red arrow indicates the transition dipole of dye 1) |
| |
实验过程中所用到的化学药品(原料,催化剂,中间体等)购自上海立科药物有限公司、天津市元立化工有限公司、天津希恩思生化试剂有限公司、利安隆博华(天津)医药化学有限公司、上海阿拉丁生化科技有限公司等。柱层析用硅胶(300~400目,100~200目)和中性氧化铝购自天津希恩思生化试剂有限公司。有机溶剂(分析纯或色谱纯)购自天津江天化学试剂有限公司,其中部分溶剂需要经预处理后使用。
1H NMR和13C NMR的测试使用AVANCE IIITM HD 400 MHz NanoBAY核磁共振波谱仪进行,内标为四甲基硅烷,测试温度298 K。紫外-可见吸收光谱测试采用配备控温装置(SPV1×1) 的Agilent Varian Cary 300紫外-可见分光光度计。荧光发射光谱测试采用Edinburgh Instruments FLS 980稳态瞬态荧光光谱仪,所有的光谱均进行了校正。红外光谱测试采用德国Bruker公司的Vertex70傅里叶变换红外光谱仪。
透射电镜(TEM)测试采用日本JOEL公司的JEM-1400FLASH的透射电子显微镜,加速电压为120 kV。测试样品的制备:将薄碳支持膜(300目)浸入Aza-BODIPY染料1的甲基环己烷溶液中(经UV/Vis光谱测试确认聚集体的形成),静置2 min后取出,用滤纸将碳支持膜上残留的溶液吸干,重复上述步骤3次。将碳支持膜浸入醋酸双氧铀的饱和水溶液中对样品染色,5 min后取出,用滤纸吸干染色剂,放在培养皿中充分晾干后测试。
1.2 合成路线如图 2所示,以查尔酮5为起始原料合成2, 6位碘取代的Aza-BODIPY前体2,首先将查尔酮5与硝基甲烷通过迈克尔加成反应得到加成产物4,之后4与醋酸铵共同加热发生偶联反应,得到的产物在碱性条件下与三氟化硼乙醚进行络合反应得到Aza-BODIPY前体3,之后用N-碘代丁二酰亚胺(NIS)与3发生碘代反应得到Aza-BODIPY前体2。1-辛基-6-乙炔基尿嘧啶的合成,则由1-辛基尿嘧啶9在正丁基锂的作用下与单质碘反应生成1-辛烷-6-碘尿嘧啶8,产物8与四甲基硅基乙炔进行偶联反应,生成的1-辛基-6-四甲基硅乙炔基尿嘧啶7在强碱性条件下脱去保护基团,即得到1-辛基-6-乙炔基尿嘧啶6。最终Aza-BODIPY前体2与1-辛基-6-乙炔基尿嘧啶6通过Sonogashira偶联反应生成目标化合物Aza-BODIPY染料1。具体实验方法及化合物表征如下。
|
| 图 2 Aza-BODIPY 1的合成路线,反应试剂和条件反应试剂和条件: a)CH3NO2,乙醇,二乙胺,回流12 h,产率95%;b)乙酸铵,120 ℃,12 h,BF3 ·Et2O,DIEA,无水DCM,室温,12 h,产率33%;c)NIS,醋酸,二氯甲烷,4 h,产率64%;d)THF,二异丙基胺,单质碘,正丁基锂,乙酸,-78 ℃~室温,12 h,产率70%;e)三甲基乙炔基硅,[(C6H5)3P]2PdCl2,CuI,三乙胺,THF,室温12 h,产率60%;f)氢氧化钾,甲醇,室温4 h,产率70%;g)[(C6H5)3P]2PdCl2,CuI,三乙胺,70 ℃,9 h,产率20% Fig.2 The synthetic route for Aza-BODIPY, reagents and conditions: a) CH3NO2, (C2H5)2NH, CH3CH2OH, reflow for 12 h, yield 95%; b) CH3COONH4, 120 ℃, 12 h, BF3 ·Et2O, (C2H5)3N, CH2Cl2, r.t., 12 h, 33%; c) NIS, CH2Cl2, CH3COOH, 4 h, 64%; d) THF, i-Pr2N, I2, n-LiBu, CH3COOH, -78—25 ℃, 12 h, 70%; e) Trimethyl silyl acetylene, [(C6H5)3P]2PdCl2, CuI, Et3N, THF, r.t., 12 h, 60%; f) KOH, CH3OH, r.t., 4 h, 70%; g) 6-ethynyl-1-n-octyluracil, PdCl2(PPh3)2, CuI, Et3N, 70 ℃, 9 h, 20% |
| |
化合物4:将查尔酮5(5.8 g,10.0 mmol)用乙醇溶解完全后,加入二乙胺(3.7 g,50.0 mmol)和硝基甲烷(3.1 g,50.0 mmol),在80 ℃下回流12 h。用薄层色谱(TLC)检测,待反应完全后,用二氯甲烷萃取,有机相用水洗涤3次,分出有机层后以无水硫酸镁干燥,过滤后将溶剂蒸干,所得粗产品通过柱色谱纯化,洗脱剂为二氯甲烷,最终得到黄色油状液体4(6.3 g,98%)。1H NMR (400 MHz, CDCl3) δ 7.88 (d, J=8.9 Hz, 2H), 7.17 (d, J=8.7 Hz, 2H), 6.90 (d, J=8.9 Hz, 2H), 6.84 (d, J=8.7 Hz, 2H), 4.80 (dd, J=12.3, 6.5 Hz, 1H), 4.63 (dd, J=12.3, 8.2 Hz, 1H), 4.20~4.09 (m, 1H), 4.01 (t, J=6.5 Hz, 2H), 3.91 (t, J=6.5 Hz, 2H), 3.35 (t, J=6.5 Hz, 2H), 1.77 (m, 4H), 1.49~1.41 (m, 4H), 1.29 (d, J=14.5 Hz, 34H), 0.89 (t, J=6.8 Hz, 6H)。
化合物3:取化合物4(6.4 g,10 mmol)和乙酸铵(13.5 g,175 mmol)混合置于500 mL圆底烧瓶中,在130 ℃下反应12 h,反应物颜色从淡黄色逐渐变成蓝黑色。用薄层色谱(TLC)检测,反应完全后冷却至室温,加入二氯甲烷溶解,加入水100 mL,多次水洗,并用饱和食盐水洗1次,有机相用无水硫酸镁干燥,过滤,滤液用旋转蒸发除去溶剂,用无水乙醇重结晶,得到中间产物。取中间产物4.0 g置于两口烧瓶中,将烧瓶内置换为氮气气氛,用注射器向烧瓶中加入二氯甲烷30 mL,二异丙基乙胺5 mL,将三氟化硼乙醚(3 mL)缓慢地逐滴加入圆底烧瓶中。滴加完毕后,在氮气气氛下室温反应24 h。TLC检测反应完全后, 用二氯甲烷萃取,有机相用水洗涤3次,再用无水硫酸镁干燥,最后过滤,蒸干溶剂所得粗产物以柱色谱分离纯化,洗脱剂为V(二氯甲烷) ∶V(石油醚)=1 ∶1(体积比),得到紫色固体3(2.0 g,33%)。1H NMR (400 MHz, CDCl3) δ 8.04 (d, J=8.6, 4.7 Hz, 8H), 6.96 (d, J=8.5 Hz, 8H), 6.91 (s, 2H), 4.02 (q, J=6.3 Hz, 8H), 1.81 (m, 8H), 1.44~1.21 (m, 72H), 0.88 (t, J=6.6 Hz, 12H)。
化合物2:将化合物3(200.0 mg,0.16 mmol)用二氯甲烷与醋酸的混合溶剂40 mL(3 ∶1)溶解,加入N-碘代丁二酰亚胺(91.1 mg,0.4 mmol),在30 ℃下反应4 h。用薄层色谱(TLC)检测反应完全后, 反应混合物依次用饱和硫代硫酸钠,饱和碳酸氢钠,饱和食盐水洗涤,有机相用无水硫酸镁干燥并过滤,蒸干溶剂后粗产物以柱色谱分离纯化,洗脱剂为V(二氯甲烷) ∶V(石油醚)=1 ∶2,得到蓝色固体2(152.2 mg,64%)。1H NMR (400 MHz, CDCl3) δ 7.84~7.76 (m, 4H), 7.69~7.61 (m, 4H), 6.95 (t, J=8.7, 8H), 4.00 (m, 8H), 1.83~1.77 (m, 8H), 1.53~1.11 (m, 72H), 0.93~0.84 (m, 12H)。
1.2.2 1-辛基-6-乙炔基尿嘧啶的合成化合物8:根据文献报道的方法合成[34],产率61%。1H NMR (400 MHz, CDCl3) δ 8.64 (s, 1H), 6.43 (s, 1H), 4.15~4.01 (m, 2H), 1.71 (qd, J=8.1, 5.3, 3.5 Hz, 2H), 1.41~1.27 (m, 11H), 0.99~0.82 (m, 3H)。
化合物7:在氮气保护下,在100 mL的双口瓶中加入双(三苯基膦)二氯化钯(20.0 mg,0.025 mmol),碘化亚铜(10.0 mg,0.05 mmol),化合物8(500.0 mg,1.4 mmol),之后用注射器加入四氢呋喃(20 mL)及三乙胺(5 mL),而后缓慢滴加三甲基硅基乙炔(560.0 mg,5.7 mmol),之后在室温下反应24 h。经TLC检测反应完全后,向反应混合物中加入10 mL水,用二氯甲烷萃取3次,无水硫酸镁干燥,有机相蒸干溶剂后所得粗产品用柱色谱分离纯化,洗脱剂为V(二氯甲烷) ∶V(乙酸乙酯)=7 ∶1,得到黄色固体7(183.3 mg,40%)。1H NMR (400 MHz, CDCl3) δ 10.24 (s, 1H), 5.91 (s, 1H), 3.95 (dd, J=9.0, 6.5 Hz, 2H), 1.68 (t, J=7.5 Hz, 2H), 1.33~1.23 (m, 11H), 0.96~0.80 (m, 4H), 0.27 (d, J=1.6 Hz, 9H)。
化合物6:在室温下,将化合物7(100.0 mg,0.3 mmol)溶于甲醇(10 mL)溶液中,加入氢氧化钾(0.2 g),继续搅拌3.5 h后,加入适量水,用二氯甲烷萃取3次,合并有机相并蒸干溶剂,粗产品用柱色谱分离纯化,洗脱剂为V(二氯甲烷) ∶V(乙酸乙酯)=9 ∶1,最终获得白色固体6(70.0 mg,91%) 1H NMR (400 MHz, CDCl3) δ 10.18 (s, 1H), 6.01 (s, 1H), 3.98 (t, J=7.8 Hz, 2H), 3.71 (s, 1H), 1.71 (q, J=7.3 Hz, 2H), 1.29 (dt, J=16.3, 5.1 Hz, 10H), 0.88 (t, J=6.6 Hz, 3H)。
1.2.3 Aza-BODIPY染料1的合成Aza-BODIPY 1:在氮气保护下,在双口瓶中依次加入将碘化亚铜(1.3 mg,0.006 7 mmol),双(三苯基膦)二氯化钯(9.4 mg,0.013 4 mmol),1-辛烷-6-乙炔基尿嘧啶(36.6 mg,0.134 0 mmol)和化合物2(100.0 mg,0.067 0 mmol),并用注射器加入三乙胺(5 mL),在75 ℃油浴中反应9 h。TLC检测反应完全后,向反应中加入20 mL水。用二氯甲烷(3×40 mL)萃取,有机相用水(3×40 mL)洗涤3次,并用无水硫酸镁干燥。蒸干溶剂所得到的粗产品用柱色谱分离纯化,洗脱剂为V(二氯甲烷) ∶V(甲醇)=40 ∶1,得到蓝绿色固体Aza-BODIPY 1(23.2 mg,20%)。1H NMR (400 MHz, CDCl3) δ 8.20 (s, 2H), 8.06 (d, J=8.3 Hz, 4H), 7.91 (d, J=8.4 Hz, 4H), 7.01 (t, J=8.8 Hz, 8H), 5.82 (s, 2H), 4.00~4.08 (dt, J=22.2, 6.7 Hz, 8H), 3.74 (t, J=6.0 Hz, 4H), 1.88~1.78 (m, 8H), 1.48 (d, J=7.2 Hz, 4H), 1.41~1.18 (m, 92H), 0.88 (t, J=6.8 Hz, 18H). 13C NMR (101 MHz, CDCl3) δ 154.04, 143.18, 130.71, 128.98, 117.93, 112.23, 107.23, 81.33, 73.74, 69.41, 40.34, 32.00, 31.93, 30.27, 29.84, 29.75, 29.69, 29.65, 29.62, 29.51, 29.44, 29.40, 29.35, 29.23, 26.14, 26.03, 22.68, 19.99, 17.44, 14.09。HRMS (ESI): calculated for C108H154BF2N7O8 [M+H]+ 1 728.274 5 m/z, found 1 728.274 1 m/z。
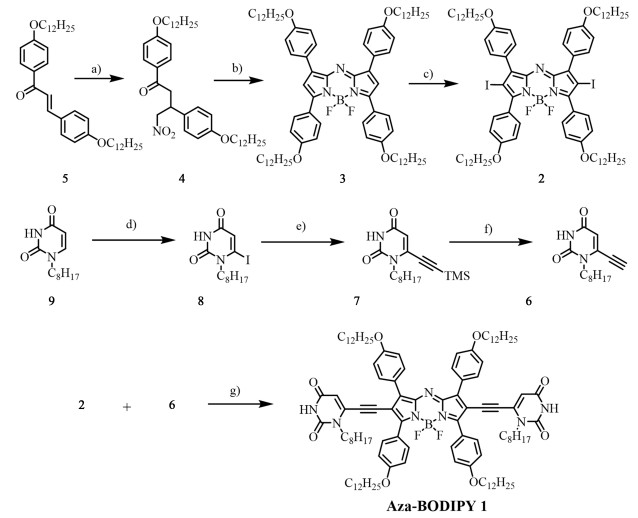
2 结果与讨论 2.1 Aza-BODIPY染料1在二氯甲烷溶液中的光谱性质图 3为Aza-BODIPY 1及其前体化合物2和3在CH2Cl2溶液中的紫外-可见吸收光谱。通过比较Aza-BODIPY前体3(λmax=697 nm)、Aza-BODIPY前体2(λmax=677 nm)以及Aza-BODIPY分子1(λmax=723 nm)的紫外-可见吸收光谱可以发现,前体3中2, 6位的氢原子被碘取代形成化合物2后,其最大吸收波长相对3发生了20 nm的蓝移,此现象与文献报道一致[35-36]。在分子2中引入炔基尿嘧啶基团后,Aza-BODIPY分子1的最大吸收波长相对于前体2发生了46 nm的红移。因此,上述染料的二氯甲烷溶液具有不同的颜色,化合物3的二氯甲烷溶液呈现出紫色,而在其2端引入碘原子以后,溶液颜色变为天蓝色,而加上尿嘧啶基团之后,染料1的溶液颜色则改变为蓝绿色。在二氯甲烷中1的摩尔吸收系数(ε)为9.9×104 L ·mol-1 ·cm-1,其光谱形状符合典型的Aza-BODIPY染料单体的光谱特征。
|
| 图 3 a) 染料化合物1,2,3在二氯甲烷溶液中(cT=1.0×10-5 mol ·L-1)的紫外-可见吸收光谱(黑色)及1的荧光光谱(红色);插图:化合物1,2,3的二氯甲烷溶液呈现不同颜色;b)染料化合物1的荧光衰减曲线 Fig.3 a) UV/Vis absorption spectra (black) of compounds 1, 2, 3 and fluorescence spectra of 1 (red) in CH2Cl2 at a concentration of 1.0×10-5 mol ·L-1; Inset: Solution color of compounds 1, 2, 3 in CH2Cl2 under daylight; b) Fluorescence decay of dye 1 |
| |
我们进一步对Aza-BODIPY 1的荧光性质进行了研究。如图 3a)所示,在二氯甲烷溶液中化合物1的荧光发射光谱与其紫外-可见吸收光谱呈镜像关系,其最大发射波长λmax在763 nm,Stokes位移为40 nm,以相对法测得Aza-BODIPY 1的荧光量子产率为0.19。在时间分辨荧光光谱[图 3b)]的测试中, 染料1呈现出双指数荧光衰减过程,其长寿命组分为13.8 ns (8.34%),短寿命组分为2.1 ns (91.66%),平均荧光寿命为3.0 ns。
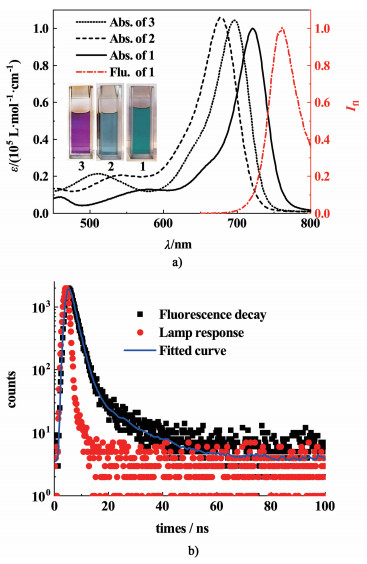
2.2 Aza-BODIPY染料1在甲基环己烷溶液中的聚集性质由文献[37]可知,非极性溶剂有利于分子间氢键相互作用。因此,我们进一步在甲基环己烷中对染料1的光谱性质进行了测试。如图 4所示,在8.0×10-7 mol ·L-1浓度下,最大吸收峰位于723 nm处, 荧光光谱的最大发射峰位于761 nm处,其光谱形状与染料分子1在二氯甲烷中[图 3a)]相同,因此1在此浓度下呈单体状态。随着化合物1浓度的增加,768 nm处出现新的吸收峰并逐渐上升,当浓度高于8.0×10-6 mol ·L-1后,光谱几乎不再变化。以上结果表明随着浓度的增加,染料分子1在溶液中形成了J-型聚集体。对该聚集体溶液进行荧光光谱测试,发现其最大发射峰相比于单体红移至825 nm[图 4c)],荧光量子产率为0.11。1的聚集过程可以进一步利用协同超分子聚合的Goldstein-Stryer模型进行分析[38-39]。如图 4b)所示,当拟合参数分别为KE=5.0×105 L ·mol-1,KN=2.5×103 L ·mol-1,s=2,σ=0.005时可以获得最佳的拟合结果,其中KE为生长阶段的平衡常数,KN为成核阶段的平衡常数,s为成核分子个数,σ为聚集过程的协同度(σ=KN/KE),σ≪1的结果表明Aza-BODIPY 1形成J-聚集体的过程具有高度的协同性。
|
| 图 4 a) Aza-BODIPY分子1在MCH中的变浓度紫外-可见吸收光谱图(8.0×10-7 mol ·L-1~1.0×10-4 mol ·L-1),箭头指示随浓度升高,光谱的变化方向;插图:染料1在MCH中聚集体溶液的照片;b)聚集体摩尔分数随浓度KEcT的变化图以及Goldstein-Stryer拟合曲线;c)染料1在不同浓度MCH溶液中的荧光光谱 Fig.4 a) Concentration-dependent absorption spectra of Aza-BODIPY 1 in MCH (cT=8.0×10-7 mol ·L-1 to 1.0×10-4 mol ·L-1). Arrows indicate the spectral changes with increasing concentration; Inset: Photograph of J-aggregates of 1 in MCH solution; b) Plot of the molar fraction of aggregated dye 1 molecules as a function of KEcT and the fitting curve applying Goldstein-Stryer model; c) Fluorescence spectra of aza-BODIPY 1 in MCH at different concentrations |
| |
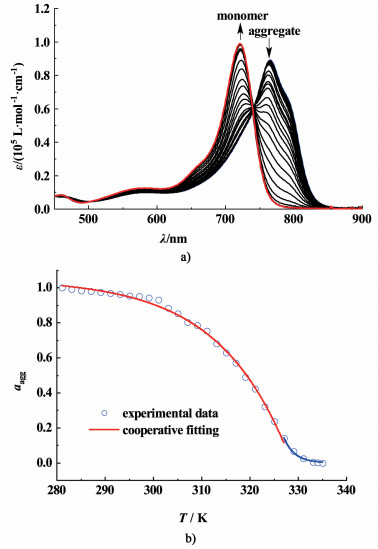
为了深入了解Aza-BODIPY分子1在甲基环己烷溶液中的J-聚集体形成机制,进一步对体系进行了变温紫外-可见吸收光谱的测试。如图 5a)所示,浓度为1.0×10-5 mol ·L-1的甲基环己烷溶液在6 ℃下,染料分子1呈现完全聚集状态,其最大紫外-可见吸收峰位于768 nm处。随着温度的逐渐升高,位于768 nm处的吸收峰逐渐降低,而在723 nm处出现了单体的吸收峰,且随着温度的升高,单体吸收峰逐渐增高,直到升温至65 ℃时,768 nm处的峰消失,说明1的J-聚集体在65 ℃下完全解聚。通过假设温度为6 ℃时呈聚集态的分子1的摩尔分数为100%,而在较高温度时(温度达到65 ℃时),呈单体状态的分子1的摩尔分数为100%,利用不同温度条件下溶液在768 nm处摩尔吸收系数,可以估算某一温度下聚集态染料分子的摩尔分数。所得数据可以进一步利用Meijer等提出的“成核-增长”模型[40-41]进行拟合,如图 5b)所示,可以获得如下参数:在浓度为1.0×10-5 mol ·L-1时,生长阶段的焓变ΔHe=-51.4 kJ mol-1,临界聚集温度Te=330 K,当温度高于该温度时,分子处于成核阶段,计算得到的无量纲的平衡常数Ka=1.2×10-4,相关系数R2=0.994。拟合结果表明1的J聚集过程可以由该模型很好地描述。
|
| 图 5 a) Aza-BODIPY分子1在MCH中的变温紫外-可见吸收光谱图(cT=1.0×10-5 mol ·L-1),箭头指示随着温度的升高,紫外-可见吸收光谱图的变化(6~65 ℃);b)聚集体摩尔分数随温度的变化图以及成核-生长模型的拟合曲线 Fig.5 a) Temperature-dependent UV-Vis absorption spectra of Aza-BODIPY 1 in MCH (cT=1.0×10-5 mol ·L-1), arrows indicate the spectra changes upon increasing temperature (6~65 ℃); b) Plot of the molar fraction of aggregated dye 1 molecules as a function of T and the fitting curve applying nucleation-elongation model |
| |
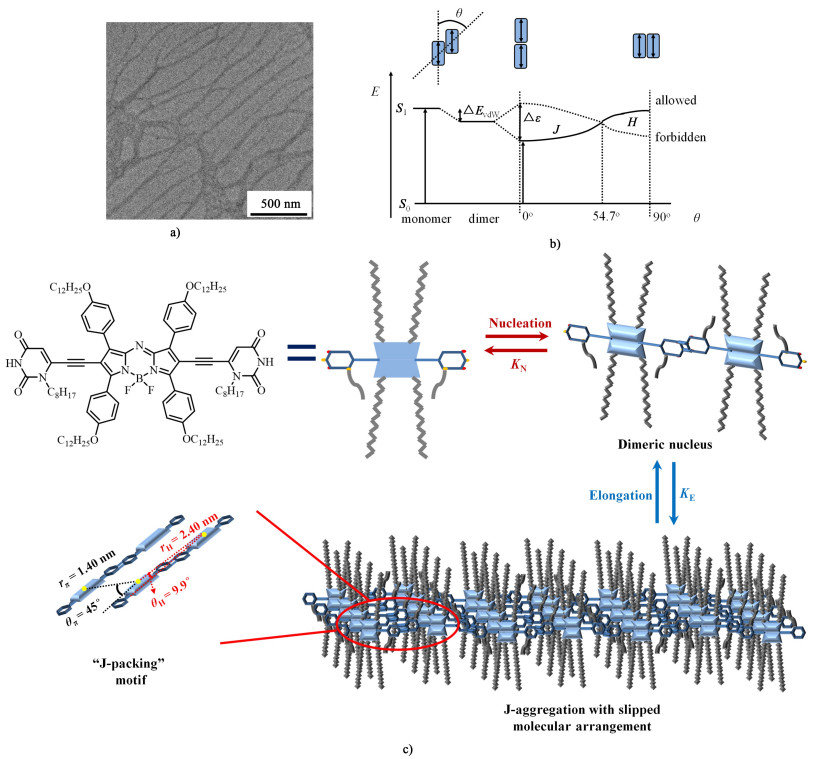
我们首先通过红外光谱(FT-IR)对染料1 J-型聚集体中的氢键相互作用进行了研究。结果发现,尿嘧啶基团上的C=O伸缩振动峰位于1 664和1 604 cm-1,与1, 3-二甲基脲嘧啶[42]的红外光谱相比发生明显的蓝移,同时3 417 cm-1处的N—H伸缩振动峰与脲嘧啶的红外光谱[43]相比信号大幅减弱,以上结果证实了J-聚集体中氢键的形成。[44]为了表征Aza-BODIPY 1在甲基环己烷溶液中形成的J-型聚集体的形貌,我们利用透射电镜对染料分子聚集体进行了测试,结果如图 6a)所示,Aza-BODIPY分子1形成的J-聚集体呈现纳米纤维状结构,其宽度约为50 nm,长度达到微米级。
|
| 图 6 a) 染料1形成J-型聚集体的透射电镜图;b)聚集体中相邻2分子发生激子耦合的能级示意图,2个分子的排列方式及角度定义见图上方;c)Aza-BODIPY分子1形成J-聚集体的组装机理及分子排列方式示意图 Fig.6 a) TEM images of Aza-BODIPY 1 aggregates; b) schematic energy diagram for exciton coupling between two molecules in aggregates; c) schematic illustration for aggregation mechanism of dye 1 and molecular arrangement in J-aggregate |
| |
由于染料分子形成J聚集体,其吸收光谱的红移可以通过Kasha等提出的激子耦合原理[5]进行解释[图 6b)]。根据该理论,聚集体跃迁能级的变化值取决于2个分子的偶极子之间的距离(r)和相对于堆积方向的偏移角度(θ),当偏移角度小于54.7°时,跃迁能级降低,此时吸收光谱发生红移,即形成J-型聚集体。光谱红移值(
| $ \Delta \tilde{v}_{\mathrm{ex}}<2 \frac{\varepsilon_{\mathrm{H}}}{h c}+2 \frac{\varepsilon_{\pi}}{h c} $ | (1) |
式(1)中:h为普朗克常量,c为光速,επ和εH分别为π-π堆积方向和氢键组装方向上的激子耦合造成的能级变化,可由公式(2)计算得到。
| $ \varepsilon=\frac{\left|\mu_{\mathrm{eg}}\right|^{2}}{4 \pi \varepsilon_{0} r^{3}}\left(1-3 \cos ^{2} \theta\right) $ | (2) |
式(2)中:ε0为真空介电常数,∣μeg∣为单体分子的跃迁偶极矩,根据染料1单体的吸收光谱,可以计算得到单体跃迁偶极矩为9.4 D。进一步利用公式(1)和(2)可以计算J-聚集体相对于单体光谱红移的大小,当氢键组装方向上相邻2分子之间的距离为rH=2.40 nm,偏移角度为θH=9.9°,π-π堆积方向上的距离rπ=1.40 nm,偏移角度为θπ=45°时,光谱的移动波数的计算值为-718 cm-1,与实验值-793 cm-1相符。根据以上计算得到的分子排列的距离和角度,我们绘制了染料1在J聚集体中的堆积模型,如图 6c)所示。染料1在聚集过程中,首先经过一个成核过程形成二聚体,该过程具有较小的平衡常数KN,然后在氢键和π-π堆积的协同作用下发生生长过程,该过程具有较大的平衡常数KE,最终形成具有一维纳米纤维结构的J-型聚集体。
3 结论设计并合成了一种2, 6位由炔基尿嘧啶基团修饰的新型Aza-BODIPY染料,通过1H NMR、13C NMR和质谱等方法对其化学结构进行了表征。研究表明,在非极性溶剂甲基环己烷中该新型染料分子可以通过分子间氢键相互作用形成J-型超分子聚集体。聚集体的形成伴随着紫外-可见吸收光谱的明显红移(Δλ=45 nm)。变温及变浓的的吸收光谱研究表明聚集体的形成过程符合成核-生长协同自组装机理,聚集体成核和生长过程的平衡常数KE=5.0×105 L ·mol-1,KN=2.5×103 L ·mol-1,且聚集体具有纳米纤维状形貌。通过激子耦合理论对聚集体光谱进行分析,得到了染料1分子在J-聚集体中的堆积结构。以上结果对于通过分子设计构筑基于新型染料分子单元的超分子J-型聚集体具有一定的指导意义。
| [1] |
Jelley E E. Spectral absorption and fluorescence of dyes in the molecular state[J]. Nature, 1936, 138(3502): 1009-1010. DOI:10.1038/1381009a0 |
| [2] |
Scheibe G. Über Die Veränderlichkeit der Absorptionsspektren in Lösungen und Die Nebenvalenzen als ihre Ursache[J]. Angewandte Chemie, 1937, 50(11): 212-219. DOI:10.1002/ange.19370501103 |
| [3] |
Cossarizza A. A new method for the cytofluorometric analysis of mitochondrial membrane potential using the J-aggregate forming lipophilic cation 5, 5', 6, 6'-tetrachloro-1, 1', 3, 3'-tetraethylbenzimidazolcarbocyanine iodide (JC-1)[J]. Biochemical and Biophysical Research Communications, 1993, 197(1): 40-45. DOI:10.1006/bbrc.1993.2438 |
| [4] |
Sugiyama S, Yao H, Matsuoka O, et al. Three-dimensional structure of J aggregates of pseudoisocyanine chloride dyes at a mica/solution interface revealed by AFM[J]. Chemistry Letters, 1999, 28(1): 37-38. DOI:10.1246/cl.1999.37 |
| [5] |
Kaiser T E, Stepanenko V, Würthner F. Fluorescent J-aggregates of core-substituted perylene bisimides: Studies on structure-property relationship, nucleation-elongation mechanism, and sergeants-and-soldiers principle[J]. Journal of the American Chemical Society, 2009, 131(19): 6719-6732. DOI:10.1021/ja900684h |
| [6] |
Hecht T Schlossarek M Stolte M, et al. Photoconductive core-shell liquid-crystals of a perylene bisimide J-aggregate donor-acceptor dyad[J]. Angewandte Chemie International Edition, 2019, 58(37): 12979-12983. DOI:10.1002/anie.201904789 |
| [7] |
Harada M, Yamamoto S, Yatsuhashi T, et al. Cooperative dissociation of J-aggregates into monomers in the 2-isobutoxyethanol/water binary solvent with the lower critical solution temperature[J]. Chemical Physics, 2020, 536: 110817-110826. DOI:10.1016/j.chemphys.2020.110817 |
| [8] |
Castriciano M A, Trapani M, Romeo A, et al. Influence of magnetic micelles on assembly and deposition of porphyrin J-aggregates[J]. Nanomaterials, 2020, 10(2): 187-192. DOI:10.3390/nano10020187 |
| [9] |
Ogi S, Sugiyasu K, Manna S, et al. Living supramolecular polymerization realized through a biomimetic approach[J]. Nature Chemistry, 2014, 6(3): 188-195. DOI:10.1038/nchem.1849 |
| [10] |
Changalvaie B, Han S, Moaseri E, et al. Indocyanine green J aggregates in polymersomes for near-infrared photoacoustic imaging[J]. ACS Applied Materials & Interfaces, 2019, 11(50): 46437-46450. |
| [11] |
Ma K, Wang R, Jiao T, et al. Preparation and aggregate state regulation of co-assembly graphene oxide-porphyrin composite Langmuir films via surface-modified graphene oxide sheets[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2020, 584: 124023-124032. DOI:10.1016/j.colsurfa.2019.124023 |
| [12] |
Zhang L, Jiang J, Liu M. Formation of silica nanotubes through a TPPS J aggregates template[J]. Chinese Science Bulletin, 2012, 57(33): 4322-4327. DOI:10.1007/s11434-012-5432-4 |
| [13] |
Qian Y, Gu Y, Feng J. Polymorphic monolayer and fibrillar nanostructures of J-aggregates of carbocyanine dye[J]. Materialovedenie, 2018, 12: 23-28. |
| [14] |
Ogul'Chansky T Y, Losytskyy M Y, Kovalska V B, et al. Interaction of cyanine dyes with nucleic acids. XVIII. Formation of the carbocyanine dye J-aggregates in nucleic acid grooves[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2001, 57(13): 2705-2715. DOI:10.1016/S1386-1425(01)00537-6 |
| [15] |
Harazi S, Kapon O, Sharoni A, et al. Direct formation of carbocyanine J-aggregates in organic solvent[J]. The Journal of Physical Chemistry C, 2019, 123(31): 19087-19093. DOI:10.1021/acs.jpcc.9b01116 |
| [16] |
Grande V, Soberats B, Herbst S, et al. Hydrogen-bonded perylene bisimide J-aggregate aqua material[J]. Chemical Science, 2018, 9(34): 6904-6911. DOI:10.1039/C8SC02409J |
| [17] |
Ghosh S, Li X, Stepanenko V, et al. Control of H- and J-type π stacking by peripheral alkyl chains and self-sorting phenomena in perylene bisimide homo- and heteroaggregates[J]. Chemistry-A European Journal, 2008, 14(36): 11343-11357. DOI:10.1002/chem.200801454 |
| [18] |
Kaiser T E, Scheblykin I G, Thomsson D, et al. Temperature-dependent exciton dynamics in J-aggregates: When disorder plays a role[J]. The Journal of Physical Chemistry B, 2009, 113(48): 15836-15842. DOI:10.1021/jp905246r |
| [19] |
Camerel F, Bonardi L, Ulrich G, et al. Self-assembly of fluorescent amphipathic boron dipyrromethene scaffoldings in mesophases and organogels[J]. Chemistry of Materials, 2006, 18(21): 5009-5021. DOI:10.1021/cm0611441 |
| [20] |
Camerel F, Ulrich G, Ziessel R. New platforms integrating ethynyl-grafted modules for organogels and mesomorphic superstructures[J]. Organic Letters, 2004, 6(23): 4171-4174. DOI:10.1021/ol048503n |
| [21] |
Li F, Zhang Y, Zhou L, et al. Synthesis and aggregation properties of boron-dipyrromethene dyes conjugated with guanine units[J]. Journal of Porphyrins and Phthalocyanines, 2018, 22(9/10): 944-952. |
| [22] |
Yang L, Fan G, Ren X, et al. Aqueous self-assembly of a charged BODIPY amphiphile via nucleation-growth mechanism[J]. Physical Chemistry Chemical Physics, 2015, 17(14): 9167-9172. DOI:10.1039/C5CP00207A |
| [23] |
Liu P, Gao F, Zhou L, et al. Tetrathienyl-functionalized red- and NIR-absorbing BODIPY dyes appending various peripheral substituents[J]. Organic & Biomolecular Chemistry, 2017, 15(6): 1393-1399. |
| [24] |
Fan G, Yang L, Chen Z. Water-soluble BODIPY and aza-BODIPY dyes: Synthetic progress and applications[J]. Frontiers of Chemical Science and Engineering, 2014, 8(4): 405-417. DOI:10.1007/s11705-014-1445-7 |
| [25] |
Chen Z, Liu Y, Wagner W, et al. Near-IR absorbing J-aggregate of an amphiphilic BF2-azadipyrromethene dye by kinetic cooperative self-assembly[J]. Angewandte Chemie International Edition, 2017, 56(21): 5729-5733. DOI:10.1002/anie.201701788 |
| [26] |
Wang H, Zhang Y, Chen Y, et al. Living supramolecular polymerization of an aza-BODIPY dye controlled by a hydrogen-bond-accepting triazole unit introduced by click chemistry[J]. Angewandte Chemie International Edition, 2020, 59(13): 5185-5192. DOI:10.1002/anie.201914966 |
| [27] |
Jiang X D, Li S, Guan J, et al. Recent advances of the near-infrared fluorescent aza-BODIPY dyes[J]. Current Organic Chemistry, 2016, 20(16): 1736-1744. DOI:10.2174/1385272820666160229224354 |
| [28] |
Zhao W, Carreira E M. Conformationally restricted aza-BODIPY: Highly fluorescent, stable near-infrared absorbing dyes[J]. Chemistry-A European Journal, 2006, 12(27): 7254-7263. DOI:10.1002/chem.200600527 |
| [29] |
Gao Y, Pan Y, Chi Y, et al. A "reactive" turn-on fluorescence probe for hypochlorous acid and its bioimaging application[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2019, 206: 190-196. DOI:10.1016/j.saa.2018.07.090 |
| [30] |
Parisotto S, Lace B, Artuso E, et al. Heck functionalization of an asymmetric aza-BODIPY core: Synthesis of far-red infrared probes for bioimaging applications[J]. Organic & Biomolecular Chemistry, 2017, 15(4): 884-893. |
| [31] |
Umezawa K, Citterio D, Suzuki K. New trends in near-infrared fluorophores for bioimaging[J]. Analytical Sciences, 2014, 30(3): 327-349. DOI:10.2116/analsci.30.327 |
| [32] |
Liu Y, Song N, Chen L, et al. Synthesis of a near-infrared BODIPY dye for bioimaging and photothermal therapy[J]. Chemistry-An Asian Journal, 2018, 13(8): 989-995. DOI:10.1002/asia.201701727 |
| [33] |
Chen Y, Zhang X, Cheng D, et al. Near-infrared laser-triggered in situ dimorphic transformation of BF2-azadipyrromethene nanoaggregates for enhanced solid tumor penetration[J]. ACS, 2020, 14(3): 3640-3650. |
| [34] |
Moriuchi T, Noguchi S, Sakamoto Y, et al. Synthesis and characterization of bioorganometallic conjugates composed of NCN-pincer platinum(Ⅱ) complexes and uracil derivatives[J]. Journal of Organometallic Chemistry, 2011, 696(5): 1089-1095. DOI:10.1016/j.jorganchem.2010.10.018 |
| [35] |
Guo S, Ma L, Zhao J, et al. BODIPY triads triplet photosensitizers enhanced with intramolecular resonance energy transfer (RET): Broadband visible light absorption and application in photooxidation[J]. Chem Sci, 2014, 5(2): 489-500. DOI:10.1039/C3SC52323C |
| [36] |
Adarsh N, Shanmugasundaram M, Avirah R R, et al. Aza-BODIPY derivatives: Enhanced quantum yields of triplet excited states and the generation of singlet oxygen and their role as facile sustainable photooxygenation catalysts[J]. Chemistry-A European Journal, 2012, 18(40): 12655-12662. DOI:10.1002/chem.201202438 |
| [37] |
Cabot R, Hunter C A, Varley L M. Hydrogen bonding properties of non-polar solvents[J]. Organic & Biomolecular Chemistry, 2010, 8(6): 1455-1462. |
| [38] |
Goldstein R F, Stryer L. Cooperative polymerization reactions. Analytical approximations, numerical examples, and experimental strategy[J]. Biophysical Journal, 1986, 50(4): 583-599. DOI:10.1016/S0006-3495(86)83498-1 |
| [39] |
Chen Z, Lohr A, Saha-Möller C R, et al. Self-assembled π-stacks of functional dyes in solution: Structural and thermodynamic features[J]. Chemical Society Reviews, 2009, 38(2): 564-584. DOI:10.1039/B809359H |
| [40] |
Smulders M M J, Schenning A P H J, Meijer E W. Insight into the mechanisms of cooperative self-assembly: The "sergeants-and-soldiers" principle of chiral and achiral C3-symmetrical discotic triamides[J]. Journal of the American Chemical Society, 2008, 130(2): 606-611. DOI:10.1021/ja075987k |
| [41] |
Jonkheijm P, van der Schoot P, Schenning A P H J, et al. Probing the solvent-assisted nucleation pathway in chemical self-assembly[J]. Science, 2006, 313(5783): 80-83. DOI:10.1126/science.1127884 |
| [42] |
Smets J, Graindourze M, Zeegers-Huyskens T, et al. FT-IR spectroscopic study of uracil derivatives and their hydrogen-bonded complexes with model proton donors. Part 5. Complexes of uracils with hydrogen chloride in argon matrices[J]. Journal of Molecular Structure, 1994, 318: 37-53. DOI:10.1016/0022-2860(93)07901-8 |
| [43] |
Mandal S, Das G, Askari H. Physicochemical properties of the ternary complexes of Pt(Ⅱ) with uracil and small peptide moieties: An experimental and computational study[J]. New Journal of Chemistry, 2015, 39(7): 5208-5217. DOI:10.1039/C5NJ00120J |
| [44] |
Kaiser T, Wang H, Stepanenko V, et al. Supramolecular construction of fluorescent J-aggregates based on hydrogen-bonded perylene dyes[J]. Angewandte Chemie, 2007, 119(29): 5637-5640. DOI:10.1002/ange.200701139 |
 2021, Vol. 38
2021, Vol. 38