2. 天津大学环境科学与工程学院, 天津 300350
2. School of Environmental Science and Engineering, Tianjin University, Tianjin 300350, China
苯酚(phenol)是一种对生物有强烈毒性的有机污染物[1]。化学工业排放的废水往往包括较高含量的酚类物质[2]。废水中苯酚的自然降解速度非常缓慢,10 mg·L-1的苯酚废水在pH值为7.0和10 ℃条件下经自然降解5 d后仅能去除75%[3]。在中国,饮用水中苯酚的最高允许浓度为0.002 mg·L-1 (GJ94-1999)。到目前为止,物理方法(萃取[4]、吸附[5-6]和液膜法[7])、生化方法(酶处理技术[8])、活性污泥法[9]和化学方法(电解[10]和氧化[1])已经被用于降解工业废水中的苯酚污染物。
高级氧化工艺(AOPs)是20世纪80年代出现的一种新型高效处理废水的技术。通过一些物理或化学方法的激活,活化过氧化氢或过硫酸盐等强氧化剂产生具有非选择性和强反应活性的各类活性物种,如硫酸根自由基(SO4·-)、羟基自由基(·OH)和氢过氧自由基(·OOH)[11]。这些高反应活性的活性物种可以将大多数有机化合物裂解成毒性较低的相对分子质量小的物质,并且最终将它们矿化成CO2和H2O[12]。H2O2在全pH范围内都具有较高的氧化还原电位(E0=1.8 V,pH=0;E0=0.87 V,pH=14.0)[13],并且其氧化能力可在过渡金属、O3和紫外光等催化作用下得到增强[14]。Haber和Walling等的研究[15-16]表明Fenton过程中存在一系列的链式反应来产生强氧化性·OH。
除了·OH外,过硫酸盐(persulfate)活化过程中产生的SO4·-也被广泛用于处理有机废水[17-19]。过硫酸盐具有较强的氧化能力(E0=2.01 V)[20]。它可以通过超声、热、光、碳材料、碱和过渡金属等方式活化,从而产生强氧化活性物种SO4·-(E0=2.5~3.1 V)。Wang等[21]认为在超声(120 W,20 kHz)下,0.5 g·L-1 0价铜和1 mmol·L-1过硫酸盐的体系在反应60 min后可以将20 μmol·L-1双酚AF完全降解。Lau等[22]提出UV/过硫酸盐体系可以在pH值为7.0和254 nm光照射下产生SO4·-进而完全矿化丁基羟基茴香醚。Moradi等[23]则使用了ZrO2/UV体系激活过硫酸盐形成SO4·-来使直接蓝71完全脱色。他们发现最适宜条件为pH=7,0.4 g·L-1 ZrO2,0.75 mmol·L-1过硫酸盐和40 min反应时间。Yang等[24]合成了一种颗粒状活性炭并应用于过硫酸盐体系中降解偶氮染料酸性橙7,观察到显著的协同效应。此外,碱活化过硫酸盐还能降解茴香醚,反应速率随着碱度的增加而增加[25]。Liu等[26]认为金属离子还可以通过增强SO4·-的生成来有效地加速污染物的降解。
近年来,以过硫酸盐为基础的AOPs处理酚类废水吸引了越来越多的研究兴趣。Lin等[27]研究表明,在pH值为3.0、7.0和11.0的条件下,通过UV活化过硫酸盐能有效降解0.5 mmol L-1苯酚而且没有二次污染,k值可达0.14~0.16 min-1。Lei等[28]合成了一种CuO-Fe3O4催化剂用于激活过硫酸盐降解苯酚。在这个体系中,pH值为11.0时反应2 h可使9.4 mg·L-1苯酚完全矿化而不会产生二次污染。此外,他们还发现体系中的主要活性物种是被吸附在催化剂上的硫酸根自由基以及催化剂表面的Cu(Ⅱ)在活化过硫酸盐后形成的Cu(Ⅲ)[28]。
Cu2(NO3)(OH)3(铜硝石)是一种存在于大自然中的含铜矿石,一般分为2种晶系(正交晶系和单斜晶系)[29]。先前已有研究将层状的Cu2(NO3)(OH)3用于催化过氧化氢降解偶氮染料[30]。Zhan等[30]使用Cu2(NO3)(OH)3在pH值为3.4~9.4条件下催化过氧化氢降解直接蓝15,反应30 min后降解率可以达到80%左右。相比于H2O2和过一硫酸盐,过硫酸盐具有化学稳定性高,运输、储存方便,成本低等优点。同时,非均相催化活化过硫酸盐的反应也更加经济、环保。Cu2(NO3)(OH)3已被用于催化H2O2降解有机污染物,但对活化过硫酸盐的研究尚未见报道。因此,本研究将主要探讨过硫酸盐和Cu2(NO3)(OH)3体系降解苯酚的效率和机理。
1 实验部分 1.1 实验试剂与仪器实验所用试剂详见表 1,所有试剂均为分析纯,阿拉丁化学试剂有限公司生产。实验所用仪器详见表 2。
| 化学试剂种类 | 化学式 |
| 硝酸铜 | Cu(NO3)2·3H2O |
| 硝酸铵 | NH4NO3 |
| 无水乙醇 | CH3CH2OH |
| 去离子水 | H2O |
| 氢氧化钠 | NaOH |
| 盐酸 | HCl |
| 苯酚 | C6H5OH |
| 过硫酸钾 | K2S2O8 |
| 甲醇 | CH3OH |
| 叔丁醇 | C4H10O |
| 叠氮化钠 | NaN3 |
| 对苯醌 | C6H4O2 |
| 5, 5-二甲基-1-吡咯啉-N-氧化物 | C6H11NO |
| 2, 2, 6, 6-四甲基-4-哌啶醇 | C9H19NO |
| 设备名称 | 设备型号 | 生产厂家 |
| pH计 | PHS-3C | 上海市精密科学仪器有限公司 |
| 电子天平 | BP121S | 天津市德盟科技有限公司 |
| 磁力搅拌器 | EMS-13 | 天津市欧诺仪器仪表有限公司 |
| 烘箱 | DHP-9272B | 上海一恒科学仪器有限公司 |
| 高速离心机 | TGL-16C | 上海市安亭科学仪器厂 |
| 冷冻干燥机 | LGJ-10 | 北京市四环科学仪器厂 |
| 电热恒温水浴锅 | DK-98-11A | 天津市泰斯特仪器有限公司 |
采用溶剂热法合成催化剂Cu2(NO3)(OH)3[30]。将4.8 g三水合硝酸铜和0.8 g硝酸铵缓慢加入60 mL的无水乙醇中,搅拌30 min。然后将搅拌后的悬浮液转移到1个100 mL水热釜中,在150 ℃下反应48 h。反应后得到的产物分别用经氮气除氧后的去离子水(3次)和无水乙醇(3次)洗涤,然后将产物收集放入真空烘箱中,保持在80 ℃下烘干8 h。制备好的样品在经过研磨后储存在厌氧手套箱中。
1.3 苯酚降解实验苯酚降解反应借助250 mL锥形瓶进行。将250 mg的Cu2(NO3)(OH)3和一定量的去离子水加入锥形瓶中,用1.0 mol·L-1 NaOH或HCl溶液来调节pH值到反应需要的pH值。然后将一定体积具有相同pH值的过硫酸盐溶液和苯酚溶液先后加入到锥形瓶内,搅拌均匀。锥形瓶被放置在1个设定温度为25 ℃,避光的恒温摇床中。摇床的转速设定为150 r/min。苯酚溶液加入的时间被设定为反应的起点,定时取样,取出的样品以7 000 r/min的速度离心3 min后取上清液。检测苯酚浓度及过硫酸盐含量;同时按照相同的实验条件,Cu2(NO3)(OH)3或过硫酸盐单独存在的对照组被用来明确体系对苯酚的氧化作用。所有反应均进行平行实验。最适宜的反应条件通过测试不同pH值、过硫酸盐用量和苯酚初始浓度来确定。
1.4 Cu2(NO3)(OH)3的表征及分析方法苯酚的浓度通过高效液相色谱(HPLC, SPD-M20 A 230 V CN)确定。色谱柱条件:C18柱(kromasil);流动相为V(水):V(甲醇)=6:4;流速:1.0 mL·min-1;检测器波长:270 nm;进样体积:20 μL;柱温:35 ℃。X射线衍射被用于确定制备的催化剂的晶体结构(XRD,D/max 2200/PC, Rigaku),以4 (°)/min的速度,从10°扫描到80°。电子扫描显微镜(SEM, MERLIN Compact)被用于观察催化剂的形貌。傅里叶红外光谱仪(FT-IR, Thermo Nicolet, Nexus)被用于确定合成的催化剂的官能团。我们还测定了溶液中总有机碳含量(TOC),反应开始后的0、10、60、120和240 min分别取20 mL样品,将悬浊液样品过0.22 μm有机滤膜除去固体残留物。将所得澄清液置于总有机碳分析仪(TOC-500, Shimadzu)中测量其TOC含量。Cu2(NO3)(OH)3的稳定性通过多次重复催化过硫酸盐降解苯酚实验来探究。每一轮实验结束后,将催化剂离心分离,水洗后用作下一轮反应催化剂。其余实验操作同1.3节苯酚降解实验,该过程进行5轮。溶液中铜离子残留量通过电感耦合原子发射光谱仪(ICP-AES, Varian 715)测定。电子顺磁共振波谱(EPR,Bruker, EMX 10/12)被用于探测反应过程中的活性氧物种。·OH和SO4·-被5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)捕获生成对应加合产物。因·OH对DMPO捕获超氧自由基(O2·-)存在干扰,而甲醇可以作为·OH淬灭剂,因此O2·-的捕获实验在1.0 mol L-1甲醇溶液中进行[31]。单线态氧(1O2)被2, 2, 6, 6-四甲基-4-哌啶醇(TMP)捕获生成对应加合产物。
2 结果与讨论 2.1 催化剂的表征采用XRD分析了所制备Cu2(NO3)(OH)3的晶体结构。从图 1上可以看出Cu2(NO3)(OH)3的主峰在2θ=5°~45°之间,与Cu2(NO3)(OH)3标准卡片(JCPDS, No.45-0594)一致,这说明我们成功合成了Cu2(NO3)(OH)3晶体。晶体的峰型较为尖锐,这表明合成的产物纯度较高,结晶度较好(图 1)。其中,2θ=6.4°和12.8°这2个衍射角分别对应了Cu2(NO3)(OH)3晶格内的(001)和(002)晶面。SEM分析(图 2)进一步表明,合成的Cu2(NO3)(OH)3形貌主要有颗粒状和片状2种,颗状形貌的直径范围主要是5~20 μm,片状形貌的长度约为10 μm,与文献报道的基本相同[30]。从样品的FT-IR图可以看出,催化剂在3 300~3 600 cm-1处表现出了较宽的吸收峰,这是明显的羟基吸收峰(图 3),其中3 544 cm-1处的吸收峰为样品结晶水中的羟基吸收峰;3 431 cm-1处的吸收峰为Cu2(NO3)(OH)3与羟基形成氢键后的特征峰(图 3)[32];880、775和674 cm-1为Cu—O—H键的特征峰;1 047、814和1 418 cm-1为NO3的特征吸收峰;2 342 cm-1处为CO2的特征峰(图 3)[33]。

|
| 图 1 Cu2(NO3)(OH)3的XRD分析图 Fig.1 X-Ray powder diffraction patterns of Cu2(NO3)(OH)3 |
| |

|
| 图 2 Cu2(NO3)(OH)3的扫描电子显微镜分析图 Fig.2 SEM analysis of the synthesized Cu2(NO3)(OH)3 |
| |

|
| 图 3 Cu2(NO3)(OH)3的傅里叶红外光谱图 Fig.3 FT-IR spectra of Cu2(NO3)(OH)3 |
| |
为了确定Cu2(NO3)(OH)3/过硫酸盐体系降解苯酚的动力学参数,利用式(1)对实验数据进行了准一级动力学拟合。
| $ \ln \left( {C/{C_0}} \right) = - kt $ | (1) |
k代表苯酚氧化准一级动力学常数,min-1;C和C0各自代表苯酚在反应的t时刻和初始时的浓度,拟合后的准一级动力学常数见表 3。并且对照试验发现,只有在Cu2(NO3)(OH)3和过硫酸盐共存时才会观察到较高的苯酚降解效率,缺少其一都不会发现苯酚的降解或者被吸附(见图 4)。
| catalyst dosage/(g·L-1) | persulfate dosage/(g·L-1) | presence of impurities | pH | k×10-2/min-1 | |
| 1 | 1.0 | 1.0 | 2.0 | 0.17 | |
| 2 | 1.0 | 1.0 | 3.0 | 0.42 | |
| 3 | 1.0 | 1.0 | 4.0 | 0.73 | |
| 4 | 1.0 | 1.0 | 5.0 | 1.52 | |
| 5 | 1.0 | 1.0 | 7.0 | 2.23 | |
| 6 | 1.0 | 1.0 | 8.0 | 3.11 | |
| 7 | 1.0 | 1.0 | 9.0 | 2.24 | |
| 8 | 1.0 | 1.0 | 10.0 | 2.61 | |
| 9 | 1.0 | 1.0 | 11.0 | 0.35 | |
| 10 | 1.0 | 1.0 | 12.0 | 0.14 | |
| 11 | 1.0 | 0.5 | 8.0 | 0.60 | |
| 12 | 1.0 | 2.0 | 8.0 | 2.59 | |
| 13 | 1.0 | 4.0 | 8.0 | 5.22 | |
| 14 | 0.5 | 1.0 | 8.0 | 1.07 | |
| 15 | 2.0 | 1.0 | 8.0 | 2.56 | |
| 16 | 1.0 | 1.0 | No Scavenger | 8.0 | 1.25 |
| 17 | 1.0 | 1.0 | 1.0 mol·L-1 Methanol | 8.0 | 0.39 |
| 18 | 1.0 | 1.0 | 5.0 mmol·L-1 BQ | 8.0 | 0.70 |
| 19 | 1.0 | 1.0 | 1.0 mol·L-1 TBA | 8.0 | 1.55 |
| 20 | 1.0 | 1.0 | 20.0 mmol·L-1 NaN3 | 8.0 | 0.76 |
| Note: Phenol concentration is 100 mg·L-1. | |||||

|
| 图 4 苯酚降解对照试验 Fig.4 Control experiment in the degradation of phenol |
| |
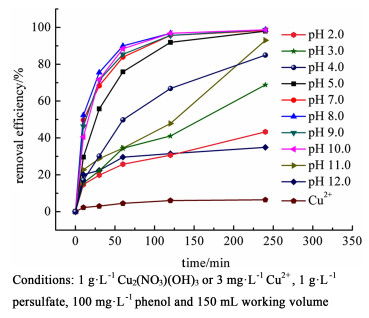
调整苯酚溶液的初始pH值从2.0到12.0来研究pH值对降解速率的影响。反应的准一级动力学常数,列于表 3中。
从图 5可以看出,在pH值为8.0时, 苯酚降解效率最好,此时的反应速率常数为3.11×10-2 min-1(表 3)。然而,当pH值大于10.0或小于5.0时,反应速率均有明显的下降。
|
| 图 5 不同pH值条件下苯酚降解效率及pH值为8.0时Cu2+活化过硫酸盐降解苯酚 Fig.5 5 The removal efficiency of phenol under different pHs and the activation of persulfate by Cu2+ at pH 8.0 on the removal efficiency of phenol |
| |
在pH值为8.0条件下,调整过硫酸盐用量从0.5~4.0 g·L-1来研究其对苯酚降解过程的影响(图 6,表 3)。反应的准一级动力学常数列于表 3中。

|
| 图 6 不同PS浓度条件下苯酚降解效率 Fig.6 The removal efficiency of phenol at different concentrations of persulfate |
| |
从图 6可以看出,在过硫酸盐浓度达到1.0 g·L-1时,反应进行彻底。继续加大过硫酸盐用量对于反应速率的提升不大。
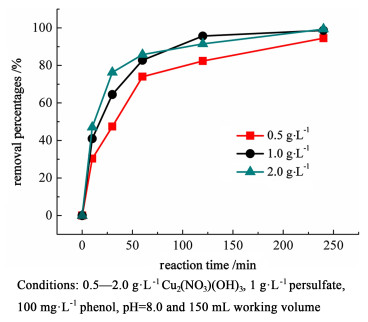
2.5 不同催化剂用量对Cu2(NO3)(OH)3催化过硫酸盐降解苯酚的影响在pH值为8.0, 过硫酸盐用量为1.0 g·L-1条件下,本研究考察了Cu2(NO3)(OH)3用量对苯酚降解速率的影响。反应的准一级动力学常数列于表 3中。
从图 7可以看出,当Cu2(NO3)(OH)3用量为1.0 g·L-1时,苯酚降解效率最佳。
|
| 图 7 不同催化剂浓度条件下苯酚降解效率 Fig.7 The removal efficiency of phenol at different dosage of Cu2(NO3)(OH)3 |
| |
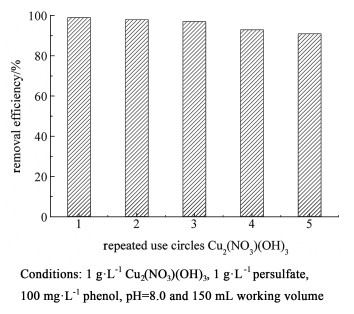
非均相反应可以实现催化剂的回收利用以及减少二次污染。因此,我们通过多次使用Cu2(NO3)(OH)3进行降解苯酚的实验对其进行了重复利用测试。在经过5次循环后,Cu2(NO3)(OH)3仍然保持了约90%的苯酚降解效率(图 8)。这表明催化剂有着良好的稳定性以及重复利用性能。我们也通过ICP-AES检测反应后溶液中的Cu2+析出量。结果发现,在pH值为8.0下反应4 h后,溶液中的Cu2+析出量约为3.0 mg·L-1。并且,我们向同样的过硫酸盐/苯酚体系中同样加入3.0 mg·L-1的Cu2+进行实验,反应4 h后没有发现明显的苯酚氧化(图 5)。因此,可以证明Cu2(NO3)(OH)3具有良好的重复利用性以及析出的Cu2+对于过硫酸盐的激活在本研究中没有起明显的作用。
|
| 图 8 Cu2(NO3)(OH)3降解苯酚的循环实验 Fig.8 The repeated cycles of Cu2(NO3)(OH)3 in the degradation of phenol |
| |
我们通过测定溶液中TOC的变化来确定苯酚降解过程中是否产生二次污染。反应条件为:pH值为8.0,苯酚初始浓度为100 mg·L-1,1 g·L-1的Cu2(NO3)(OH)3和过硫酸盐。反应开始前,苯酚溶液的TOC含量为79.3 mg·L-1。随后我们在10、30、60、120以及240 min时分别取样测定TOC变化。结果显示,溶液的TOC含量逐渐下降,依次为45.1、23.9、11.6、3.9和2.2 mg·L-1。同时,我们根据HPLC法测得反应过程中的苯酚浓度依据式(2)计算此时溶液TOC值。m碳表示碳元素相对分子质量,m苯酚表示苯酚相对分子质量,C苯酚表示取样时苯酚浓度(mg·L-1)。经过计算,TOC值分别为35.1、15.9、7.2、1.9和0.3 mg·L-1,该数值与仪器测得TOC值基本吻合,说明降解过程中苯酚完全转化为CO2与H2O,没有生成其它小分子造成二次污染。
| $ {\rm{TOC = }}\frac{{6{m_碳}\;{C_{苯酚}}}}{{{m_{苯酚}}}} $ | (2) |
为了明确苯酚氧化降解过程中,不同活性物种的贡献,我们在pH值为8.0条件下进行了淬灭剂实验(图 9)。

|
| 图 9 不同淬灭剂存在下苯酚降解效率 Fig.9 The removal efficiency of phenol in the presence of various scavengers |
| |
通常来说,SO4·-和·OH是过硫酸盐活化过程中的主要活性物种[34-35]。叔丁醇(TBA)是一种有效的·OH淬灭剂(k=6.0×108 L·mol-1·s-1),但对于SO4·- (k=8.0×105 L·mol-1·s-1)的抑制效果不佳[36-37]。而甲醇(Methanol)对于SO4·- (k=2.5×107 L·mol-1·s-1)[37]和·OH (k=9.7×108 L·mol-1·s-1)[37]均有显著的淬灭作用,这使得我们可以在这个过程中区分SO4·-和·OH的贡献。在体系内加入1.0 mol L-1甲醇后,可以发现反应速率下降至0.39×10-2 min-1(表 3),这表明苯酚的氧化过程中SO4·-和·OH可能存在一定的氧化作用。但是当1.0 mol L-1叔丁醇加入后,苯酚的氧化速度却没有明显的变化,这说明·OH对于苯酚的氧化没有起到主要贡献,起主要作用的活性物种应该为SO4·-(表 3)。对苯醌(BQ)可以用作O2·-(k=9.0×108 L·mol-1·s-1)[38]的淬灭,因此我们使用对苯醌来确认O2·-的生成。在5 mmol L-1对苯醌存在下,k从3.11×10-2减小到0.7×10-2 min-1(表 3),这说明O2·-也在苯酚的氧化过程中起了重要的作用。先前有相关研究认为过硫酸盐体系也可产生1O2并对苯酚产生明显的氧化作用[39-40],因此我们使用叠氮化钠(NaN3)(k=2×109 L·mol-1·s-1)[41]来消除体系中的1O2。在20 mmol L-1叠氮化钠存在下,k值下降到0.76×10-2 min-1(表 3),这说明体系中也能产生1O2并起到了重要的作用。
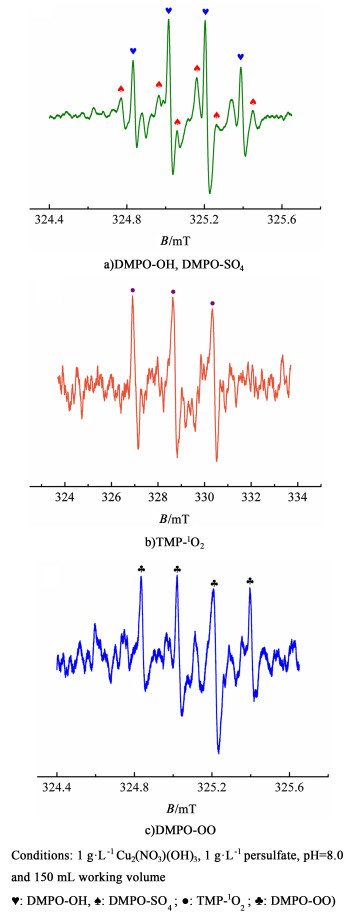
2.9 EPR表征为进一步验证反应过程中是否存在·OH、SO4·-、O2·-和1O2,我们使用EPR技术来检测相关自由基的信号。自旋捕获剂DMPO和TMP被加入体系来捕获可能产生的活性物种。DMPO被用于捕获·OH、SO4·-和O2·-,生成对应的自旋加合产物DMPO-OH, DMPO-SO4和DMPO-OO[40]。TMP被用于捕获1O2来生成TMP-1O2[40, 42]。在反应过程中,EPR检测到标记为♥、强度比为1:2:2:1的四重峰,标记为♠的六重峰,标记为●、强度比为1:1:1的三重峰和标记为♣的四重峰,这些特征峰分别为DMPO捕获·OH、SO4·-、1O2和O2·-形成的DMPO-OH、DMPO-SO4、TMP-1O2和DMPO-OO加合产物(图 10)[40, 42]。因此EPR结果表明DMPO-OH、DMPO-SO4、DMPO-OO和TMP-1O2的峰均存在,说明反应体系中·OH、SO4·-、O2·-和1O2均存在。结合先前淬灭剂实验结果,进一步说明虽然反应过程中生成了·OH、SO4·-、O2·-和1O2,但·OH并不是苯酚降解的主要的活性物种(图 10)。
|
| 图 10 Cu2(NO3)(OH)3-过硫酸盐体系的EPR谱, a)DMPO-OH, DMPO-SO4, b)TMP-1O2和c)DMPO-OO Fig.10 EPR spectra of a) DMPO-OH, DMPO-SO4, b)TMP-1O2 and c)DMPO-OO for Cu2(NO3)(OH)3- persulfate system in the presence of DMPO or TMP |
| |
基于以上的结果,Cu2(NO3)(OH)3/过硫酸盐体系氧化降解苯酚的机理如下所示。苯酚氧化过程中的主要活性物种为SO4·-、O2·-和1O2。与均相体系的过渡金属离子活化过硫酸盐的机理类似,由催化剂表面的Cu(Ⅱ)作为电子供体将电子传递给过硫酸盐,使其活化生成SO4·-和Cu(Ⅲ),如式(3)~式(4)[28]。随后,生成的SO4·-进一步通过链式反应转化为1O2和·OH,如式(5)~式(9)[40, 43-46]。DMPO和SO4·-之间的速率常数(k=2.9×104 L·mol-1·s-1)比DMPO和·OH (k=2.8×109 L·mol-1·s-1)时要低得多[47],所以DMPO-SO4的峰强度应远低于DMPO-OH。此外反应过程产生的SO4·-可通过H2O或OH-进一步转化为·OH[48-49],也提高了DMPO-OH的信号强度,这说明虽然EPR结果显示羟基自由基在反应体系中存在,但·OH不是体系中主要活性物种,因此并未在苯酚的氧化中起到主要作用。Yang等[50]报道了合成一种新型多层碳纳米管催化剂,可以有效激活过硫酸盐产生1O2,从而起到降解苯酚的作用,在他们的研究中发现1O2是主要的活性物种,且对苯酚有高效的降解速度。因此,我们相信1O2是一种对于苯酚降解非常有效的活性物种。同时,O2·-可以通过HO2-和S2O82-之间的反应生成,如式(7)[44]。O2·-也可以转化为其他的活性物种(1O2和H2O2),如式(8)和式(9)[40, 46]。总的来说,Cu2(NO3)(OH)3/过硫酸盐体系降解苯酚类似于均相的Cu2+活化过硫酸盐降解苯酚。相比于均相反应,非均相的Cu2(NO3)(OH)3催化过硫酸盐降解苯酚有着更快的反应速度以及更低的Cu2+残留在处理后的废水中,因此这项研究反映了Cu2(NO3)(OH)3优良的活化过硫酸盐的性能。
| $ {{\rm{S}}_2}{\rm{O}}_8^{2 - } + {\rm{C}}{{\rm{u}}^{2 + }} \to {\rm{SO}}_4^{ \cdot - } + {\rm{C}}{{\rm{u}}^{3 + }} + {\rm{SO}}_4^{2 - } $ | (3) |
| $ {\rm{C}}{{\rm{u}}^{3 + }} + {\rm{O}}{{\rm{H}}^ - } \to \cdot {\rm{OH}} + {\rm{C}}{{\rm{u}}^{2 + }} $ | (4) |
| $ {\rm{SO}}_4^{ \cdot - } + {\rm{O}}{{\rm{H}}^ - } \to \cdot {\rm{OH + SO}}_4^{2 - } $ | (5) |
| $ {{\rm{S}}_2}{\rm{O}}_8^{2 - } + 3{\rm{O}}{{\rm{H}}^ - } \to {\rm{OH}}_2^ - + {{\rm{H}}_2}{\rm{O + 2SO}}_4^{2 - } $ | (6) |
| $ {{\rm{S}}_2}{\rm{O}}_8^{2 - } + {\rm{OH}}_2^ - + {\rm{O}}{{\rm{H}}^ - } \to {\rm{O}}_2^{ \cdot - } + {{\rm{H}}_2}{\rm{O + SO}}_4^{2 - } + {\rm{SO}}_4^{ \cdot - } $ | (7) |
| $ {\rm{O}}_2^{ \cdot - } + \cdot {\rm{OH}} \to {}^1{{\rm{O}}_{\rm{2}}} + {\rm{O}}{{\rm{H}}^ - } $ | (8) |
| $ 2{\rm{O}}_2^{ \cdot - } + 2{{\rm{H}}_2}{\rm{O}} \to {}^1{{\rm{O}}_{\rm{2}}} + {\rm{O}}{{\rm{H}}^ - } + 2{{\rm{H}}_2}{{\rm{O}}_2} $ | (9) |
本研究开发出的Cu2(NO3)(OH)3可作为激活过硫酸盐的催化剂。Cu2(NO3)(OH)3/过硫酸盐体系在弱酸性和碱性条件下均能有效地活化过硫酸盐降解苯酚。在pH值为8.0,1 g·L-1过硫酸盐和1 g·L-1 Cu2(NO3)(OH)3条件下,100 mg·L-1苯酚可以在4 h内被完全降解。尽管EPR实验显示1O2、SO4·-、·OH和O2·-都在Cu2(NO3)(OH)3/过硫酸盐体系中被发现, 但淬灭剂实验却证实只有1O2、SO4·-和O2·-对于苯酚的氧化有贡献。通过Cu2(NO3)(OH)3激活过硫酸盐降解苯酚丰富了我们的认知,为有机废水处理提供了一个可行的新方案。
| [1] |
Esplugas S, Giménez J, Contreras S, et al. Comparison of different advanced oxidation processes for phenol degradation[J]. Water Research, 2002, 36(4): 1034-1042. DOI:10.1016/S0043-1354(01)00301-3 |
| [2] |
Sprynskyy M, Lebedynets M, Namie J, et al. Phenolics occurrence in surface water of the Dniester river basin (West Ukraine):Natural background and industrial pollution[J]. Environmental Geology, 2007, 53(1): 67-75. DOI:10.1007/s00254-006-0619-0 |
| [3] |
Wu C, Liu X, Wei D, et al. Photosonochemical degradation of phenol in water[J]. Water Research, 2001, 35(16): 3927-3933. DOI:10.1016/S0043-1354(01)00133-6 |
| [4] |
Li Z, Wu M, Jiao Z, et al. Extraction of phenol from wastewater by N-octanoylpyrrolidine[J]. Journal of Hazardous Materials, 2004, 114(1/2/3): 111-114. |
| [5] |
Alzaydien A S, Manasreh W. Equilibrium, kinetic and thermodynamic studies on the adsorption of phenol onto activated phosphate rock[J]. International Journal of Physical Sciences, 2009, 4(4): 172-181. |
| [6] |
Banat F A, Al-Bashir B, Al-Asheh S, et al. Adsorption of phenol by bentonite[J]. Environ Pollut, 2000, 107(3): 391-398. DOI:10.1016/S0269-7491(99)00173-6 |
| [7] |
Cahn R P, Li N. Separation of phenol from waste water by the liquid membrane technique[J]. Separation Science, 1974, 9(6): 505-519. DOI:10.1080/00372367408055596 |
| [8] |
Klibanov A M, Tu T M, Scott K P. Peroxidase-Catalyzed removal of phenols from coal-conversion waste waters[J]. Science, 1983, 221(4607): 259-261. |
| [9] |
Marrot B, Barrios-Martinez A, Moulin P, et al. Biodegradation of high phenol concentration by activated sludge in an immersed membrane bioreactor[J]. Biochemical Engineering Journal, 2006, 30(2): 174-183. DOI:10.1016/j.bej.2006.03.006 |
| [10] |
De Sucre V S, Watkinson A P. Anodic oxidation of phenol for waste water treatment[J]. The Canadian Journal of Chemical Engineering, 1980, 58(6): 52-59. DOI:10.1002/cjce.5450580607 |
| [11] |
Liu Y, He X, Fu Y, et al. Degradation kinetics and mechanism of oxytetracycline by hydroxyl radical-based advanced oxidation processes[J]. Chemical Engineering Journal, 2016, 284: 1317-1327. DOI:10.1016/j.cej.2015.09.034 |
| [12] |
Hu P, Long M. Cobalt-Catalyzed sulfate radical-based advanced oxidation:A review on heterogeneous catalysts and applications[J]. Applied Catalysis B:Environmental, 2016, 181: 103-117. DOI:10.1016/j.apcatb.2015.07.024 |
| [13] |
Dewil R, Appels L, Baeyens J. Improving the heat transfer properties of waste activated sludge by advanced oxidation processes[EB/OL]. 2007
|
| [14] |
Neyens E, Baeyens J. A review of classic Fenton's peroxidation as an advanced oxidation technique[J]. Journal of Hazardous Materials, 2003, 98(1/2/3): 33-50. |
| [15] |
Haber F, Weiss J. The catalytic decomposition of hydrogen peroxide by iron salts[J]. Proceedings of the Royal Society of London Series A-Mathematical and Physical Sciences, 1934, 147(861): 332-351. |
| [16] |
Walling C. Fenton's reagent revisited[J]. Accounts of Chemical Research, 1975, 8(4): 125-131. DOI:10.1021/ar50088a003 |
| [17] |
House D A. Kinetics and mechanism of oxidations by peroxydisulfate[J]. Chem Rev, 1962, 62(3): 185-203. DOI:10.1021/cr60217a001 |
| [18] |
Rao Y, Qu L, Yang H, et al. Degradation of carbamazepine by Fe(Ⅱ)-activated persulfate process[J]. Journal of Hazardous Materials, 2014, 268: 23-32. DOI:10.1016/j.jhazmat.2014.01.010 |
| [19] |
Liang C, Liang C, Chen C. pH dependence of persulfate activation by EDTA/Fe(Ⅲ) for degradation of trichloroethylene[J]. Journal of Contaminant Hydrology, 2009, 106(3/4): 173-182. |
| [20] |
Wang W, Song J, Han X. Schwertmannite as a new Fenton-like catalyst in the oxidation of phenol by H2O2[J]. Journal of Hazardous Materials, 2013, 262: 412-419. DOI:10.1016/j.jhazmat.2013.08.076 |
| [21] |
Wang Q, Cao Y, Zeng H, et al. Ultrasound-Enhanced zero-valent copper activation of persulfate for the degradation of bisphenol AF[J]. Chemical Engineering Journal, 2019. DOI:10.1016/j.cej.2019.122143 |
| [22] |
Lau T K, Chu W, Graham N. The aqueous degradation of butylated hydroxyanisole by UV/S2O82-:Study of reaction mechanisms via dimerization and mineralization[J]. Environmental Science & Technology, 2007, 41(2): 613-619. |
| [23] |
Moradi M, Ghanbari F, Manshouri M, et al. Photocatalytic degradation of azo dye using nano-ZrO2/UV/Persulfate:Response surface modeling and optimization[J]. Korean J. Chem. Eng., 2015, 33: 539-546. |
| [24] |
Yang S, Yang X, Shao X, et al. Activated carbon catalyzed persulfate oxidation of Azo dye acid orange 7 at ambient temperature[J]. Journal of Hazardous Materials, 2011, 186(1): 659-666. DOI:10.1016/j.jhazmat.2010.11.057 |
| [25] |
Furman O S, Teel A L, Ahmad M, et al. Effect of basicity on persulfate reactivity[J]. Journal of Environmental Engineering, 2011, 137(4): 241-247. DOI:10.1061/(ASCE)EE.1943-7870.0000323 |
| [26] |
Liu C, Shih K, Sun C, et al. Oxidative degradation of propachlor by ferrous and copper ion activated persulfate[J]. Science of the Total Environment, 2012, 416: 507-512. DOI:10.1016/j.scitotenv.2011.12.004 |
| [27] |
Lin Y, Liang C, Chen J. Feasibility study of ultraviolet activated persulfate oxidation of phenol[J]. Chemosphere, 2011, 82(8): 1168-1172. DOI:10.1016/j.chemosphere.2010.12.027 |
| [28] |
Lei Y, Chen C, Tu Y, et al. Heterogeneous degradation of organic pollutants by persulfate activated by CuO-Fe3O4:Mechanism, stability, and effects of pH and bicarbonate ions[J]. Environmental Science & Technology, 2015, 49(11): 6838-6845. |
| [29] |
Bovio B, Locchi S. Crystal structure of the orthorhombic basic copper nitrate, Cu2(OH)3NO3[J]. Journal of Crystallographic and Spectroscopic Research, 1982, 12(6): 507-517. DOI:10.1007/BF01160904 |
| [30] |
Zhan Y, Zhou X, Fu B, et al. Catalytic wet peroxide oxidation of azo dye (Direct Blue 15) using solvothermally synthesized copper hydroxide nitrate as catalyst[J]. Journal of Hazardous Materials, 2011, 187(1/2/3): 348-354. |
| [31] |
Shen L, Liang S, Wu W, et al. Multifunctional NH2- mediated zirconium metal-organic framework as an efficient visible-light-driven photocatalyst for selective oxidation of alcohols and reduction of aqueous Cr(Ⅵ)[J]. Dalton Transactions, 2013, 42(37): 13649-13657. DOI:10.1039/c3dt51479j |
| [32] |
Henrist C, Traina K, Hubert C, et al. Study of the morphology of copper hydroxynitrate nanoplatelets obtained by controlled double jet precipitation and urea hydrolysis[J]. Journal of Crystal Growth, 2003, 254(1/2): 176-187. |
| [33] |
Petersen A B, Gniadecki R, Vicanova J, et al. Hydrogen peroxide is responsible for UVA-induced DNA damage measured by alkaline comet assay in HaCaT keratinocytes[J]. Journal of Photochemistry and Photobiology B:Biology, 2000, 59(1/2/3): 123-131. |
| [34] |
Liang C, Su H. Identification of sulfate and hydroxyl radicals in thermally activated persulfate[J]. Industrial & Engineering Chemistry Research, 2009, 48(11): 5558-5562. |
| [35] |
Devi P, Das U, Dalai A K. In-situ chemical oxidation:Principle and applications of peroxide and persulfate treatments in wastewater systems[J]. Science of The Total Environment, 2016, 571: 643-657. DOI:10.1016/j.scitotenv.2016.07.032 |
| [36] |
Buxton G V, Greenstock C L, Helman W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O-in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(2): 513-886. DOI:10.1063/1.555805 |
| [37] |
Neta P, Huie R E, Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(3): 1027-1284. DOI:10.1063/1.555808 |
| [38] |
Xu T, Kamat P V, O'Shea K E. Mechanistic evaluation of arsenite oxidation in TiO2Assisted photocatalysis[J]. The Journal of Physical Chemistry A, 2005, 109(40): 9070-9075. DOI:10.1021/jp054021x |
| [39] |
Duan X, Ao Z, Zhang H, et al. Nanodiamonds in sp2/sp3 configuration for radical to nonradical oxidation:Core-Shell layer dependence[J]. Applied Catalysis B:Environmental, 2018, 222: 176-181. DOI:10.1016/j.apcatb.2017.10.007 |
| [40] |
Cheng X, Guo H, Zhang Y, et al. Non-Photochemical production of singlet oxygen via activation of persulfate by carbon nanotubes[J]. Water Research, 2017, 113: 80-88. DOI:10.1016/j.watres.2017.02.016 |
| [41] |
Gsponer H E, Previtali C M, García N A. Kinetics of the photosensitized oxidation of polychlorophenols in alkaline aqueous solution[J]. Toxicological & Environmental Chemistry, 1987, 16(1): 23-37. |
| [42] |
Qi C, Liu X, Ma J, et al. Activation of peroxymonosulfate by base:Implications for the degradation of organic pollutants[J]. Chemosphere, 2016, 151: 280-288. DOI:10.1016/j.chemosphere.2016.02.089 |
| [43] |
Wang J, Wang S. Activation of persulfate (PS) and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502-1517. DOI:10.1016/j.cej.2017.11.059 |
| [44] |
Yang Y, Pignatello J J, Ma J, et al. Comparison of halide impacts on the efficiency of contaminant degradation by sulfate and hydroxyl radical-based advanced oxidation processes (AOPs)[J]. Environmental Science & Technology, 2014, 48(4): 2344-2351. |
| [45] |
Herrmann H, Reese A, Zellner R. Time-Resolved UV/VIS diode array absorption spectroscopy of SOx-(x=3, 4, 5) radical anions in aqueous solution[J]. Journal of Molecular Structure, 1995, 348: 183-186. DOI:10.1016/0022-2860(95)08619-7 |
| [46] |
Mehdi A, Farshid G. Degradation of organic pollutants by photoelectro-peroxone/ZVI process:Synergistic, kinetic and feasibility studies[J]. J Environ Manage, 2018, 228: 32-39. DOI:10.1016/j.jenvman.2018.08.102 |
| [47] |
Wei Z, Villamena F A, Weavers L K. Kinetics and mechanism of ultrasonic activation of persulfate:An in situ EPR spin trapping study[J]. Environmental Science & Technology, 2017, 51(6): 3410-3417. |
| [48] |
Furman O S, Teel A L, Watts R J. Mechanism of base activation of persulfate[J]. Environmental Science & Technology, 2010, 44(16): 6423-6428. |
| [49] |
Ike I A, Linden K G, Orbell J D, et al. Critical review of the science and sustainability of persulphate advanced oxidation processes[J]. Chemical Engineering Journal, 2018, 338: 651-669. DOI:10.1016/j.cej.2018.01.034 |
| [50] |
Yang W, Jiang Z, Hu X, et al. Enhanced activation of persulfate by nitric acid/annealing modified multi-walled carbon nanotubes via non-radical process[J]. Chemosphere, 2019, 220: 514-522. DOI:10.1016/j.chemosphere.2018.12.136 |
 2021, Vol. 38
2021, Vol. 38





