海藻酸钠(SA)是基于β-d-甘露糖醛酸(M)和α-l-古鲁糖醛酸(G)重复单元组成的天然阴离子多糖,壳聚糖(CTS)主要是由随机分布的β-(1-4)连接的d-葡萄糖胺(脱去乙酰基单元)和N-乙酰基-d-葡萄糖胺(乙酰化单元)组成的天然阳离子多糖,因他们具有良好的生物相容性、无毒性、可生物降解性而引起很大的关注[1-2]。海藻酸钠中带有负电荷的羧基与壳聚糖中带有正电荷的氨基由于静电相互作用形成聚电解质复合物[3]。海藻酸钠中的羧基与金属离子之间也可以交联形成凝胶,通常被称为蛋壳模型[4-5]。
近年来,以海藻酸盐为基础的水凝胶广泛应用于医用敷料的商业产品中,以及作为食品配方的封装[6]。海藻酸盐/壳聚糖聚电解质复合物水凝胶也被研究用于药物、蛋白质的包封[7-8]。该复合水凝胶具有保护封装物的特性,可作为潜在的无毒传递系统[9]。
薄荷油含有薄荷醇、薄荷酮和薄荷呋喃主要成分,广泛应用于食品、调味品、日化品和制药等行业。然而,当暴露在空气和紫外线下时,它很容易被氧化,并且在自然界中具有很高的挥发性,因此,为了克服这些缺点,经常使用微胶囊化的薄荷油[1]。
天然大分子单宁酸(TA)有多个o-二羟基和三羟基芳香苯环,是一种多羟基多酚,由于其在水溶液中的抗菌和防腐性而备受关注[10]。它也可以用作交联剂,在不增加材料毒性的同时,可方便地用于生物材料的改性[11]。单宁酸可以作为壳聚糖的交联剂[12-14]。Sionkowska等[15]研究了单宁酸对明胶/壳聚糖聚合物的改性。然而,单宁酸交联海藻酸钠/壳聚糖微球的制备及其对微球性能的影响和薄荷油(PP)微胶囊化的应用,目前尚无报道。
本研究以海藻酸钠/壳聚糖作为制备水凝胶微球的原料制备水凝胶微球,探究引入单宁酸交联剂对海藻酸钠/壳聚糖微球性能的影响,以及对单宁酸交联改性海藻酸钠/壳聚糖水凝胶在包封薄荷油微胶囊化应用方面性能的影响。
1 实验部分 1.1 试剂和仪器w(海藻酸钠) >90%,采购于上海麦克林科技有限公司;w[壳聚糖(脱乙酰度>90%)]>90%,由北京索莱宝科技有限公司提供;单宁酸和无水氯化钙是由天津市科密欧化学试剂有限公司生产。以上试剂均为分析纯。
ZNCL-BS智能磁力搅拌器,巩义市(河南)予华仪器有限责任公司;Free Zone 2.5真空冷冻干燥机,美国Labconco公司;TENSOR 27傅里叶变换红外光谱仪,德国Bruker公司;SDT Q600热重分析仪,美国TA仪器公司;Lambda 750s紫外分光光度计,美国PerkinElmer有限公司。
1.2 SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的制备微球的形成是基于离子预凝胶技术[16]。将海藻酸钠2 g在室温下溶于超纯水98 g在磁力搅拌下过夜,配制2%的海藻酸钠溶液。将壳聚糖0.4 g溶于199.6 g质量分数为1%醋酸溶液中,将无水氯化钙4 g溶于配置好的壳聚糖溶液中。分别用配有27 g口径针头的1 mL的注射器将海藻酸钠溶液和海藻酸钠/单宁酸(占总生物聚合物质量的0.2%)的混合液滴加到壳聚糖和氯化钙溶液中,在500 r/min的恒定转速的磁力搅拌下形成SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球。固化15 min,用超纯水冲洗3次,去除表面的Ca2+。冷冻干燥24 h。
1.3 傅里叶红外变换光谱将冷冻干燥的SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球及交联聚合物包封薄荷油微胶囊研磨成粉末分别与溴化钾(KBr)混合,研磨混合均匀,然后用高压钳压在ZnSe板上。在400~4 000 cm-1范围内用傅里叶变换红外光谱仪进行红外光谱测定。
1.4 热重分析将冷冻干燥的SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球及交联聚合物包封薄荷油微胶囊研磨成粉末,通过SDT Q600热重分析仪来研究它们的热稳定性。每个样品设置升温区间为20~800 ℃内进行,加热速率10 ℃/min,氮气吹扫速率20 mL/min。
1.5 SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的平均直径和含水量用Image J软件对数字图像进行分析,得到SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球及交联聚合物包封薄荷油微胶囊的平均直径。微球的含水量是根据冷冻干燥前后微球的质量变化来计算的,根据式(1)确定含水量,分别研究了SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的含水量,式(1)中,ww为湿凝胶微球的重量g;wd是微球冷冻干燥后的质量g。
| $ 含水量 = \frac{{{w_{\rm{w}}} - {w_{\rm{d}}}}}{{{w_{\rm{d}}}}} \times 100\% $ | (1) |
分别研究了SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的溶胀行为。称取一定质量的冷冻干燥好的微球,浸泡在超纯水中72 h。溶胀后的微球用滤纸擦干并称质量。本研究中微球的溶胀行为是以微球的质量变化来表征的,平衡溶胀指数按式(2)计算。式(2)中,wa为浸泡溶胀后的凝胶微球的质量,g。
| $ 平衡溶胀指数 = \frac{{{w_{\rm{a}}} - {w_{\rm{d}}}}}{{{w_{\rm{d}}}}} \times 100\% $ | (2) |
取2%的海藻酸钠溶液9 g,加入1 g薄荷油,用均质器在10 000 r/min下均质30 min,根据1.2节方法,制备包裹薄荷油的SA/CTS/Ca2+包封薄荷油微胶囊。称取含有0.2%单宁酸的海藻酸钠溶液9 g,加入1 g薄荷油,根据1.2节方法,制备TA/SA/CTS/Ca2+包封薄荷油微胶囊。将包封薄荷油的微胶囊冷冻干燥,以供进一步的研究。
1.8 薄荷油包封率的测定以冻干微胶囊中薄荷油的总质量与薄荷油的添加的总质量之比定义为包封率。用紫外分光光度计法测定了薄荷油的含量[1]。将冻干的微胶囊样品与无水乙醇混合,不破坏微胶囊。用摇杯法提取表面精油。收集残留样品,进一步测定微球中薄荷油的含量。过滤微胶囊在研钵中粉碎,用无水乙醇洗涤3次。然后提取薄荷油进行过滤,去除过滤残渣。收集到的含有薄荷油的乙醇溶液在50 mL容量瓶中定容,再稀释100倍。根据紫外吸收光谱知最大吸收峰出现在波长203 nm处。用标准曲线法定量测定薄荷油的含量。对薄荷油的包封率进行了3次测定,取平均值。包封率计算如式(3)所示。
| $ 包封率 = \frac{{{w_1}}}{{{w_2}}} \times 100\% $ | (3) |
式(3)中:w1为微球中薄荷油的总质量,g;w2是体系中薄荷油的投入量,g。
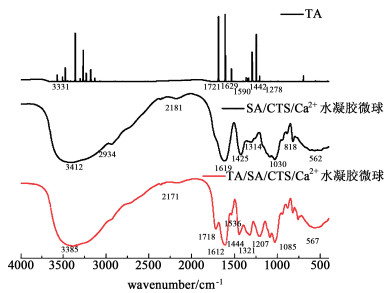
2 结果和讨论 2.1 SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的红外光谱分析本工作利用红外光谱分析SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球,拟揭示单宁酸对海藻酸钠/壳聚糖聚合物化学结构的影响。TA、SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的红外光谱如图 1所示。
|
| 图 1 单宁酸和SA/CTS/Ca2+水凝胶微球和TA/SA/CTS/Ca2+水凝胶微球的红外光谱 Fig.1 Infrared spectra of tannic acid, SA/CTS/Ca2+ hydrogel microspheres and TA/SA/CTS/Ca2+ hydrogel microspheres |
| |
红外光谱结果表明,加入单宁酸交联剂后,谱图结果发生了明显的变化。在单宁酸的红外光谱中,由于—OH的拉伸变形,在大约3 600~3 000 cm-1处出现了1个宽频峰带。1 721 cm-1处的峰对应于羧基羰基。1 629和1 590 cm-1处的峰都表明芳香环中的—C=C的存在。在1 442 cm-1处的峰值表明酚类中—C—C—的振动,1 318 cm-1处的峰值表明酚基的存在。在1 218 cm-1处的峰值是由碳氢化合物引起的。900~550 cm-1区域的峰是由苯环中的C—H引起的。我们的研究结果与Muhoza等[17]关于单宁酸红外谱图分析一致。
在TA/SA/CTS/Ca2+水凝胶微球的红外光谱中,SA/CTS/Ca2+水凝胶微球中出现的氨基峰(酰胺-A,代表—NH2和—OH)已经从3 421 cm-1处移动到3 385 cm-1, 说明由于氢键的形成向低波数移动。光谱显示2 934 cm-1(酰胺-B,代表壳聚糖骨链的C—H拉伸变形)被削弱,这可能与单宁酸和壳聚糖的反应有关。在单宁酸交联的微胶囊中出现了1个新的吸收峰在1 718 cm-1处,可能是由于在单宁酸中有C=O的存在。这是因单宁酸中含有芳香酯类,C=O键伸缩振动在1 730~1 705 cm-1能够被辨别出来[18]。我们的研究结果与Al Luqman Abdul Halim等[19]在单宁酸/壳聚糖膜红外谱图分析结果一致。原来在1 314 cm-1处的弱吸收峰的消失。这些变化表明,生物高分子的官能团与单宁酸的官能团之间可能存在相互作用。
2.2 SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的热稳定性分析SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的热失重曲线如图 2所示。

|
| 图 2 SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的热重曲线 Fig.2 Thermogravimetric curve of SA/CTS/Ca2+ and TA/SA/CTS/Ca2+ hydrogel microspheres |
| |
微球质量的失量曲线分为2个阶段。第1阶段发生在大约100 ℃,这是由于样品中结合水水分的蒸发。TA/SA/CTS/Ca2+和SA/CTS/Ca2+水凝胶微球的损失质量差异不大。
在200~400 ℃左右的第2次失量过程中,TA/SA/CTS/Ca2+和SA/CTS/Ca2+水凝胶微球的失量率分别为45%和48%。TA/SA/CTS/Ca2+水凝胶微球总热分解质量为58%,SA/CTS/Ca2+水凝胶微球的热分解总质量为63%。由红外图谱知单宁酸与海藻酸钠/壳聚糖存在相互作用可能诱导了相对分子质量更高的单宁酸/海藻酸钠/壳聚糖聚合物,从而提高所得复合物的热稳定性。
2.3 SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的平均直径及含水量制备的SA/CTS/Ca2+水凝胶微球和TA/SA/CTS/Ca2+水凝胶微球如图 3a)和图 3b)所示。用Image J对图片进行处理,统计分析得到的SA/CTS/Ca2+水凝胶微球粒径分布如图 3c)所示,TA/SA/CTS/Ca2+水凝胶微球粒径如图 3d)所示,SA/CTS/Ca2+微球粒径为1.041 4 mm,而TA/SA/CTS/Ca2+水凝胶微球粒径为1.066 4 mm。随着单宁酸的加入,液滴的大小发生了变化,导致了尺寸和体积的增大。King[20]认为微胶囊的尺寸为0.2~5 000.0 μm。

|
| 图 3 SA/CTS/Ca2+水凝胶微球a)和TA/SA/CTS/Ca2+水凝胶微球b)SA/CTS/Ca2+水凝胶微球的粒径分布c)和TA/SA/CTS/Ca2+水凝胶微球直径分布d) Fig.3 SA/CTS/Ca2+ hydrogel microspheres a), TA/SA/CTS/Ca2+ hydrogel microspheres b), the diameter distribution of SA/CTS/Ca2+ hydrogel microspheres c) and diameter distribution of TA/SA/CTS/Ca2+ hydrogel microspheres d) |
| |
根据1.5节公式(1)计算得出SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球的含水量分别为96.32%和96.73%。结果显示单宁酸的加入会影响微球的含水量,即微球形成后保留在聚合物中的自由水的水分。随着单宁酸的加入,含水量增加。
冷冻干燥完后的微球如图 4所示,我们观察到,经过冷冻干燥后,交联单宁酸和未交联单宁酸的水凝胶微球的体积明显变化。我们观察到未交联单宁酸的SA/CTS/Ca2+水凝胶微球的体积明显减小,如图 4a)所示,这可能是冷冻脱水导致的减少,如Van Neerven等[21]报道的海藻酸盐微珠在冷冻干燥过程中也出现了体积收缩现象。Pereira等[22]指出这种结构现象的出现可能与微球的出水有关,从而导致了基质的弱化,呈现出塌陷现象。而冷冻干燥后的TA/SA/CTS/Ca2+水凝胶微球的体积稍微增加如图 4b)所示,这可能是因为冰的体积比纯水的体积大9%,冷冻后(脱水前)可使微球膨胀,在大多数情况下,膨胀程度因许多因素而有很大差异,其中包括水分含量,一般来说,自由水水分含量越高,冷冻的微球体积也越高[23]。我们的结果与红外光谱的结果是一致的,揭示了由于单宁酸的交联作用,增加了海藻酸钠/壳聚糖凝胶体系的保水性能,从而引起了海藻酸钠/壳聚糖微球在干燥过程中颗粒的大小和形状的变化。

|
| 图 4 冷冻干燥后的SA/CTS/Ca2+水凝胶微球a)和TA/SA/CTS/Ca2+水凝胶微球b) Fig.4 Freeze-dried SA/CTS/Ca2+ hydrogel microspheres a) and TA/SA/CTS/Ca2+ hydrogel microsphere b) |
| |
聚合物的溶胀行为取决于聚合物结构的性质、使用的液体性质以及聚合物的交联程度[5]。根据1.6节公式(2)计算得出SA/CTS/Ca2+水凝胶微球的平衡溶胀率为169%,而TA/SA/CTS/Ca2+的平衡溶胀率为568%。单宁酸的加入大大提高了平衡溶胀率。这可能是由于单宁酸与海藻酸钠/壳聚糖的相互作用导致了复合物的形成,而且单宁酸中含有大量的酚羟基(—OH),具有良好的亲水性。
2.5 交联聚合物包封薄荷油微胶囊的应用对海藻酸钠/壳聚糖聚合物和单宁酸交联的海藻酸钠/壳聚糖聚合物进行薄荷油的微胶囊化的应用,考察单宁酸的加入对微胶囊粒径、包封率和热稳定性的影响。
制备的SA/CTS/Ca2+包封薄荷油微胶囊和TA/SA/CTS/Ca2+包封薄荷油微胶囊如图 5a)和5b)所示。用Image J对图片进行处理,统计分析得到的SA/CTS/Ca2+包封薄荷油微胶囊粒径分布如图 5c)所示,TA/SA/CTS/Ca2+包封薄荷油微胶囊粒径分布如图 5d)所示,SA/CTS/Ca2+包封薄荷油微胶囊平均粒径为1.040 7 mm,而TA/SA/CTS/Ca2+水凝胶微球平均粒径为1.053 1 mm。由于薄荷油的存在,单宁酸的引入对海藻酸钠/壳聚糖聚合物制备的薄荷油的微胶囊的体积影响不大。

|
| 图 5 SA/CTS/Ca2+包封薄荷油微胶囊a)和TA/SA/CTS/Ca2+包封薄荷油微胶囊b)SA/CTS/Ca2+包封薄荷油微胶囊的粒径分布c)和TA/SA/CTS/Ca2+包封薄荷油微胶囊的粒径分布d) Fig.5 SA/CTS/Ca2+ peppermint oil microspheresa), TA/SA/CTS/Ca2+peppermint oil microspheresb), the diameter distribution of SA/CTS/Ca2+ peppermint oil microspheresc), and diameter distribution of TA/SA/CTS/Ca2+ peppermint oil microspheres d) |
| |
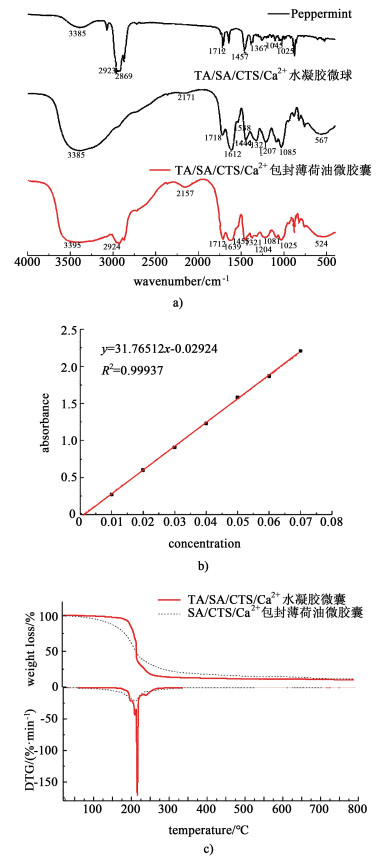
薄荷油以及TA/SA/CTS/Ca2+水凝胶微球和TA/SA/CTSCa2+包封薄荷油微胶囊的红外谱图如图 6a)所示;薄荷油的紫外吸收光谱标准曲线如图 6b)所示;SA/CTS/Ca2+和TA/SA/CTS/Ca2+聚合物包封薄荷油微胶囊的热重曲线如图 6c)所示。
|
| 图 6 薄荷油以及TA/SA/CTS/Ca2+水凝胶微球和TA/SA/CTS/Ca2+包封薄荷油微胶囊的红外谱图a)薄荷油的紫外吸收光谱标准曲线b), SA/CTS/Ca2+和TA/SA/CTS/Ca2+包封薄荷油微胶囊的热重曲线c) Fig.6 Infrared spectra of peppermint oil, TA/SA/CTS/Ca2+ hydrogel microspheres and TA/SA/CTS/Ca2+ peppermint oil microspheres a), standard curve of ultraviolet absorption spectrum of peppermint oil b), and thermogravimetric curve of SA/CTS/Ca2+ and TA/SA/CTS/Ca2+ peppermint oil microspheres c) |
| |
如图 6a)所示,薄荷油的红外光谱在3 385、2 923、2 869、1 712、1 457、1 367、1 045和1 025 cm-1处有不同的峰。交联单宁酸TA/SA/CTS/Ca2+聚合物包封薄荷油微胶囊红外光谱峰位分别为3 395、2 924、2 157、1 712、1 639、1 455、1 367、1 204、1 203、1 081、1 025和524 cm-1。比较包封薄荷油的微胶囊和未包封薄荷油的微球的红外光谱,包封薄荷油的微胶囊在2 924 cm-1出现新的薄荷油的特征吸收峰,表明薄荷油被包裹在微胶囊中。薄荷油紫外吸收光谱的标准曲线如图 6b)所示,根据标准曲线方程计算知未交联单宁酸SA/CTS/Ca2+聚合物和交联单宁酸TA/SA/CTS/Ca2+聚合物包封薄荷油微胶囊的平均包封率分别为17.57%和45.21%。结果表明, 单宁酸的引入提高了海藻酸钠/壳聚糖薄荷油包载体系的包封率。这可能是由于单宁酸具有两亲结构,交联单宁酸的聚合物与薄荷油的亲和能力更强导致的。
图 6c)为SA/CTS/Ca2+和TA/SA/CTS/Ca2+聚合物包封薄荷油微胶囊热失量曲线。失量第1阶段温度在150~195 ℃之间,是由于表面薄荷油的分解。在第2阶段中,结果显示未交联单宁酸SA/CTS/Ca2+聚合物包封的薄荷油微胶囊起始分解温度大约为175 ℃,交联单宁酸TA/SA/CTS/Ca2+聚合物包封薄荷油微胶囊起始温度大约为195 ℃,热稳定性明显提高。这充分证明了单宁酸的加入可以改善海藻酸钠/壳聚糖聚合物包封薄荷油微胶囊的包封率和热稳定性。
3 结论本研究采用滴加法,基于离子预凝胶技术制备SA/CTS/Ca2+和TA/SA/CTS/Ca2+水凝胶微球以及交联单宁酸和未交联单宁酸海藻酸钠/壳聚糖聚合物包封薄荷油的微胶囊,并对微球和微胶囊进行了表征。红外光谱证实了单宁酸和海藻酸钠/壳聚糖分子结构之间的相互作用。单宁酸与海藻酸钠/壳聚糖的相互作用导致了复合物的形成,提高了微球的热稳定性,微球的含水量提高了0.4%,溶胀率提高了399%。由于单宁酸的加入,液滴的大小发生了变化,导致了粒径的增大。交联单宁酸的聚合物包封薄荷油微胶囊,包封效率提高了27.64%,起始热分解温度增大了大约20 ℃。
| [1] |
Deka C, Deka D, Bora M M, et al. Synthesis of peppermint oil-loaded chitosan/alginate polyelectrolyte complexes and study of their antibacterial activity[J]. Journal of Drug Delivery Science and Technology, 2016, 35: 314-322. DOI:10.1016/j.jddst.2016.08.007 |
| [2] |
Maestrelli F, Jug M, Cirri M, et al. Characterization and microbiological evaluation of chitosan-alginate microspheres for cefixime vaginal administration[J]. Carbohydrate Polymers, 2018, 192: 176-183. DOI:10.1016/j.carbpol.2018.03.054 |
| [3] |
Saboktakin M R. Biomedical properties study of modified chitosan nanoparticles for drug delivery systems[EB/OL]. 2013
|
| [4] |
Gulrez S K H, Al-Assaf S, Phillips G O. Hydrogels:Methods of preparation, characterization and applications[M]. Progress in Molecular and Environmental Bioengineering-From Analysis and Modeling to Technology Applications, InTech, 2011. DOI:10.5772/24553
|
| [5] |
Grant G T, Morris E R, Rees D A, et al. Biological interactions between polysaccharides and divalent cations:The egg-box model[J]. FEBS Letters, 1973, 32(1): 195-198. DOI:10.1016/0014-5793(73)80770-7 |
| [6] |
Bergo P, Sobral P J A. Effects of plasticizer on physical properties of pigskin gelatin films[J]. Food Hydrocolloids, 2007, 21(8): 1285-1289. DOI:10.1016/j.foodhyd.2006.09.014 |
| [7] |
De S, Robinson D. Polymer relationships during preparation of chitosan-alginate and poly-l-lysine-alginate nanospheres[J]. Journal of Controlled Release, 2003, 89(1): 101-112. DOI:10.1016/S0168-3659(03)00098-1 |
| [8] |
Gazori T, Khoshayand M R, Azizi E, et al. Evaluation of alginate/chitosan nanoparticles as antisense delivery vector:Formulation, optimization and in vitro characterization[J]. Carbohydrate Polymers, 2009, 77(3): 599-606. DOI:10.1016/j.carbpol.2009.02.019 |
| [9] |
Afzal S, Maswal M, Dar A A. Rheological behavior of pH responsive composite hydrogels of chitosan and alginate:Characterization and its use in encapsulation of citral[J]. Colloids and Surfaces B:Biointerfaces, 2018, 169: 99-106. DOI:10.1016/j.colsurfb.2018.05.002 |
| [10] |
Li Y. Three-Dimensional composite hydrogel based on polyamine zirconium oxide, alginate and tannic acid with high performance for Pb(Ⅱ), Hg(Ⅱ) and Cr(Ⅵ) trapping[J]. Journal of the Taiwan Institute of Chemical Engineers, 2016, 65: 304-311. DOI:10.1016/j.jtice.2016.05.023 |
| [11] |
Sionkowska A, Kaczmarek B, Lewandowska K. Modification of collagen and chitosan mixtures by the addition of tannic acid[J]. Journal of Molecular Liquids, 2014, 199: 318-323. DOI:10.1016/j.molliq.2014.09.028 |
| [12] |
Rivero S, García M A, Pinotti A. Crosslinking capacity of tannic acid in plasticized chitosan films[J]. Carbohydrate Polymers, 2010, 82(2): 270-276. DOI:10.1016/j.carbpol.2010.04.048 |
| [13] |
Wu J, Chen J. Adsorption characteristics of tannic acid onto the novel protonated palygorskite/chitosan resin microspheres[J]. Journal of Applied Polymer Science, 2013, 127(3): 1765-1771. DOI:10.1002/app.37787 |
| [14] |
An J H, Dultz S. Adsorption of tannic acid on chitosan-montmorillonite as a function of pH and surface charge properties[J]. Applied Clay Science, 2007, 36(4): 256-264. DOI:10.1016/j.clay.2006.11.001 |
| [15] |
Sionkowska A, Kaczmarek B, Lewandowska K. Modification of collagen and chitosan mixtures by the addition of tannic acid[J]. Journal of Molecular Liquids, 2014, 199: 318-323. DOI:10.1016/j.molliq.2014.09.028 |
| [16] |
Fontes G C, Calado V, Rossi A M, et al. Characterization of antibiotic-loaded alginate-osa starch microbeads produced by ionotropic pregelation[J]. BioMed Research International, 2013. DOI:10.1155/2013/472626 |
| [17] |
Muhoza B, Xia S, Zhang X. Gelatin and high methyl pectin coacervates crosslinked with tannic acid:The characterization, rheological properties, and application for peppermint oil microencapsulation[J]. Food Hydrocolloids, 2019. DOI:10.1016/j.foodhyd.2019.105174 |
| [18] |
Pantoja-Castro M A, González-Rodríguez H. Study by infrared spectroscopy and thermogravimetric analysis of Tannins and Tannic acid[J]. Revista Latinoamericana De Quimica, 2010, 39(3): 107-112. |
| [19] |
Halim A L A, Kamari A, Phillip E. Chitosan, gelatin and methylcellulose films incorporated with tannic acid for food packaging[J]. International Journal of Biological Macromolecules, 2018, 120: 1119-1126. DOI:10.1016/j.ijbiomac.2018.08.169 |
| [20] |
King A H. Encapsulation of food ingredients[C]//ACS Symposium Series, 1995
|
| [21] |
van Neerven A R W, Wijffels R, Zehnder A J B. Scanning electron microscopy of immobilized bacteria in gel beads:A comparative study of fixation methods[J]. Journal of Microbiological Methods, 1990, 11(3/4): 157-168. |
| [22] |
Pereira A D S, Diniz M M, de Jong G, et al. Chitosan-alginate beads as encapsulating agents for Yarrowia lipolytica lipase:Morphological, physico-chemical and kinetic characteristics[J]. International Journal of Biological Macromolecules, 2019, 139: 621-630. DOI:10.1016/j.ijbiomac.2019.08.009 |
| [23] |
Zohar-Perez C, Chet I, Nussinovitch A. Irregular textural features of dried alginate-filler beads[J]. Food Hydrocolloids, 2004, 18(2): 249-258. DOI:10.1016/S0268-005X(03)00081-X |
 2021, Vol. 38
2021, Vol. 38





