2. 陕西省冶金工程技术研究中心, 西安 710055
2. Shaanxi Province Metallurgical Engineering and Technology Research Centre, Xi'an 710055, China
废铅酸电池已经成为再生铅的主要来源,大约占铅回收总量的85%左右。近年来,随着汽车和电动自行车等行业对铅酸蓄电池需求量的增加,导致废旧铅酸蓄电池产生量不断提高,越来越多的废旧铅酸电池需要无害化和高值化处理。废铅膏高效利用是废旧铅酸电池处理回收的关键环节,如何高效、无污染、低成本的实现有效处理对废旧铅酸蓄电池综合利用具有重要意义[1]。铅膏由铅硫酸盐、不同价态铅的氧化物、少量金属铅和微量杂质元素(Fe、Ba、Sb和Zn等)组成。在传统的火法冶金回收方法中,不仅需要较高的温度来分解铅膏中的硫酸铅,而且大量SO2酸性气体及挥发性铅尘的产生将导致严重的环境问题[2]。因此,铅膏湿法预脱硫技术得到了许多铅回收企业青睐,也引起了大量研究学者的广泛关注[3]。
目前,对废铅膏湿法预脱硫研究较多的单一脱硫剂有碳酸钠、碳酸钾、碳酸铵等[4-6],复合脱硫剂有柠檬酸-柠檬酸钠和碳酸钠-碳酸氢钠等[7-8]。其中碳酸钠因其具有较好的脱硫效果和较高的经济利用价值被常用作铅膏脱硫剂。在铅膏湿法脱硫过程中,碳酸钠浓度对脱硫效率影响较大。Zhu等[9]以碳酸钠作为脱硫剂,在碳酸钠与硫酸铅物质的量之比为2,液固比为10的条件下,获得铅膏脱硫率达到99%的转化效果;边文璟等[10]用碳酸钠进行脱硫,当碳酸钠与硫酸铅的物质的量之比为1.1、浆液浓度为30%~60%时,可使物料含硫小于0.3%。杜新玲等[11]采用单因素实验法分析了碳酸钠浓度、温度、反应时间、矿浆浓度对PbSO4转化率的影响,得出碳酸钠浓度在1.8 mol/L时,脱硫效率能达到98.12%。脱硫剂浓度的选择不仅对脱硫效率影响较大,而且对脱硫过程铅收得率(定义为脱硫后铅膏中铅的含量与开始投入时的比值)也会产生较大影响。因此,深入研究碳酸钠浓度对铅膏脱硫过程的机理对铅膏利用具有重要意义。
本研究采用碳酸钠作为脱硫剂,在前期对铅膏脱硫影响因子实验研究的基础上,考察了碳酸钠浓度对脱硫过程铅膏脱硫率以及铅收得率的影响,并且分析了铅膏脱硫过程动力学。结合扫描电镜-能谱仪(SEM-EDS)、X射线衍射分析仪(XRD)对铅膏脱硫产物的结构形貌及物相组成进行表征,探索了不同浓度下铅膏脱硫转化机理,对完善铅膏脱硫工艺的研究有重要的意义。
1 实验 1.1 实验原料实验所用铅膏由某废旧铅酸蓄电池处理厂提供,经烘干、破碎、筛选后备用。采用化学分析方法对各成分含量进行测定,得到主要含铅成分如表 1所示。实验所用脱硫剂为分析纯碳酸钠。
| ingredient | mass fraction/% |
| lead sulfate | 61.4 |
| lead oxide | 37.2 |
| metal lead | 0.36 |
| lead element | 74.2 |

|
| 图 1 脱硫前铅膏SEM图 Fig.1 SEM image of lead paste before desulfurization |
| |
| point No. | mass fraction/% | ||||
| Pb | S | O | Ca | Si | |
| 1 | 67.14 | 12.02 | 20.23 | 0.29 | 0.32 |
| 2 | 83.69 | 16.06 | 0.25 | ||
| 3 | 84.43 | 15.37 | 0.12 | 0.08 | |
| 4 | 65.52 | 14.48 | 19.36 | 0.36 | 0.28 |
| 5 | 66.39 | 12.83 | 19.62 | 0.47 | 0.69 |
由图 1可以看出,脱硫前的铅膏形状大小不一,主要由细长杆状物质以及白色、灰色团状的颗粒组成。结合表 2可以得出白色团状大颗粒为硫酸铅,灰色颗粒为铅氧化物,而杆状物质可能为废旧铅酸蓄电池中隔板破碎后形成的玻璃纤维。
XRD分析结果如图 2所示。

|
| 图 2 脱硫前铅膏XRD图 Fig.2 XRD pattern of lead paste before desulfurization |
| |
图 2显示出硫酸铅和铅的氧化物是铅膏中的主要成分,其中铅氧化物以PbO和PbO2形式存在。
1.2 实验过程称取20 g铅膏,并配置一定浓度碳酸钠溶液。调节恒温水浴锅至设定温度后,打开搅拌器,将铅膏及碳酸钠溶液加入烧杯,并放置于恒温水浴锅中,同时记录开始反应时间。待反应时间达到预定值后,迅速取出烧杯,采用真空分液漏斗固液分离,用去离子水反复冲洗滤渣数次(去除残留盐),最后将干燥充分后的滤渣进行称量,送化学分析,计算铅膏脱硫率,并采用SEM-EDS和XRD对产物的微观形貌和物相组成等进行分析表征。脱硫率计算如式(1)所示。
| $ \text { 脱硫率 }=\left(\frac{m_{0} w_{0}-m_{1} w_{1}}{m_{0} w_{0}}\right) \times 100 \% $ | (1) |
式(1)中:m1为经碳酸盐转化后滤渣质量,g;w1为经碳酸盐转化后滤渣中S的质量分数,%;m0为实验所用铅膏的质量,g;w0为废铅膏中S的质量分数,%。
采用EDTA滴定分析法对滤液中的铅含量进行分析,计算铅收得率,铅收得率计算如式(2)所示。
| $ \text { 铅收得率 }=\left(1-\frac{c_{0} V_{0}}{m_{0} w_{2}}\right) \times 100 \% $ | (2) |
式(2)中:V0为滤液的体积,L;c0为滤液中的铅浓度,mol/L;w2为脱硫前铅膏中Pb的质量分数,%。
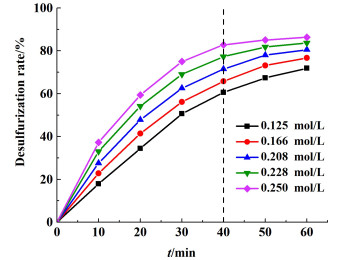
2 实验结果与讨论 2.1 碳酸钠浓度对铅膏脱硫的影响 2.1.1 浓度对铅膏脱硫率的影响在反应温度为60 ℃,液固比为10:1,搅拌器转速为50 r/min的条件下,考察了初始碳酸钠浓度为0.125、0.166、0.208、0.228和0.250 mol/L时对铅膏脱硫率的影响,结果如图 3所示。
|
| 图 3 不同浓度下脱硫率随时间的变化 Fig.3 Changes of desulfurization rate with time at different concentrations |
| |
从图 3可以看出,在同一时间下,初始碳酸钠浓度越高,铅膏脱硫率越大,脱硫效果越好;同一浓度下,随着脱硫转化时间的增加,铅膏脱硫率不断上升。脱硫反应在前40 min速率较快,之后增幅降低。当碳酸钠浓度为0.125 mol/L,铅膏脱硫率仅为71.87%。碳酸钠浓度增加到0.228 mol/L时,铅膏脱硫率达到了83.72%。这是由于浓度增加,CO32-在溶液中的扩散加快,铅膏脱硫速率越快,能够和硫酸铅更好地接触发生转化反应,脱硫效果增强。当浓度为0.250 mol/L时,铅膏脱硫率为86.30%,脱硫率增比较小,推测是由于反应生成的产物覆盖在了铅膏的表面,阻碍了反应的进一步进行[12]。
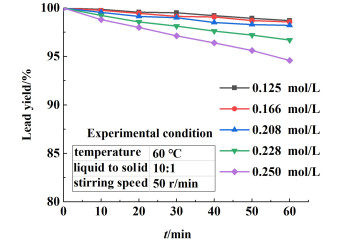
2.1.2 浓度对铅收得率的影响保持反应温度为60 ℃,液固比为10:1,搅拌器转速为50 r/min的条件,考察碳酸钠浓度对铅收得率的影响,结果如图 4所示。
|
| 图 4 碳酸钠浓度对铅收得率的影响 Fig.4 Effect of sodium carbonate concentration on yield of lead |
| |
图 4表明,碳酸钠浓度对铅收得率影响显著。当碳酸钠浓度低于0.208 mol/L时,随着反应时间的延长,铅收得率基本不变,均在98.56%以上。随着碳酸钠浓度的增加,铅收得率显著降低,在浓度0.250 mol/L,时间60 min时,铅收得率仅有94.60%。这主要是由于脱硫过程生成的碳酸铅与碳酸钠能够继续发生反应,生成的产物溶解度较高,溶解量变大造成铅收率下降。
2.2 铅膏脱硫动力学分析 2.2.1 动力学模型铅膏脱硫转化是一个液固反应,反应过程中有固体物生成,且生成物附着在未反应核之外,因此可采用有固相生成的收缩未反应核模型进行描述[13]。收缩未反应核模型主要有内扩散控制、表面化学反应控制及二者混合控制[14]3种模型。碳酸钠与硫酸铅反应时,必须到达硫酸铅的表面。因此,反应的具体步骤为:1)溶液中参与硫酸铅反应的碳酸钠通过液膜层到达固体表面的传质扩散。2)碳酸钠经过固相产物碳酸铅膜层到达硫酸铅表面的传质扩散。3)碳酸钠扩散到硫酸铅表面与硫酸铅发生脱硫反应。生成的硫酸钠经固相膜层由反应表面向外扩散,经固相表面上的液膜层向液相扩散。
将固态反应物硫酸铅近似按球形处理,假设界面化学反应为一级不可逆反应,液态产物的扩散速率足够快[15],则以上步骤依次发生的动力学方程式如式(3)~式(5)。
1) 反应物Na2CO3通过液体边界层的扩散速率为:
| $ -\frac{\mathrm{d} x}{\mathrm{d} t}=\frac{4 \pi r_{0}^{2} D_{1}}{\delta}\left(C_{1}-C_{12}\right) $ | (3) |
2) 反应物Na2CO3通过固体产物层PbCO3的扩散速率为:
| $ -\frac{\mathrm{d} x}{\mathrm{d} t}=\frac{4 \pi r_{0} r D_{2}}{r_{0}-r}\left(C_{2}-C_{12}\right) $ | (4) |
3) 界面化学反应速率为:
| $ -\frac{\mathrm{d} x}{\mathrm{d} t}=4 \pi r^{2} k_{\mathrm{r}} C_{12} $ | (5) |
式(3)~式(5)中:C1为反应物外表面的浓度;C2为固体内部的浓度;C12为反应界面处的浓度;r0为反应后固体的半径;r为未反应核的半径;D1为反应物通过液体边界层的有效扩散系数;D2为反应物通过固体产物层的有效扩散系数;δ为液体边界层厚度;k为界面化学反应速率常数。
通过对式(3)~式(5)积分可导出该模型包含的3个控制步骤方程,如式(6)~式(8)所示。
| $ \begin{array}{c} t_{1}=\left[1-(1-\alpha)^{1 / 3}\right] / k_{1} \end{array} $ | (6) |
| $ t_{2}=\left[1-2 \alpha / 3-(1-\alpha)^{2 / 3}\right] / k_{2} $ | (7) |
| $ t=\left[1-(1-\alpha)^{1 / 3}\right] / k_{1}+ \\ {\left[1-2 \alpha / 3-(1-\alpha)^{2 / 3}\right] / k_{2}} $ | (8) |
在铅膏粒径为0.25~0.35 mm,液固比为10:1,搅拌器转速为50 r/min,转化剂浓度分别在0.125、0.166、0.208、0.228和0.250 mol/L的条件下,研究不同温度对铅膏脱硫率的影响。图 5是浓度为0.208 mol/L时不同温度对铅膏脱硫率的曲线图。

|
| 图 5 不同温度下脱硫率随时间的变化 Fig.5 The change of desulfurization rate with time at different temperatures |
| |
由图 5可知,随着温度的增加,反应速率明显加快,这是由于温度的提高降低了溶液的黏度,增加了溶液中离子的扩散速度。在反应时间40 min的条件下,当反应温度由30 ℃提升至60 ℃,铅膏脱硫率由76.46%提高到86.33%;之后,进一步提高反应温度,脱硫率增加较小。
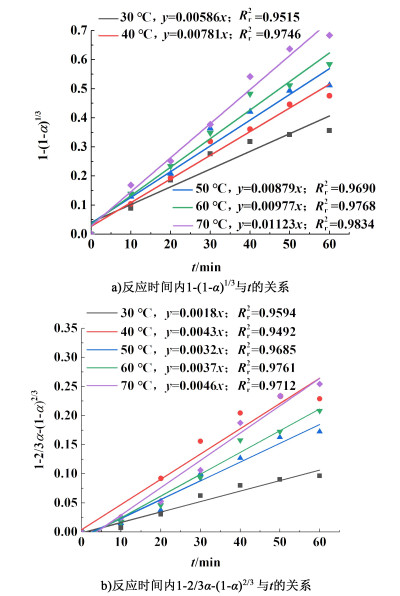
将图 5数据代入式(6)及式(7),得出了不同温度下的动力学模型如图 6所示。
|
| 图 6 不同温度下2种动力学模型图 Fig.6 Two kinetic model diagrams at different temperatures |
| |
2种模型可以得出,化学反应控制的相关系数均大于扩散控制,可以得出铅膏脱硫过程更倾向于为化学反应控制。图 6中所得直线斜率即为反应速率常数,以lnk对T-1做图得到铅膏脱硫过程活化能,浓度为0.208 mol/L时其拟合结果如图 7所示。

|
| 图 7 浓度为0.208 mol/L时lnk-T-1的关系曲线 Fig.7 The relationship between lnk-T-1 at the concentration of 0.208 mol/L |
| |
同样,对其他4种浓度下的动力学模型进行分析,并拟合lnk-T-1关系曲线。经计算,最终得出在化学反应控制模型条件下铅膏脱硫活化能变化如图 8所示。

|
| 图 8 浓度与活化能关系图 Fig.8 Relationship between concentration and activation energy |
| |
由图 8可以看出,浓度对活化能的影响显著,随着浓度的增加,活化能不断减小。浓度从0.125 mol/L增至0.208 mol/L时,活化能降低幅度较大,由7.275 kJ/mol降至5.312 kJ/mol。之后活化能随浓度的增加基本趋于稳定。
2.3 铅膏脱硫产物表征为了明确不同浓度下铅膏脱硫产物形貌结构和物相组成,分析铅膏脱硫转化机理,采用SEM-EDS和XRD对脱硫产物表征。结果如图 9、表 3和图 11所示。

|
| 图 9 不同浓度下脱硫铅膏SEM图 Fig.9 SEM image of desulfurized lead paste at different concentrations |
| |
| point No. | mass fraction/% | ||||
| Pb | S | C | O | Na | |
| 1 | 65.32 | 11.03 | 23.63 | 0.02 | |
| 2 | 84.32 | 15.68 | |||
| 3 | 64.28 | 10.02 | 22.42 | ||
| 4 | 66.52 | 8.66 | 24.36 | 0.46 | |
| 5 | 64.39 | 9.53 | 25.29 | 0.79 | |
| 6 | 63.74 | 9.25 | 25.58 | 1.43 | |
|
| 图 10 不同浓度下脱硫产物的XRD图 Fig.10 XRD pattern of desulfurization products at different concentrations |
| |
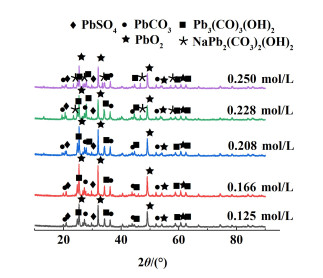
由图 9及表 3可以看出,脱硫产物中出现的灰色团状物质为硫酸铅及铅的氧化物,附着在灰色聚集物表面的白色小颗粒为碳酸铅及碱式碳酸。另外,白色小颗粒随浓度的增加而增多,且逐渐成为表面疏松多孔的团状聚集物。
图 10表明,在碳酸钠浓度低于0.166 mol/L时,脱硫产物中出现碳酸铅及碱式碳酸铅,这主要是因为发生了式(9)和式(10)反应,由于脱硫反应不完全,产物中含有部分硫酸铅。
| $\mathrm{PbSO}_{4}+\mathrm{Na}_{2} \mathrm{CO}_{3}=\mathrm{PbCO}_{3}+\mathrm{Na}_{2} \mathrm{SO}_{4} $ | (9) |
| $ \begin{array}{c} 3 \mathrm{PbSO}_{4}+2 \mathrm{Na}_{2} \mathrm{CO}_{3}+2 \mathrm{H}_{2} \mathrm{O}= \\ \mathrm{Pb}_{3}\left(\mathrm{CO}_{3}\right)_{2}(\mathrm{OH})_{2}+2 \mathrm{Na}_{2} \mathrm{SO}_{4}+\mathrm{H}_{2} \mathrm{SO}_{4} \end{array} $ | (10) |
在脱硫剂浓度为0.208 mol/L时,产物中存在较多碱式碳酸铅,而PbCO3逐渐减少。这是由于浓度的增加,溶液中OH-增多,PbCO3向Pb3(CO3)2(OH)2发生转化。产物中硫酸铅几乎不存在,说明脱硫反应较为彻底;在浓度为0.228 mol/L时,脱硫产物中开始出现钠盐[NaPb2(CO3)2(OH)2]。碱式碳酸铅和碳酸钠继续发生式(11)反应。此结果与相关研究[16-18]结果基本一致。铅氧化物在整个脱硫反应过程中含量几乎没有变化,说明碳酸钠浓度变化对铅氧化物没有影响。
| $ \begin{array}{c} \mathrm{Pb}_{3}\left(\mathrm{CO}_{3}\right)_{2}(\mathrm{OH})_{2}+2 \mathrm{Na}_{2} \mathrm{CO}_{3}= \\ 3 \mathrm{NaPb}_{2}\left(\mathrm{CO}_{3}\right)_{2}(\mathrm{OH})_{2}+\mathrm{NaOH} \end{array} $ | (11) |
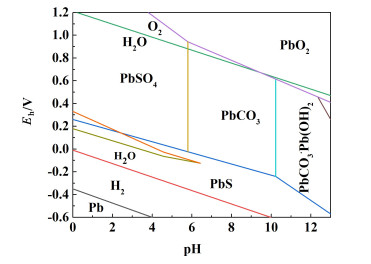
碳酸盐溶液中pH值与CO32-离子浓度有关,结合碳酸盐水溶液中铅化合物的热力学Eh-pH图(图 11)也可以得出,当pH值小于6时,Pb2+主要与SO42-结合形成PbSO4,同时不易实现PbSO4向PbCO3的化学转化;当溶液的pH值为6~10时,此时溶液中会发生式(9)反应,PbCO3作为稳定固相存在于反应体系中。当pH值大于10时,PbCO3与OH-结合形成碱式碳酸铅2PbCO3·Pb(OH)2,甚至形成铅酸盐而溶解,造成铅收得率下降。
2.4 碳酸钠浓度对铅膏脱硫过程影响机理分析基于以上分析,碳酸钠作为铅膏脱硫的脱硫剂,其浓度对脱硫过程的影响机理图如图 12所示。

|
| 图 12 浓度对铅膏脱硫过程影响机理图 Fig.12 Effect of concentration on the desulfurization process of lead paste |
| |
图 12表明,在碳酸钠浓度小于0.208 mol/L时,碳酸钠进入铅膏内与硫酸铅发生反应,生成的产物PbCO3和Pb3(CO3)2(OH)2覆盖在铅膏表面。在浓度进一步增大时,PbCO3与溶液中的OH-离子发生反应生成Pb3(CO3)2(OH)2,而浓度达到0.228 mol/L后,Pb3(CO3)2(OH)2部分转化为钠盐[NaPb2(CO3)2(OH)2],由于NaPb2(CO3)2(OH)2溶解度较大,导致滤液中铅含量增加,造成铅收得率下降。
3 结论1) 碳酸钠浓度对铅膏脱硫效率和铅收得率影响显著。当碳酸钠浓度在0.125 mol/L时,铅膏脱硫率为73.83%,铅收得率为98.56%,随着浓度的增加,脱硫率不断提高,铅收得率逐渐下降,在浓度为0.250 mol/L时,脱硫率为86.56%,铅收得率仅为91.81%。
2) 铅膏脱硫过程主要受化学反应控制,且随着浓度的增加,表观活化能逐渐减小,浓度从0.125 mol/L增至0.208 mol/L时,其活化能由7.275 kJ/mol降至5.312 kJ/mol,之后随着浓度的增加,活化能变化较小。
3) 碳酸钠浓度小于0.208 mol/L时,脱硫产物主要是以PbCO3和Pb3(CO3)2(OH)2形式存在;浓度越大,脱硫产物中Pb3(CO3)2(OH)2越多,PbCO3逐渐减少;浓度达到0.228 mol/L时,Pb3(CO3)2(OH)2与Na2CO3进一步发生反应,脱硫产物中含有较多钠盐,导致铅收得率明显降低。
| [1] |
张艳, 冯晓建, 付国权. 铅酸电池中碳酸盐与铅膏脱硫转化的关系[J]. 电源技术, 2018, 42(4): 548-550. Zhang Yan, Feng Xiaojian, Fu Guoquan. Desulfurization conversion relationship between carbonate with lead paste in lead-acid battery[J]. Chinese Journal of Power Sources, 2018, 42(4): 548-550. (in Chinese) |
| [2] |
杨家宽, 朱新锋, 刘万超, 等. 废铅酸电池铅膏回收技术的研究进展[J]. 现代化工, 2009, 29(3): 32-37. Yang Jiakuan, Zhu Xinfeng, Liu Wanchao, et al. Research progress on lead-acid recovery technology of waste lead-acid batteries[J]. Modern Chemical Industry, 2009, 29(3): 32-37. (in Chinese) |
| [3] |
韩召, 李领, 魏晓磊, 等. 硫酸铅在碳酸钠-硝酸钠熔盐中的脱硫转化[J]. 材料热处理学报, 2012, 33(6): 14-19. Han Zhao, Li Ling, Wei Xiaolei, et al. Desulfurization and phase transformation of lead sulfate in sodium carbonate-sodium nitrate molten salt[J]. Transactions of Materials and Heat Treatment, 2012, 33(6): 14-19. (in Chinese) |
| [4] |
刘辉, 银星宇, 覃文庆, 等. 铅膏碳酸盐化转化过程的研究[J]. 湿法冶金, 2005, 24(3): 146-149. Liu Hui, Yin Xingyu, Qin Wenqing, et al. Conversion of pastes in exhausted lead storage batteries into lead carbonate in sodium carbonate solution[J]. Hydrometallurgy of China, 2005, 24(3): 146-149. (in Chinese) |
| [5] |
Yanakieva V P, Haralampiev G A, Lyakov N K. Desulphurization of the damped lead battery paste with potassium carbonate[J]. Journal of Power Sources, 2000, 85(1): 178-180. DOI:10.1016/S0378-7753(99)00398-5 |
| [6] |
郭光辉, 曹新, 刘芳芳. 化学转化法处理废铅酸电池铅膏制备超细氧化铅[J]. 现代化工, 2015, 35(7): 66-68, 70. Guo Guanghui, Cao Xin, Liu Fangfang. Preparation of ultrafine lead oxide from spent lead paste via chemical conversion[J]. Modern Chemical Industry, 2015, 35(7): 66-68, 70. (in Chinese) |
| [7] |
Zhang W, Yang J, Hu Y, et al. Effect of pH on desulphurization of spent lead paste via hydrometallurgical process[J]. Hydrometallurgy, 2016, 164: 83-89. DOI:10.1016/j.hydromet.2016.05.012 |
| [8] |
孙晓娟, 李卉, 朱新锋, 等. 复合脱硫剂对废铅酸蓄电池铅膏脱硫影响的研究[J]. 蓄电池, 2013, 50(4): 147-152. Sun Xiaojuan, Li Hui, Zhu Xinfeng, et al. Study on effects of complex desulfurizer on the desulfurization ratio of lead pastes from used lead-acid battery[J]. Battery, 2013, 50(4): 147-152. (in Chinese) |
| [9] |
Zhu X, Li L, Sun X, et al. Preparation of basic lead oxide from spent lead acid battery paste via chemical conversion[J]. Hydrometallurgy, 2012, 117: 24-31. |
| [10] |
边文璟, 易亮, 周文芳, 等. 基于表面更新的废铅膏脱硫实验[J]. 化工进展, 2016, 35(5): 1539-1543. Bian Wenjing, Yi Liang, Zhou Wenfang, et al. Experimental research on damped lead paste desulfurization based on the surface updated[J]. Chemical Industry and Engineering Progress, 2016, 35(5): 1539-1543. (in Chinese) |
| [11] |
杜新玲, 王国富. 废旧铅酸蓄电池密闭短窑熔炼的生产实践[J]. 中国有色冶金, 2013, 42(4): 34-38. Du Xinling, Wang Guofu. Production practice of smelting wasted lead-acid battery with sealing short kiln[J]. China Nonferrous Metallurgy, 2013, 42(4): 34-38. (in Chinese) |
| [12] |
Zhang J, Yi L, Yang L, et al. A new pre-desulphurization process of damped lead battery paste with sodium carbonate based on a "surface update" concept[J]. Hydrometallurgy, 2016, 160: 123-128. DOI:10.1016/j.hydromet.2015.12.016 |
| [13] |
孙会兰, 于海燕, 王波, 等. 12CaO·7Al2O3溶出动力学[J]. 中国有色金属学报, 2008, 18(10): 1920-1925. Sun Huilan, Yu Haiyan, Wang Bo, et al. Leaching dynamics of 12CaO·7Al2O3[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(10): 1920-1925. (in Chinese) |
| [14] |
隋丽丽, 翟玉春. 硫酸氢铵焙烧高钛渣的溶出动力学研究[J]. 材料导报, 2013, 27(18): 137-140. Sui Lili, Zhai Yuchun. Dissolving kinetics of roasted high titanium slag by ammonium hydrogen sulfate[J]. Materials Review, 2013, 27(18): 137-140. (in Chinese) |
| [15] |
俞小花, 杨大锦, 谢刚, 等. 含硫酸铅物料的碳酸盐转化试验研究[J]. 中国稀土学报, 2010, 28: 457-460. Yu Xiaohua, Yang Dajin, Xie Gang, et al. Experimental study on carbonate conversion of lead sulfate containing materials[J]. Journal of the Chinese Rare Earth Society, 2010, 28: 457-460. (in Chinese) |
| [16] |
Lyakov N K, Atanasova D A, Vassilev V S, et al. Desulphurization of damped battery paste by sodium carbonate and sodium hydroxide[J]. Journal of Power Sources, 2007, 171(2): 960-965. DOI:10.1016/j.jpowsour.2007.06.014 |
| [17] |
李云, 陈永明, 薛浩天, 等. 氯化铅在碳酸氢铵溶液中的物相转化机理[J]. 中国有色金属学报, 2017, 27(7): 1479-1484. Li Yun, Chen Yongming, Xue Haotian, et al. Phase transformation mechanism of lead chloride in ammonium bicarbonate solution[J]. The Chinese Journal of Nonferrous Metals, 2017, 27(7): 1479-1484. (in Chinese) |
| [18] |
Ma Y, Qiu K. Recovery of lead from lead paste in spent lead acid battery by hydrometallurgical desulfurization and vacuum thermal reduction[J]. Waste Management, 2015, 40: 151-156. DOI:10.1016/j.wasman.2015.03.010 |
| [19] |
陈维平, 杨霞, 曾悦, 等. 废蓄电池泥渣湿法处理过程的热力学和动力学[J]. 矿冶工程, 1997, 17(4): 48-51. Chen Weiping, Yang Xia, Zeng Yue, et al. Wet processing of lead battery sludge:Thermodynamics and kinetics[J]. Mining and Metallurgical Engineering, 1997, 17(4): 48-51. (in Chinese) |
 2020, Vol. 37
2020, Vol. 37