2. 和田师范专科学校, 新疆 和田 848000;
3. 内蒙古工业大学化工学院, 呼和浩特 010051
2. Hetian Normal College, Xinjiang Hetian 848000, China;
3. School of Chemical Engineering, Inner Mongolia University of Technology, Hohhot 010051, China
化石燃料的大规模使用直接导致了大量的二氧化碳排放,而二氧化碳排放又导致了严重的气候变化——温室效应[1-2]。在近年来提出的各种解决二氧化碳释放问题的概念或技术方法中,CO2甲烷化被认为是有效的方法之一,具有广阔的应用前景[3-4]。
在二氧化碳甲烷化的研究中,许多研究者将Ⅷ族金属(Pd[5]、Ru[6]、Rh[7]、Co[8]和Ni[9-11]等)负载在不同的载体上(SiO2[10]、Al2O3[8, 11]、ZrO2[12]、TiO2[13]、CeO2[6, 14]、Y2O3-ZrO2[15]和CeO2-ZrO2[16]等)。其中Pd、Ru和Rh基催化剂具有较高的活性和CH 4选择性,但是高昂的价格限制了其工业应用。Co催化剂活性较好,但是容易发生碳链增长生成大分子碳氢化合物,也易中毒、成本较高,不适合工业应用,很少用作单金属甲烷化催化剂,通常作为助剂或与其他金属组成多金属催化剂使用[17]。镍基催化剂具有较好的催化活性,且廉价易得,具有较好的CO2甲烷化工业应用前景。但是,镍基催化剂存在低温下活性较差和高温下金属镍纳米粒子易烧结等问题。另一方面,由于CO2的惰性,提高其低温活性是一项困难的工作。二氧化碳不能在Al2O3和SiO2等常规载体上被激活,从CO2到CH4是一个具有很大动能势垒的八电子过程,需要有效的催化剂来提高CO2的转化率,尤其是在低温下[18]。
载体是影响CO2甲烷化催化性能的重要因素之一,用于CO2甲烷化反应的载体通常要有大的比表面、好的热稳定性及载体与活性组分具有强的相互作用。被报道的用于CO2甲烷化的载体中,CeO2具有丰富的氧空位有利于CO2的活化,ZrO2具有高的热稳定性和强的CO2吸附性,因此二者常被用于CO2甲烷化催化剂载体。焙烧后的铈锆复合氧化物可形成Ce-Zr固溶体,由于在ZrO2晶格中的Zr4+被Ce4+部分取代,CexZr1-xO2固溶体具有高的储氧能力,氧化还原性能和热稳定性[19],其与活性组分具有强的相互作用。李岩峰等[20]发现,在铈锆固溶体中掺杂过渡金属,可以在不同程度上使其晶格发生畸变,同时易于形成表面晶格缺陷,增强晶格氧的移动能力进而提高催化剂的氧化还原性能[21]。此外,纳米铈锆固溶体具有特殊的萤石结构,将部分金属(包括稀土、过渡金属、碱土或其他金属)掺杂到铈锆固溶体中,可以对这些催化材料的物理化学性质进行可控的调节,以进行特定反应的研究[22]。据报道,由Ce-ZrO2的小颗粒负载的Ni催化剂对于CO2甲烷化具有很高的活性和稳定性[23-25],混合的Ce-Zr氧化物负载的Ni催化剂比相应的Ni/CeO2具有更高的催化活性[16]。
提高活性金属的分散度也是提高CO2甲烷化低温催化活性和热稳定性的一个重要思路。Zhen等[26]通过将Ni纳米颗粒分散到大比表面积的MOF-5载体上,有效提高了活性金属的分散度,得到了低温活性较好的催化剂。此外,螯合剂的加入也会使得Co[27]和Ni活性组分的分散度得到有效的提高。氮三乙酸(NTA)、柠檬酸(CA)和乙二胺四乙酸(EDTA)等多种螯合配体已在加氢处理催化剂的制备中得到应用,有效提高了活性组分的分散度并取得了良好的催化效果。在这些螯合配体中,CA因其低成本、无毒、易于操作和在水溶液中形成稳定的配位化合物而成为潜在的候选配体[28]。从催化剂制备方法出发,等离子体还原法[29]、原位生长法[30]、液相还原法[31]等一些新的催化剂制备方法也可以提升活性组分分散度,从而有效阻止Ni聚集,提高催化活性和稳定性。
本研究中,采用共沉淀法制备了CexZr1-xO2固溶体载体,为了保持Ni NPs的稳定性,同时提高金属Ni在载体表面的分散度,采用柠檬酸络合法负载镍。相较于传统浸渍法,柠檬酸络合法能有效地改善Ni的分散性,而分散性较好的Ni NPs对于CO2甲烷化具有良好的活性。本研究考察了Ni负载量和n(Ce)/ n(Zr)比对催化剂结构和CO2甲烷化催化性能影响,实验结果发现我们制备的Ni/CexZr1-xO2催化剂的催化性能显著优于已报道的Ni/CexZr1-xO2催化剂,这归因于本工作采用了柠檬酸络合技术负载镍。
1 实验部分 1.1 CexZr1-xO2载体的制备采用软模板法,以非离子表面活性剂PEG 4000为模板剂制备CexZr1-xO2(x=0, 0.15, 0.20, 0.25, 0.30, 1.00;x为铈金属离子所占的摩尔分数)载体。将总物质的量为0.025 mol的Ce(NO3)3·6H2O和Zr(NO3)4·5H2O的混合盐与PEG 4000按照一定物质的量之比分别溶于去离子水中。常温搅拌下,将铈锆混合盐溶液和25%(质量分数,下同)的氨水缓慢滴入PEG 4000的水溶液中,该过程始终保持pH值为11(±0.5)。共沉淀完成后,向浆液中加入30 mL无水乙醇,于室温搅拌2 h后,再次加入30 mL无水乙醇,升温至70 ℃,继续搅拌3 h后,70 ℃下恒温老化24 h。待样品冷却至室温,水洗抽滤至中性后,将样品放入冰箱冷冻12 h,冷冻干燥至粉末,再置于马弗炉中,以2 ℃/min的升温速率升温至600 ℃后煅烧3 h,得到所需的CexZr1-xO2载体。
1.2 x%Ni/CexZr1-xO2的制备 1.2.1 x%Ni/Ce0.2Zr0.8O2催化剂的制备采用柠檬酸络合法,在制得的Ce0.2Zr0.8O2的载体上负载不同量的金属Ni,制备x%Ni/Ce0.2Zr0.8O2催化剂(其中x=6、9、12和15)。将Ni(NO3)2·6H2O和无水柠檬酸按照物质的量之比为1.0/1.2溶解于0.6 mL去离子水,常温搅拌15 min至分散均匀。在搅拌后的溶液中滴加4滴乙二醇,超声分散10 min。将所得盐溶液均匀滴加至Ce0.2Zr0.8O2的载体中,室温静置24 h后,将样品置于烘箱中于80 ℃下络合6 h,于120 ℃下干燥12 h。将烘干后的样品以2 ℃/min的升温速率升温至450 ℃下煅烧3 h。实验过程中保证煅烧后所得样品总质量为1 g,所得前驱体在H2气氛中经充分还原后,即得x%Ni/Ce0.2Zr0.8O2催化剂,图 1中用x%Ni/C0.2Z表示。

|
| 图 1 不同Ni负载量催化剂的a)CO2转化率、b)CH4选择性和CO选择性 Fig.1 a) CO2 conversion, b) CH4 selectivity and CO selectivity over catalysts with different Ni loadings |
| |
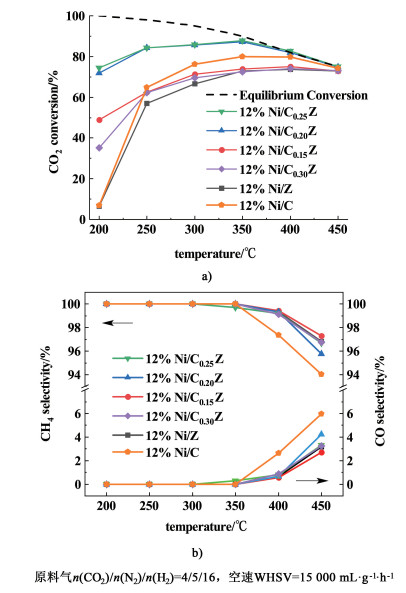
采用柠檬酸络合法,在1.1制得的CexZr1-xO2载体上负载等量的金属Ni,制备12%Ni/CexZr1-xO2催化剂(其中x=0、0.15、0.20、0.25、0.30和1.00)。将Ni(NO3)3·6H2O和无水柠檬酸按照物质的量之比为1.0/1.2溶解于0.6 mL去离子水,常温搅拌15 min至分散均匀。在搅拌后的溶液中滴加4滴乙二醇,超声分散10 min。将所得盐溶液均匀滴加至CexZr1-xO2的载体中,室温静置24 h后,将样品置于烘箱中于80 ℃下络合6 h,于120 ℃下烘干12 h。将烘干后的样品以2 ℃/min的升温速率升温至450 ℃下煅烧3 h。实验过程中保证煅烧后所的样品总质量为1 g,所得前驱体在H2气氛中经充分还原后,即得12%Ni/CexZr1-xO2催化剂,图 2~图 11中用12%Ni/CxZ表示。
|
| 图 2 不同Ce/Zr比催化剂的a)CO2转化率、b)CH4选择性和CO选择性 Fig.2 a) CO2 conversion, b) CH4 selectivity and CO selectivity over catalysts with different Ce/Zr ratio |
| |
|
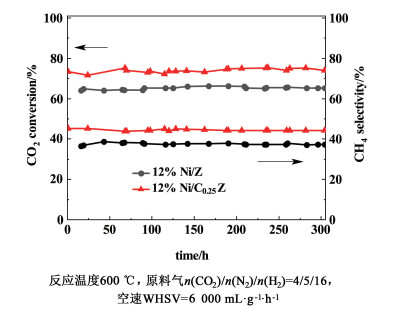
| 图 3 12%Ni/Ce0.25Zr0.75O2和12%Ni/ZrO2催化剂的稳定性测试 Fig.3 Stability test data of the 12%Ni/Ce0.25Zr0.75O2 and 12%Ni/ZrO2 catalyst |
| |
|
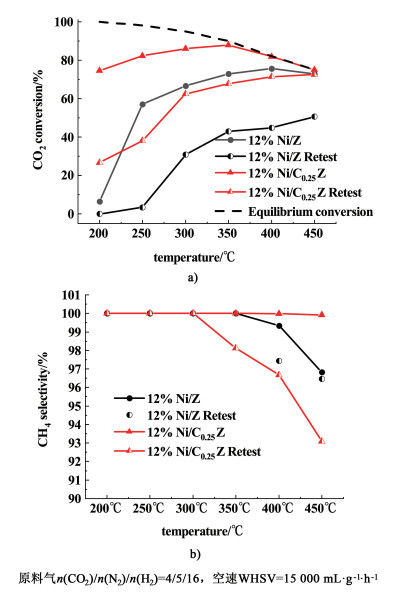
| 图 4 稳定性测试前后催化剂的a)CO2转化率和b)CH4选择性性能测试 Fig.4 a) CO2 conversion and b) CH4 selectivity over catalysts before and after thermal stability test |
| |

|
| 图 5 12%Ni/CexZr1-xO2催化剂的H2-TPR谱图 Fig.5 H2-TPR profiles of the12%Ni/CexZr1-xO2 catalysts |
| |
|
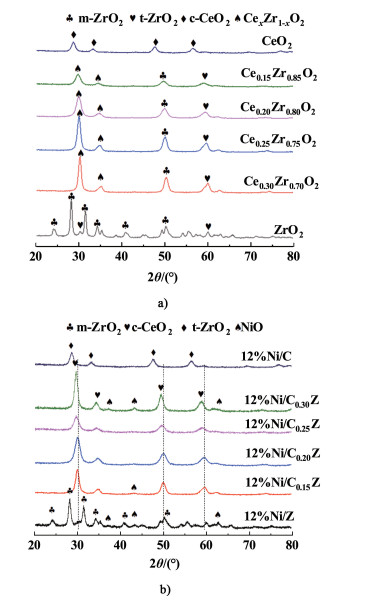
| 图 6 a) 载体CexZr1-xO2的XRD图和b)12%Ni/CexZr1-xO2的XRD图 Fig.6 XRD patterns of a) CexZr1-xO2 and b) 12%Ni/CexZr1-xO2 catalysts |
| |

|
| 图 7 a) 载体的N2吸附-脱附曲线、b)新鲜催化剂的N2吸附-脱附曲线和c)新鲜催化剂的孔径分布曲线 Fig.7 a) Nitrogen adsorption-desorption isotherms of CexZr1-xO2, b) nitrogen adsorption-desorption isotherms of fresh 12%Ni/CexZr1-xO2 catalysts and c) pore size distribution curves of fresh 12%Ni/CexZr1-xO2 catalysts |
| |
|
| 图 8 12%Ni/CexZr1-xO2催化剂的H2-TPD谱图 Fig.8 H2-TPD profiles of fresh 12%Ni/CexZr1-xO2 catalysts |
| |
|
| 图 9 12%Ni/CexZr1-xO2催化剂的CO2-TPD谱图 Fig.9 CO2-TPD profiles of 12%Ni/CexZr1-xO2 catalysts |
| |
|
| 图 10 稳定性测试后12%Ni/ZrO2、12%Ni/Ce0.25Zr0.75O2样品的TG曲线 Fig.10 TG profiles of catalysts after stability test |
| |

|
| 图 11 12%Ni/ZrO2、12%Ni/Ce0.25Zr0.75O2样品稳定性测试前后的XRD图 Fig.11 XRD profiles of catalysts before and after stability test |
| |
CO2甲烷化催化性能测试在常压微型固定床反应器中进行。将制得的催化剂粉末压片并粉碎至粒径在40~60目之间的颗粒,取0.2 g催化剂颗粒装填进内径为7 mm的石英玻璃管中。在开始测试之前,石英管内通入纯H2,流速为32 mL·min-1,将催化剂置于上述气氛中进行原位还原,还原条件为:升温速率2 ℃·min-1,并于450 ℃下保持2 h。催化剂还原后冷却至室温,通入物质的量之比为4:5:16的CO2、N2和H2的混合气体,调节气体流速至50 mL·min-1,折算空速WHSV=15000 mL·g-1·h-1。待原料气混合均匀,多次测试原料气组成至稳定后,升温至200 ℃并稳定1 h后进行催化剂性能测试,之后每隔50 ℃进行采点测试直至450 ℃,每温度点下测试条件、采样次数、恒温时间均相同,每温度下测试2~3次。
测试过程中,反应温度由插入反应床内部的K型热电偶确定,误差(±0.1) ℃。采用配备TCD检测器的福立9790II型气相色谱仪在线分析原料及产物组成,内标气及载气分别为N2和H2。通过CO2转化率(XCO2)、CH4选择性(SCH4)和CO选择性(SCO)对催化剂的性能进行评价。具体计算公式如式(1):
| $ X_{\mathrm{CO}_{2}}=\frac{C_{\mathrm{CO}_{2}(\mathrm{in})}-C_{\mathrm{CO}_{2}(\mathrm{out})}}{C_{\mathrm{CO}_{2}(\mathrm{in})}} $ | (1) |
式(1)中:XCO2为CO2甲烷化反应的转化率;CCO2(in)为原料气中CO2体积分数;CCO2(out)为反应产物中CO2体积分数。
| $ S_{\mathrm{CH}_{4}}=\frac{C_{\mathrm{CH}_{4}(\text { out })}}{C_{\mathrm{CH}_{4}(\text { out })}+C_{\mathrm{CO}(\text { out })}} $ | (2) |
| $ S_{\mathrm{CO}}=\frac{C_{\mathrm{CO}(\text { out })}}{C_{\mathrm{CH}_{4}(\text { out })}+C_{\mathrm{CO}(\text { out })}} $ | (3) |
式(2)和式(3)中:SCH4为反应产物CH4的选择性;SCO为反应产物CO的选择性;CCH4(out)为反应产物中CH4体积分数;CCO(out)为反应产物中CO体积分数。
1.4 催化剂表征样品粉末的X射线衍射测试(XRD)在Bruker D8 Focus X射线衍射仪上进行。采用Cu靶,Kα射线(λ=0.1541 nm),工作电压40 kV,工作电流100 mA,扫描步长8 (°)·min-1,扫描范围为20°~80°。微晶尺寸由Scherrer方程计算,如式(4)。
| $ D=k \lambda /(\beta \cos \theta) $ | (4) |
式(4)中:D为晶粒尺寸,nm;λ=1.5406 nm,为X射线波长;θ为衍射角,β为半峰宽;k=0.89,Scherrer常数。
样品的N2物理吸附-脱附等温线在Trwastar 3000 micromeritics自动物理吸附仪上进行测定。将样品粉末在200 ℃下脱气4 h。之后,在-196 ℃下测定N2吸附和脱附等温线,相对压力为0.05~0.30。由BET方程计算比表面积,由BJH方法计算样品的孔容和孔径分布。
样品的程序升温还原测试(H2-TPR)在Thermo-Finnigan全自动多用吸附仪上进行测定。取40~60目的样品50 mg上下装填石英棉,置于石英反应管中。以30 mL·min-1的速度通入体积分数为5%的H2-Ar混合气还原处理,以2 ℃·min-1的升温速率进行程序升温还原。反应前后H2含量的变化由TCD检测器检测记录,以50 mg CuO的耗氢量为标准校正。
样品的H2程序升温脱附(H2-TPD)和CO2程序升温脱附(CO2-TPD)在全自动化学吸附仪(AutoChem 2910)上进行。取40~60目的样品100 mg上下装填石英棉,置于石英反应管中,在H2气氛下于450 ℃原位还原2 h。待还原后的样品冷却至室温后,开始测试。
对于CO2-TPD测试,采用CO2气流脉冲数次,直至样品不再吸收CO2气体,峰面积恒定。通入流速为30 mL·min-1的He气吹扫30 min以除去样品表面物理吸附的CO2。最后,将样品升温至900 ℃记录脱附峰,程序升温速率为10 ℃·min-1。
对于H2-TPD测试,通入流速为30 mL·min-1的He气吹扫30 min以除去样品表面物理吸附的H2。最后,将样品升温至900 ℃记录脱附峰,程序升温速率为10 ℃·min-1。采用TCD检测器检测尾气中的H2含量,并根据H2-TPD测试结果计算催化剂的相关物理性质。具体计算公式如式(5)~式(7)。
Ni分散度:
| $ D=\frac{2 \cdot V_{\mathrm{ad}} \cdot M \cdot \mathrm{SF}}{m \cdot P \cdot V_{\mathrm{m}} \cdot d_{\mathrm{r}}} \times 100 \% $ | (5) |
金属Ni的比表面积:
| $ S_{\mathrm{Ni}}=\frac{2 V_{\mathrm{ad}} \cdot N_{\mathrm{A}} \cdot \delta_{\mathrm{Ni}}}{m \cdot V_{\mathrm{m}}} $ | (6) |
金属Ni的平均颗粒尺寸:
| $ d=\frac{6 \times 1000 P}{\rho_{\mathrm{Ni}} S_{\mathrm{Ni}}} $ | (7) |
式(5)和式(6)中:Vad为根据H2-TPD计算出的化学吸附H2的体积,标准状况下,mL;M为Ni的相对分子质量,其值为58.693 4 g·mol-1;SF为化学计量因子,化学吸附的n(Ni)/ n(H)为1;m为样品质量,g;P为催化剂样品中金属Ni的理论质量分数;Vm为H2标准状况下的摩尔体积,22 400 mL·mol-1;dr为根据H2-TPD计算出的Ni的还原度;NA为阿伏伽德罗常数,6.02×1023;δN为Ni原子的横截面积,为0.064 9 nm2。
热重分析(TG)在NETZSCH STA 449F5仪器上进行,以计算催化剂稳定性测试后沉积在催化剂表面的积碳量。测试时,取40 mg粉末样品在空气气氛下程序升温,从30 ℃升温至1 000 ℃,升温速率10 ℃·min-1。总质量损失计算公式如式(8)。
| $ \text { 总质量损失 }=\frac{w_{1}-w_{2}}{w_{1}} \times 100 \% $ | (8) |
图 1是不同含量Ni负载在Ce0.2Zr0.8O2上制得的x%Ni/Ce0.2Zr0.8O2催化剂的CO2甲烷化性能数据。
实验结果表明,随着反应温度升高,各催化剂CO2转化率和甲烷选择性均逐渐增大,其中,反应温度为300 ℃时,12% Ni/Ce0.2Zr0.8O2催化剂表现出最高的CO2转化率和CH4选择性。随着反应温度继续升高,各催化剂的CO2转化率开始降低,但12% Ni/Ce0.2Zr0.8O2催化剂的下降程度最小,由此可见,当金属Ni的负载量为12%时,催化剂保持了最佳的催化性能,尤其在低反应温度下(200~300 ℃),明显优于其他负载量的催化剂。
2.1.2 载体n(Ce)/n(Zr)的影响我们采用柠檬酸络合法将12%Ni负载于CexZr1-xO2上制得12%Ni/CexZr1-xO2催化剂,考察了n(Ce)/n(Zr)对催化性能的影响,实验结果见图 2。
结果表明,纯CeO2和ZrO2载体制得的催化剂活性较差,尤其在较低温度范围内,200 ℃时CO2转化率均低于10%。随着ZrO2载体中Ce掺杂量的增加,所得催化剂在低温范围内的活性提高较为明显,且在200~450 ℃反应温度范围内的催化剂活性均优于纯ZrO2负载的催化剂。在Ce掺杂量为25%时,催化剂在反应温度范围内的性能均为同系列最佳,在200 ℃时,其CO2转化率高达74.5%,CH4选择性为100%。随着Ce含量的进一步增大[n(Ce)=0.3],12%Ni/Ce0.3Zr0.7O2催化剂活性降低。从图 2b)不同催化剂的CH4选择性可以看出,在350 ℃以下,所有催化剂的甲烷选择性都接近于100%。由于逆水煤气反应(RWGS)生成副产物CO的原因,当温度高于350 ℃时,所有催化剂的CH4选择性都有所下降。
2.1.3 催化剂的热稳定性测试12%Ni/Ce0.25Zr0.75O2催化剂和12%Ni/ZrO2催化剂的稳定性测试结果如图 3所示,测试期间催化剂未见明显失活,CO2转化率和CH4选择性均较为稳定。但2种催化剂在整个稳定性测试区间内CO2转化率和CH4选择性存在较为明显的差异,12%Ni/Ce0.25Zr0.75O2催化剂的性能始终优于12%Ni/ZrO2催化剂。
稳定性测试结束后,将催化剂降至室温,采用1.3常规性能测试条件重新测试催化剂的性能,并与常规性能测试结果进行比较。12%Ni/Ce0.25Zr0.75O2和12%Ni/ZrO2催化剂热稳定性测试前后的CO2甲烷化性能数据对比如图 4。稳定性测试后的2个催化剂均出现明显的失活现象。但是,12%Ni/ZrO2催化剂的失活程度比12%Ni/Ce0.25Zr0.75O2催化剂更为显著,在200 ℃下的转化率由7%降至0,低温下完全失活。这说明载体中CeO2的加入,在一定程度上可提高催化剂热稳定性。
2.2 催化剂表征 2.2.1 H2-TPR表征图 5为不同n(Ce)/n(Zr)的12%Ni/CexZr1-xO2催化剂的H2-TPR表征结果,因图谱中不同温度下的还原峰出现交叉重叠,不易于分析,故已对图谱进行分峰拟合处理。
如图 5所示,12%Ni/Ce0.15Zr0.85O2、12%Ni/Ce0.2Zr0.8O2、12%Ni/Ce0.25Zr0.75O2、12%Ni/Ce0.3Zr0.7O2、12%Ni/ZrO2催化剂中均出现了明显的H2吸收峰。第1个还原峰出现在较低温度(340 ℃附近),当归属于与载体之间弱相互作用高度分散的NiO的还原;而第2个还原峰出现在较高温度(435 ℃附近),当归属于与ZrO2载体之间强相互作用NiO的还原。在12%Ni/ZrO2中2个还原峰出现较为明显的叠加,从2个还原峰的峰面积大小比较可以看出,第1个还原峰的面积大于第2个还原峰的峰面积,说明在12%Ni/ZrO2催化剂中,与载体弱相互作用的NiO占比较大。纯的CeO2为载体的12%Ni/CeO2催化剂在270~400 ℃时出现了大包峰,这也可归属于高度分散在载体表面的NiO还原峰和与载体强作用NiO的还原峰的重叠。
随着载体中Ce含量的不断增加,载体形成铈锆固溶体,对应的12%Ni/Ce0.15Zr0.85O2、12%Ni/Ce0.2Zr0.8O2和12%Ni/Ce0.25Zr0.75O2催化剂中2个还原峰发生明显重叠,且随着载体中CeO2含量的增加,还原温度明显向高温方向移动。这说明CeO2-ZrO2固溶体的形成,使催化剂中NiO NPs与载体之间相互作用明显增强。随着Ce含量进一步增加,12%Ni/Ce0.3Zr0.7O2催化剂340 ℃附近与载体弱作用的还原峰基本消失,完全转变为与载体强相互作用的NiO,这有利于提高催化剂的稳定性。但是,这会致使还原变得困难,从而降低催化剂的低温活性。
对于上述催化剂,TPR测试计算得到的H2消耗量基本上等于NiO完全还原为金属Ni的理论值,如表 1所示。
| Samples | Reduction degree/% |
| 12%Ni/Z | 99.80 |
| 12%Ni/C0.15Z | 99.50 |
| 12%Ni/C0.2Z | 99.60 |
| 12%Ni/C0.25Z | 100.00 |
| 12%Ni/C0.3Z | 99.80 |
| 12%Ni/C | 100.00 |
铈锆固溶体载体的晶胞参数、晶相组成及晶粒尺寸见表 2,结合图 6a)CexZr1-xO2载体XRD图可知,纯CeO2经煅烧后形成了立方萤石结构(PDF 34-0394),在2θ值为28.59°、33.12°、47.51°、56.38°和69.44°的衍射峰分别归属于立方CeO2的(111)、(200)、(220)、(311)和(400)晶面的特征衍射峰。纯ZrO2载体经煅烧后形成了单一的单斜晶形(PDF 37-1484),在2θ值为24.13°、28.29°、31.51°、34.22°和35.33°的衍射峰分别归属于单斜ZrO2(110)、(-111)、(111)、(200)、(002)晶面的特征衍射峰。如图 6a)所示,在ZrO2中掺杂少量CeO2引起了晶形的变化,从单斜相转变为四方相,且复合氧化物中没有明显的游离的CeO2或ZrO2的特征衍射峰,结合其晶胞参数的变化规律,说明Ce已进入ZrO2晶格中,形成了均匀的铈锆固溶体结构[32-33],没有出现相的分离。
| Samples | Cell parameters/nm | Cell volume×103/nm3 | Crystalline phase | Grain size/nma |
| ZrO2 | a=0.530, b=0.520, c=0.514 | 140.00 | 单斜 | 11.6 |
| Ce0.15Zr0.85O2 | a=0.362, b=0.362, c=0.515 | 67.55 | 四方 | 14.9 |
| Ce0.2Zr0.8O2 | a=0.360, b=0.360, c=0.515 | 66.71 | 四方 | 6.0 |
| Ce0.25Zr0.75O2 | a=0.360, b=0.360, c=0.515 | 66.71 | 四方 | 5.4 |
| Ce0.3Zr0.7O2 | a=0.360, b=0.360. c=0.515 | 66.71 | 四方 | 12.4 |
| CeO2 | a=0.537, b=0.537, c=0.537 | 154.60 | 立方 | 6.2 |
| a:晶粒尺寸依据图 6a)载体XRD图谱中标注的主要衍射峰计算得来,为各晶面晶粒的平均粒径。 | ||||
值得注意的是,随着CeO2的摩尔分数从15%增加到30%,ZrO2的特征衍射峰2θ逐渐向低角度偏移,这是由于Ce4+离子半径(0.101 nm)比Zr4+离子半径(0.086 nm)大,当Ce4+取代Zr4+时,铈锆固溶体的晶格变大引起的。
图 6b)为不同n(Ce)/n(Zr)催化剂的XRD谱图。由图 6b)可见,Ni/Zr催化剂上出现NiO的(111)(200)(220)衍射峰,未发现其它形态镍的出现。随着CeO2的掺杂,Ni/CexZr1-xO2催化剂(x=0.20和0.25)上未发现明显的NiO的衍射峰,这说明铈锆固溶体的形成易于NiO在载体上的高度分散,这与载体的高比表面积和螯合剂柠檬酸的加入有关。当CeO2的掺杂量为x=0.15时,在Ni/Ce0.15Zr0.85O2催化剂上出现NiO(200)衍射峰,当CeO2的掺杂量增加到x=0.30时,在Ni/Ce0.3Zr0.7O2催化剂上出现NiO(111)、(200)、(220)衍射峰,对应表 2可知,Ce0.15Zr0.85O2和Ce0.3Zr0.7O2载体的晶粒尺寸达到最大值,同时催化剂的N2-吸附脱附的测试结果显示Ni/Ce0.3Zr0.7O2催化剂具有最小的比表面积。综上所述,与已报道的Ni/Ce-Zr-O催化剂相比[16, 33],采用柠檬酸络合法制备的Ni/CexZr1-xO2催化剂具有更高的NiO分散度和更大的比表面积,结合性能测试结果可以发现,我们制备的Ni/Ce0.25Zr0.75O2催化剂表现出更好活性。
2.2.3 N2吸附-脱附表征不同n(Ce)/n(Zr)载体和Ni基催化剂的N2吸附-脱附等温线和孔径分布曲线分别如图 7a)、图 7b)和图 7c)所示,根据IUPAC分类,6种载体及对应催化剂的吸附等温线均为典型的具有H2型回滞环的Ⅳ型等温线形态。当相对压力在0.6~1.0范围内时,出现明显的毛细管凝结现象,表明所有样品均为介孔材料,这有利于Ni纳米颗粒在载体上的高度分散。
与载体相比,催化剂的回滞环面积明显减小,但也具有明显的介孔结构,这说明活性组分Ni进入了载体的孔道中并成功负载在其内表面[36]。
催化剂样品的比表面积、孔容和平均孔径在表 3中列出。其中12%Ni/Ce0.25Zr0.75O2催化剂具有最大的比表面积140.84 m2·g-1,而12%Ni/Ce0.3Zr0.7O2具有最小的比表面积58.41 m2·g-1,这说明不同的铈锆比显著影响催化剂的孔结构和比表面积,12%Ni/Ce0.25Zr0.75O2大的比表面积有利于活性组分NiO的分散,这与XRD、H2-TPD和性能测试结果是一致的,12%Ni/Ce0.25Zr0.75O2催化剂的NiO处于高分散状态,该催化剂表现出最优的催化活性及良好的热稳定性。
| Samples | n(CeO2)/ % |
w(Ni)/ % |
SBET(carrier)/ (m2·g-1) |
SBET(catalyst)/ (m2·g-1) |
Pore size/ nm |
VBJH/ (cm3·g-1) |
Crystal sizea/ nm |
| 12%Ni/Z | 0 | 12 | 89.54 | 120.52 | 12.47 | 0.36 | 11.6 |
| 12%Ni/C0.15Z | 15 | 12 | 83.46 | 108.91 | 9.51 | 0.21 | 14.9 |
| 12%Ni/C0.2Z | 20 | 12 | 124.31 | 116.24 | 3.82 | 0.17 | 6.0 |
| 12%Ni/C0.25Z | 25 | 12 | 127.25 | 140.84 | 4.92 | 0.21 | 5.4 |
| 12%Ni/C0.3Z | 30 | 12 | 79.15 | 58.41 | 12.36 | 0.20 | 12.4 |
| 12%Ni/C | 100 | 12 | 88.02 | 75.99 | 3.83 | 0.14 | 6.2 |
| a:晶粒尺寸依据图 6b)催化剂XRD图谱中标注的主要衍射峰计算得来,为各晶面晶粒的平均粒径。 | |||||||
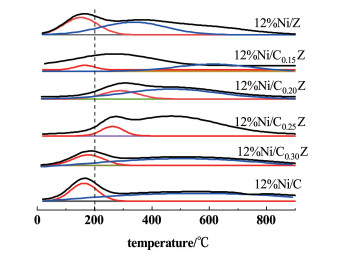
不同n(Ce)/n(Zr)的12%Ni/Ce1-xZrxO2催化剂的H2-TPD谱图见图 8。
由图 8可见,各催化剂在低温和高温均有脱附峰存在,其中低温下的脱附峰是H2与Ni弱作用的脱附峰,高温下的脱附峰是H2和催化剂表面的活性组分的强作用的脱附峰,这说明催化剂存在有2个活性位,这与H2-TPR的结果是一致的。随着载体中Ce含量的增加,对应催化剂的强吸附作用逐渐增强,但当Ce含量过高时催化剂中强吸附作用减弱。对应性能测试结果可知,对于CO2甲烷化的反应,2个活性位均是起作用的,但高温下的强吸附峰影响较大。由H2-TPD测试中H2脱附量计算得出活性金属Ni的分散度DNi、比表面积SNi、平均颗粒尺寸dNi在表 4中列出。由表 4可知,随着CeO2含量的不断增加,金属Ni的平均粒径总体呈现出先减小后增大的趋势,12%Ni/Ce0.25Zr0.75O2催化剂中Ni的平均粒径最小。另外,金属Ni的分散度呈现先增大后减小的趋势,同样的12%Ni/Ce0.25Zr0.75O2催化剂中Ni的分散度最大。这与XRD结果是一致的。
| Catalyst | H2-uptake/ (mL·g-1) |
DNi/ % |
SNi/ (m2·g-1) |
dNi/ nm |
| 12%Ni/Z | 2.84 | 12.40 | 9.91 | 8.16 |
| 12%Ni/C0.15Z | 1.73 | 7.54 | 6.02 | 13.43 |
| 12%Ni/C0.2Z | 1.95 | 8.50 | 6.79 | 11.92 |
| 12%Ni/C0.25Z | 2.67 | 11.67 | 9.32 | 8.68 |
| 12%Ni/C0.3Z | 1.70 | 7.43 | 5.94 | 13.63 |
| 12%Ni/C | 1.82 | 7.93 | 6.33 | 12.77 |
对于12%Ni/Ce1-xZrxO2体系而言,CO2的本征活性主要取决于活性金属Ni的平均颗粒尺寸和分散度。而反应的低温活性主要受2种因素影响,1)催化剂的本征活性;2)活性金属的比表面积即活性位点数目。综合2种因素影响,从催化剂性能表现上来看,12%Ni/Ce0.25Zr0.75O2催化剂性能最佳,这与本结果基本一致。
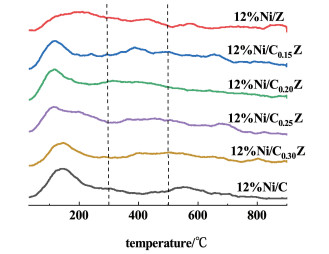
2.2.5 CO2-TPD表征通过CO2-TPD分别测试了12%Ni/Ce0.15Zr0.85O2、12%Ni/Ce0.2Zr0.8O2、12%Ni/Ce0.25Zr0.75O2、12%Ni/Ce0.3Zr0.7O2、12%Ni/ZrO2和12%Ni/CeO2催化剂上的碱性位点分布情况,如图 9所示。
所有催化剂的解吸峰可以划分为3个吸附区,分别对应3种具有不同基本特征的碱性位点,其中,弱碱性位点(0~300 ℃)与表面OH-有关,中强碱性位点(300~500 ℃)与金属-氧对有关,强碱性位点(>500 ℃)与低配位的表面O2-有关[35]。在ZrO2载体上,有较大的CO2解吸峰,说明ZrO2本身具有较强的CO2吸附能力。研究表明,CO2甲烷化反应主要受中等强度碱性位点的影响。弱吸附的CO2未被完全活化,而过强吸附的CO2难以从催化剂表面解吸[37]。由图 9可明显观察到,随着Ce掺杂量的提高,催化剂上的弱碱性位点明显增多,而中强碱性位点和强碱性位点的吸收峰并未发生明显变化,可以认为,Ce的掺杂并未显著提升催化剂上碱性位点的数量。从催化剂性能测试的结果来看,由于一系列催化剂之间碱性位点差别不大,并未显著影响催化剂的低温活性。催化剂的性能主要受活性组分晶粒尺寸、活性组分分散度以及比表面积影响[34],结合前述表征结果可知,柠檬酸络合的制备方法能有效提高NiO在载体上的分散度,其中12%Ni/Ce0.25Zr0.75O2催化剂具有最小的晶粒尺寸、最大的比表面积和最好的活性组分分散度,对应该催化剂表现出最好的催化活性和热稳定性。
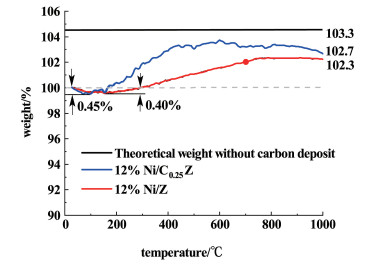
2.2.6 稳定性测试后催化剂的TG测试分别对稳定性实验后的12%Ni/ZrO2和12%Ni/Ce0.25Zr0.75O2催化剂进行热重分析以测试催化剂上的积碳情况。图 10中,黑色直线表示新鲜催化剂完全氧化后的理论质量,2条曲线分别表示稳定性试验后12%Ni/Ce0.25Zr0.75O2和12%Ni/ZrO2催化剂在空气中加热后的质量变化。
热重分析测试中,催化剂的质量变化主要包括2方面,还原后催化剂的活性组分Ni在空气中氧化为NiO会使催化剂的质量增加,而积碳氧化会使催化剂的质量减少[18]。0~200 ℃之间的质量损失0.45%应为水分的损失,升温至1 000 ℃后,12%Ni/Ce0.25Zr0.75O2催化剂的质量增至102.7%。按照积碳量=催化剂理论增质量-(实际增质量+水分损失)的计算方法得到:12%Ni/Ce0.25Zr0.75O2催化剂的积碳量为0.15%,12%Ni/ZrO2催化剂的积碳量为0.6%。这说明Ce的掺杂具有一定的抗积碳作用。
12%Ni/ZrO2和12%Ni/Ce0.25Zr0.75O2催化剂还原后和稳定性测试后的XRD谱图如图 11所示,与12%Ni/ZrO2催化剂相比,还原后12%Ni/Ce0.25Zr0.75O2催化剂未见明显的Ni0特征衍射峰,这再一次证明了Ce掺杂和柠檬酸络合的制备方法使得中活性组分Ni具有高的分散性。稳定测试后,2种催化剂在2θ=45.5°附近均出现Ni的特征衍射峰,但12%Ni/Ce0.25Zr0.75O2催化剂Ni的聚集程度明显低于12%Ni/ZrO2催化剂,这说明12%Ni/Ce0.25Zr0.75O2催化剂具有更好的抗烧结性。
3 结论用软模板法成功制备了不同n(Ce)/n(Zr)的CexZr1-xO2固溶体,采用柠檬酸络合浸渍法负载了NiO纳米颗粒制得用于CO2甲烷化催化剂,考察了Ni负载量和n(Ce)/n(Zr)对催化剂结构和性能的影响。结果表明,柠檬酸络合法负载活性组分镍实现了镍的高分散。随着Ce4+部分取代Zr4+形成CexZr1-xO2固溶体,ZrO2晶形由单斜相转变为四方相,形成的铈锆固溶体载体有利于增强活性金属Ni和载体之间的相互作用,其中12%Ni/Ce0.25Zr0.75O2催化剂具有比表面积最大,Ni晶粒尺寸最小,分散度最高的结构特征,在350 ℃、0.1 MPa和WHSV为15 000 mL·g-1·h-1的反应条件下,12%Ni/Ce0.25Zr0.75O2催化剂的CO2转化率达到平衡转化率84%,CH4选择性为100%,具有最佳的催化性能。热稳定性测试结果表明,12%Ni/Ce0.25Zr0.75O2催化剂具有更好的抗积碳和抗烧结性,这也是源于CeO2的掺杂提高了催化剂的储释氧能力以及NiO的分散度。
| [1] |
Lechkar A, Barroso B A, Blanco G, et al. Methanation of carbon dioxide over ceria-praseodymia promoted Ni-alumina catalysts. Influence of metal loading, promoter composition and alumina modifier[J]. Fuel, 2018, 234: 1401-1413. DOI:10.1016/j.fuel.2018.07.157 |
| [2] |
Liang C, Hu X, Wei T, et al. Methanation of CO2 over Ni/Al2O3 modified with alkaline earth metals:Impacts of oxygen vacancies on catalytic activity[J]. International Journal of Hydrogen Energy, 2019, 44(16): 8197-8213. DOI:10.1016/j.ijhydene.2019.02.014 |
| [3] |
Marocco P, Morosanu E A, Giglio E, et al. CO2 methanation over Ni/Al hydrotalcite-derived catalyst:Experimental characterization and kinetic study[J]. Fuel, 2018, 225: 230-242. DOI:10.1016/j.fuel.2018.03.137 |
| [4] |
Urasaki K, Sekine Y, Kawabe S, et al. Catalytic activities and coking resistance of Ni/perovskites in steam reforming of methane[J]. Applied Catalysis A:General, 2005, 286(1): 23-29. DOI:10.1016/j.apcata.2005.02.020 |
| [5] |
Hyun Y K, Hyuck M L, Jung-Nam P. Bifunctional mechanism of CO2 methanation on Pd-MgO/SiO2 catalyst:Independent roles of MgO and Pd on CO2 methanation[J]. J. Phys. Chem. C, 2010, 114: 7128-7131. DOI:10.1021/jp100938v |
| [6] |
Wang F, He S, Chen H, et al. Active site dependent reaction mechanism over Ru/CeO2 catalyst toward CO2 methanation[J]. Journal of the American Chemical Society, 2016, 138(19): 6298-6305. DOI:10.1021/jacs.6b02762 |
| [7] |
Trovarelli A, Deleitenburg C, Dolcetti G, et al. CO2 methanation under transient and steady-state conditions over Rh/CeO2 and CeO2-promoted Rh/SiO2:The role of surface and bulk ceria[J]. Journal of Catalysis, 1995, 151(1): 111-124. |
| [8] |
Daroughegi R, Meshkani F, Rezaei M. Enhanced activity of CO2 methanation over mesoporous nanocrystalline Ni-Al2O3 catalysts prepared by ultrasound-assisted co-precipitation method[J]. International Journal of Hydrogen Energy, 2017, 42(22): 15115-15125. DOI:10.1016/j.ijhydene.2017.04.244 |
| [9] |
张浩, 武媛媛, 胡彤宇, 等. La2O3含量对La-Ni/ZrO2-Al2O3催化剂甲烷化性能的影响[J]. 化学工业与工程, 2018, 35(1): 39-44. Zhang Hao, Wu Yuanyuan, Hu Tongyu, et al. Effect of La2O3 addition on catalytic performance of La-Ni/ZrO2-Al2O3 catalyst for syngas methanation[J]. Chemical Industry and Engineering, 2018, 35(1): 39-44. (in Chinese) |
| [10] |
Guo M, Lu G. The effect of impregnation strategy on structural characters and CO2 methanation properties over MgO modified Ni/SiO2 catalysts[J]. Catalysis Communications, 2014, 54: 55-60. DOI:10.1016/j.catcom.2014.05.022 |
| [11] |
Song F, Zhong Q, Yu Y, et al. Obtaining well-dispersed Ni/Al2O3 catalyst for CO2 methanation with a microwave-assisted method[J]. International Journal of Hydrogen Energy, 2017, 42(7): 4174-4183. DOI:10.1016/j.ijhydene.2016.10.141 |
| [12] |
Takano H, Kirihata Y, Izumiya K, et al. Highly active Ni/Y-doped ZrO2 catalysts for CO2 methanation[J]. Applied Surface Science, 2016, 388: 653-663. DOI:10.1016/j.apsusc.2015.11.187 |
| [13] |
Liu J, Li C, Wang F, et al. Enhanced low-temperature activity of CO2 methanation over highly-dispersed Ni/TiO2 catalyst[J]. Catalysis Science & Technology, 2013, 3(10): 2627-2633. |
| [14] |
Fukuhara C, Hayakawa K, Suzuki Y, et al. A novel nickel-based structured catalyst for CO2 methanation:A honeycomb-type Ni/CeO2 catalyst to transform greenhouse gas into useful resources[J]. Applied Catalysis A:General, 2017, 532: 12-18. DOI:10.1016/j.apcata.2016.11.036 |
| [15] |
Simonetta T, Igor L, Fabio L, et al. Nickel supported on Y2O3-ZrO2 as highly selective and stable CO2 methanation catalyst for in-situ propellant production on Mars[C]//2018 5th IEEE International Workshop on Metrology for AeroSpace (MetroAeroSpace), 20-22 June 2018, doi: 10.1109/MetroAeroSpace.2018.8453548
|
| [16] |
Pan Q, Peng J, Sun T, et al. CO2 methanation on Ni/Ce0.5Zr0.5O2 catalysts for the production of synthetic natural gas[J]. Fuel Processing Technology, 2014, 123: 166-171. DOI:10.1016/j.fuproc.2014.01.004 |
| [17] |
Harshini D, Kwon Y, Han J. Suppression of carbon formation in steam reforming of methane by addition of Co into Ni/ZrO2 catalysts[J]. Korean Journal of Chemical Engineering, 2010, 27(2): 480-486. |
| [18] |
Wang W, Gong J. Methanation of carbon dioxide:An overview[J]. Frontiers of Chemical Science and Engineering, 2011, 5(1): 2-10. |
| [19] |
Roh H S, Koo K Y, Yoon W L. Combined reforming of methane over co-precipitated Ni-CeO2, Ni-ZrO2 and Ni-Ce0.8Zr0.2O2 catalysts to produce synthesis gas for gas to liquid (GTL) process[J]. Catalysis Today, 2009, 146(1/2): 71-75. |
| [20] |
李岩峰, 李梅, 柳召刚, 等. 铈锆固溶体掺杂改性的研究进展[J]. 稀土, 2009, 30(5): 78-83. Li Yanfeng, Li Mei, Liu Zhaogang. Research progress of doping modification of cerium zirconium solid solution[J]. Rare earth, 2009, 30(5): 78-83. (in Chinese) |
| [21] |
Shao J, Zhang P, Tang X, et al. Effect of preparation method and calcination temperature on low-temperature CO oxidation over Co3O4/CeO2 Catalysts[J]. Chinese Journal of Catalysis, 2007, 28(2): 163-169. DOI:10.1016/S1872-2067(07)60015-1 |
| [22] |
Liu J, Zhao Z, Xu C, et al. Structure, synthesis, and catalytic properties of nanosize cerium-zirconium-based solid solutions in environmental catalysis[J]. Chinese Journal of Catalysis, 2019, 40(10): 1438-1487. DOI:10.1016/S1872-2067(19)63400-5 |
| [23] |
Zhang Q, Li Y, Xu B. Reforming of methane and coalbed methane over nanocomposite Ni/ZrO2 catalyst[J]. Catalysis Today, 2004, 98(4): 601-605. |
| [24] |
Xu B, Wei J, Wang H, et al. Nano-MgO:Novel preparation and application as support of Ni catalyst for CO2 reforming of methane[J]. Catalysis Today, 2001, 68(1/2/3): 217-225. |
| [25] |
Roh H S, Potdar H S, Jun K. Carbon dioxide reforming of methane over co-precipitated Ni-CeO2, Ni-ZrO2 and Ni-Ce-ZrO2 catalysts[J]. Catalysis Today, 2004, 93/94/95: 39-44. |
| [26] |
Zhen W, Li B, Lu G, et al. Enhancing catalytic activity and stability for CO2 methanation on Ni@MOF-5 via control of active species dispersion[J]. Chemical Communications, 2015, 51(9): 1728-1731. DOI:10.1039/C4CC08733J |
| [27] |
Klimova T E, Valencia D, Mendoza-Nieto J A, et al. Behavior of NiMo/SBA-15 catalysts prepared with citric acid in simultaneous hydrodesulfurization of dibenzothiophene and 4, 6-dimethyldibenzothiophene[J]. Journal of Catalysis, 2013, 304: 29-46. DOI:10.1016/j.jcat.2013.03.027 |
| [28] |
Wu H, Duan A, Zhao Z, et al. Preparation of NiMo/KIT-6 hydrodesulfurization catalysts with tunable sulfidation and dispersion degrees of active phase by addition of citric acid as chelating agent[J]. Fuel, 2014, 130: 203-210. DOI:10.1016/j.fuel.2014.04.038 |
| [29] |
王伟.氢等离子还原法制备磷化镍及加氢精制催化性能研究[D].辽宁大连: 大连理工大学, 2018 Wang Wei. Preparation of nickel phosphides by hydrogen plasma reduction and their catalytic performance in hydrotreatment[D]. Liaoning Dalian: Dalian University of Technology, 2018 |
| [30] |
张燕平, 杨春辉, 陈攀, 等. 基于原位生长法的Ni-Ce-LDHs/γ-Al2O3催化剂在CO2甲烷化反应中的活性研究[J]. 山东化工, 2016, 45(13): 33-35. Zhang Yanping, Yang Chunhui, Chen Pan, et al. Study on the activity of Ni-Ce-LDHs/γ-Al2O3 catalyst in CO2 methanation reaction based on in situ growth method[J]. Shandong Chemical Industry, 2016, 45(13): 33-35. (in Chinese) |
| [31] |
张涛, 刘洋, 赵凯, 等. 液相还原法制备纳米镍粉[J]. 材料科学与工艺, 2008, 26(6): 51-56. Zhang Tao, Liu Yang, Zhao Kai, et al. Preparation of nanometer nickel powder by liquid phase reduction[J]. Materials Science and Technology, 2008, 26(6): 51-56. (in Chinese) |
| [32] |
Kambolis A, Matralis H, Trovarelli A, et al. Ni/CeO2-ZrO2 catalysts for the dry reforming of methane[J]. Applied Catalysis A:General, 2010, 377(1/2): 16-26. |
| [33] |
Nie X, Li W, Jiang X, et al. Recent advances in catalytic CO2 hydrogenation to alcohols and hydrocarbons[J]. Advances in Catalysis, 2019, 65: 121-233. |
| [34] |
Yu Y, Bian Z, Song F, et al. Influence of calcination temperature on activity and selectivity of Ni:CeO2 and Ni:Ce0.8Zr0.2O2 catalysts for CO2 methanation[J]. Topics in Catalysis, 2018, 61(15): 1514-1527. |
| [35] |
Pan Q, Peng J, Sun T, et al. Insight into the reaction route of CO2 methanation:Promotion effect of medium basic sites[J]. Catalysis Communications, 2014, 45: 74-78. DOI:10.1016/j.catcom.2013.10.034 |
| [36] |
Tan J, Wang J, Zhang Z, et al. Highly dispersed and stable Ni nanoparticles confined by MgO on ZrO2 for CO2 methanation[J]. Applied Surface Science, 2019, 481: 1538-1548. DOI:10.1016/j.apsusc.2019.03.217 |
| [37] |
Yan Y, Dai Y, He H, et al. A novel W-doped Ni-Mg mixed oxide catalyst for CO2 methanation[J]. Applied Catalysis B:Environmental, 2016, 196: 108-116. DOI:10.1016/j.apcatb.2016.05.016 |
 2020, Vol. 37
2020, Vol. 37





