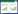直接尿素燃料电池(DUFC)具有易于运输和存储燃料的优点,且产物不具有污染性[1]。提高尿素电氧化反应的催化活性对于改善直接尿素燃料电池的性能并加速其商业化过程至关重要。镍是一种理想的过渡金属催化剂,对尿素电氧化具有较高活性和稳定性[2-4],然而其性能距离商业化实用尚有较大距离。研究表明,在碱性介质中,镍基催化剂上的尿素通过间接和直接途径被氧化:1)间接途径:电化学-化学(E-C)机理[5-7]。首先,Ni(OH)2在电化学反应中形成活性催化剂(NiOOH)并释放出电子,活性催化剂(NiOOH)与有机分子(尿素)之间的化学反应将尿素氧化分解为氮气和二氧化碳。同时,活性催化剂(NiOOH)被还原为Ni(OH)2,并且失去了活性催化位点。2)直接途径:Guo等[6]认为尿素氧化的直接途径是:尿素首先与OH-分离并吸附到NiOOH上,OH-基团使胺基去质子化,解吸剩余的氮,同时将电子直接转移到电极上。吸附在NiOOH上的OH-和来自电解质中的OH-同时将CO2氧化成碳酸盐并最终被释放出来。目前,尿素电氧化催化剂的研究主要集中在以下3个方面:1)在Ni基催化剂中掺杂其它金属以制备二元或多元金属催化剂,利用多种金属之间的协同作用来克服Ni基催化剂在尿素电氧化反应中的初始氧化电位较高、电化学极化较大等问题[2, 8-9]。2)使用新的载体代替传统的载体-Vulcan-XC72R是尿素电氧化催化剂研究的热点之一[10-12]。目前,已报道的有活性炭[13]、石墨烯[14]、三维石墨烯[15]和泡沫镍[16]等。3)通过将其它氧化物添加到NiO催化剂中来构建混合氧化物[15]。在电催化反应中,混合氧化物将促进NiO向α-Ni(OH)2的转化并增强催化剂的活性。尽管上述的研究已取得较大的成果,然而尿素电氧化催化剂的性能仍远远不能满足实用化的要求,需要寻找新的思路来构建Ni基合金催化剂。另外尿素电氧化催化剂为负载型电催化剂,其载体上官能团的种类对催化剂的性能至关重要,但目前尚无系统的报道。本研究通过液相还原法制备了高性能的NixB/多壁碳纳米管(MWCNTs)电催化剂,初步研究了官能团对NixB/MWCNTs催化剂表面化学状态和电催化活性的影响。
1 实验材料和方法 1.1 实验材料用作载体的所有功能性碳纳米管(FCNT)均购自XFNano。表 1总结了3种FCNT的特性。碳纸(Toray碳纸060,TGP-H-60)由Toray Inc.提供。
| electrocatalyst | length/μm | diameter/nm | function group content | ssa/(m2·g) | density/(g·cm3) |
| OH-MWCNTs | 0.5~2.0 | 8~15 | Hydroxyl content:3.70% | >233.0 | ~2.10 |
| NH2-MWCNTs | 0.5~2.0 | 8~15 | Ammonia content:0.45% | >233.0 | 0.27 |
| N-MWCNTs | 50.0 | 30~80 | Nitrogen content>2.50% | >78.9 | 0.27 |
将0.3 g的FCNT和3 mmol·L-1的氯化镍溶解在50 mL的乙二醇中,将混合物超声20 min后,在70 ℃水浴下搅拌60 min,然后将10 mL N2H4·H2O(质量分数为80%)缓慢添加到混合物中。再加入10 mL KOH溶液(10 mol·L-1),直到Ni2+完全还原。混合物自然冷却后,将溶液过滤,洗涤,在60 ℃下真空干燥3 h。
1.3 NixB/OH-MWCNTs的制备将100 mg OH-MWCNTs加入到含100 mL蒸馏水的烧杯中,超声处理30 min后,在连续搅拌下将1.0 mmol·L-1的NiCl2·6H2O溶液加入到悬浊液中,15 min后,将含有1.0 mol·L-1 NaBH4和0.1 mol· L-1 NaOH的10 mL水溶液缓慢加入到悬浊液中。45 min后,将悬浊液过滤,洗涤至中性。然后将沉淀物冷冻干燥24 h以获得负载在OH-MWCNT上的NixB纳米颗粒,称为NixB/OH-MWCNT。
1.4 电化学测量使用三电极体系表征所制备的催化剂的电催化活性。大面积的Pt箔作为对电极,参比电极为Hg/HgO电极。工作电极的制备如下:将10 mg的催化剂加入到1 mL的无水乙醇中,该乙醇含有60 μL Nafion溶液(质量分数为5%的溶液)。将该催化剂浆料混合物超声分散30 min,使用微量移器将70 μL催化剂浆料转移到准备好的碳纸电极表面(1 cm×1 cm)然后在343 K的烘箱中干燥10 min。所有实验均在1.0 mol·L-1 NaOH+0.33 mol·L-1尿素溶液中进行。电化学实验用PARSTAT2273电化学工作站(Princeton Applied Research Inc.)进行。循环伏安图(CV)的扫描速率为20 mV·s-1,计时电流法(CA)的阶跃电位为0.55 V。
1.5 材料表征实验中采用X射线衍射技术(XRD)分析样品物相[日本理学公司,Rigaku D/Max 2 500 V/PC,Cu靶,Kα辐射,入射波长λ=0.1541 nm,扫描角度10°~90°,扫速为4 (°)/min];采用场发射透射电子显微镜技术(TEM)对样品进行形貌、晶体结构分析(Tecnai G2 F20 Stwin型);采用ESCALAB250型X射线光电子能谱仪(XPS)来表征样品表面的元素及元素化合价态[ESCALAB250型,Al靶,Kα辐射(hv=1486.6 eV)作为激发源]。
2 结果与讨论 2.1 MWCNTs表面官能团的影响图 1为Ni/N-MWCNT、Ni/NH2-MWCNT和Ni/OH-MWCNT的XRD谱图。
|
| (a)Ni/OH-MWCNTs,(b)Ni/NH2-MWCNTs,(c)Ni/N-MWCNTs(d)NixB/OH-MWCNTs (a)Ni/OH-MWCNTs, (b)Ni/NH2MWCNTs, (c) Ni/N-MWCNTs, (d) NixB/OH-MWCNTs 图 1 3种Ni基/FCNTs电催化剂的XRD图谱 Fig.1 XRD patterns of three Ni-based/FCNTs electrocatalysts. |
| |
从图 1中可以看到,在2θ≈25°处出现了明显的衍射峰,这是碳的特征峰,表明3种催化剂中存在MWCNT[17]。而在2θ=44.0°,51.0°和76.0°处的3个峰分别对应于Ni的(111)、(200)和(220)晶面[JCPDS(89-7128)],表明镍的金属氯化物盐被完全还原成纯金属而没有其它氧化物。MWCNTs表面上不同类型的官能团不影响Ni催化剂的晶体结构。
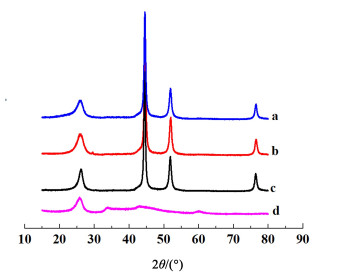
图 2a)为Ni/N-MWCNTs电极在20 mV/s时的CV图。从图 2a)中可以看出,曲线(i)在正向扫描中的峰值电流出现在电位为0.47 V处(Ipa约为12 mA),在负向扫描中显示的峰值电流出现在电位为0.35 V处(Ipc约为-12 mA)。这是碱性介质中β-NiOOH和β-Ni(OH)2之间存在可逆转化[18]。曲线(ii)显示正向扫描中的峰值电流出现在电位为0.59 V处(Ipa约为13.9 mA),负向扫描中的峰值电流出现在电位为0.32 V处(Ipc约为-2 mA)。即溶液中含有尿素时,β-Ni(OH)2/β-NiOOH阳极峰的电流密度大大增加,这表明尿素的氧化还原反应在该区域发生。此外,在反向扫描中,曲线(ii)的峰出现在0.59 V处,该峰可能由于CO2的覆盖以及CO2与碱性溶液的反应所致[19]。在曲线(ii)上约0.32 V处的另1个还原峰是β-NiOOH转化为β-Ni(OH)2的反应[18]。比较曲线(i)和曲线(ii),可以看出2个初始氧化电位均为0.40 V,这证实了Tammam等[3]得出的结论。对于尿素电氧化,催化活性中心不是Ni或Ni(OH)2,而是NiOOH。曲线(ii)的阴极峰面积小于曲线(i)的峰面积,表明产生的NiOOH在尿素电氧化反应中被部分消耗。尿素在Ni/N-MWCNTs催化剂上的电氧化可能是间接电氧化过程。图 2b)是3种不同电催化剂电极的CV图。3个电极的初始氧化电位约为0.41 V。这意味着使用不同的碳载体时,Ni(OH)2电极的动力学行为几乎保持不变。如图 2b)所示,可以看出尿素电氧化的催化剂活性随催化剂载体而变化。不同催化剂的循环伏安法峰面积、峰电位和峰电流密度随载体的变化有很大的改变。这表明Ni和碳载体之间存在协同作用。与无尿素电解液中获得的曲线相比,所有催化剂的循环伏安图均显示出阳极电流密度的增加和阴极电流密度的减少,并且最大氧化电流密度随载体变化而不同,其中Ni/OH-MWCNTs具有最高的尿素电氧化活性(54.56 mA·cm-2),高于Ni/NH2-MWCNTs电极(36.54 mA·cm-2)和Ni/N-MWCNTs电极(13.12 mA·cm-2)。根据表 1中的特征参数,可以得出结论,不同的载体对尿素电氧化具有不同的催化活性。其原因可能是OH-MWCNT具有较高的理论比表面积和羟基含量,这可能导致液相还原制备的Ni颗粒中具有更多的活性位点,从而提高了尿素电氧化的性能。图 2c)显示了不同碳载体负载纯Ni催化剂在0.55 V下的CA曲线。从图 2c)可以看出,当将相同的阶跃电势施加到电催化剂上时,3个电极的CA曲线形状相似,并且平台阶段相对稳定。用于尿素电氧化的Ni/OH-MWCNTs催化剂的稳定电流密度为34 mA·cm-2,Ni/NH2-MWCNTs的稳定电流密度为21 mA·cm-2,Ni/N-MWCNTs的稳定电流密度为9 mA·cm-2。Ni/OH-MWCNTs电极的电流密度最高,表明作为催化剂载体的OH-MWCNTs具有更好的稳定性,这与循环伏安法测试结果一致。
|
| 图 2 a) Ni/N-MWCNTs在1.0 mol·L-1 KOH溶液中有无0.33 mol·L-1尿素中的CV图;b)不同催化剂在0.33 mol·L-1尿素中的CV;c)不同催化剂在1.0 mol·L-1 KOH+0.33 mol·L-1尿素溶液中0.55 V vs. Hg/HgO下的CA图 Fig.2 a) CV plots of Ni/N-MWCNTs electrodes in absence and presence of 0.33 mol·L-1 urea in 1.0 mol·L-1 KOH at a screen rate of 20 mVs-1; b) CV in 1.0 mol·L-1 KOH with 0.33 mol·L-1 urea for three electrocatalysts; c) Chromoamperograms of different Ni/FCNTs electrocatalysts in 1 mol·L-1 KOH with 0.33 mol·L-1 urea at a potential value of 0.55 V for 1 000 s |
| |
图 1中的曲线d为NixB/OH-MWCNTs电催化剂的XRD图。在2θ≈25.0°处出现了MWCNT的碳(002)的特征峰。在2θ=33.4°、43.1°和62.0°处检测到3个宽衍射峰,它们可能与NixB合金的形成相关。根据Masa等[20]的报道,可以认为,NixB由Ni2B和Ni3B的纳米微晶组成。
图 3为Ni/OH-MWCNTs和NixB/OH-MWCNTs催化剂的TEM图像。

|
| 图 3 a)、b)Ni/OH-MWCNTs的TEM图;c)~e)NixB/OH-MWCNTs的TEM图 Fig.3 TEM images of Ni/OH-MWCNTs a), b) and NixB/OH-MWCNTs c)—e) |
| |
从图 3a)可以看出,负载在OH-MWCNT上的Ni颗粒的粒径约为50 nm。图 3b)显示,与Ni/OH-MWCNT上的Ni颗粒相比,NixB-MWCNT具有更好的分散性和更小的粒度。此外,从图 3b)可以看出,NixB/OH-MWCNT中催化剂的结晶度较弱,显示出无定形结构,这与XRD分析的结果一致。
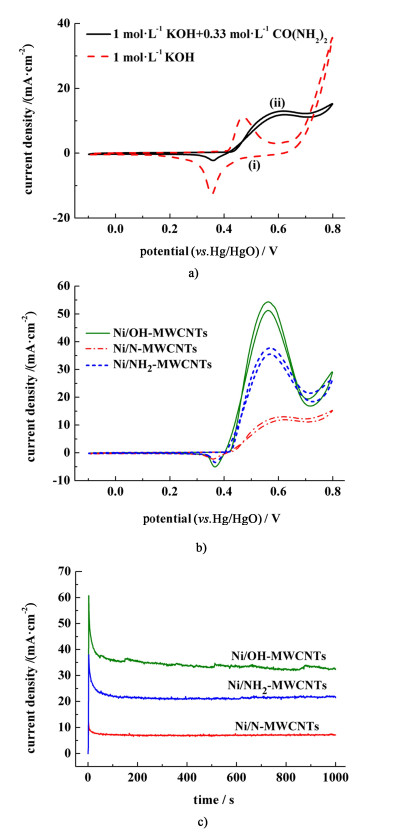
图 4是Ni/OH-MWCNT和NixB/OH-MWCNT的XPS谱。图 4b)为NixB/OH-MWCNTs催化剂的B 1s XPS光谱图。可以看出,B 1s的结合能为192.15 eV,为氧化态,这是由于当暴露于空气和水中时,非晶态金属硼化物会自发氧化,从而形成表面氧化物[21]。
|
| 图 4 a) 全谱图; b)B 1s的XPS图;c)、d)Ni/OH-MWCNTs and NixB/OH-MWCNTs的Ni的2p XPS图 Fig.4 a) The full survey scan; b) B 1s and c), d) Ni 2p XPS spectra of Ni/OH-MWCNTs and NixB/OH-MWCNTs |
| |
图 4c)和4d)是2种催化剂中Ni 2p的XPS光谱图。拟合后发现855.6 eV处的峰分为4组峰。其中,852.6 eV是由于镍与硼的相互作用所致[21],853.4、855.6和857.3 eV处的峰分别对应于NiO、Ni(OH)2和NiOOH[22-23]。在861 eV处出现1个宽峰,推测该区域的峰是各种含镍物质的振动峰[25]。拟合结果分解为4个峰,其中,860.3 eV是NiO的振动峰,863.2和864.8 eV分别是Ni(OH)2和NiOOH的振动峰[24]。具有特殊结构的Ni2+的振动峰处于861.7 eV。表 2列出了2种催化剂的拟合结果。从表 2可以看出,2种催化剂的表面层中镍种类的相对百分比是不同的。
| eletrode | type | |||
| Ni-B | NiO | Ni(OH)2 | NiOOH | |
| NixB/OH-MWCNTs | 7.31 | 16.97 | 49.52 | 21.20 |
| Ni/OH-MWCNTs | 0 | 0 | 83.60 | 16.40 |
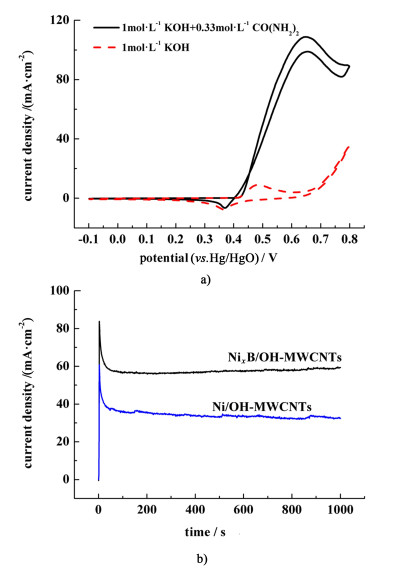
图 5为NixB/OH-MWCNTs电极在碱性介质中的循环伏安图。
|
| 图 5 a) NixB/OH-MWCNTs在1.0 mol·L-1 KOH溶液中有无0.33 mol·L-1尿素中的CV图;b) NixB/OH-MWCNTs在1.0 mol·L-1 KOH+ 0.33 mol·L-1尿素溶液中0.55 V vs. Hg/HgO下的CA图 Fig.5 a) CV plots of NixB/OH-MWCNTs electrodes in absence and presence of 0.33 mol·L-1 urea in 1.0 mol·L-1 KOH at a screen rate of 20 mV·s-1; b) Chromoamperograms of NixB/OH-MWCNTs in 1 mol·L-1 KOH with 0.33 mol·L-1 urea at a potential value of 0.55 V for 1 000 s |
| |
从图 5可以看出,与Ni/OH-MWCNTs催化剂相比,NixB/OH-MWCNTs催化剂具有更高的尿素电氧化催化活性(Ipa=109.09 mA·cm-2)。NixB/OH-MWCNTs催化剂在尿素电氧化过程中的初始氧化电位约为0.41 V(vs. Hg/HgO),与Ni(OH)2氧化成NiOOH的电位一致,表明在尿素电氧化过程中,NixB/OH-MWCNTs催化剂中的NiOOH起着催化作用。图 5b)是NixB/OH-MWCNTs催化剂在0.55 V时的计时电流图。从图 5中可以看出,NixB/OH-MWCNTs催化剂用于尿素电氧化的电流平台为57 mA·cm-2,Ni/OH-MWCNTs催化剂的电流平台为34 mA·cm-2,表明NixB/OH-MWCNTs用于尿素电氧化的性能大大提高。这与循环伏安法所得出的结论是一致的。结合XRD,TEM和XPS的结果,可以认为提高NixB/OH-MWCNTs的催化活性的原因如下:1)Botte等[5, 7]和Guo等[6]认为,二氧化碳的吸附会导致催化剂中毒并降低尿素电氧化过程中的催化剂活性。大量研究表明,氧化物可以提供过量的氧空位,并去除吸附在催化剂上的二氧化碳[10, 15, 18]。从表 2可以看出,在添加硼元素之后,NixB催化剂的表面上存在大量的氧化镍和氢氧化镍,这种现象可以增加催化剂的活性。2)Masa等[25]认为,用硼对镍进行改性可显著增强其对析氧反应的电催化活性。Okamoto等[26-29]报道了在硼存在下镍的电子富集,这些电子将增加镍和硼之间的相互作用并改善二氧化碳的解吸问题。3)用B修饰Ni会导致Ni晶格的变化[25]。例如,Ni2B中最接近的Ni-Ni距离为0.253 0 nm,而Ni3B中最接近的Ni-Ni距离为0.243 0 nm,2者都不同于纯Ni中的Ni-Ni键长0.249 2 nm[25]。晶格参数的不同会导致主体金属的电子结构的细微变化,可能会使二氧化碳的吸附发生变化,并在电极/电解质界面起着独特的相互作用,这在纯镍电极上是不存在的[25]。
3 结论本论文比较了不同的碳纳米管对尿素电氧化的电催化活性,探讨不同官能团对尿素电催化剂催化活性的影响。发现Ni/OH-MWCNTs表现出最好的电催化性能,尿素电氧化的电流密度为54.56 mA·cm-2。该结果表明,将Ni负载在OH-MWCNT上提供了更多的活性位点并促进了尿素的氧化。3种碳纳米管对尿素电催化活性的影响顺序为:OH-MWCNTs>NH2-MWCNTs>N-MWCNTs。XRD和XPS表明通过液相还原法可以在OH-MWCNTs上成功制备NixB合金。B元素的引入改变了Ni的结晶状态并形成非晶态。电化学实验的结果表明,NixB/MWCNTs对尿素的电氧化具有很高的催化性能。CV的峰值电流密度为109.09 mA·cm-2,是Ni/OH-MWCNTs电极的2倍。该结果可能归因于Ni和B之间的相互作用,影响了Ni的晶格参数,增强催化剂的抗中毒性能,并改善催化活性。
| [1] |
Lan R, Tao S, Irvine J T S. A direct urea fuel cell-power from fertiliser and waste[J]. Energy and Environmental Science, 2010, 3(4): 438-441. DOI:10.1039/b924786f |
| [2] |
Boggs B K, King R L, Botte G G. Urea electrolysis:Direct hydrogen production from urine[J]. Chemical Communications, 2009(32): 4859-4861. DOI:10.1039/b905974a |
| [3] |
Tammam R H, Saleh M M. On the electrocatalytic urea oxidation on nickel oxide nanoparticles modified glassy carbon electrode[J]. Journal of Electroanalytical Chemistry, 2017, 794: 189-196. DOI:10.1016/j.jelechem.2017.04.023 |
| [4] |
Abdel H R M, Medany S S. Enhanced electrocatalytic activity of NiO nanoparticles supported on graphite planes towards urea electro-oxidation in NaOH solution[J]. International Journal of Hydrogen Energy, 2017, 42(38): 24117-24130. DOI:10.1016/j.ijhydene.2017.07.236 |
| [5] |
Vedharathinam V, Botte G G. Understanding the electro-catalytic oxidation mechanism of urea on nickel electrodes in alkaline medium[J]. Electrochimica Acta, 2012, 81: 292-300. DOI:10.1016/j.electacta.2012.07.007 |
| [6] |
Guo F, Ye K, Du M, et al. Electrochemical impedance analysis of urea electro-oxidation mechanism on nickel catalyst in alkaline medium[J]. Electrochimica Acta, 2016, 210: 474-482. DOI:10.1016/j.electacta.2016.05.149 |
| [7] |
Vedharathinam V, Botte G G. Direct evidence of the mechanism for the electro-oxidation of urea on Ni(OH)2 catalyst in alkaline medium[J]. Electrochimica Acta, 2013, 108: 660-665. DOI:10.1016/j.electacta.2013.06.137 |
| [8] |
Gao X, Wang Y, Li W, et al. Free-Standing Ni-Co alloy nanowire arrays:Efficient and robust catalysts toward urea electro-oxidation[J]. Electrochimica Acta, 2018, 283: 1277-1283. DOI:10.1016/j.electacta.2018.07.033 |
| [9] |
Ding R, Li X, Shi W, et al. Mesoporous Ni-P nanocatalysts for alkaline urea electrooxidation[J]. Electrochimica Acta, 2016, 222: 455-462. DOI:10.1016/j.electacta.2016.10.198 |
| [10] |
Bian L, Du T, Du Q, et al. Multiwalled carbon nanotubes twined α-nickel hydroxide microspheres as high-efficient urea electrooxidation catalysts[J]. Journal of Applied Electrochemistry, 2017, 47(8): 905-915. DOI:10.1007/s10800-017-1087-9 |
| [11] |
Wu M, Lin G, Yang R. Hydrothermal growth of vertically-aligned ordered mesoporous nickel oxide nanosheets on three-dimensional nickel framework for electrocatalytic oxidation of urea in alkaline medium[J]. Journal of Power Sources, 2014, 272: 711-718. DOI:10.1016/j.jpowsour.2014.09.009 |
| [12] |
Basumatary P, Konwar D, Yoon Y S. A novel NiCu/ZnO@MWCNT anode employed in urea fuel cell to attain superior performances[J]. Electrochimica Acta, 2018, 261: 78-85. DOI:10.1016/j.electacta.2017.12.123 |
| [13] |
Barakat N A M, Alajami M, Al Haj Y, et al. Enhanced onset potential NiMn-decorated activated carbon as effective and applicable anode in urea fuel cells[J]. Catalysis Communications, 2017, 97: 32-36. DOI:10.1016/j.catcom.2017.03.027 |
| [14] |
Barakat N A M, Motlak M, Ghouri Z K, et al. Nickel nanoparticles-decorated graphene as highly effective and stable electrocatalyst for urea electrooxidation[J]. Journal of Molecular Catalysis A:Chemical, 2016, 421: 83-91. DOI:10.1016/j.molcata.2016.05.011 |
| [15] |
Das G, Tesfaye R M, Won Y, et al. NiO-Fe2O3 based graphene aerogel as urea electrooxidation catalyst[J]. Electrochimica Acta, 2017, 237: 171-176. DOI:10.1016/j.electacta.2017.03.197 |
| [16] |
Liang Y, Liu Q, Asiri A M, et al. Enhanced electrooxidation of urea using NiMoO4·xH2O nanosheet arrays on Ni foam as anode[J]. Electrochimica Acta, 2015, 153: 456-460. DOI:10.1016/j.electacta.2014.11.193 |
| [17] |
Li J, Li X, Huang C, et al. Catalytic activity of Ni-based/graphene aerogel for urea electrooxidation in alkaline solution[J]. Ionics, 2019, 25(4): 1943-1951. DOI:10.1007/s11581-019-02902-z |
| [18] |
Daramola D A, Singh D, Botte G G. Dissociation rates of urea in the presence of NiOOH catalyst:A DFT analysis[J]. Journal of Physical Chemistry A, 2010, 114(43): 11513-11521. DOI:10.1021/jp105159t |
| [19] |
Siwal S S, Thakur S, Zhang Q B, et al. Electrocatalysts for electrooxidation of direct alcohol fuel cell:Chemistry and applications[J]. Materials Today Chemistry, 2019. DOI:10.1016/j.mtchem.2019.06.004 |
| [20] |
Masa J, Sinev I, Mistry H, et al. Ultrathin high surface area nickel boride (NixB) nanosheets as highly efficient electrocatalyst for oxygen evolution[J]. Advanced Energy Materials, 2017. DOI:10.1002/aenm.201700381 |
| [21] |
Xu B, Liu Y, Tian J, et al. Ni3(BO3)2 as anode material with high capacity and excellent rate performance for sodium-ion batteries[J]. Chemical Engineering Journal, 2019, 363: 285-291. DOI:10.1016/j.cej.2019.01.089 |
| [22] |
Subhan F, Liu B. Acidic sites and deep desulfurization performance of nickel supported mesoporous AlMCM-41 sorbents[J]. Chemical Engineering Journal, 2011, 178: 69-77. DOI:10.1016/j.cej.2011.10.013 |
| [23] |
Subhan F, Aslam S, Yan Z, et al. Confinement of mesopores within ZSM-5 and functionalization with Ni NPs for deep desulfurization[J]. Chemical Engineering Journal, 2018, 354: 706-715. DOI:10.1016/j.cej.2018.08.059 |
| [24] |
Oliveira M C, do Rego A M B. The effect of the hypophosphite ion oxidation on the Ni surface electrode:An XPS study[J]. Journal of Alloys and Compounds, 2006, 425(1/2): 64-68. |
| [25] |
Masa J, Andronescu C, Antoni H, et al. Role of boron and phosphorus in enhanced electrocatalytic oxygen evolution by nickel borides and nickel phosphides[J]. Chem Electro Chem, 2019, 6: 235-240. |
| [26] |
Okamoto Y, Nitta Y, Imanaka T, et al. Surface characterisation of nickel boride and nickel phosphide catalysts by X-ray photoelectron spectroscopy[J]. Journal of the Chemical Society, Faraday Transactions, 1979, 75: 2027-2039. DOI:10.1039/f19797502027 |
| [27] |
Tyan Y S, Toth L E, Chang Y. Low temperature specific heat study of the electron transfer theory in refractory metal borides[J]. Journal of Physics and Chemistry of Solids, 1969, 30(4): 785-792. DOI:10.1016/0022-3697(69)90272-8 |
| [28] |
Kohm A, Merz H. Charge transfer in some transition-metal semiborides[J]. Physica Status Solid B-Basic Solid State Physics, 1974, 61(1): 147-152. DOI:10.1002/pssb.2220610110 |
| [29] |
Greenwood N N, Parish R V, Thornton P. Metal borides[J]. Quarterly Reviews, Chemical Society, 1966. DOI:10.1039/QR9662000441 |
 2020, Vol. 37
2020, Vol. 37