2. 陕西省冶金工程技术研究中心, 西安 710055
2. Metallurgical Engineering Technology Research Center of Shaanxi Province, Xi'an 710055, China
近年来,随着大规模储能技术的发展和环境及能源危机的加剧,世界各国越来越重视清洁能源的开发与利用[1]。太阳能、风能等新能源由于受到自然条件限制,在能量输出方面具有间歇性和不稳定性弊端,要解决这些新能源的间歇性和和不稳定性问题,必须结合储能技术[2-3]。全钒氧化还原液流电池(VRB)因其制造维护成本低、运行使用寿命长、设计灵活、选址自由、效率高、可深度充放电等优点,成为大规模储能的最佳选择[4-6]。
目前,全钒液流电池电解液的支持电解质主要为不同浓度的硫酸溶液,在长期的充放电过程中正极5价钒离子在高温条件下(>40 ℃),会经过去质子过程和缩合反应而转变为V2O5晶体析出[7-8],降低了电解液的稳定性。为此,前人做了大量研究来提高电解液的性能。Mohamed等[9]研究表明,H2SO4浓度越高,电解质的电导率越好,H2SO4浓度降低会增加V2+、V3+和V4+的溶解度,但会降低V5+的溶解度。Li等[10]报告称,H2SO4-HCl混酸电解质可使钒浓度达到2.5 mol/L,然而,Cl2气体的产生不利于蠕动泵运行,从而影响VRB的性能。除增加H2SO4浓度和混酸做支撑电解质外,添加剂是改善正电解液稳定性的另一种有效的选择,微量添加剂的加入对电解液的电化学性能影响不大,但能显著提高其稳定性。Li等[11]研究了果糖、甘露醇和葡萄糖等多元醇作为VRB正极电解质的添加剂,不仅提高了V(Ⅴ)的溶解度,而且为V(Ⅳ)/V(Ⅴ)氧化还原反应提供了更多的活性点。但是,这些添加剂由于羟基基团还原性的存在,会被V(Ⅴ)氧化分解。研究表明,无机添加剂[12-14]的加入可以明显改善电解液的电导率,并改善电解液的电化学性能,但是对电解液的稳定性作用不大,有机添加剂[15-18]通过抑制钒离子之间的缔合,使得电解液的稳定性增加,但对电解液电化学性能提高不明显。
本研究将有机、无机添加剂组成复合添加剂,通过向电解液中加入3种不同的复合添加剂,对复合添加剂加入后电解的稳定性及电化学性能进行考察,从而为改善钒电池电解液性能提供了一种有效途径。
1 实验部分 1.1 电解液的制备将V2O5(AR,天津市福晨化学试剂厂)加入到盛有3 mol/L H2SO4(质量分数为98%,西安长安区化学试剂厂)的烧杯中,放入90 ℃水浴锅中不断搅拌让其反应,逐滴加入水合肼,观察颜色变化,取少量溶液用去离子水稀释10倍,利用紫外可见分光光度计(TU-1901型紫外可见分光光度计,北京普析通用仪器有限责任公司)进行钒离子相态分析,判断制得V(Ⅱ)/V(Ⅲ)电解液,然后利用液流电池夹具(东莞之升化工有限公司)对负极电解液以60 mA/cm2的电流密度进行恒流充电制备正极电解液。
1.2 主要测试方法表面张力和接触角测试:采用表面张力仪(DCAT21)测量不同表面活性剂在不同浓度下与1% KHSO4加入正极电解液后,电解液与工作电极表面张力及接触角的变化,以确定最适添加剂的含量,其中工作电极尺寸为:10 mm×30 mm×1 mm。
稳定性测试:将空白及含有添加剂的负极、正极电解液分别静置于15及45 ℃的恒温水浴锅中,定期观察并记录不同温度下沉淀析出的时间及沉淀量。
黏度和电导率测试:采用数显黏度计(NDJ-5S)测定电解液在添加剂加入后的黏度值,测量值取多次测量的平均值,以分析添加剂加入后电解液的黏度变化。采用电导率仪(DDS-307)测定添加剂加入后电解液的电导率变化,其中电极为DJS-1C型铂黑电极,参数为1.021。
循环伏安测试:循环伏安测试在上海辰华CHI660C型电化学工作站进行,测试使用含有盐桥的三电极体系,其中参比电极为饱和甘汞电极,工作电极为石墨电极,对电极为2 cm×2 cm的Pt电极。石墨电极在使用前分别用400、600、1 200细度的碳化硅砂纸打磨后进行清洗,采用石蜡对电极进行密封,留出1 cm2的工作面积。扫描速率20.00 mV/s,扫描范围0~1.6 V。
XRD测试:通过测定加入添加剂后,电解液中的沉淀物相组成,对比原料V2O5的衍射图谱,验证沉淀物是否为钒的氧化物,测试过程中2θ的范围为5°~90°,测试速度10 (°)/min。
2 结果与讨论 2.1 添加剂对电解液表面张力和接触角的影响受环境温度和压强等因素的影响,溶液的表面张力随外界条件的变化会发生相应的改变。以制备正极电解液为研究对象,在溶液温度为45 ℃下,分别将SDBS、D-山梨醇和CTAB与1%KHSO4同时加入待测水溶液中,待充分溶解后,测量不同表面活性剂在不同浓度下与1%KHSO4加入后对正极电解液与工作电极表面张力及接触角的影响。本实验测量工作电极与加入添加剂后电解液的表面张力与接触角。其中工作电极样品尺寸为:10 mm×30 mm×1 mm,测量结果如图 1和图 2所示。

|
| 图 1 不同浓度添加剂加入后电解液表面张力变化 Fig.1 Surface tension evolution of electrolyte after addition of different concentrations of additives |
| |

|
| 图 2 不同浓度添加剂作用下电解液与石墨电极接触角变化 Fig.2 Change of contact angle between electrolyte and graphite electrode under different concentration of additives |
| |
根据图 1可知,电解液的表面张力在3种复合添加剂的作用下都能够显著降低,并且随着添加剂浓度的增加,电解液表面张力呈现先减小再增加的趋势,这主要是受到表面活性剂临界胶束浓度的影响。根据前人研究,当溶液中添加剂含量达到临界胶束浓度时,溶液表面张力降至最低,此时,再增加添加剂浓度,溶液表面形成胶束,一旦胶束形成,表面活性剂的活性不再增加,因此,可根据临界胶束法确定添加剂用量[19]。根据图 1中表面张力变化的转折点,当CTAB的用量为2 mmol/L时,溶液的表面张力降至30.231 mN/m;SDBS用量为3 mmol/L时,对电解液表面张力降低幅度最为明显,此时电解液表面张力为25.916 mN/m;D-山梨醇在自身羟基作用下,当浓度为2 mmol/L时,表面张力降至最低点26.567 mN/m。因此确定3种添加剂的最适宜浓度为:2 mmol/L CTAB、3 mmol/L SDBS和2 mmol/L D-山梨醇。
图 2为正极电解液中加入不同浓度添加剂后,电解液与工作电极之间接触角的变化。结合表面张力与添加剂的浓度关系可知,在表面活性剂为临界胶束浓度时,对应的接触角的值也最小,接触角最低点对应着添加剂在正极电解液中的临界胶束浓度值,其最低值分别为:CTAB,82.217°;SDBS,83.532°;D-山梨醇,83.293 °。可以看出表面张力的变化与接触角的变化趋势大致相同。根据表面张力及接触角变化,确定3种添加剂加入量具体如下:1%KHSO4+3 mmol/L SDBS、1%KHSO4+2 mmol/L D-山梨醇、1%KHSO4+2 mmol/L CTAB。
2.2 添加剂对电解液UV-Vis的光谱影响根据确定的复合添加剂配比,分别将KHSO4、SDBS、CTAB、D-山梨醇按照配比加入到电解液中,加入添加剂后的电解液采用紫外可见分光光度计进行扫描,根据扫描结果,判断添加剂加入后是否影响电解液中钒离子相态变化,结果如图 3、图 4和图 5所示。
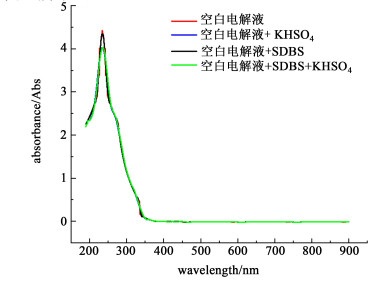
|
| 图 3 含1%KHSO4与SDBS的电解液紫外可见光谱 Fig.3 Ultraviolet-Visible spectra of electrolyte containing 1%KHSO4 and SDBS |
| |

|
| 图 4 含1%KHSO4与CTAB的电解液紫外可见光谱 Fig.4 Ultraviolet-Visible spectra of electrolyte with 1% KHSO4 and CTAB |
| |
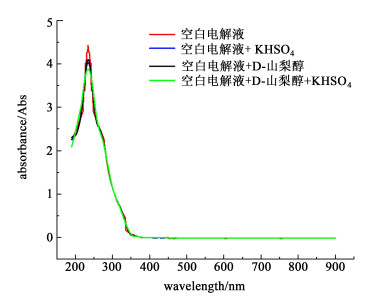
|
| 图 5 含1% KHSO4与D-山梨醇的电解液紫外可见光谱 Fig.5 Ultraviolet-Visible spectra of electrolyte with 1% KHSO4 and D-sorbitol |
| |
根据以上紫外可见分光光度计扫描图谱结果:添加剂加入后的电解液与空白电解液的吸收峰几乎未发生改变,吸收峰均在230 nm附近,由于V(Ⅴ)的特征峰为λ=230 nm[20],所以无机添加剂KHSO4的加入,并未引起V(Ⅴ)对应波峰的偏移,说明KHSO4的加入不会引起钒离子相态变化。有机添加剂SDBS、CTAB、D-山梨醇加入后,扫描图谱中的波峰位置也没有发生变化,同时未出现其他峰形,说明添加剂的加入并未在溶液中形成新的化学键,不会导致新的物质生成[21],从而可以得出复合添加剂加入电解液后,并未与电解液中钒离子发生化学反应而改变钒离子相态,复合添加剂可以在电解液中稳定存在。
2.3 添加剂对电解液稳定性影响当正极电解液处于高温情况下时,稳定性较差,容易生成V2O5沉淀。为了考察添加剂对正极电解液稳定性的影响,分别向H2SO4浓度为3 mol/L、钒离子浓度为2 mol/L的电解液中添加1%的KHSO4与临界胶束浓度值下的不同添加剂,将溶液密封于容器中静置于45 ℃恒温水浴锅中,在不同时间间隔后,取溶液上清液过滤后,测定滤液中的钒离子浓度,其浓度变化曲线如图 6所示。
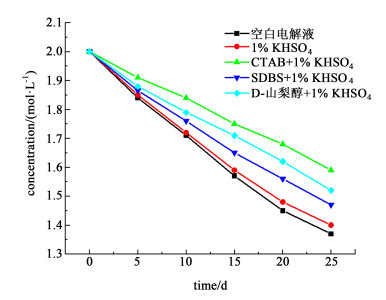
|
| 图 6 添加剂加入后电解液浓度随时间变化 Fig.6 Change of electrolyte concentration with time after adding additives |
| |
由图 6可知,添加剂加入后,正极电解液稳定性有一定的提高。1%KHSO4加入到电解液中,可以缓解电解液沉淀,但是效果与其余3种复合添加剂相比,不太明显。
从图 6中可以看出CTAB与1%KHSO4作为一种复合添加剂加入到V(Ⅴ)硫酸溶液中,对降低V(Ⅴ)沉淀作用最为明显,主要是因为CTAB作为一种长链的阳离子表面活性剂,其胶束的季铵头部基团与5价钒作用,使得V(Ⅴ)链结聚合,从而抑制了5价钒的结晶[17]。D-山梨醇具有亲水性,从而可使电解液更加稳定。SDBS与1%KHSO4加入电解液后,对V(Ⅴ)稳定性的有所提高,主要是因为SDBS作为一种阴离子表面活性剂,溶于电解液后会形成十二烷基苯磺酸根胶束,它会被[VO2(H2O)3]+吸附,从而取代[VO2(H2O)3]+第2结合层水分子,此时HSO4-与SO42+结合成胶束包裹在第2结合层,进而防止[VO2(H2O)3]+脱水形成沉淀[21]。但是SDBS较CTAB与D-山梨醇的作用结果稍差,可能是由于SDBS在硫酸浓度较高时,十二烷基苯磺酸根离子部分水解,使得吸附作用变差,从而沉淀减缓效果不是很明显[22]。
2.4 添加剂对电解液黏度与电导率的影响黏度与电导率作为电解液性能的重要指征,黏度影响电解液的流动性,电导率是影响电解液电荷传质过程的重要因素。不同添加剂加入正极电解液后的黏度及电导率测试结果见表 1。
| 样品 | 黏度/(mPa·s) | 电导率/(mS·cm-1) |
| 1 | 3.26 | 88.5 |
| 2 | 3.18 | 106.3 |
| 3 | 3.38 | 105.9 |
| 4 | 3.42 | 108.4 |
| 5 | 3.04 | 92.8 |
| 注:1号样品为原始电解液;2号样品为添加1% KHSO4的电解液;3号样品为添加1% KHSO4与3 mmol/L SDBS的电解液;4号样品为添加1% KHSO4与2 mmol/L CTAB的电解液;5号样品为添加1% KHSO4与2 mmol/L D-山梨醇的电解液。 | ||
由表 1可知,1% KHSO4加入电解液后,电解液的黏度几乎没有变化,电导率增加,主要原因是KHSO4加入后,打乱了溶液中HSO4-的平衡,溶液中K+、H+以及HSO4-都相对增加,K+与H+的增加,导致溶液的导电能力增强,对应的也就是导电率的升高。对于SDBS与CTAB,2者都属于长链有机物,加入电解液后,电解液的黏度变大,主要原因是长链有机物的吸附作用,使得溶液中颗粒体积变大,从而导致溶液黏度增加。且SDBS在水溶液中电离出Na+,是良好的离子导电载体,结合KHSO4在水溶液中电离后的导电能力,导致导电率变化较大。非离子型表面活性剂因其结构中含有多个疏水羟基(—OH)基团,吸附于钒离子表面,使得钒离子更加分散,从而导致黏度降低,而黏度的降低使得活性物质的扩散更加容易。
2.5 添加剂对V(Ⅳ)/V(Ⅴ)电极反应循环伏安特性的影响将含有添加剂1%KHSO4+3 mmol/L SDBS、1% KHSO4+2 mmol/L D-山梨醇、1%KHSO4+2 mmol/L CTAB与空白电解液进行循环伏安扫描测试,结果如图 7所示。

|
| 图 7 含不同添加剂电解液的循环伏安扫描曲线 Fig.7 Cyclic voltammetric scanning curves of electrolytes containing different additives |
| |
由图 7可知,添加1%KHSO4+2 mmol/L D-山梨醇的电解液循环伏安扫描曲线中的峰电位差及峰电流差都接近于空白电解液,表明D-山梨醇对电解液的可逆性及电化学活性影响较小;加入1% KHSO4+3 mmol/L SDBS的电解液峰电位差增大,峰电流几乎不变,表明SDBS的加入,会降低电解液可逆性,极化较为严重,这可能是因为SDBS中阴离子形成胶束吸附在电极表面,阻碍电解液中电子转移,从而抑制电极反应正常进行。1% KHSO4+2 mmol/L CTAB加入后,含有V(Ⅳ)与V(Ⅴ)的电解液峰电位差减小,峰电流增加,峰电位差的减小,说明电解液可逆性有所提高,峰电流的增加,表明反应活性增加,电化学性能有所提高,说明CTAB与KHSO4在合适配比下,能够有效提高正极电解液的可逆性和电化学活性。这与CTAB对负极电解液的循环伏安测试结果截然相反,主要原因是含有CTAB的电解液对V(Ⅳ)/V(Ⅴ)的氧化还原反应有一定的电催化作用[23],CTAB形成胶束后,胶束的季铵头部作用于V(Ⅴ),V(Ⅴ)与V(Ⅱ)、V(Ⅲ)相比,离子半径较小,使得V(Ⅴ)局限的胶束头部区域,形成长链大分子结构,使得CTAB不易附着于电极表面,为电解反应提供更多的活性位点,促进电极反应的进行。结合循环伏安测试数据,对测试结果进行相关分析,如表 2所示。
| 样品 | 阳极峰 | 阴极峰 | 峰电流比 | 峰电位差/V | |||
| 电流/(10-2 A) | 电压/V | 电流/(10-2 A) | 电压/V | ||||
| 空白 | 7.64 | 0.865 | -5.820 | 8.150 | 1.312 | 0.050 | |
| SDBS+KHSO4 | 7.38 | 0.952 | -5.620 | 0.754 | 1.314 | 0.198 | |
| CTAB+KHSO4 | 8.62 | 0.874 | -6.690 | 0.836 | 1.288 | 0.038 | |
| D-山梨醇+KHSO4 | 7.16 | 0.882 | -5.348 | 0.815 | 1.339 | 0.067 | |
根据循环伏安曲线扫描图谱结合表 2中含不同添加剂电解液的循环伏安曲线特征参数可知,图谱中氧化峰与还原峰基本对称,阳极峰与阴极峰的峰电流比接近于1.3,可将V(Ⅳ)/V(Ⅴ)电对的电极反应视为可逆过程的氧化还原反应。说明添加剂的加入对电极反应的可逆性有所改变,也验证了之前的分析结果。
2.6 沉淀物物相分析将正极电解液置于45 ℃的水浴体系中,恒温静置10 h,然后对电解液进行抽滤,收集析出的棕黄色沉淀,利用烘箱将沉淀物烘干。烘干后的固体经研钵研磨,通过200目筛子的粉末用于XRD测试,不同添加剂作用下电解液的沉淀物XRD测试见图 8。
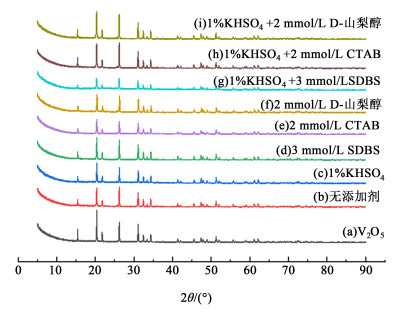
|
| 图 8 不同添加剂作用下沉淀物XRD衍射图谱 Fig.8 XRD diffraction patterns of precipitates with different additives |
| |
由图 8可知,空白电解液(无添加剂)及不同添加剂作用下电解液中沉淀物的XRD衍射峰与制备电解液的原料V2O5的XRD衍射峰的位置没有发生变化,几乎重合,峰的强度发生了改变,说明沉淀物中没有生成新的物相,也就是说添加剂加入后产生的沉淀中添加剂没有参与相关的反应。1% KHSO4与3 mmol/L SDBS作用下,沉淀物的XRD衍射峰强度减小最为明显,说明沉淀的结晶物结晶度不高;1% KHSO4与2 mmol/L CTAB、1%KHSO4与2 mmol/L D-山梨醇加入后,电解液的沉淀物XRD衍射峰明显加强且峰的宽度更细,说明沉淀物V2O5的结晶度较好,主要原因是未被吸附、胶束化等物理作用的离子很快结晶聚合在一起,颗粒之间没有外力的影响导致结晶度更好。结合紫外可见分光光度计扫描图谱,再次说明添加剂的加入,不会直接与钒的不同价态的离子发生化学反应,添加剂对电解液的稳定性,主要通过物理作用来实现。
3 结论通过3种复合添加剂对正极电解液中稳定性和电化学性的研究,发现复合添加剂的加入不会改变钒离子的相态,3种复合添加剂均可提高正极电解液的稳定性。加入1%KHSO4+2 mmol/L CTAB的电解液峰电流增加,峰电位差降低了12 mV,峰电流增加了0.98 mA,提高了正极电解液的可逆性和电化学活性。而加入1%KHSO4+3 mmol/L SDBS的电解液峰电位差增大,峰电流几乎不变,电解液极化加剧,降低了电解液可逆性。1%KHSO4+2 mmol/L D-山梨醇的电解液峰电位差及峰电流差都接近于空白电解液,对电解液的可逆性及电化学活性产生的影响较小。相比之下1%KHSO4+2 mmol/L CTAB更适合作为钒电池正极电解液的复合添加剂。
| [1] |
代铭玉. 国内外新能源利用现状[J]. 绿色科技, 2011(8): 61-64. Dai Mingyu. Analysis of domestic and oversea utilization status of new energy[J]. Journal of Green Science and Technology, 2011(8): 61-64. (in Chinese) |
| [2] |
谢聪鑫, 郑琼, 李先锋, 等. 液流电池技术的最新进展[J]. 储能科学与技术, 2017, 6(5): 1050-1057. Xie Congxin, Zheng Qiong, Li Xianfeng, et al. Current advances in the flow battery technology[J]. Energy Storage Science and Technology, 2017, 6(5): 1050-1057. (in Chinese) |
| [3] |
张华民, 王晓丽. 全钒液流电池技术最新研究进展[J]. 储能科学与技术, 2013, 2(3): 281-288. Zhang Huamin, Wang Xiaoli. Recent progress on vanadium flow battery technologies[J]. Energy Storage Science and Technology, 2013, 2(3): 281-288. (in Chinese) |
| [4] |
Choi C, Kim S, Kim R, et al. A review of vanadium electrolytes for vanadium redox flow batteries[J]. Renewable & Sustainable Energy Reviews, 2017, 69: 263-274. |
| [5] |
Xu Q, Ji Y, Qin L, et al. Evaluation of redox flow batteries goes beyond round-trip efficiency:A technical review[J]. Journal of Energy Storage, 2018, 16: 108-115. DOI:10.1016/j.est.2018.01.005 |
| [6] |
刘素琴, 黄可龙, 刘又年, 等. 储能钒液流电池研发热点及前景[J]. 电池, 2005, 35(5): 356-359. Liu Suqin, Huang Kelong, Liu Younian, et al. The development and research progress in a energy storage unit:The vanadium redox flow battery[J]. Battery Bimonthly, 2005, 35(5): 356-359. (in Chinese) |
| [7] |
Vijayakumar M, Li L, Graff G, et al. Towards understanding the poor thermal stability of V5+ electrolyte solution in vanadium redox flow batteries[J]. Journal of Power Sources, 2011, 196(7): 3669-3672. DOI:10.1016/j.jpowsour.2010.11.126 |
| [8] |
Wang G, Chen J, Wang X, et al. Study on stabilities and electrochemical behavior of V(V) electrolyte with acid additives for vanadium redox flow battery[J]. Journal of Energy Chemistry, 2014, 23(1): 73-81. |
| [9] |
Mohamed M R, Leung P K, Sulaiman M H. Performance characterization of a vanadium redox flow battery at different operating parameters under a standardized test-bed system[J]. Applied Energy, 2015, 137: 402-412. DOI:10.1016/j.apenergy.2014.10.042 |
| [10] |
Li L, Kim S, Wang W, et al. A stable vanadium redox-flow battery with high energy density for large-scale energy storage[J]. Advanced Energy Materials, 2011, 1(3): 394-400. |
| [11] |
Li S, Huang K, Liu S, et al. Effect of organic additives on positive electrolyte for vanadium redox battery[J]. Electrochimica Acta, 2011, 56(16): 5483-5487. DOI:10.1016/j.electacta.2011.03.048 |
| [12] |
Ulaganathan M, Aravindan V, Yan Q, et al. Recent advancements in all-vanadium redox flow batteries[J]. Advanced Materials Interfaces, 2016. DOI:10.1002/admi.201500309 |
| [13] |
罗冬梅, 许茜, 隋智通. 添加剂对钒电池电解液性质的影响[J]. 电源技术, 2004, 28(2): 94-96. Luo Dongmei, Xu Qian, Sui Zhitong. Effect of additives on the properties of electrolyte for vanadium redox battery[J]. Chinese Journal of Power Sources, 2004, 28(2): 94-96. (in Chinese) |
| [14] |
梁艳, 何平, 于婷婷, 等. 添加剂对全钒液流电池电解液的影响[J]. 西南科技大学学报, 2008, 23(2): 11-14. Liang Yan, He Ping, Yu Tingting, et al. Influence of additives on all vanadium redox flow battery electrolyte[J]. Journal of Southwest University of Science and Technology, 2008, 23(2): 11-14. (in Chinese) |
| [15] |
He Z, Liu J, Han H, et al. Effects of organic additives containing NH2 and SO3H on electrochemical properties of vanadium redox flow battery[J]. Electrochimica Acta, 2013, 106: 556-562. DOI:10.1016/j.electacta.2013.05.086 |
| [16] |
刘素琴, 吴雪文, 张庆华, 等.含有添加剂的钒电池电解液以及钒电池: CN, 101714642[P]. 2010-05-26 Liu Suqin, Wu Xuewen, Zhang Qinghua, et al. Vanadium battery electrolyte containing additives and vanadium battery: CN, 101714642[P]. 2010-05-26(in Chinese) http://cprs.patentstar.com.cn/Search/Detail?ANE=7AFA9DIC6CEA9CEG2BAA4AEA9CID9DEDHIHACIEA9DFD4AEA |
| [17] |
吴雪文, 刘素琴, 黄可龙. CTAB作为钒电池电解液添加剂的研究[J]. 无机材料学报, 2010, 25(6): 641-646. Wu Xuewen, Liu Suqin, Huang Kelong. Characteristics of CTAB as electrolyte additive for vanadium redox flow battery[J]. Journal of Inorganic Materials, 2010, 25(6): 641-646. (in Chinese) |
| [18] |
Yang Y, Zhang Y, Liu T, et al. Improved properties of positive electrolyte for a vanadium redox flow battery by adding taurine[J]. Research on Chemical Intermediates, 2018, 44(2): 769-786. |
| [19] |
Rosen M J, Kunjappu J T. 表面活性剂和界面现象[M]. 北京: 化学工业出版社, 2015.
|
| [20] |
陈勇.全钒液流电池电解液的研究[D].长沙: 中南大学, 2014 Chen Yong. Research on electrolyte of all-vanadium flow battery[D]. Changsha: Central South University, 2014(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10337-1015439069.htm |
| [21] |
Wu X, Liu S, Wang N, et al. Influence of organic additives on electrochemical properties of the positive electrolyte for all-vanadium redox flow battery[J]. Electrochimica Acta, 2012, 78: 475-482. DOI:10.1016/j.electacta.2012.06.065 |
| [22] |
俞伟元, 高波, 路文江, 等. SDS作为正极电解液添加剂对钒电池性能的影响[J]. 兰州理工大学学报, 2014, 40(1): 10-14. Yu Weiyuan, Gao Bo, Lu Wenjiang, et al. Effect of SDS as an additive of positive electrolyte on performance of vanadium battery[J]. Journal of Lanzhou University of Technology, 2014, 40(1): 10-14. (in Chinese) |
| [23] |
吴雪文.全钒液流电池高性能稳定电解液的研究[D].长沙: 中南大学, 2010 Wu Xuewen. Research on high performance stable electrolyte of all vanadium redox flow battery[D]. Changsha:Central South University, 2010(in Chinese) 10.7666/d.y1718518 |
 2020, Vol. 37
2020, Vol. 37





