2. 鄱阳湖环境与资源利用教育部重点实验室, 南昌 330047
2. Key Laboratory of Poyang Lake Environment and Resource Utilization, Ministry of Education, Nanchang 330047, China
钕铁硼(NdFeB)是一种优异的永磁材料,与其他永磁体相比,价低且性能优良,被广泛应用于电机、微波炉、计算机和打印机等设备[1-4]。与铈和镧相比,地壳中钕和镨的丰度较低,但市场对钕铁硼永磁体的需求与日俱增。稀土元素同煤、石油和天然气一样,属于不可再生资源,为了节约资源,缓解对原生稀土矿的过度开采,从废弃物及工业边角料中回收永磁材料,具有重大意义。
目前溶剂萃取法广泛应用于稀土元素的分离回收[5]。其原理是使用酸性萃取剂P507、P204进行多级萃取。一般萃取1个RE3+需要置换3个H+至水相中,随着水相中H+浓度的增大,萃取效率逐渐降低[6-7]。为了保证萃取效率,在工业生产中通常会加入氨水或液氨皂化有机相,去除H+。皂化过程虽然保证了萃取效率,同时也会导致氨氮废水释放到环境中,难以治理[8]。肖海建等[9]使用P507-N235双溶剂萃取体系,通过P507萃取稀土释放H+,N235萃取HCl,实现了对氯化稀土的无皂化萃取分离。邱玉珍等[10]使用皂化工艺萃取稀土,将含氨氮废水在萃取分离过程中富集,提高水相中氯化铵的浓度,最终将高浓度氯化铵结晶。以上方法虽然避免了氨氮的释放,但前者使用P507-N235双溶剂萃取体系,萃取效率较低,难以保证萃取率;后者属于末端治理,且工艺要求较高,不符合清洁生产的要求。
离子液体是一种由阴阳离子组成的新型室温熔融盐[11-12]。它们的结构易于调整,结构的独特性赋予了其优异的物理和化学性质[13],近年来,被广泛应用于有机合成、电化学、催化、分离等领域[14]。Padhan等[4]使用[A336]Cl-Cyanex272双功能离子液体萃取钕铁硼磁铁滤液中的Nd和Pr时,随着萃取剂浓度的提高,Nd和Pr的萃取率分别可达98.97%和99.08%。Huang等[15]使用[N8, 8, 8]Cl、[P6, 6, 6, 14]Cl和[P6, 6, 6, 14][SOPAA]一系列离子液体从煤燃烧产物的浸出液中纯化稀土元素,纯化倍数可达8.7倍。较传统酸性萃取剂,使用离子液体萃取稀土元素,无需皂化即可达到优异的萃取效果。
与其它种类离子液体相比,咪唑类离子液体易制备且化学性质稳定。因此,本研究采用微波辅助法合成疏水性离子液体[BMIM][PF6],通过与不同萃取剂组合形成疏水性离子液体-中性磷氧萃取剂双官能团萃取体系,得到最适宜萃取体系[BMIM][PF6]-TOPO。探究了在最适宜萃取体系下时间、温度、pH值和V(A)/V(O) (水相稀土离子/有机相萃取体系)对萃取率的影响,得到最适宜萃取工艺。
1 实验部分 1.1 试剂与仪器溴代正丁烷、N-甲基咪唑、六氟磷酸钾、氢氧化钠、无水乙醚、乙腈、乙酸乙酯、磷酸三丁酯(TBP)、浓盐酸(36%~37%,质量分数)、氯化钠、醋酸、醋酸钠、三正辛基氧化膦(TOPO)、氧化钕、氧化镨、煤油、活性炭,实验室所用水均为去离子水。
DZF-6020型真空干燥箱、BL-2200H电子分析天平、DF-1型集热式恒温磁力搅拌器、KQ3200超声波清洗器、85-2型恒温磁力搅拌器、GZX-9070MBE数显鼓风干燥箱、WP700L17微波炉、TDL-4离心机、5700傅里叶变换红外光谱仪、Bruker Avance600核磁共振波普仪、Trip TOFTM 5600LC-TOF MS-MS、ICAP7400电感耦合等离子发射光谱仪(ICP)。
1.2 实验方法 1.2.1 离子液体的合成合成路线如下所示:
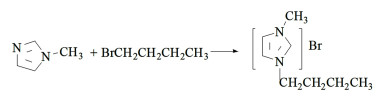 |
(1) |
 |
(2) |
1) 取8.2 g N-甲基咪唑,13.7 g溴代正丁烷置于锥形瓶中,放入微波炉中加热90 s,关闭微波炉,取出反应物,搅拌均匀,待其恢复至室温[16],重复上述步骤3次,出现金黄色产物。将产物置于分液漏斗中,使用10 mL乙酸乙酯洗涤,取出下层金黄色油状液体,重复3次上述操作。将洗涤完成的上述产物置于真空干燥箱中于75 ℃真空干燥8 h,得到中间产物1-丁基-3-甲基咪唑溴盐([BMIM]Br)。
2) 取18.4 g六氟磷酸钾,100 mL去离子水,置于圆底烧瓶中,控温30 ℃,搅拌均匀。将中间产物1-丁基-3-甲基咪唑溴盐([BMIM]Br)置于100 mL滴液漏斗中,控制滴速12滴/min,滴入上述圆底烧瓶,待其完全滴入,继续搅拌6 h。
3) 通过上述步骤得到粗的淡黄色产物1-丁基-3-甲基咪唑六氟磷酸盐([BMIM][PF6]),将粗产物置于分液漏斗中,使用10 mL去离子水洗涤,取下层液体,重复上述步骤3次;再取10 mL无水乙醚洗涤上述产物,重复3次。将最终所得下层液体置于真空干燥箱,75 ℃下真空干燥24 h。
4) 取出上述产物,称取1 g活性炭置于其中,搅拌均匀,放于漏斗中静置过滤,得到接近透明的黏稠状液体,即为1-丁基-3-甲基咪唑六氟磷酸盐([BMIM][PF6]),产率为91.4%。
FTIR:3 170.65(νsC4, 5Н), 3 125.83(νasC4, 5Н),2 966.85(νaCH3), 2 877.26(νsCH3), 1 573.37,1 169.61(νring),1 465.45(δCH2,CH3),1 434.81(δCH3N), 1 386.49(δCH3C),1 339.56(δCCH),941.32(δNCHN),749(δCCH),651.58,623.91(νring),830.25(νaP-F);1HNMR:δ:0.908(t,3H,CH3),1.286(m,2H,CH2),1.799(m,2H,NCH2CH2),3.852(s,3H,NCH3),4.163(m,2H,NCH2),7.671(s,H, CH),7.737(s,H,CH),9.079(s,H,CH);LC-TOF-MS,m/z:calcd for C8H15N2 [M+H+] 139.22,observed 139.124 8。
1.2.2 萃取过程稀土氯化物溶液的制备:使用盐酸溶解单一的稀土氧化物,蒸发去除多余的盐酸,过滤定容,用去离子水将稀土氯化物标定至一定浓度(0.01 mol·L-1)。
萃取剂的制备:称取定量的1-丁基-3-甲基咪唑六氟磷酸盐([BMIM][PF6]),使用乙酸乙酯为共溶剂,定容至所需浓度;磷酸三丁酯(TBP),三正辛基氧化膦(TOPO)使用煤油稀释,定容至所需浓度。
萃取实验:当萃取体系为单一离子液体或萃取剂时,均取10 mL进行萃取实验;当萃取体系为双官能团萃取体系时,分别移取5 mL[BMIM][PF6]及5 mL各萃取剂于离心管中混合均匀。将各萃取体系加入到含有10 mL氯化稀土溶液的烧杯中,置于集热式恒温磁力搅拌器上控温搅拌,待搅拌结束,置于分液漏斗中静置分层,取出下层水层,使用ICAP7400电感耦合等离子体发射光谱仪(ICP)测定稀土离子浓度,通过测定萃取前后溶液中Nd3+和Pr3+离子的含量,通过差减法来评价萃取体系对Nd3+和Pr3+的萃取能力。萃取率E及分配比D的计算方法如式(3)和式(4)
| $ E = {\rm{ }}\frac{{{c_0} - {c_{\rm{i}}}}}{{{c_0}}} \times 100\% $ | (3) |
| $ D = {\rm{ }}\frac{{{c_0} - {c_{\rm{i}}}}}{{{c_{\rm{i}}}}} $ | (4) |
式(3)和式(4)中,E为萃取率,%;D为分配比;c0为萃取前水相中稀土离子浓度,mol·L-1;ci为萃取后水相中稀土离子浓度,mol·L-1。
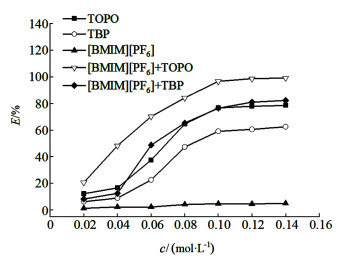
2 结果与讨论 2.1 萃取体系选择实验选取(a)TBP(cTBP=0.02~0.14 mol·L-1),(b)TOPO(cTOPO=0.02~0.14 mol·L-1),(c)[BMIM][PF6](c[BMIM][PF6]=0.02~0.14 mol·L-1),(d)[BMIM][PF6]-TBP(c[BMIM][PF6]=cTBP=0.02~0.14 mol·L-1,V[BMIM][PF6] :VTBP=1 :1),(e)[BMIM][PF6]-TOPO(c[BMIM][PF6]=cTOPO=0.02~0.14 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1) 5种萃取体系进行萃取Nd3+和Pr3+的研究。萃取条件为:时间60 min、温度25 ℃、pH值为5.0、V(A)/V(O)=1。
由图 1可知:在相同的条件下a体系对于Nd3+的萃取效果较差,随着萃取体系浓度的增加,萃取率从6.20%增长至62.47%;b体系对于Nd3+的萃取效果较好,随着萃取体系浓度的增加,萃取率从12.20%增长至78.54%;c体系萃取前后Nd3+溶液浓度基本没有变化,萃取效果极差;d体系对于Nd3+的萃取效果较好,随着萃取体系浓度的增加,萃取率从8.16%增长至82.35%;e体系萃取效果最为优异,随着萃取体系浓度的增加,萃取率从20.52%增长至99.20%。
|
| 图 1 不同浓度下5种萃取体系对Nd3+的萃取效果 Fig.1 Extraction rate of Nd3+ by 5 extraction systems at different concentrations |
| |
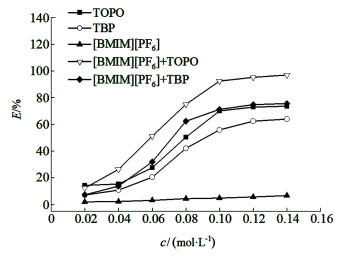
由图 2可知:在相同的条件下a体系对于Pr3+的萃取效果较差,随着萃取体系浓度的增加,萃取率从7.10%增长至63.91%;b体系对于Pr3+的萃取效果较好,随着萃取体系浓度的增加,萃取率从14.30%增长至73.60%;c体系萃取前后Pr3+浓度基本没有变化,萃取效果极差;d体系对于Pr3+的萃取效果良好,随着萃取体系浓度的增加,萃取率从7.26%增长至75.60%;e体系萃取效果最为优异,随着萃取体系浓度的增加,萃取率从12.30%增长至96.90%。
|
| 图 2 不同浓度下5种萃取体系对Pr3+的萃取效果 Fig.2 The extraction rate of Pr3+ by 5 extraction systems at different concentrations |
| |
原因分析:a体系中TBP为中性磷氧萃取剂,对于酸性稀土的萃取效果排序如下:草酸、乙酸>HClO4>HNO3>H3PO4>HCl>H2SO4[18],在上述排序中,阴离子水化能逐渐增大,萃取难度也随之增大。本次萃取稀土离子为氯化稀土,萃取剂TBP与RE3+形成配合物RE(Cl)3 ·3TBP[10],阴离子水化能偏大,导致体系萃取效果较差;b体系TOPO与a体系中TBP同为中性磷氧萃取剂,这一类萃取剂的通式为G3P=O,基团G可以是烷氧基R-O(或烷基R),烷氧基中有电负性大的O原子,拉电子能力强,与稀土离子形成配位键的能力最弱[18]。TBP中G基团为(RO) 3P=O类,TOPO中G基团为PR3=O类,后者与稀土离子形成配合物的能力更强,萃取剂TOPO与RE3+结合,形成配合物RE(Cl)3 ·3TOPO,萃取效果较好[19];c体系通过ICP测定,萃取前后水相中Nd3+浓度变化很小,这是由于咪唑类离子液体结构的不对称性,导致阴阳离子之间的作用力很小,与稀土离子难以形成稳定的配合物;d体系为离子液体-中性磷氧萃取剂双官能团萃取体系,萃取体系与RE3+形成配合物RE(TBP)3(PF6)3,静置分层明显, 萃取效果良好。e体系为离子液体-中性磷氧萃取剂双官能团萃取体系,萃取剂体系与RE3+形成配合物RE(TOPO)3(PF6)3[20],与上述a、b、c和d萃取体系相比,萃取效果最为优异。
综合图 1和图 2,各萃取体系对Nd3+和Pr3+萃取效率依次为[BMIM][PF6]-TOPO>[BMIM][PF6]-TBP>TOPO>TBP>[BMIM][PF6]。因此,本次研究采用e萃取体系进行萃取实验。
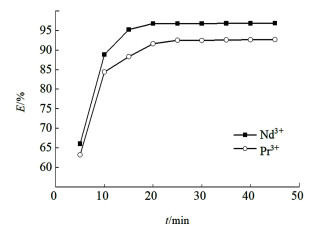
2.2 离子液体萃取性能评价 2.2.1 时间对萃取率的影响设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO=0.1 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1)、温度25 ℃、pH值=5.0、V(A)/V(O)=1,考察时间对萃取Nd3+的影响;设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO= 0.1 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1)、温度25 ℃、pH值=5.0、V(A)/V(O)=1,考察时间对萃取Pr3+的影响。萃取率随时间变化如图 3所示。
|
| 图 3 时间对萃取率的影响 Fig.3 Effect of time on extraction rate |
| |
由图 3可知,萃取率随萃取时间的增加而增大,由于镧系收缩[18],萃取体系对Nd3+的萃取率略高于Pr3+。对于Nd3+,在5~20 min,萃取率随着时间的延长而增大,从66.05%增长至96.78%;在20~45 min,萃取率维持在96.78%~96.87%,达到萃取平衡状态。对于Pr3+,在5~25 min,萃取率随时间的延长而增大,从63.20%增长至92.50%,在25~45 min,萃取率维持在91.60%~92.67%范围,达到萃取平衡状态。
分析原因:萃取Nd3+和Pr3+过程分别在20和25 min时达到萃取平衡。未加入共溶剂时,离子液体黏度大,传质困难,达到萃取平衡所用时间均接近90 min,共溶剂的加入,大幅缩减了萃取平衡时间。因此:Nd3+最适宜萃取时间为20 min,Pr3+最适宜萃取时间为25 min。
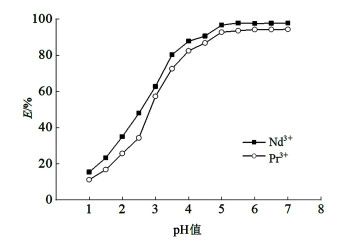
2.2.2 pH值对萃取率的影响设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO=0.1 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1)、时间20 min、温度25 ℃、V(A)/V(O)=1,考察pH值对萃取Nd3+的影响;设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO=0.1 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1)、时间25 min、温度25 ℃、V(A)/V(O)=1,考察pH值对萃取Pr3+的影响。萃取率随pH值的变化如图 4所示。
|
| 图 4 pH值对萃取率的影响 Fig.4 Effect of pH on extraction rate |
| |
由图 4可知,对于Nd3+,pH值从1.0增加至5.0,萃取率随pH值的增大而增大,萃取率从15.4%增长至96.62%,增幅为81.22%;pH值从5.0增加至7.0,萃取率随pH值的增大波动很小,萃取过程达到平衡。对于Pr3+,pH值从1.0增加至5.0,萃取率从11.20%增长至92.78%,增幅为81.58%;pH值从5.0增加至7.0,萃取率随pH值的增大波动很小,萃取过程达到平衡。
分析原因:当pH值较低时,水相酸度大,H+与稀土离子存在竞争关系[20],会干扰稀土离子与萃取体系形成配合物,导致生成配合物数量较少;当pH值升高时,H+浓度降低,竞争减弱,稀土离子与萃取体系较易形成配合物,pH值继续增大,H+浓度较小,对萃取体系干扰较小。故Nd3+最适宜萃取pH值为6.0,Pr3+最适宜萃取pH值为6.0。
2.2.3 V(A)/V(O)对萃取率的影响设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO=0.1 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1)、时间20 min、温度25 ℃、pH值=6.0,考察V(A)/V(O)对萃取Nd3+的影响。设置萃取条件:萃取体系(c[BMIM][PF6]= cTOPO=0.1 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1)、时间25 min、温度25 ℃、pH值=6.0,考察V(A)/V(O)对萃取Pr3+的影响。萃取率随V(A)/V(O)的变化如图 5所示。

|
| 图 5 V(A)/V(O)对萃取率的影响 Fig.5 Effect of V(A)/V(O) on extraction rate |
| |
由图 5可知,随着萃取剂量的减少,萃取率呈降低趋势。对于Nd3+,当V(A)/V(O)为0.2~2.0时,萃取率维持在较高的范围;当V(A)/V(O)为2.0~9.0时,萃取率从92.58%降至13.02%,降幅为76.56%;对于Pr3+,当V(A)/V(O)为0.2~2.0时,萃取率维持在较高范围;当V(A)/V(O)为2.0~9.0时,萃取率从85.47%降至13.60%,降幅为71.83%。
分析原因,当V(A)/V(O)很低时,萃取体系量足够多,Nd3+和Pr3+与萃取体系易形成配合物,萃取率较高;当V(A)/V(O)很高时,萃取体系为不足量状态,Nd3+、Pr3+与萃取体系形成的配合物少,平衡导致水相中剩余Nd3+和Pr3+浓度高,难以实现萃取,萃取效果差。同时,高相比对于萃取效果的提升有限,当V(A)/V(O)为1.0时,对于Nd3+和Pr3+的萃取率分别可达97.8%和94.2%。因此,最适宜V(A)/V(O)为1.0。
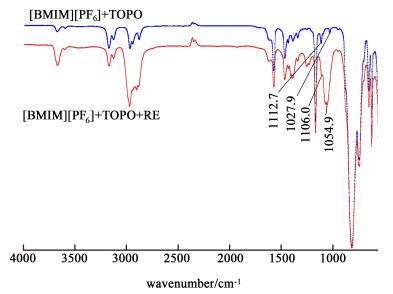
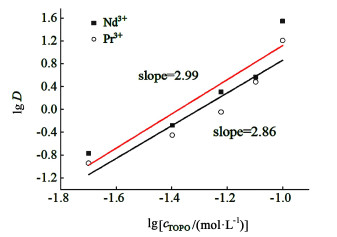
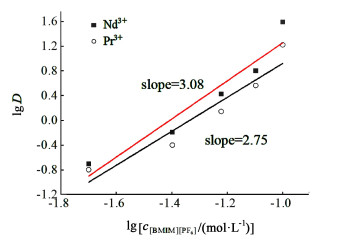
2.2.4 萃取机理探究图 6为萃取体系萃取前后红外光谱变化图;保持水相组成不变,首先固定萃取体系中[BMIM][PF6](c[BMIM][PF6]=0.1 mol·L-1,V[BMIM][PF6]=5 mL)浓度,改变TOPO(cTOPO=0.02~0.1 mol·L-1, VTOPO=5 mL)浓度[21],对浓度cTOPO及分配比D做对数函数,线性拟合得到图 7,图 7为lgD与lgcTOPO关系图。同理,保持水相组成不变,固定萃取体系中TOPO(cTOPO=0.1 mol·L-1, VTOPO=5 mL)浓度,改变[BMIM][PF6] (c[BMIM][PF6]=0.02~0.10 mol·L-1,V[BMIM][PF6]=5 mL)浓度,对浓度c[BMIM][PF6]及分配比D做对数函数,线性拟合得到图 8,图 8为lgD与lgc[BMIM][PF6]关系图。
|
| 图 6 不同体系红外光谱图 Fig.6 IR transmittance spectra of different systems |
| |
|
| 图 7 lgD与lgcTOPO关系图 Fig.7 Plot of lgD vs. lgcTOPO |
| |
|
| 图 8 lgD与lgc[BMIM][PF6]关系图 Fig.8 Plot of lgD vs. lgc[BMIM][PF6] |
| |
由图 6可以观察到萃取前后离子液体红外光谱的变化。TOPO的P O键伸缩振动吸收峰位置为1 112.7 cm-1,[BMIM][PF6]的C—N键伸缩振动吸收峰位置为1 027.9 cm-1,经过与Nd3+作用之后,发生了明显的偏移,P O键吸收峰位置移动至1 106 cm-1,C—N键吸收峰位置移动至1 054.9 cm-1。结果表明,在萃取过程中,P O、C—N键与Nd3+发生了相互作用。萃取剂与Nd3+配位关系由斜率法表示[4, 21-22],如图 7、图 8所示,lgD与lgcTOPO、lgD与lgc[BMIM][PF6]表现出良好的线性关系,斜率分别为2.99和3.08,表明萃取1 mol Nd3+需要消耗3 mol TOPO及3 mol [BMIM][PF6]。根据参考文献[4, 22]及图 6、图 7和图 8可知,[BMIM][PF6]-TOPO萃取体系萃取RE3+的机理如式(5)所示。
式(5)可简写为:
| $ {\rm{RE}}_{_{{\rm{aqu}}}}^{^{3 + }} + 3{\rm{C}}{{\rm{l}}^ - } + 3{\rm{TOP}}{{\rm{O}}_{{\rm{org}}}} + 3\left[ {{\rm{BMIM}}} \right]{\left[ {{\rm{P}}{{\rm{F}}_6}} \right]_{{\rm{org}}}} \Leftrightarrow \left[ {{\rm{RE}} \cdot {\rm{TOP}}{{\rm{O}}_3}} \right]\left[ {_{\rm{P}}{{\rm{F}}_{\rm{6}}}_{{\rm{org}}}{\rm{ + 3}}{\rm{BMIM}}} \right]{\left[ {{\rm{Cl}}} \right]_{{\rm{org}}}} $ | (6) |
萃取反应的平衡常数K可以表示为:
| $ K{\rm{ = }}\frac{{c{\rm{([RE}} \cdot {\rm{TOP}}{{\rm{O}}_{\rm{3}}}{\rm{][P}}{{\rm{F}}_{\rm{6}}}{\rm{]}}{_{\rm{3}}}_{{\rm{org}}}{\rm{)\cdot}}{c^{\rm{3}}}{\rm{(}}\left[ {{\rm{BMIM}}} \right]{{{\rm{[Cl]}}}_{{\rm{org}}}}{\rm{)}}}}{{c{\rm{(RE}}_{_{{\rm{aqu}}}}^{{\rm{3 + }}}{\rm{)\cdot}}{c^{\rm{3}}}{\rm{(C}}{{\rm{l}}^ - }{\rm{)\cdot}}{c_{\rm{3}}}{\rm{(TOP}}{{\rm{O}}_{{\rm{org}}}}{\rm{)\cdot}}{c^{\rm{3}}}{\rm{(}}\left[ {{\rm{BMIM}}} \right]{{{\rm{[P}}{{\rm{F}}_6}{\rm{]}}}_{{\rm{org}}}}{\rm{)}}}} $ | (7) |
稀土在水相中的主要存在形式为RE3+, 则分配比D可以表示为:
| $ D = {\rm{ }}\frac{{c({\rm{[RE}} \cdot {\rm{TOP}}{{\rm{O}}_{\rm{3}}}{\rm{][P}}{{\rm{F}}_6}{{\rm{]}}_{{\rm{3org}}}}{\rm{)}}}}{{ c{\rm{(RE}}_{_{{\rm{aqu}}}}^{{\rm{3 + }}}{\rm{)}}}} $ | (8) |
| $ K = {\rm{ }}\frac{{D \cdot {c^3}(\left[ {{\rm{BMIM}}} \right]{{\left[ {{\rm{Cl}}} \right]}_{{\rm{org}}}}{\rm{)}}}}{{{c^{\rm{3}}}{\rm{(C}}{{\rm{l}}^ - }{\rm{)}} \cdot {c^{\rm{3}}}{\rm{(TOP}}{{\rm{O}}_{{\rm{org}}}}{\rm{)}} \cdot {c^{\rm{3}}}{\rm{(}}\left[ {{\rm{BMIM}}} \right]{{\left[ {{\rm{P}}{{\rm{F}}_6}} \right]}_{{\rm{org}}}}{\rm{)}}}}{\rm{}} $ | (9) |
或:
| $ D = {\rm{ }}\frac{{K \cdot {c^3}{\rm{(C}}{{\rm{l}}^ - }{\rm{)}} \cdot {c^{\rm{3}}}{\rm{(TOP}}{{\rm{O}}_{{\rm{org}}}}{\rm{)}} \cdot {c^{\rm{3}}}{\rm{(}}\left[ {{\rm{BMIM}}} \right]{{\left[ {{\rm{PF}}} \right]}_6}_{{\rm{org}}}{\rm{)}}}}{{{c^{\rm{3}}}{\rm{(}}\left[ {{\rm{BMIM}}} \right]{{\left[ {{\rm{Cl}}} \right]}_{{\rm{org}}}}{\rm{)}}}}{\rm{}} $ | (10) |
对式(10)取对数可得:
| $ \begin{array}{l} \;\;\;\;\;{\rm{lg}}D{\rm{ = lg}}K{\rm{ + 3lg}}{c_{{\rm{TOPO}}}}_{_{{\rm{org}}}}\\ {\rm{ + 3lg}}{c_{{\rm{C}}{{\rm{l}}^ - }}}{\rm{ + 3lg}}{c_{\left[ {{\rm{BMIM}}} \right]{{\left[ {{\rm{P}}{{\rm{F}}_6}} \right]}_{{\rm{org}}}}}} - \\ \;\;\;\;\;\;\;\;\;{\rm{3lg}}{c_{\left[ {{\rm{BMIM}}} \right]{\rm{[Cl]}}}}_{_{{\rm{org}}}}{\rm{}} \end{array} $ | (11) |
设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO=0.1 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1)、时间20 min、pH值=6.0、V(A)/V(O)=1.0,考察萃取温度对萃取Nd3+的影响;设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO=0.1 mol·L-1,V[BMIM][PF6] :VTOPO=1 :1)、时间25 min、pH值=6.0、V(A)/V(O)=1.0,控制温度,得到Pr3+的萃取率。萃取率随温度的变化如图 9所示。
|
| 图 9 温度对萃取率的影响 Fig.9 Effect of temperature on extraction rate |
| |
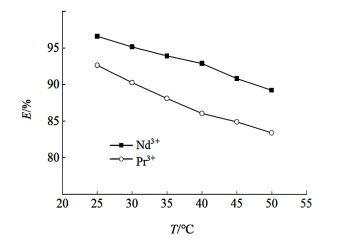
由图 9可知:对于Nd3+,当温度从25 ℃升高至50 ℃时,萃取率从96.59%降至89.20%;对于Pr3+,当温度从25 ℃升高至50 ℃时,萃取率从92.61%降至83.40%。萃取率随着温度的升高而下降,但整体变化不大。根据范特霍夫方程,做出不同温度下lgD与1/T关系[23],如图 10所示:
|
| 图 10 lgD与1000/T的关系 Fig.10 Plot of lgD vs. 1000/T |
| |
| $ {\rm{lg}}D = - {\rm{ }}\frac{H}{{2.303R}}{\rm{ }}\frac{{{\rm{ }}1}}{{{\rm{ }}T{\rm{ }}}} + C $ | (12) |
式(12)中:ΔH为反应的焓变,kJ·mol-1;R为气体常数,kJ·(mol·K)-1;T为绝对温度,K;C为积分常数。
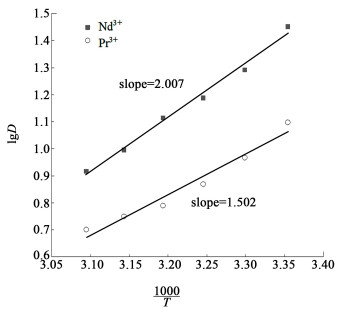
由图 10可知,斜率分别为K(Nd3+)=2.007,K(Pr3+)=1.502,通过斜率,计算得到ΔH(kJ·mol-1)分别为-38.43和-28.76 kJ·mol-1。ΔG(kJ·mol-1)和ΔS(J·mol-1·K)的计算公示如式(13)和式(14):
| $ \Delta G = - RT{\rm{ln}}K $ | (13) |
| $ \Delta S = \frac{{\Delta H - \Delta G}}{T}{\rm{ }} $ | (14) |
由式(13)可得ΔG(Nd3+)=-24.57 kJ·mol-1,ΔG(Pr3+)=-22.44 kJ·mol-1,通过ΔH及式(14)可以计算得出ΔS(Nd3+)=-46.51 J·mol-1·K-1,ΔS(Pr3+)=-21.2 J·mol-1·K-1。ΔH<0,萃取过程为放热反应,因此,降低温度,有助于萃取过程的进行。故Nd3+和Pr3+最适宜萃取温度为25 ℃。
2.2.6 萃取体系各组分体积比对萃取率的影响设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO=0.1 mol·L-1)、温度25 ℃、时间20 min、pH值=6.0、V(A)/V(O)=1:1,控制[BMIM][PF6]与TOPO的体积比,得到Nd3+的萃取率;设置萃取条件:萃取体系(c[BMIM][PF6]=cTOPO=0.1 mol·L-1)、时间25 min、温度25 ℃、pH值=6.0、V(A)/V(O)=1:1,控制[BMIM][PF6]与TOPO的体积比,得到Pr3+的萃取率。V([BMIM][PF6]) :V(TOPO)对萃取效率的影响如图 11所示。
|
| 图 11 萃取体系各组分体积比对萃取率的影响 Fig.11 Effect of volumetric ratio of components in extraction system on extraction rate |
| |
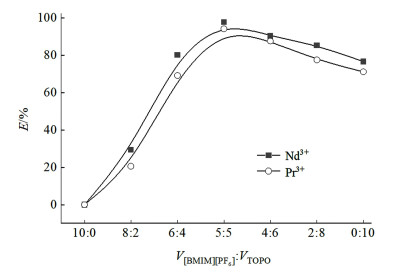
由图 11可知,对于Nd3+、Pr3+,当V[BMIM][PF6] :VTOPO从10 :0变至1 :1,萃取率逐渐增大,当V[BMIM][PF6] :VTOPO=1 :1时,萃取率达到最大;当体积比从1 :1变至0 :10,萃取效果逐渐变差,整体来说,萃取率先增大后减小。因此,萃取Nd3+、Pr3+的最适宜体积比均为V[BMIM][PF6] :VTOPO=1 :1。
3 结论1) 通过两步法,经FT-IR,1HNMR,MS表征表明合成了离子液体[BMIM][PF6],产率为91.4%。考察了[BMIM][PF6],TBP,TOPO,[BMIM][PF6]-TBP,[BMIM][PF6]-TOPO 5种体系对于稀土元素中Nd3+和Pr3+的萃取效果,结果表明:5种体系萃取性能依次为[BMIM][PF6]-TOPO>[BMIM][PF6]-TBP>TOPO>TBP>[BMIM][PF6]。
2) 对[BMIM][PF6]-TOPO体系萃取性能进行评价,当萃取条件为萃取时间为20 min、温度为25 ℃、pH值为6.0、V(A)/V(O)为1.0、V[BMIM][PF6] :VTOPO=1 :1,体系对于Nd3+的萃取效果最佳,萃取率可达97.8%;萃取时间为25 min、温度为25 ℃、pH值为6.0、V(A)/V(O)为1.0、V[BMIM][PF6] :VTOPO=1 :1,体系对于Pr3+的萃取效果最佳,萃取率可达94.3%。
3) 萃取过程ΔH<0,萃取为放热过程,在常温下萃取即可达到很高的萃取率,有大规模推广使用的潜质。
| [1] |
张逸.新型功能化离子液体的制备与在CO2吸收及稀土金属萃取方面的应用[D].武汉: 武汉大学, 2015 Zhang Yi. Synthesis of novel functionalized ionic liquids and their application in CO2 absorption and extraction of rare earth elements[D]. Wuhan: Wuhan University, 2015(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10486-1015306043.htm |
| [2] |
邓永春, 姜银举, 王永强. 高稀土氧化物渣系熔化温度的测定[J]. 过程工程学报, 2017, 17(6): 1203-1207. Deng Yongchun, Jiang Yinju, Wang Yongqiang. Melting temperature test of slag rich in rare earth oxides[J]. The Chinese Journal of Process Engineering, 2017, 17(6): 1203-1207. (in Chinese) |
| [3] |
吴迪, 钱贵霞. 中国稀土产业经济研究现状与发展趋势分析[J]. 稀土, 2014, 35(5): 104-112. Wu Di, Qian Guixia. Reseatch situation and development trend of China rare earth industry[J]. Chinese Rare Earths, 2014, 35(5): 104-112. (in Chinese) |
| [4] |
Padhan E, Sarangi K. Recovery of Nd and Pr from NdFeB magnet leachates with bi-functional ionic liquids based on Aliquat 336 and Cyanex 272[J]. Hydrometallurgy, 2017, 167: 134-140. DOI:10.1016/j.hydromet.2016.11.008 |
| [5] |
卞玉洋.从钕铁硼废料中回收稀土元素的新工艺研究[D].上海: 上海大学, 2016 Bian Yuyang. Development of novel processes on the recovery of rare earth elements from NdFeB-based permanent magnet wastes[D]. Shanghai: Shanghai University, 2016(in Chinese) |
| [6] |
崔佳娜, 王明. 稀土萃取分离皂化工艺研究进展[J]. 稀有金属与硬质合金, 2017, 45(2): 1-5. Cui Jiana, Wang Ming. Research progress on saponification process of rare earth extraction separation[J]. Rare Metals and Cemented Carbides, 2017, 45(2): 1-5. (in Chinese) |
| [7] |
Chen J, Huang C, Wang Y, et al. Extraction behavior of bifunctional ionic liquid[N1888][SOPAA] and TBP for rare earth elements[J]. Journal of Rare Earths, 2016, 34(12): 1252-1259. DOI:10.1016/S1002-0721(16)60161-8 |
| [8] |
Wang W, Yang H, Cui H, et al. Application of bifunctional ionic liquid extractants[J]. Industrial & Engineering Chemistry Research, 2011, 50(12): 7534-7541. |
| [9] |
肖海建, 蓝桥发, 黄金, 等. P507-N235体系稀土萃取分离试验研究[J]. 稀土, 2015, 36(6): 32-38. Xiao Haijian, Lan Qiaofa, Huang Jin, et al. Research on extraction and separation of rare earth in P507-N235 system[J]. Chinese Rare Earths, 2015, 36(6): 32-38. (in Chinese) |
| [10] |
邱玉珍, 王超, 徐海波, 等. P507-盐酸体系中氯化铵对RE3+萃取分离的影响研究[J]. 稀土, 2017, 38(4): 68-75. Qiu Yuzhen, Wang Chao, Xu Haibo, et al. Influences of ammonium chloride on extraction and separation of rare earth ions in P507-hydrochloric acid system[J]. Chinese Rare Earths, 2017, 38(4): 68-75. (in Chinese) |
| [11] |
Zhang J, Li M, Yang M, et al. Magnetic retrieval of ionic liquids:Fast dispersive liquid-liquid microextraction for the determination of benzoylurea insecticides in environmental water samples[J]. Journal of Chromatography. A, 2012, 1254: 23-29. DOI:10.1016/j.chroma.2012.07.051 |
| [12] |
Stojanovic A, Keppler B K. Ionic liquids as extracting agents for heavy metals[J]. Separation Science and Technology, 2012, 47(2): 189-203. |
| [13] |
Jha M K, Kumari A, Panda, R, et al. Review on hydrometallurgical recovery of rare earth metals[J]. Hydrometallurgy, 2016, 165: 2-26. DOI:10.1016/j.hydromet.2016.01.035 |
| [14] |
Liao C, Li Z, Zeng Y, et al. Selective extraction and recovery of rare earth metals from waste fluorescent powder using alkaline roasting-leaching process[J]. Journal of Rare Earths, 2017, 35(10): 1008-1013. DOI:10.1016/S1002-0721(17)61006-8 |
| [15] |
Huang C, Wang Y, Huang B, et al. The recovery of rare earth elements from coal combustion products by ionic liquids[J]. Minerals Engineering, 2019. DOI:10.1016/j.mineng.2018.10.002 |
| [16] |
Namboodiri V V, Varma R S. Solvent-Free sonochemical preparation of ionic liquids[J]. Organic Letters, 2002, 4(18): 3161-3163. DOI:10.1021/ol026608p |
| [17] |
Ramenskaya L M, Grishina E P. Intensification phenomenon of weak ionic interactions of 1-butyl-3-methylimidazolium hexafluorophosphate ionic liquid macro-dispersed in poly(methyl methacrylate):FTIR spectroscopic evidence[J]. Journal of Molecular Liquids, 2016, 218: 133-137. DOI:10.1016/j.molliq.2016.02.037 |
| [18] |
徐光宪. 稀土的溶剂萃取[M]. 北京: 科学出版社, 1987. Xu Guangxian. Solvent extraction of rare earth[M]. Beijing: Science Press, 1987. (in Chinese) |
| [19] |
Batchu N K, Vander Hoogerstraete T, Banerjee D, et al. Non-aqueous solvent extraction of rare-earth nitrates from ethylene glycol to n-dodecane by Cyanex 923[J]. Separation and Purification Technology, 2016. DOI:10.1016/j.seppur.2016.10.039 |
| [20] |
Coll M T, Fortuny A, Kedari C S, et al. Studies on the extraction of Co(Ⅱ) and Ni(Ⅱ) from aqueous chloride solutions using Primene JMT-Cyanex272 ionic liquid extractant[J]. Hydrometallurgy, 2012, 125-126. DOI:10.1016/j.hydromet.2012.05.003 |
| [21] |
陈莉莉, 邱祖民, 黄金莲, 等. PMBP缩2-ABT/TBP/离子液体双水相对稀土离子的协同萃取[J]. 稀土, 2011, 32(3): 68-71. Chen Lili, Qiu Zumin, Huang Jinlian, et al. Synergistic extraction of lanthanide ions with PMBP-2-ABT and TBP in ionic liquid two-phase aqueous system[J]. Chinese Rare Earths, 2011, 32(3): 68-71. (in Chinese) |
| [22] |
Shen L, Chen J, Chen L, et al. Extraction of mid-heavy rare earth metal ions from sulphuric acid media by ionic liquid[A336][P507][J]. Hydrometallurgy, 2016. DOI:10.1016/j.hydromet.2016.01.015 |
| [23] |
Xiong Y, Kuang W, Zhao J, et al. Ionic liquid-based synergistic extraction of rare earths nitrates without diluent:Typical ion-association mechanism[J]. Separation and Purification Technology, 2017, 179: 349-356. DOI:10.1016/j.seppur.2017.02.026 |
 2020, Vol. 37
2020, Vol. 37





