2. 中北大学环境与安全工程学院, 太原 030051
2. School of Environment and Safety Engineering, North University of China, Taiyuan 030051, China
柴油车氮氧化物排放是导致我国雾霾元凶之一,NOx控制减排是我国环境保护核心战略。自我国实行国四法规以来NH3-SCR技术一直都是控制NOx排放最有效的技术,该技术的成功得益于不断改进的催化剂。相比我国重型柴油车国五排放法规,已实施的国六a阶段法规要求NOx排放限值降低80% [国五2.0 g/kWh,国六(a) 0.4 g/kWh],同时耐久性增加40%以上(国五N1/N2/N3不同车型分别为10/20/50万km,国六20/30/70万km)。铜基菱沸石分子筛催化剂(Cu/CHA,主要指Cu/SAPO-34和Cu/SSZ-13催化剂)由于具有小孔结构(孔道尺寸0.38 nm)特点,相比其他分子筛催化剂具有更加优异的水热稳定性、高的低温NOx去除效率、高N2选择性及宽的温度窗口,因而能够满足国六排放法规对于SCR催化剂长寿命及高效率的要求,而成为新一代柴油车NOx排放控制催化剂的首选。
我国目前柴油中S的质量分数低于10×10-6 [燃烧后尾气中硫的质量分数仅为(1~2)×10-6];然而即便如此低的S含量,也会使得催化剂在长时间应用过程后积累大量硫,导致Cu/CHA催化剂NOx转化率出现下降[1],从而影响催化剂实际NOx减排效率。硫中毒问题一直是SCR催化剂在实际应用过程中必须面对的关键问题之一。因此,明确该催化剂相关失活及恢复机理,对于柴油车后处理系统整体应用至关重要[2]。本论文针对铜基小孔分子筛催化剂,首先综述了Cu/CHA催化剂NH3-SCR反应机理,包括反应活性中心及微观反应机理研究现状,在此基础上总结了硫氧化物对Cu/CHA催化剂NH3-SCR催化剂反应影响机制的研究进展,包括Cu/CHA催化剂硫中毒与再生研究,归纳了其硫中毒、再生等微观原因。
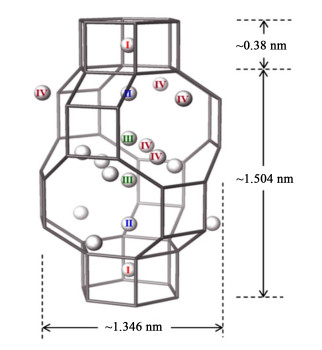
1 Cu/CHA活性位及反应机理尽管SAPO-34和SSZ-13分子筛组成有差异,但二者都具有菱沸石结构,通过TO4四面体氧原子首尾相接,有序地排列成具有八元环结构的椭球形笼(0.73 nm×1.20 nm)和三维交叉孔道结构(如图 1所示)[3],孔道尺寸为0.38 nm×0.38 nm。对于铜在CHA中位置,模拟结果表明铜离子交换位只可能有以下4种:1)双六元环中心(位置Ⅰ);2)CHA笼内并靠近六元环面部(位置Ⅱ);3)CHA笼内,沿着三维轴线(位置Ⅲ);4)八元环窗内或附近(位置Ⅳ)。
Xue等[4]通过EPR结合TOF计算首次发现Cu/SAPO-34催化剂,活性位是位置Ⅱ的孤立态二价铜离子(图 1)。相似地,Cu/SSZ-13离子态的铜仍然是反应的活性位,但可能由于SSZ-13催化剂交换度较高(能够达到100%交换度),活性中心为位于CHA结构Ⅱ及Ⅳ的具有相同反应活性的Cu2+以及Cu(OH)+[5]。
Wang等[6]利用原位红外手段研究了Cu/SAPO-34低温SCR反应机理,研究发现反应过程包括2个部分:1)孤立态Cu2+上形成的硝酸铵与NO反应;2)B酸上吸附的NH3与NO2生成的亚硝酸铵分解反应。Su等[7]利用原位红外结合TPSR技术研究了Cu/SSZ-13催化剂表面反应过程,研究发现低温下SCR反应主要是活性Cu物种上吸附的NH3与NO2-进行反应,当铜含量较高时,Cu-NO3-也会与Cu-NH3进行反应。
在上述吸附物种反应的同时,活性位发生着价态的变化。Yu等[8]利用原位EPR研究了Cu/SAPO-34催化剂反应机理发现Cu2+在反应时会发生还原及氧化反应。Gao[9]及Paolucci等[10]同样地发现Cu/SSZ-13标准SCR反应包括还原半周期和氧化半周期。NO吸附在[(NH3)2-CuII-OH]+物种羟基位,进而发生反应完成还原反应生成Cu+-NH3;Cu+-NH3进一步吸附NH3形成[CuI(NH3)2]+,通过笼内迁移并与O2反应完成氧化反应过程。
此外,对于Cu/CHA催化剂NH3-SCR高温反应,NH3氧化的反应至关重要。对于Cu/SAPO-34,NH3氧化主要发生在CuOx上[11]。而对于Cu/SSZ-13而言,高温氨氧化活性中心主要是Cu(OH)+[12],但是当Cu/SSZ-13催化剂经过高温水热等处理产生CuOx物种后,CuOx仍然被认为是主要反应活性位[13]。
2 Cu/CHA硫中毒及再生 2.1 Cu/CHA催化剂硫中毒研究进展硫中毒对Cu/CHA催化剂活性影响程度与硫氧化物种类、气氛(SO2、SO3、H2O或NH3等)及温度密切相关。这是由于上述条件影响了Cu/CHA催化剂在硫化过程中形成的硫物种[H2SO4、(NH4)2SO4、CuHSO3、CuSO4和Al2(SO4)3等]种类及含量[14-26]。
Shen等[14]研究发现Cu/SAPO-34在单纯SO2硫化后,催化剂有硫酸铜的生成的同时伴随着活性位数量的下降,表明活性位的下降是由于硫酸盐生成导致的,且催化剂SCR活性下降与活性位下降线性相关。Brookshear等[15]发现高温下更易生成大量的硫酸盐,进而会导致Cu/SAPO-34催化剂SCR活性下降。Wijayanti等[16]利用H2-TPR发现,Cu/SAPO-34在经过SO2硫化后,活性位下降导致的氧化还原能力降低是NOx性能下降的主要原因。对于Cu/SSZ-13催化剂,Jangjou等[17]同样发现Cu/SSZ-13硫化后活性下降与活性位上生成的Cu-S物种相关。并且硫化条件下,Cu/SSZ-13催化剂中活性Cu(OH)+相比Cu2+更易与SO2反应形成硫酸盐[18]。
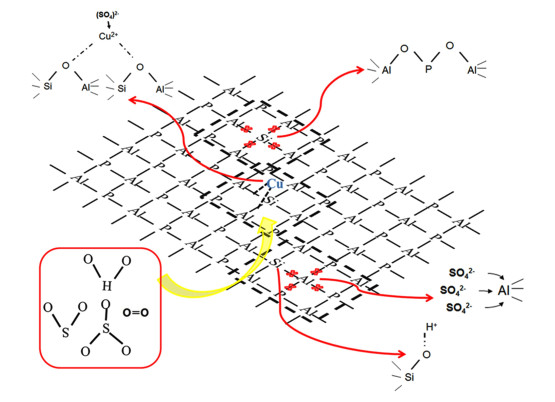
当NH3存在于SO2硫化气氛当中时,硫氨物种的影响不可忽视。Wang等[19]对Cu/SAPO-34硫氨共同硫化研究发现,250 ℃活性位上大量生成硫酸铵,而350 ℃只生成硫酸铜,进一步通过TOF证明无论活性位上生成何种硫酸盐,孤立Cu2活性位的降低是活性下降的主因(如图 2所示)。Wijayanti等[20]发现Cu/SSZ-13催化剂在200 ℃硫氨共同硫化条件下会生成主要生成硫酸铵,而400 ℃主要生成硫酸铜。Jangjou等[17]提出了Cu/SSZ-13低温硫铵共硫化机理(如图 3所示)。作者认为该条件下只有在Cu2+上才会形成硫酸铵,而Cu(OH)+只会生成CuHSO4。
此外,由于柴油车后处理系统包含氧化型催化剂,从而使得尾气中会有部分SO3存在。Wang等[21]研究发现,SO3存在更有利于生成硫酸铜生成,同时高含量SO3存在的情况下还会对Cu/SAPO-34骨架结构造成破坏,生成硫酸铝(如图 4所示)。Su等[22]对比了2种Cu/CHA催化剂硫中毒差异,发现Cu/SAPO-34相比Cu/SSZ-13会在硫化过程中生成更多的硫酸铝。Wang等[23]对Cu/SSZ-13催化剂SO3中毒还发现,由于Cu/SSZ-13催化剂抗酸能力强,SO3只会生成硫酸铜而不会对结构产生影响。Hammershøi等[24]研究了温度对于Cu/CHA催化剂SO3中毒影响,研究发现200 ℃相比550 ℃会生成更多硫酸盐物种。
以上研究表明,虽然不同硫化条件下生成的硫酸盐物种及含量有差异,但Cu/CHA催化剂SCR活性降低都是源于减少的活性位数量。
值得注意的是Cu/CHA催化剂硫中毒后性能变化与SCR反应中NO2/NOx比例关系较大[16, 25-26]。相比新鲜Cu/CHA,Cu/CHA催化剂在硫化后,标准SCR反应(NO2/NOx=0时,体积分数,下同)条件下催化活性显著下降,而快速SCR(NO2/NOx=0.5)和慢速SCR反应(NO2/NOx=0.5~1.0)条件下的催化活性并无明显差异。
2.2 Cu/CHA催化剂再生研究进展硫化在Cu/CHA催化剂上形成的硫酸盐,由于其热力学稳定性限制,硫酸盐可以被去除从而使得催化剂性能得到部分或者完全恢复。硫酸盐去除方法主要有2种:1)高温有氧去除法;2)化学脱附法(其他化学组分存在下的去除法)。
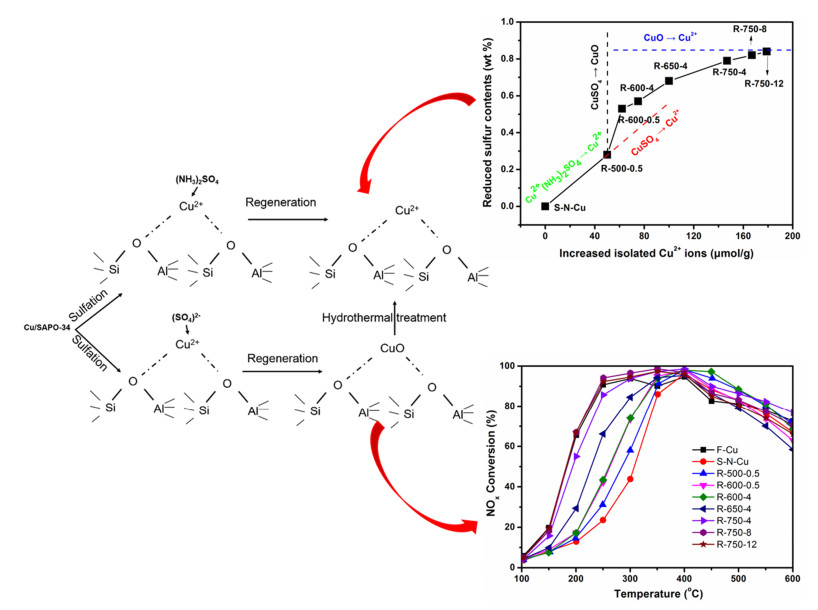
高温有氧去除硫酸盐一般是指在500~700 ℃氧化环境中脱硫。Zhang等[27]研究发现硫铵物种由于较低的热力学分解温度,因此该硫酸盐能够在500 ℃以下完全去除。Hammershøi等[28]研究Cu/SAPO-34催化剂的单纯SO2硫老化后的再生性能,发现Cu/SAPO-34催化剂在550 ℃处理后低温催化活性可恢复80%,再生温度提高到700 ℃,催化活性可完全恢复,作者指出性能完全恢复的关键在于硫酸铜的去除。Shen等[29]对Cu/SAPO-34催化剂硫酸盐物种的再生情况进行了详细研究,并指出硫铵物种可以在500 ℃以下完全去除从而使得该部分毒化活性铜物种完全恢复;而硫酸铜则需要较高的温度,750 ℃水热条件下硫酸铜才能完全分解并在铜迁移作用下使得活性铜物种完全恢复(如图 5所示)。
Su等[22]研究了Cu/SSZ-13催化剂硫酸盐再生情况,同样发现硫铵物种能够在450 ℃下去除,而硫酸铜则需要较高温度才能完全去除。Brookshear等[15]研究了Cu/SSZ-13催化剂再生性能,500 ℃热处理后NOx活性同样只能部分恢复。Kumar等[30]研究了的硫老化Cu/CHA催化剂分别在550、650和700 ℃再生,再生温度达到700 ℃,可以恢复大部分的NOx转化率和NH3氧化性能。Shen等[31]详细地研究了Cu/SSZ-13催化剂上稳定硫酸铜的去除机制(如图 6所示),发现硫酸铜在700 ℃水热条件下可以完全去除,而且硫酸铜在分解过程中伴随着氧化铜的生成以及铜迁移2种反应,然而受到Cu/SSZ-13高温脱铝的影响,活性位数量始终恢复不到新鲜状态。
化学脱附法一般是指在氧化环境下通入某些低浓度具有还原性的气体组分的方法[32-33]。Kumar等[33]发现在氧化性气氛中通入1 000×10-6丙烯能够在450 ℃将硫化过程(300 ℃, 70% SO3/SOx硫化)产生的硫酸盐几乎完全去除,从而恢复Cu/CHA催化剂的大部分催化性能。作者推测化学脱附法之所以能够有效降低脱硫温度是因为还原性气氛能够在Cu-zeolites表面形成局部还原环境,改变活性铜物种价态,从而降低了硫酸盐与活性位之间的结合能力所致。
综上,可以得知硫中毒Cu/CHA催化剂再生过程与硫中毒过程正好相反,其活性再生的原因主要是通过硫酸盐的去除使活性位逐渐恢复,进而增加再生催化剂的氧化还原能力,使得SCR活性逐渐恢复。
3 结语通过以上内容,不难发现硫中毒及再生过程对铜基小孔分子筛(Cu/CHA)催化剂活性中心数量及骨架结构的影响决定了其SCR性能变化。然而,为使Cu/CHA催化剂仍然能够在国六b排放法规中具有更加高效的性能,仍需对Cu/CHA催化剂硫中毒及再生进行如下研究:
1) 利用目前掌握的硫中毒及再生机理,从催化剂结构和酸性位等角度,自下而上地对Cu/CHA催化剂抗硫中毒方面性质进行研究;2)实际应用条件下,还存在Cu/CHA催化剂其他失活因素,比如碱金属、P中毒等其他形式的化学中毒,因此综合考虑上述化学中毒情况,掌握催化剂综合失活原因及主要影响因素;3)柴油车后处理系统除SCR催化剂之外,还包括氧化型催化剂和DPF,未来可能还需要包括冷启动催化剂,所以在硫中毒状态下,需要进一步开展全尺寸样品的台架实验研究及仿真动力学模拟,掌握各催化剂之间在中毒状态下的匹配情况,从而能够根据后处理系统特点提出有效脱硫再生措施,进一步提高Cu/CHA催化剂寿命及NOx脱除效率。
| [1] |
Montenegro G, Onorati A. Urea-SCR technology for deNOx after treatment of diesel exhausts[EB/OL]. 2014 http://rd.springer.com/chapter/10.1007/978-1-4899-8071-7_17
|
| [2] |
Cheng Y, Montreuil C N, Cavataio G, et al. Sulfur tolerance and DeSOx studies on diesel SCR catalysts[J]. SAE International Journal of Fuels and Lubricants, 2008, 1(1): 471-476. DOI:10.4271/2008-01-1023 |
| [3] |
Gao F, Kwak J H, Szanyi J, et al. Current understanding of Cu-exchanged Chabazite molecular sieves for use as commercial diesel engine DeNOx catalysts[J]. Topics in Catalysis, 2013, 56(15/17): 1441-1459. |
| [4] |
Xue J, Wang X, Qi G, et al. Characterization of copper species over Cu/SAPO-34 in selective catalytic reduction of NOx with ammonia:Relationships between active Cu sites and de-NOx performance at low temperature[J]. Journal of Catalysis, 2013, 297: 56-64. DOI:10.1016/j.jcat.2012.09.020 |
| [5] |
Wang J, Shao L, Wang C, et al. Controllable preparation of various crystal size and nature of intra-crystalline diffusion in Cu/SSZ-13 NH3-SCR catalysts[J]. Journal of Catalysis, 2018, 367: 221-228. DOI:10.1016/j.jcat.2018.09.004 |
| [6] |
Wang D, Zhang L, Kamasamudram K, et al. In situ-DRIFTS study of selective catalytic reduction of NOx by NH3 over Cu-exchanged SAPO-34[J]. ACS Catalysis, 2013, 3(5): 871-881. DOI:10.1021/cs300843k |
| [7] |
Su W, Chang H, Peng Y, et al. Reaction pathway investigation on the selective catalytic reduction of NO with NH3 over Cu/SSZ-13 at low temperatures[J]. Environmental Science & Technology, 2015, 49(1): 467-473. |
| [8] |
Yu T, Hao T, Fan D, et al. Recent NH3-SCR mechanism research over Cu/SAPO-34 catalyst[J]. The Journal of Physical Chemistry C, 2014, 118(13): 6565-6575. DOI:10.1021/jp4114199 |
| [9] |
Gao F, Wang Y, Szanyi J, et al. Selective catalytic reduction over Cu/SSZ-13:Linking homo-and heterogeneous catalysis[J]. J Am Chem Soc, 2017, 139: 4935-4942. DOI:10.1021/jacs.7b01128 |
| [10] |
Christopher P, Ishant K, Atish P A, et al. Dynamic multinuclear sites formed by mobilized copper ions in NOx selective catalytic reduction[J]. Science, 2017, 357: 898-903. DOI:10.1126/science.aan5630 |
| [11] |
Wang J, Huang Y, Yu T, et al. The migration of Cu species over Cu-SAPO-34 and its effect on NH3 oxidation at high temperature[J]. Catalysis Science & Technology, 2014, 4(9): 3004-3012. |
| [12] |
Leistner K, Mihai O, Wijayanti K, et al. Comparison of Cu/BEA, Cu/SSZ-13 and Cu/SAPO-34 for ammonia-SCR reactions[J]. Catalysis Today, 2015, 258: 49-55. DOI:10.1016/j.cattod.2015.04.004 |
| [13] |
Wang C, Wang J, Wang J, et al. The role of impregnated sodium ions in Cu/SSZ-13 NH3-SCR catalysts[J]. Catalysts, 2018, 8: 593-607. DOI:10.3390/catal8120593 |
| [14] |
Shen M, Wen H, Hao T, et al. Deactivation mechanism of SO2 on Cu/SAPO-34 NH3-SCR catalysts:Structure and active Cu2+[J]. Catalysis Science & Technology, 2015, 5(3): 1741-1749. |
| [15] |
Brookshear D, Nam J, Nguyen K, et al. Impact of sulfation and desulfation on NOx reduction using Cu-chabazite SCR catalysts[J]. Catalysis Today, 2015, 258: 359-366. DOI:10.1016/j.cattod.2015.04.029 |
| [16] |
Wijayanti K, Andonova S, Kumar A, et al. Impact of sulfur oxide on NH3-SCR over Cu-SAPO-34[J]. Applied Catalysis B:Environmental, 2015, 166. |
| [17] |
Jangjou Y, Quan D, Gu Y, et al. Nature of Cu active centers in Cu-SSZ-13 and their responses to SO2 exposure[J]. ACS Catalysis, 2018, 8(2): 1325-1337. DOI:10.1021/acscatal.7b03095 |
| [18] |
Luo J, Wang D, Kumar A, et al. Identification of two types of Cu sites in Cu/SSZ-13 and their unique responses to hydrothermal aging and sulfur poisoning[J]. Catalysis Today, 2016, 267: 3-9. DOI:10.1016/j.cattod.2015.12.002 |
| [19] |
Wang C, Wang J, Wang J, et al. The effect of sulfate species on the activity of NH3-SCR over Cu/SAPO-34[J]. Applied Catalysis B:Environmental, 2017, 204: 239-249. DOI:10.1016/j.apcatb.2016.11.033 |
| [20] |
Wijayanti K, Xie K, Kumar A, et al. Effect of gas compositions on SO2 poisoning over Cu/SSZ-13 used for NH3-SCR[J]. Applied Catalysis B:Environmental, 2017, 219: 142-154. DOI:10.1016/j.apcatb.2017.07.017 |
| [21] |
Shen M, Zhang Y, Wang J, et al. Nature of SO3 poisoning on Cu/SAPO-34 SCR catalysts[J]. Journal of Catalysis, 2018, 358: 277-286. DOI:10.1016/j.jcat.2017.12.008 |
| [22] |
Su W, Li Z, Zhang Y, et al. Identification of sulfate species and their influence on SCR performance of Cu/CHA catalyst[J]. Catalysis Science & Technology, 2017, 7(7): 1523-1528. |
| [23] |
Wang C, Hou Y, Yan W, et al. The role of SO3 poisoning in CU/SSZ-13 NH3-SCR catalysts[J]. Catalysts, 2019, 9: 741-754. DOI:10.3390/catal9090741 |
| [24] |
Hammershøi P S, Jangjou Y, Epling W S, et al. Reversible and irreversible deactivation of Cu-CHA NH3-SCRcatalysts by SO2 and SO3[J]. Applied Catalysis B:Environmental, 2018, 226: 38-45. DOI:10.1016/j.apcatb.2017.12.018 |
| [25] |
Dahlin S, Lantto C, Englund J, et al. Chemical aging of Cu-SSZ-13 SCR catalysts for heavy-duty vehicles-Influence of sulfur dioxide[J]. Catalysis Today, 2019, 320: 72-83. DOI:10.1016/j.cattod.2018.01.035 |
| [26] |
Wijayanti K, Leistner K, Chand S, et al. Deactivation of Cu-SSZ-13 by SO2 exposure under SCR conditions[J]. Catalysis Science & Technology, 2015, 6(8): 2565-2579. |
| [27] |
Zhang L, Wang D, Liu Y, et al. SO2 poisoning impact on the NH3-SCR reaction over a commercial Cu-SAPO-34 SCR catalyst[J]. Applied Catalysis B:Environmental, 2014, 156/157: 371-377. |
| [28] |
Hammershøi P S, Vennestrøm P N R, Falsig H, et al. Importance of the Cu oxidation state for the SO2- poisoning of a Cu-SAPO-34 catalyst in the NH3-SCR reaction[J]. Applied Catalysis B:Environmental, 2018, 236: 377-383. DOI:10.1016/j.apcatb.2018.05.038 |
| [29] |
Shen M, Li X, Wang J, et al. Nature identification of Cu active sites in sulfur-fouled Cu/SAPO-34 regeneration[J]. Ind Eng Chem Res, 2018, 57(10): 3501-3509. DOI:10.1021/acs.iecr.7b05053 |
| [30] |
Kumar A, Smith M A, Kamasamudram K, et al. Impact of different forms of feed sulfur on small-pore Cu-zeolite SCR catalyst[J]. Catalysis Today, 2014, 231: 75-82. DOI:10.1016/j.cattod.2013.12.038 |
| [31] |
Shen M, Wang Z, Li X, et al. Effects of regeneration conditions on sulfated CuSSZ-13 catalyst for NH3-SCR[J]. Korean J Chem Eng, 2019, 36(8): 1249-1257. DOI:10.1007/s11814-019-0307-x |
| [32] |
Ando R, Banno Y, Nagata M. Detailed mechanism of S poisoning and de-sulfation treatment of Cu-SCR catalyst[J]. SAE Technical Paper Series, 2017. DOI:10.4271/2017-01-0944 |
| [33] |
Kumar A, Smith M A, Kamasamudram K, et al. Chemical deSOx: An effective way to recover Cu-zeolite SCR catalysts from sulfur poisoning[J]. Catalysis Today, 2016, 267: 10-16. DOI:10.1016/j.cattod.2016.01.033 |
 2020, Vol. 37
2020, Vol. 37