为缓冲太阳能和风力发电的间歇性带来的影响,并改善电网的电力质量[1-3],可再生能源的日益发展和智能电网的普及对大规模的电能存储系统(EES)提出了更高的要求。理想的EES系统应快速、高效、经济地存储和释放大量的能源。在各种EES系统中,氧化还原液流电池(RFBs)由于在发电和能量储存方面采取分离的方式,因此在大规模应用中具有优越的可伸缩性、操作灵活和足够的安全性[4],作为一个有前途的技术脱颖而出。但是大规模部署该电池成本相对较高,同时因为它的能量密度受到电解质的溶解度的限制,使得使用的限制大大增加。传统的钒氧化还原电池(VRB)中钒氧化还原物质的浓度约为2 mol/L,导致能量密度仅为25~30 Wh/L[5]。
为了解决活性物质的溶解度带来的问题,人们尝试采用不同的活性电对和电解质溶剂,以期提高相应的能量密度,但效果都不太明显。而在半固态的液流电池中[6-7],正负极电解液采用流动的悬浮液,打破了氧化还原物质的溶解度的极限。但是相应的问题也十分明显,大量的导电添加剂的加入和悬浮液的高黏度会产生复杂的流体动力学,增加泵体的负载,降低了能量效率。另一种可以提高效率的方法是采用一种新的概念——氧化还原靶向反应。2006年Wang等[8]首次提出氧化还原靶向反应来消除如LiFePO4绝缘电池材料中的导电剂的加入。这种概念同之前提出的在绝缘电池材料表面合成分子布线和聚合物布线[9-10]相似,通过采取一种介质,来提高离子的电导率和电子的传输。而在传统的液流电池中,结合氧化还原靶向反应,可以消除活性物质的溶解度问题,极大地提高电池的能量密度。
1 工作原理在传统的氧化还原液流电池中,泵体将正负极液罐中的电解液输送至正负极,在电极表面进行反应,同时通过隔膜进行离子的转移。氧化还原靶向反应则是通过引入在电解质中具有高溶解度、并与活性物质配对的氧化还原介质,来将活性物质与电极联系起来。这样既可以消除活性物质的溶解度问题,又可以将低溶解度的活性物质储存在液罐中。
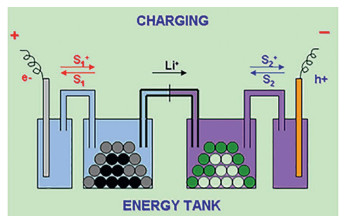
以锂离子电池为例,从图 1可以了解到,在充电过程中,氧化还原介质(图 1中的S)先在电极表面被氧化为S+,随后通过电解液传输到液罐中的活性材料LiFePO4表面,将LiFePO4氧化为FePO4,而其被还原成S,扩散到电极上进行新一轮的反应。相反,在放电过程中,在Li+存在下S向材料表面扩散,S将FePO4还原为LiFePO4,介质本身被氧化成S+,并扩散到电极还原为S进行另一个反应循环。在这有一个要求就是这种氧化还原介质的标准氧化还原电位与电池活性材料相匹配,我们通常使用1个高电位和1个低电位的分子(相对于活性物质来说),使得其存在一定的电位差来促使反应快速进行。
相比于半固态液流电池(SSFB)需要添加大量的导电剂以及自身的高黏度性,以此造成的复杂的流体动力学问题,氧化还原靶向反应的引入能够巧妙地避免传统液流电池活性物质的低溶解度造成的低能量密度的问题。在此反应过程中,储能活性物质不需要直接输送至电极表面进行反应,而是由氧化还原介质S的传输将两者联系起来,如图 2所示。因此将此原理应用于液流电池时,相应装置的改变并不是太大,都由2个储液罐、大比表面积的电极、隔膜、集流体以及泵体等构成。
目前氧化还原靶向反应的原理主要应用于锂离子液流电池、太阳能充电液流电池和其它液流电池方面。
2.1 锂离子液流电池将绿色环保和高能量密度的传统锂离子电池与输出功率和储能容量可独立设计的液流电池相结合的锂离子液流电池,近些年受到人们的广泛关注。然而与全钒液流电池不同的是,这种电池的悬浮液属于非水系的有机电解液,同时还具有电子导电性,从而导致电池的串联高压输出和密封绝缘设计较困难。将氧化还原靶向反应应用于锂离子液流电池则会解决上述问题。
Huang等[11]采用二溴化二茂铁(FcBr2)与二茂铁(Fc)作为阴极的氧化还原介质,将LiFePO4作为锂离子储能材料。在循环伏安曲线上可以看到这2种介质的半波电位为3.55和3.25 V(vs. Li+/Li),而LiFePO4的电位位于2者中间,存在的电位差使得可逆的解锂和嵌锂成功进行,同时FcBr2和Fc的消耗可以通过加入的LiFePO4的量来得以估计。近些年,随着液流电池的发展,二茂铁及其衍生物也多被用在水系有机体系作为阴极活性物质[12]。
Jia等[13]采用LiFePO4和TiO2分别作为阴极和阳极锂离子储能材料,如图 3所示,它的阴极和阳极分别采用二溴化二茂铁/二茂铁(FcBr2/Fc)和二茂钴/二茂钴的衍生物(CoCp2/CoCp2*)作为氧化还原介质,这是首次在阴阳极同时使用氧化还原介质,在此过程中RFLB的体积能量密度可达到500 Wh/L(孔隙率50%),是钒氧化还原液流电池的10倍。
Huang等[14]在以锂金属作为液流电池的阳极,溶解在水系电解质溶液中的LiI作为液体阴极,使用I-/I3-与I3-/I2作为氧化还原介质,并将氧化还原靶向原理引入其中,既解决了原本的锂金属和水之间的安全隐患,又避免了在使用有机溶剂时LiI的溶解度问题。它们的氧化还原电位在循环伏安曲线可观察到,分别为3.15与3.70 V(vs. Li+/Li),而LiFePO4的电位位于2者中间,使得反应得以有足够的电位差能够进行,此时能量密度能达到670 Wh/L,是传统液流电池的10倍。通过使用碘相关离子作为介质,代替原来的二茂铁及其衍生物,活性物质和氧化还原介质之间有着更快的反应速度。其次使用单分子的介质有利于装置的组装和维修,使得电池有着更长的使用寿命,还有碘的价格较便宜,对于以前所使用的二溴化二茂铁价格往往在1 000元/g,而LiI的价格在10元/g左右,因此可以很大程度上节省费用。
Yu等[15]使用LiFePO4和LiTi2(PO4)3作为阴阳极的储能材料,以[Fe(CN)6]4-/[Fe(CN)6]3-和S2-/S22-分别作为阴阳极的氧化还原介质,此时阳极和阴极的体积比容量分别为305和207 Ah/L。在68次的充放电循环后,容量保持率仍能达到100%。此外,与非水基电解质相比,该系统隔膜中的Li+导电性呈现出明显增强,从而大大提高了功率性能。
Zhou等[16]提出了单分子氧化还原反应(SMRT),在保持液流电池特点的基础上,简化了电解质溶液的组成部分。此反应过程中,使用二茂铁枝节纤维的离子液体作为氧化还原介质,反应进行的电位差是由氧化还原介质在充放电循环过程中活性的变化而产生的,它使LiFePO4发生可逆的解锂和嵌锂,电压效率达到95%,同时容积罐能量密度能显著提高到330 Wh/L,这个能量密度可能会优化到942 Wh/L。此外,还利用紫外-可见光谱技术对流动电池中氧化还原产物的演变过程进行了实时监测,为液流电池中SMRT反应速率的研究提供了有用的信息。相应的反应示意图见图 4。
Zhu等[17]使用双功能的氧化还原介质四甲基对苯二胺(TMPD)对储能物质LiFePO4进行反应。它的氧化还原电位在循环伏安曲线上有2个峰,其峰电位分别为3.20与3.60 V(vs. Li+/Li)。该电池的能量密度达到1 023 Wh/L,功率密度达到61 mW/cm2,电压效率达到91%。
2.2 太阳能充电液流电池太阳能可充液流电池(SRFBs)为间歇太阳能的收集和存储提供了一种很有效的方法[18-19],相比于其它的液流电池,仅用1个额外的TiO2光电极代替阴极室中的常规电极。光充电后,吸附在TiO2光阳极上的染料分子受到激发,由染料分子的激发态向TiO2的导电带中注入光生电子,进而向锂阳极移动,进行循环充放电。这种方法是通过氧化还原产物放电的光电电化学再生来实现的。然而,这些太阳能可充电液流电池(SRFBs)要么具有非常低的能量密度,要么该电池的整体性能受到低效光电化学反应的限制,光电极的性能会在不同的电荷状态运行时严重受损[20]。
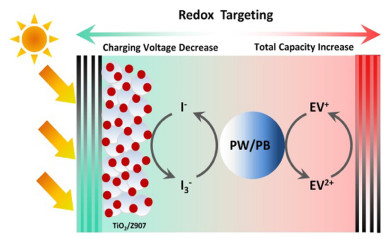
Fan等[21]以乙基紫精二碘化物(EVI2)作为电极的双功能氧化还原介质与低成本颜料材料普鲁士蓝(PB)作为电池储能材料,研究了一种以氧化还原靶向反应为基础的氧化还原液流电池。采用以I-/I3-为基底的电解质,可与染料敏化TiO2光电极有效集成,实现光辅助充电。PB的引入不仅使能量密度提高到117 Wh/L,具有良好的循环性能和容量保持能力,而且能瞬间再生I-,以此保证I-/I3-浓度的稳定性,这对光电极的工作至关重要。
如图 5所示,放电时,电解液中的氧化还原产物在TiO2光电极上电化学还原,形成的EV+在电解液流经槽内时,将普鲁士蓝PB还原为普鲁士白(PW)。这一过程包括将Li+嵌入到PB材料中,在光照下充电时,化学吸附在TiO2上的染料分子被光激发,然后光生电子从染料分子的激发态移动到TiO2的导电带上,在外偏置作用下迁移到Li阳极。同时,电解液中的I-通过从染料分子的最高占据分子轨道(HOMO)上捕获空穴被氧化成I3-,当电解液在槽内循环时,形成I3-进一步氧化解锂的PW。
对于近些年发展的锂硫液流电池,目前的阻碍在于硫阴极的绝缘性和“穿梭效应”,导致使用过量的导电添加剂或在较小的电压窗内进行操作(其中活性硫是可溶性的),大大降低了电池的能量密度。与RFLBs类似,Li等[22]报道了基于氧化还原靶向反应,使用了2种氧化还原介质的Li-S液流电池,二茂铬的衍生物(CrCp2*)的还原电位为1.96 V(vs. Li+/Li),二茂镍的衍生物(NiCp2*)的氧化电位为2.49 V(vs. Li+/Li),用它们来可逆地使S/Li2S变为锂离子/脱硫化物。与只添加氧化还原物质的材料相比,使用固体材料后电池的容量增加了近8倍。此外,电池可以使用导电性能差或完全绝缘的S/Li2S阴极材料工作,省去了30%(质量分数)的导电添加剂,可以显著提高电池的能量密度。
对于锂硫液流电池,Li等[23]再次基于氧化还原靶向的原理,报道了一种只用一种氧化还原介质(双高氯酸乙酯)的改进设计,并利用化学和电化学充电和放电相结合的硫阴极,使流动电池能够在没有添加剂或可溶性阴极的情况下更接近其理论容量。
聚苯胺(PANI)是一种稳定的,在酸性溶液中具有化学活性的高分子氧化物,也可被用作固体储能材料,在氧化还原靶向的液流电池中使用,由于PANI具有3种不同的氧化态,且在酸性环境中表现出2种可逆氧化还原转变,所以它被用作阳极和阴极材料。Zanzola等[24]采用Fe3+/Fe2+和V3+/V2+作为氧化还原介质,在25个循环周期内,均表现出良好的比容量和循环稳定性,当将聚苯胺和炭黑导电复合材料添加到完整流动电池的电解质槽中时,容量有了显著的提高,在电流密度为38.5 mA/cm时,比容量可达到64.8 mAh/g。
表 1总结了自此原理用于液流电池后的相关性能参数,对于不同氧化还原介质和储能材料的选择,相关性能也有着较大的差距。
| 液流电池的种类 | 氧化还原介质(阴极/阳极) | 储能物质(阴极/阳极) | 能量密度 | 参考文献 |
| 锂离子液流电池 | FcBr2/Fc(阴极) | LiFePO4(阴极) | [11] | |
| 锂离子液流电池 | FcBr2/Fc(阴极) CoCp/CoCp2* (阳极) |
LiFePO4(阴极) TiO2(阳极) |
500 Wh/L | [13] |
| 锂离子液流电池 | I-/I3-和I3-/I3 | LiFePO4 | 670 Wh/L | [14] |
| 锂离子液流电池 | [Fe(CN)6]4-/[Fe(CN)6]3-(阴极) S2-/S22-(阳极) |
LiFePO4(阴极) LiTi(PO4)3(阳极) |
305 Ah/L207 Ah/L(体积比容量) | [15] |
| 锂离子液流电池 | 二茂铁枝节纤维的离子液体 | LiFePO4 | 330 Wh/L | [16] |
| 锂离子液流电池 | 四甲基对苯二胺(TMPD) | LiFePO4 | 1 023 Wh/L | [17] |
| 太阳能充电液流电池 | 乙基紫精二碘化物(EVI2) | 普鲁士蓝(PB) | 117 Wh/L | [21] |
| 锂硫液流电池 | CoCp2*/CoCp2*+(阴极) NiCp2*/NiCp2*+(阳极) |
单质硫(S) | 766 mAh/g(放电容量) | [22] |
| 锂硫液流电池 | 双高氯酸乙酯 | 单质硫(S) | 756/775 mAh/g(充放电容量) | [23] |
| 其它 | Fe3+/Fe2+和V3+/V2+ | 聚苯胺(PANI) | 64.8 mAh/g(电流条件:38.5 mA/cm) | [24] |
氧化还原介质作为此原理的最关键的一环,它的选择和有效的利用能很大程度上使得反应快速进行,对电池效率的提高有着重要的作用。在选择介质时,对于半电池来说,需要2种氧化还原介质,固体储能材料电位要在这两种介质的氧化还原电位中间,其中形成的电位差来作为反应进行的动力。然而种类不同的介质给电池的运行和循环稳定性带来了极大的复杂性。此外,同一电解液中氧化还原产物的电位差会造成较大的过电位损失,从而影响电池的电压效率。
为了简化电解质溶液中的组成部分,于是有了单分子氧化还原靶向(SMRT)反应的提出[15, 22],该反应将储能材料的氧化还原靶向介质降低为1个分子,在SMRT反应中,氧化还原介质必须具有与目标固体储能材料相同的氧化还原电势,储能材料与氧化还原介质之间的反应是由氧化还原分子在充放电时活性变化引起的能斯特电位差驱动的。如前文提到的双功能的氧化还原介质四甲基对苯二胺(TMPD)对储能物质LiFePO4进行反应,以及采用Fe3+/Fe2+和V3+/V2+作为氧化还原介质对聚苯胺(PANI)进行反应,都是SMRT的相关应用。
3.2 电解质和储能材料的选择在选择氧化还原介质的同时,电解质的选择也十分重要,它可以明显地影响溶解度、稳定性以及反应动力学。在水体系电解质中,电位-pH图(甫尔拜图)可以为固体储能材料和氧化还原介质提供热力学基础,以避免水电解。在非水体系电解质中,电解质与膜的相容性是防止电解质交叉的重要因素。同时,电池在强酸/强碱环境下工作,会对相应材料的化学稳定性带来额外的挑战。
而对于储能材料来说,在高电流的条件下,材料的利用率往往达不到一定的程度,而氧化还原靶向反应的提出就是为了提高能量密度,但是在电池储能材料非充分使用的条件下是不可能实现这一目标的。对于某些电池材料来说,只有小部分材料可用氧化还原介质进行反应,这对容量和电压效率带来了内在的限制,尤其是SMRT系统,它的电荷转移的驱动力对于提高电压效率来说是最小的。此外,对于电导率较差的储能材料来说,将其与导电添加剂混合有利于促进固相内电荷的输运。因此,合理地选择储能材料尤为重要。
3.3 隔膜的选择和储能罐的优化同传统的液流电池一样,隔膜在基于氧化还原靶向原理的液流电池中的作用也十分重要,它要使得质子能顺利穿过,保证溶液的平衡,但是又不能使得电子穿过,避免短路,还有一点就是要防止正负极电解液的交叉污染。在具有这些功能的同时,隔膜本身还要具有一定的化学稳定性、机械稳定性以保证电解液的长时间循环而损坏较低[25],在液流电池中常使用的隔膜Nafion膜、氧离子交换膜和阴离子交换膜等[12],它们都可以有效地保证库仑效率和电池容量,但是能够防止交叉污染的隔膜往往都具有一定的电阻性。多孔聚合物交换器膜的使用可以在一定程度上解决这个问题,通过调整膜孔径的大小和氧化还原产物的尺寸大小,可以有效地分离氧化还原活性离子,有望解决非水系液流电池中的功率问题[26-27]。
至于作为储存固体活性材料的容器,储能罐的设计十分重要。在储能罐中的氧化还原靶向反应有着多重的动力学过程,包括电解液进入罐体,与固体材料接触和反应并随后流出罐体等一系列过程。因此,为了在电化学电池和储能槽之间达到理想的平衡,需要对其进行系统的研究。目前的做法是在大尺寸的装置中,采用填充颗粒或者小球[28],颗粒的孔隙体积、孔隙率和弯曲度等微观结构决定了电解质在固体基体中的反应速率、扩散途径和效能;颗粒的形状和大小决定了球团之间的填充和扩散途径;颗粒的机械强度决定了其在流动电解质环境下的抗破碎性和耐磨性[29]。计算机建模是一种有效预测化学反应过程和流体动力学的有用工具,结合实验研究得到的参数,可以为优化单个球团的微观结构以及特定储能系统的封装方法提供有用的指导。
4 总结主要阐述了新的氧化还原原理在各种液流电池中的应用,以及相比于传统的液流电池而言,它所具有的优势点,其中最重要的一点就是它可以克服传统液流电池由于活性物质溶解度造成的电流密度较低的问题。此原理在锂离子液流电池中的研究现在已比较成熟,目前正在向其它液流电池方向发展,与此同时,此原理还可以在其它装置中使用,如碳的氧化还原、水的解离[30-31]以及其它金属空气电池。
由于目前还没有适合于非水体系的隔膜,基于水系的氧化还原靶向液流电池系统,尤其是基于SMRT反应的液流电池系统,在近期内具有广阔的应用前景。同时,对于相比于传统的液流电池,这种形式的电池结构变化并不是太大,可能在储能罐的设计方面以及介质和储能材料的选择有所需要注意,但是对于性能的提高是有目共睹的,而且对于添加的氧化还原介质的性能与价格问题的匹配程度将会随着时间实现最大的收益化,可以认为,基于氧化还原靶反应的液流电池技术是未来大规模电化学储能的可靠解决方案。
| [1] |
Soloveichik G L. Flow batteries:Current status and trends[J]. Chemical Reviews, 2015, 115(20): 11533-11558. DOI:10.1021/cr500720t |
| [2] |
Wang W, Luo Q, Li B, et al. Recent progress in redox flow battery research and development[J]. Advanced Functional Materials, 2013, 23(8): 970-986. DOI:10.1002/adfm.201200694 |
| [3] |
Dunn B, Kamath H, Tarascon J M. Electrical energy storage for the grid:A battery of choices[J]. Science, 2011, 334(6058): 928-935. DOI:10.1126/science.1212741 |
| [4] |
Zhang H, Li X, Zhang J. Redox flow batteries[M]. USA: CRC Press, 2017.
|
| [5] |
Skyllas-Kazacos M, Chakrabarti M H, Hajimolana S A, et al. Progress in flow battery research and development[J]. Journal of the Electrochemical Society, 2011. DOI:10.1149/1.3599565 |
| [6] |
Duduta M, Ho B, Wood V C, et al. Semi-Solid lithium rechargeable flow battery[J]. Advanced Energy Materials, 2011, 1(4): 511-516. DOI:10.1002/aenm.201100152 |
| [7] |
陈永翀, 武明晓, 任雅琨, 等. 锂离子液流电池的研究进展[J]. 电工电能新技术, 2012, 31(3): 81-85. Chen Yongchong, Wu Mingxiao, Ren Yakun, et al. Research progress in lithium-ion flow battery[J]. Advanced Technology of Electrical Engineering and Energy, 2012, 31(3): 81-85. DOI:10.3969/j.issn.1003-3076.2012.03.018 (in Chinese) |
| [8] |
Wang Q, Zakeeruddin S M, Wang D, et al. Redox targeting of insulating electrode materials:A new approach to high-energy-density batteries[J]. Angewandte Chemie International Edition, 2006, 45(48): 8197-8200. DOI:10.1002/anie.200602891 |
| [9] |
Wang Q, Evans N, Zakeeruddin S M, et al. High energy lithium batteries by molecular wiring and targeting approaches[J]. Journal of Power Sources, 2007, 174(2): 408-413. DOI:10.1016/j.jpowsour.2007.06.202 |
| [10] |
Wang D, Ela S E, Zakeeruddin S M, et al. Polymer wiring of insulating electrode materials:An approach to improve energy density of lithium-ion batteries[J]. Electrochemistry Communications, 2009, 11(7): 1350-1352. DOI:10.1016/j.elecom.2009.04.030 |
| [11] |
Huang Q, Li H, Grätzel M, et al. Reversible chemical delithiation/lithiation of LiFePO4:Towards a redox flow lithium-ion battery[J]. Phys Chem Chem Phys, 2013, 15(6): 1793-1797. DOI:10.1039/C2CP44466F |
| [12] |
Hu B, DeBruler C, Rhodes Z, et al. Long-Cycling aqueous organic redox flow battery (AORFB) toward sustainable and safe energy storage[J]. Journal of the American Chemical Society, 2017, 139(3): 1207-1214. DOI:10.1021/jacs.6b10984 |
| [13] |
Jia C, Pan F, Zhu Y, et al. High-Energy density nonaqueous all redox flow lithium battery enabled with a polymeric membrane[J]. Science Advances, 2015. DOI:10.1126/sciadv.1500886 |
| [14] |
Huang Q, Yang J, Ng C B, et al. A redox flow lithium battery based on the redox targeting reactions between LiFePO4and iodide[J]. Energy & Environmental Science, 2016, 9(3): 917-921. |
| [15] |
Yu J, Fan L, Yan R, et al. Redox targeting-based aqueous redox flow lithium battery[J]. ACS Energy Letters, 2018, 3(10): 2314-2320. DOI:10.1021/acsenergylett.8b01420 |
| [16] |
Zhou M, Huang Q, Pham T T N, et al. Nernstian-Potential-Driven redox-targeting reactions of battery materials[J]. Chem, 2017, 3(6): 1036-1049. DOI:10.1016/j.chempr.2017.10.003 |
| [17] |
Zhu Y, Du Y, Jia C, et al. Unleashing the power and energy of LiFePO4-based redox flow lithium battery with a bifunctional redox mediator[J]. Journal of the American Chemical Society, 2017, 139(18): 6286-6289. DOI:10.1021/jacs.7b01146 |
| [18] |
Wedege K, Azevedo J, Khataee A, et al. Direct solar charging of an organic-inorganic, stable, and aqueous alkaline redox flow battery with a hematite photoanode[J]. Angewandte Chemie International Edition, 2016, 55(25): 7142-7147. DOI:10.1002/anie.201602451 |
| [19] |
Liao S, Zong X, Seger B, et al. Integrating a dual-silicon photoelectrochemical cell into a redox flow battery for unassisted photocharging[J]. Nature Communications, 2016. DOI:10.1038/ncomms11474 |
| [20] |
Yu Z, Gorlov M, Nissfolk J, et al. Investigation of iodine concentration effects in electrolytes for dye-sensitized solar cells[J]. The Journal of Physical Chemistry C, 2010, 114(23): 10612-10620. DOI:10.1021/jp1001918 |
| [21] |
Fan L, Jia C, Zhu Y, et al. Redox targeting of Prussian blue:Toward low-cost and high energy density redox flow battery and solar rechargeable battery[J]. ACS Energy Letters, 2017, 2(3): 615-621. DOI:10.1021/acsenergylett.6b00667 |
| [22] |
Li J, Yang L, Yang S, et al. The application of redox targeting principles to the design of rechargeable Li-S flow batteries[J]. Advanced Energy Materials, 2015. DOI:10.1002/aenm.201501808 |
| [23] |
Li J, Yang L, Yuan B, et al. Combined mediator and electrochemical charging and discharging of redox targeting lithium-sulfur flow batteries[J]. Materials Today Energy, 2017, 5: 15-21. DOI:10.1016/j.mtener.2017.04.006 |
| [24] |
Zanzola E, Dennison C R, Battistel A, et al. Redox solid energy boosters for flow batteries:Polyaniline as a case study[J]. Electrochimica Acta, 2017, 235: 664-671. DOI:10.1016/j.electacta.2017.03.084 |
| [25] |
Maurya S, Shin S H, Kim Y, et al. A review on recent developments of anion exchange membranes for fuel cells and redox flow batteries[J]. RSC Advances, 2015, 5(47): 37206-37230. DOI:10.1039/C5RA04741B |
| [26] |
Yuan Z, Zhu X, Li M, et al. A highly ion-selective zeolite flake layer on porous membranes for flow battery applications[J]. Angewandte Chemie International Edition, 2016, 55(9): 3058-3062. DOI:10.1002/anie.201510849 |
| [27] |
Milton M, Cheng Q, Yang Y, et al. Molecular materials for nonaqueous flow batteries with a high coulombic efficiency and stable cycling[J]. Nano Letters, 2017, 17(12): 7859-7863. DOI:10.1021/acs.nanolett.7b04131 |
| [28] |
Nemec D, Levec J. Flow through packed bed reactors:1. Single-Phase flow[J]. Chemical Engineering Science, 2005, 60(24): 6947-6957. DOI:10.1016/j.ces.2005.05.068 |
| [29] |
Allen K G, von Backström T W, Kröger D G. Packed bed pressure drop dependence on particle shape, size distribution, packing arrangement and roughness[J]. Powder Technology, 2013, 246: 590-600. DOI:10.1016/j.powtec.2013.06.022 |
| [30] |
Rausch B, Symes M D, Chisholm G, et al. Decoupled catalytic hydrogen evolution from a molecular metal oxide redox mediator in water splitting[J]. Science, 2014, 345(6202): 1326-1330. DOI:10.1126/science.1257443 |
| [31] |
Amstutz V, Toghill K E, Powlesland F, et al. Renewable hydrogen generation from a dual-circuit redox flow battery[J]. Energy Environ Sci, 2014, 7(7): 2350-2358. DOI:10.1039/C4EE00098F |
 2020, Vol. 37
2020, Vol. 37