近年来,荧光纳米材料因具有优越的稳定性、较高的灵敏度以及低的背景信号等优点受到了广大研究人员的关注[1]。其中,碳点因具有荧光量子产率高、细胞毒性低以及制备条件温和的优点而成为最受欢迎的荧光纳米材料之一[2-4]。各种改性碳点不仅可以响应Fe3+和Hg2+等金属离子,还可以和其他金属纳米颗粒结合用于识别非金属物质如谷胱甘肽等[5-7]。此外,金纳米簇由于具有尺寸小、毒性低、生物相容性好以及发射光谱可调等优点也引起了科研者的极大兴趣,被广泛应用于生物传感、成像和催化等[8-10]。
在荧光传感分析应用中,由于单个荧光信号很容易受到实验条件如温度、仪器条件、探针浓度以及溶剂极性等的影响,所以单一响应的材料已经不能满足各类传感应用的需求,发展新型多元复合纳米荧光材料成为该领域的一个研究方向。已有研究报道表明基于双发射的荧光探针受外界环境影响较小,可以排除单个荧光探针中的一些不利条件,从而实现更优越的检测性能[11-16]。如:采用碳点和金纳米簇结合的双发射荧光探针检测Hg2+,得到了比单一模式探针更高的灵敏度和更低的检出限[11-12];量子点与金纳米簇结合探针对Pb2+具有很高的灵敏度,能用于自来水、矿泉水等实际水样中Pb2+的检测[13];“开-关-开”模式的碳点和金纳米簇复合探针能选择性检测水中Cd2+和血清中的抗坏血酸[14]。这些研究结果都表明复合纳米荧光探针具有更高的稳定性、选择性和可靠性等优点,有很大的潜在应用价值。
本研究先采用水热法制备碳点,再以含硫超支化聚合物作为模板和还原剂对氯金酸进行还原制备金纳米簇,然后对碳点-金纳米簇结合的双发射荧光探针的光谱性质、稳定性进行了考察,实现了对四环素类药物的传感应用。
1 实验部分 1.1 药品与仪器实验试剂:超支化聚乙烯亚胺(PEI,MW=1 800),阿法埃莎(中国)化学有限公司;柠檬酸,天津科威公司;氯金酸(HAuCl4),北京索莱宝科技有限公司;四环素类药物(TCs),北京华威锐科化工有限公司。以上试剂以及实验中所用其它试剂均为分析纯,直接使用。
实验仪器:电子天平(BT-125D,德国赛多利斯科学仪器有限公司);pH计(FE20K,德国梅特勒-托利多公司);数控超声波清洗器(KQ2200,昆山市超声仪器有限公司);电热真空干燥箱(DZG-4018,天津市天宇实验仪器有限公司);循环水多用真空泵(SHZ-D(III),巩义市瑞德仪器设备有限公司);紫外-可见分光光度计(T6,北京普析通用仪器有限公司);荧光分光光度计(Cary Eclipse,美国瓦里安公司);透射电子显微镜(TF20,FEI)。
1.2 碳点(CD)的制备碳点的合成采用水热合成法[17]。主要过程为:取2.0 g PEI和4.2 g三乙胺溶解于15 mL三氯甲烷。在冰浴条件下,边搅拌边滴加3.8 g乙酸酐,然后氮气保护下继续搅拌8 h,得到改性聚乙烯亚胺。取0.2 g改性聚乙烯亚胺和0.2 g柠檬酸溶于5 mL蒸馏水,超声至改性聚乙烯亚胺完全溶解,然后将溶液转入到聚四氟乙烯内衬的高压反应釜中,在180 ℃的烘箱中加热3 h。取出后用0.22 μm水膜过滤,所得滤液在8 000 r/min的条件下离心10 min,得到纯化的棕黑色碳点原液,低温避光保存备用。
1.3 金纳米簇(AuNCs)的制备采用乙酰化含硫超支化聚酰胺-胺[HPA(S)-Ac]作为模板和还原剂制备金纳米簇(AuNCs)[18]:将聚合物HPA(S)-Ac配置成5 g/L的水溶液,用1 mol/L的NaOH溶液将20 mmol/L的HAuCl4水溶液调至pH值为5.8。在80 ℃水浴中,按照V(HAuCl4):V[HPA(S)-Ac]为3:10的比例将HAuCl4溶液边搅拌边缓慢滴加到HPA(S)-Ac溶液中。待溶液充分混匀后,将其静置于80 ℃的电热真空干燥箱中反应20 h,得到黄色溶液,用0.22 μm的水膜过滤得到纯化的AuNCs溶液,将其存放于4 ℃冰箱中避光备用。
1.4 pH值对CD-AuNCs荧光强度的影响配制pH值2~10的醋酸-醋酸钠溶液。用不同pH值的溶液将AuNCs原液稀释10倍,碳点稀释2 000倍,再以V(CD):V(AuNCs)=3:4的比例混合。在激发波长为370 nm,狭缝为10 nm的条件下测试CD-AuNCs体系的荧光强度。
1.5 CD-AuNCs对四环素类药物(TCs)的传感分析碳点原液和金纳米簇原液用pH=6的醋酸-醋酸钠缓冲溶液分别稀释2 000倍和60倍,然后以V(CD):V(AuNCs)=1:9的比例将金纳米簇加入到碳点中,超声5 min,得到双发射CD-AuNCs荧光探针。
取CD-AuNCs溶液2 mL于离心管中,加入0.5 mL缓冲溶液,超声使其混合均匀,然后加入相同体积、相同浓度的四环素(TC)、金霉素(CTE)、地美霉素(DEM)、多西霉素(DOX)和土霉素(OXY)溶液,在370 nm激发波长,狭缝10 nm条件下进行荧光测试。
1.6 CD-AuNCs对TCs的选择性考察实验条件同1.5,考察非四环素类药物红霉素(ERY)、链霉素(STR)、氯霉素(CL)、青霉素(PEN)、头孢曲松钠(CRO)和磺胺甲基嘧啶(SUL)对CD-AuNCs荧光强度的影响。
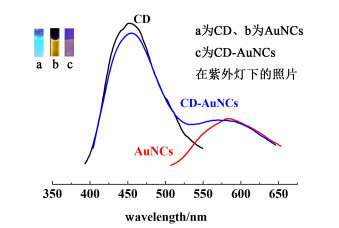
2 结果与讨论 2.1 CD、AuNCs以及CD-AuNCs的光谱性质在370 nm激发波长下得到CD、AuNCs和CD-AuNCs的荧光谱图和紫外灯下光学照片如图 1所示。
|
| 图 1 CD、AuNCs和CD-AuNCs的荧光光谱图 Fig.1 Fluorescence spectra of CD, AuNCs and CD-AuNCs |
| |
从图 1中可以看出CD和AuNCs分别在450和580 nm有发射峰,CD和AuNCs混合后的CD-AuNCs保持了CD和AuNCs各自原有的发射峰位置,但AuNCs在580 nm处发射峰有部分重叠,所以发射峰有所变宽。在紫外灯的照射下CD、AuNC以及CD-AuNC分别呈现亮蓝色(a)、棕黄色(b)和紫红色(c)。3个月后再次测试CD-AuNCs,发现其荧光强度无明显变化,说明CD-AuNCs有良好的稳定性,可长期使用。
2.2 CD-AuNCs的形貌表征用透射电子显微镜对CD-AuNCs的形貌和尺寸进行了表征,结果如图 2所示。图 2中可清晰地看到CD和AuNCs粒子尺寸均接近2 nm,呈球状,且分散均匀,与文献报道一致[17-18]。

|
| 图 2 CD-AuNCs的透射电镜图 Fig.2 TEM image of CD-AuNCs |
| |
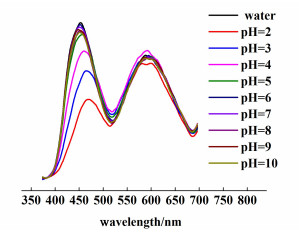
考察pH值对CD-AuNCs体系荧光强度的影响时我们发现:在pH值为2~10范围内,AuNCs的荧光强度几乎不受pH值的影响,但CD的荧光强度随着pH值的增大先增强后降低,在pH=6时达到最大,CD-AuNCs的荧光强度也在pH=6达到最强(图 3)。通常情况下,pH值对可离子化的荧光物质的荧光强度影响很大。因为碳点表面有大量的羧基基团,在酸性条件下羧基电离发生较大变化,所以CD的荧光强度受pH值影响较大[19];而AuNCs表面没有离子,所以其荧光强度受pH值影响较小。后续的实验测试均在pH=6的条件下进行。
|
| 图 3 pH值对CD-AuNCs荧光强度的影响 Fig.3 Effect of pH on the fluorescence intensity of CD-AuNCs |
| |
首先考察了不同浓度TC对CD-AuNCs的荧光强度的影响,发现TC对CD和AuNCs的荧光都有猝灭作用[图 4a)],且碳点和金纳米簇的荧光强度比值(FCD/FAuNCs)与一定浓度范围内的TC浓度呈线性关系。在1.9×10-4~5.2×10-2 g/L浓度范围内,以FCD/FAuNCs对TC浓度作线性关系图[图 4b)],得到线性方程FCD/FAuNCs=2.54812-17.22774c,R=0.99。

|
| 图 4 不同TC浓度下的CD-AuNCs荧光光谱图和FCD/FAuNCs与TC浓度的线性关系 Fig.4 Fluorescence spectra of CD-AuNCs with various TC and relationship between FCD/FAuNCs and TC |
| |
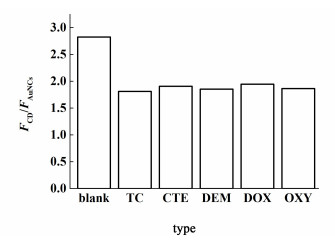
实验考察了5种四环素类药物[四环素(TC)、金霉素(CTE)、地美霉素(DEM)、多西霉素(DOX)、土霉素(OXY)]对CD-AuNCs荧光强度的影响情况。实验发现这5种四环素类药物均对CD-AuNCs荧光有猝灭作用,且相同浓度的各种四环素药物对CD-AuNCs荧光强度的猝灭趋势和程度基本一致(图 5),表明可以使用CD-AuNCs检测TCs总量。
|
| 图 5 同样浓度的各种四环素药物对CD-AuNCs荧光强度的影响 Fig.5 Effect of the same concentration of various tetracyclines on the fluorescence of CD-AuNCs |
| |
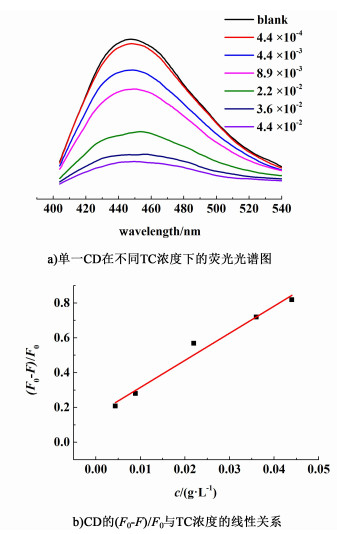
用单一CD检测TC结果如图 6所示。当TC浓度在4.4×10-3~4.4×10-2 g/L时,CD的荧光猝灭程度(F0-F)/F0和TC浓度存在线性关系,其线性方程为(F0-F)/F0=0.15967+15.55546c,R=0.97。所以说,与单一CD的测试结果相比,CD-AuNCs检测线性范围更宽,灵敏度更高。
|
| 图 6 单一CD在不同TC浓度下的荧光光谱图和CD的(F0-F)/F0与TC浓度的线性关系 Fig.6 Fluorescence spectra of CD with various TC and relationship between (F0-F)/F0of CD and TC |
| |
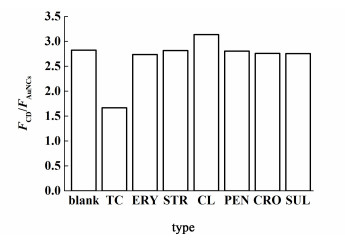
考察了CD-AuNCs对非四环素类药物红霉素(ERY)、链霉素(STR)、氯霉素(CL)、青霉素(PEN)、头孢曲松钠(CRO)和磺胺甲基嘧啶(SUL)的响应情况,结果如图 7所示。实验结果发现:只有四环素类药物可以猝灭CD-AuNCs的荧光,而其它非四环素类药物对CD-AuNCs的荧光强度几乎没有影响。
|
| 图 7 TC和其它非四环素类药物对CD-AuNCs荧光强度的影响 Fig.7 Effects of TC and other non-tetracyclines on the fluorescence of CD-AuNCs |
| |
|
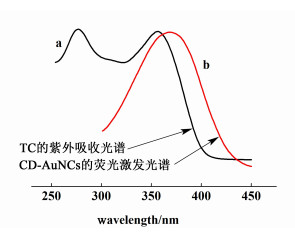
| 图 8 TC的紫外吸收光谱和CD-AuNCs的荧光激发光谱 Fig.8 UV absorption spectrum of TC and excitation spectrum of CD-AuNCs |
| |
因为TC的紫外吸收带和CD-AuNCs的荧光激发带在370 nm处存在重叠(图 8),所以我们推测可能是因为内过滤效应的存在,导致TC吸收部分激发光使CD-AuNCs的荧光减弱。又因为内过滤效应和吸收激发光物质的浓度有关,所以随着TC浓度的增大,CD-AuNCs体系的荧光强度逐渐降低[4,20]。因此,我们可以利用CD-AuNCs实现对四环素类药物的选择性检测。
3 结论设计了一种CD与AuNCs结合的双发射荧光探针,考察了CD-AuNCs的荧光性质、稳定性以及对TCs的传感情况。研究结果表明CD-AuNCs对四环素类药物(TCs)响应灵敏且具有选择性,比单一CD探针具有更宽的线性范围和更高的灵敏度。
| [1] |
Yao J, Yang M, Liu Y, et al. Fluorescent CdS quantum dots: Synthesis, characterization, mechanism and interaction with gold nanoparticles[J]. Journal of Nanoscience and Nanotechnology, 2015, 15(5): 3720-3727. DOI:10.1166/jnn.2015.9522 |
| [2] |
An X, Zhuo S, Zhang P, et al. Carbon dots based turn-on fluorescent probes for oxytetracycline hydrochloride sensing[J]. RSC Advances, 2015, 5(26): 19853-19858. DOI:10.1039/C4RA16456C |
| [3] |
Yang K, Wang S, Wang Y, et al. Dual-Channel probe of carbon dots cooperating with gold nanoclusters employed for assaying multiple targets[J]. Biosensors and Bioelectronics, 2017, 91: 566-573. DOI:10.1016/j.bios.2017.01.014 |
| [4] |
Joseph J, Anappara A A. Microwave-Assisted hydrothermal synthesis of UV-emitting carbon dots from tannic acid[J]. New Journal of Chemistry, 2016, 40(9): 8110-8117. DOI:10.1039/C6NJ02107G |
| [5] |
Yan F, Zou Y, Wang M, et al. Highly photoluminescent carbon dots-based fluorescent chemosensors for sensitive and selective detection of mercury ions and application of imaging in living cells[J]. Sensors and Actuators B: Chemical, 2014, 192: 488-495. DOI:10.1016/j.snb.2013.11.041 |
| [6] |
Qu K, Wang J, Ren J, et al. Carbon dots prepared by hydrothermal treatment of dopamine as an effective fluorescent sensing platform for the label-free detection of iron(Ⅲ) ions and dopamine[J]. Chemistry-A European Journal, 2013, 19(22): 7243-7249. DOI:10.1002/chem.201300042 |
| [7] |
Shi Y, Pan Y, Zhang H, et al. A dual-mode nanosensor based on carbon quantum dots and gold nanoparticles for discriminative detection of glutathione in human plasma[J]. Biosensors and Bioelectronics, 2014, 56: 39-45. DOI:10.1016/j.bios.2013.12.038 |
| [8] |
Kaur N, Aditya R N, Singh A, et al. Biomedical applications for gold nanoclusters: Recent developments and future perspectives[J]. Nanoscale Research Letters, 2018, 13: 1-12. DOI:10.1186/s11671-017-2411-3 |
| [9] |
Wang Y, Mao L, Liu W, et al. A ratiometric fluorometric and colorimetric probe for the β-thalassemia drug deferiprone based on the use of gold nanoclusters and carbon dots[J]. Microchimica Acta, 2018, 185(9): 1-9. |
| [10] |
Yang X, Zhu S, Dou Y, et al. Novel and remarkable enhanced-fluorescence system based on gold nanoclusters for detection of tetracycline[J]. Talanta, 2014, 122: 36-42. DOI:10.1016/j.talanta.2013.12.008 |
| [11] |
Yan Y, Yu H, Zhang K, et al. Dual-Emissive nanohybrid of carbon dots and gold nanoclusters for sensitive determination of mercuric ions[J]. Nano Research, 2016, 9(7): 2088-2096. DOI:10.1007/s12274-016-1099-5 |
| [12] |
Huang D, Niu C, Ruan M, et al. Highly sensitive strategy for Hg2+ detection in environmental water samples using long lifetime fluorescence quantum dots and gold nanoparticles[J]. Environmental Science & Technology, 2013, 47(9): 4392-4398. |
| [13] |
Zhu H, Yu T, Xu H, et al. Fluorescent nanohybrid of gold nanoclusters and quantum dots for visual determination of lead ions[J]. ACS Applied Materials & Interfaces, 2014, 6(23): 21461-21467. |
| [14] |
Niu W, Shan D, Zhu R, et al. Dumbbell-Shaped carbon quantum dots/AuNCs nanohybrid as an efficient ratiometric fluorescent probe for sensing cadmium (Ⅱ) ions and L-ascorbic acid[J]. Carbon, 2016, 96: 1034-1042. DOI:10.1016/j.carbon.2015.10.051 |
| [15] |
He Y, Pan C, Cao H, et al. Highly sensitive and selective dual-emission ratiometric fluorescence detection of dopamine based on carbon dots-gold nanoclusters hybrid[J]. Sensors and Actuators B: Chemical, 2018, 265: 371-377. DOI:10.1016/j.snb.2018.03.080 |
| [16] |
Qu F, Xu X, You J. A new dual-emission fluorescence sensor based on carbon nanodots and gold nanoclusters for the detection of melamine[J]. New Journal of Chemistry, 2017, 41(17): 9438-9443. DOI:10.1039/C7NJ02594G |
| [17] |
路晨, 余莉萍. 超支化聚乙烯亚胺改性荧光碳点材料的制备和表征[J]. 化学工业与工程, 2019, 36(3): 16-21. Lu Chen, Yu Liping. Preparation and characterization of fluorescent carbon dots modified by hyperbranched polyethyleneimine[J]. Chemical Industry and Engineering, 2019, 36(3): 16-21. DOI:10.3969/j.issn.1006-7906.2019.03.006 (in Chinese) |
| [18] |
Zhang T, Zhan C, Chen Y, et al. Disulfide-Functionalized hyperbranched poly(amidoamine) derivatives as both reductant and stabilizer for the synthesis of fluorescent gold nanoclusters[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2017, 535: 206-214. DOI:10.1016/j.colsurfa.2017.09.048 |
| [19] |
韩荣成, 喻敏, 沙印林. 溶液环境中CdSeS量子点与金纳米颗粒相互作用[J]. 物理化学学报, 2011, 27(1): 255-261. Han Rongcheng, Yu Min, Sha Yinlin. Interaction between CdSeS quantum dots and gold nanoparticles in solution[J]. Acta Physico-Chimica Sinica, 2011, 27(1): 255-261. DOI:10.3866/PKU.WHXB20110135 (in Chinese) |
| [20] |
Cao X, Shen F, Zhang M, et al. Efficient inner filter effect of gold nanoparticles on the fluorescence of CdS quantum dots for sensitive detection of melamine in raw milk[J]. Food Control, 2013, 34(1): 221-229. |
 2020, Vol. 37
2020, Vol. 37





