2. 五峰赤诚生物科技股份有限公司, 国家林业和草原局五倍子高效培育与精深加工工程技术研究中心, 湖北 五峰 443400
2. Wufeng Chicheng Biotechnology Co., LTD., Research Center of Engineering and Technology on Efficient Cultivation and Intensive Processing for Gallnut, National Forestry and Grassland Administration, Hubei Wufeng 443400, China
2, 3, 4-三羟基二苯酮(2, 3, 4-trihydroxybenzo phenone, 3HBP),分子结构如图 1所示,是一种重要的工业材料,可用于微电子工业的光致抗蚀剂(光刻胶)、医药、紫外线吸收剂、树脂稳定剂和染料等领域[1-3]。例如,以它为原料合成的三羟基二苯甲酮酯化215感光剂具有分辨率高、抗干法蚀刻性强、耐热性好及去胶方便等优点,满足了大规模集成电路的集成度不断提高、图形的线宽达微米并向亚微米级发展的需要[4]。目前,高纯度多羟基二苯甲酮(如3HBP)的生产和市场主要在美国、欧洲和日本等发达国家和地区,全球预计年需求达到万吨以上,而实际生产能力不到需求的1/3,存在很大的供需矛盾。目前我国是世界上集成电路产业主要生产国之一,对3HBP的需求量逐年增加,因此,合成能满足工业要求的3HBP有重要的现实意义。

|
| 图 1 3HBP的合成示意图 Fig.1 Synthesis of 3HBP |
| |
焦性没食子酸为没食子酸的脱羧产物,而没食子酸可从五倍子等植物原料中获得[5]。我国是五倍子的主要生产国家[6-7],在世界总产量中占95%左右,五倍子的主要成分单宁在酸、碱和酶等作用下水解即生成没食子酸[7-8]。因此,工业上通常采用容易得到的焦性没食子酸为起始原料,苯甲酸、苯甲酰氯或三氯甲苯等为酰基化试剂进行Friedel-Crafts酰化反应来合成3HBP[9-13]。由于三氯甲苯为酰化剂的反应条件温和、原料易得,是目前工业上采用的主要方法,但是该方法一般以传统的Lewis酸(如无水AlCl3、ZnCl2或SOCl2等)为催化剂[9-12],存在催化剂用量大、回收难、污染严重、产品易被氧化成深色副产物、收率低等问题。因此,寻找高效、低廉、环境友好的催化剂合成3HBP并发展其生产工艺具有重要意义。
本研究以焦性没食子酸与三氯甲苯为原料,首次提出以甲醇-水组成的混合溶剂代替单一溶剂或芳香烃-水组成的二元混合溶剂,以草酸-磷酸混合酸代替传统的Lewis酸为催化剂来合成3HBP[13],期望通过温和的、环境友好的反应条件合成得到收率高、纯度好、品质高的3HBP。
1 实验材料与方法 1.1 材料与试剂焦性没食子酸,湖北五峰赤城生物科技股份有限公司;磷酸,甲醇,乙酸乙酯,广东光华科技股份有限公司(以上试剂均为分析纯);草酸(C2H2O4·2H2O),天津风船化学试剂科技有限公司;实验室用水为去离子水。
1.2 仪器与设备AB204-型精密型电子天平,瑞士Mettler Toledo公司;C-MAGHS-7型磁力搅拌器,德国IKA公司;TENSON27型傅里叶变换红外光谱仪,德国布鲁克光谱仪器有限公司;Cary Series紫外-可见吸收光谱仪,Agilent 1290液相色谱串联飞行时间质谱仪,美国Agilent Technologies公司;200F3差示扫描量热仪,德国耐驰仪器制造有限公司;Bruker Avance 300 Hz核磁共振仪(s为单峰,d为双峰,t为三重峰,m为多重峰),瑞士BRUKER公司;硅胶(200~300目),薄层色谱硅胶板(GF254),青岛海洋化工有限公司。
1.3 合成3HBP的方法准确称量6.3 g (0.05 mol)焦性没食子酸加入带有温度计、冷凝回流管、滴液漏斗和进气口的四口瓶中,然后分别加入0.063 g草酸和0.063 g磷酸(二者总质量为焦性没食子酸质量的2.0%),再加入50.0 mL体积比为3:7的甲醇-水混合溶剂。将反应装置置于水浴锅中,通入氮气一段时间后将反应混合溶液加热至40 ℃,然后恒温条件下打开滴液漏斗缓慢滴加三氯甲苯(0.055 mol),滴加完毕后在45 ℃的条件下反应4~8 h。以石油醚和乙酸乙酯为展开剂(体积比为2:1),当薄层色谱法(TLC)检测原料焦性没食子酸消失后,将装有反应混合液的四口瓶于冰水中冷却,有红色固体生成,过滤,得到的固体即为3HBP粗产物,滤液备用。
1.4 纯化3HBP的方法采用柱层析法对3HBP进行纯化,具体操作为:将粗产物3HBP溶解于少量的乙酸乙酯中,加入硅胶,抽干,干法上柱,以石油醚/乙酸乙酯(体积比为2:1)为洗脱剂经柱层析分离后得到的浅黄色固体即为目标产物3HBP,根据公式(1)计算出产物的收率。
| $ 收率 = \left( {产物实际质量/产物理论质量} \right) \times 100\% $ | (1) |
合成3HBP时,控制焦性没食子酸的质量为6.3 g,三氯甲苯的物质的量为0.055 mol,体积比为3:7的甲醇-水混合溶剂50.0 mL,反应温度为45 ℃,控制混合酸的质量比为1.0,考察混合酸的用量(以焦性没食子酸的质量计)0、1.0%、2.0%、3.0%和4.0%对3HBP收率的影响;其它条件不变,在以上较适宜条件下,考察混合溶剂V(甲醇):V(水)为0:10、1:9、2:8、3:7和4:6对3HBP收率的影响;其它条件不变,在以上较适宜条件下,考察反应温度45、55、65、75和85 ℃对3HBP收率的影响。
1.6 溶剂重复利用实验将反应结束后过滤得到的滤液重新加至另一反应瓶中,根据溶剂体积换算出焦性没食子酸和三氯甲苯的质量,然后按照1.3中的实验方法再次合成3HBP。
2 结果与讨论 2.1 3HBP的合成以三氯甲苯为原料来合成二苯甲酮的相关报道较多[10-12],由于三氯甲苯不溶于水,合成时一般选用有机芳香烃-水为二元混合溶剂,固体路易斯酸为催化剂[10-12]。本方法以草酸-磷酸代替一般的固体酸作为催化剂[13],将焦性没食子酸溶于甲醇-水的混合溶剂,三氯甲苯以滴加的方式进入反应体系,恒温反应后合成了3HBP,反应方程式如图 1所示。该反应的优点是原料在均相体系中进行反应,反应条件温和,产物以固体形式析出,后处理简单,经过滤后溶剂和催化剂可回收利用。此外,反应进行的整个过程都有惰性气体保护,可防止原料和产物氧化生成深色的产物,提高产物收率。
2.2 3HBP的纯化由于酚类物质容易被氧化而造成产物的颜色较深,影响产品质量,因此,后处理时对3HBP进行脱色、重结晶或重蒸等纯化是获得高品质产品的重要步骤。柱层析法可有效去除有色物质和杂质,虽然工业成本略高,但产品纯度高、品质好。本研究着重研究的是3HBP的新合成工艺,因此,对3HBP的纯化方法并未做更深入的探索,仅以柱层析法对产品进行了纯化。工业生产中,以树脂、活性炭等进行脱色,选用不同溶剂和方法对产品进行重结晶仍有重要意义。
2.3 3HBP的结构表征化合物3HBP为浅黄色固体,熔点为141.9 ℃,质谱结果显示(ESI-TOF) m/z 3HBP(C13H10O4)的相对分子质量为230.0,核磁共振谱1H NMR(600 MHz, CDCl3) δ: 12.70 (s, 1H), 7.64 (t, J=7.2 Hz,2H), 7.57 (t, J=7.2 Hz, 1H), 7.49 (t, J=7.6 Hz, 2H), 7.15 (d, J=8.8 Hz, 1H), 6.50 (d, J=9.2 Hz,1H), 6.21(s, 1H), 5.90(s, 1H); 13C NMR(CDCl3,150 MHz), δ: 200.77, 151.63, 150.24, 138.05, 131.86, 131.43, 129.13, 128.45, 126.76, 113.39, 107.27。红外(IR, KBr, cm-1): 3 492, 3 438, 1 635, 1 587, 1 563, 1 506, 1 282, 1 164, 1 038, 848, 800, 749, 621, 575。紫外-可见光(UV-Vis)显示3HBP分别在245和309 nm处有吸收峰。
2.4 单因素实验结果 2.4.1 混合酸用量的影响如图 2所示,焦性没食子酸6.3 g,体积比为3:7的甲醇-水混合溶剂为50.0 mL,在温度为45 ℃的条件下进行反应,未加入混合酸时目标产物3HBP的收率仅有42.5%(原料剩余较多);随着混合酸的加入,收率明显提高,当混合酸用量为2%时,收率达到最大,为72.1%;继续增大混合酸用量,收率几乎不变。焦性没食子酸与三氯甲苯为原料合成3HBP是典型的Friedel-Crafts反应,这类反应通常以路易斯酸为催化剂,其中最常用的是ZnCl2和AlCl3等,这些固体酸反应后是以其氢氧化物的固体形式存在于反应混合体系中,存在用量大、回收难等问题。本方法以草酸和磷酸代替固体酸为催化剂[13],催化剂用量少且有效地提高了产物收率,这是因为磷酸是缺电子的路易斯酸,作为催化剂参与了反应[15-16],可能的反应机理[17-19]如图 3所示;而草酸是具有很强的还原性的有机酸,除了调节反应体系的酸性还起到了抗氧化的作用。此外,该反应结束后经过滤即可实现混合酸与产物分离,且含有混合酸的滤液可以再次利用,避免了常见固体酸用量大、回收难的问题,三废处理简单,有效地降低了工业成本。单因素结果表明,为获得更高的收率,混合酸的最适宜用量为焦性没食子酸的质量的2.0%。

|
| 图 2 混合酸的用量对收率的影响 Fig.2 Effect of amount of mixed acid on yield |
| |
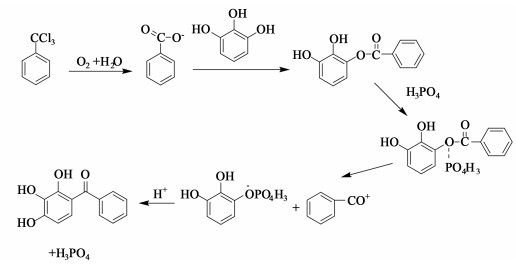
|
| 图 3 合成3HBP可能的机理 Fig.3 Possible mechanism diagram of 3HBP synthesis |
| |
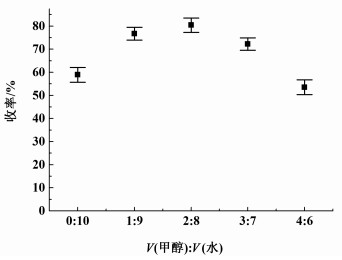
如图 4所示,焦性没食子酸为6.3 g,混合酸的用量为焦性没食子酸的质量的2.0%,溶剂只有水时,产物的收率仅有58.8%;当溶剂中加入甲醇后产物收率显著提高,当V(甲醇):V(水)为2:8时可获得84.4%的高收率,但是继续增加混合溶剂中甲醇的比例,产物的收率反而迅速下降。这是因为三氯甲苯不溶于水,只有水作溶剂时,三氯甲苯与原料焦性没食子酸接触不充分,反应处于非均相体系,导致反应不能完全进行;而采用甲醇-水为混合溶剂,增加了三氯甲苯的溶解性,各物质在均相体系中进行反应,使产物收率提高;然而,当混合溶剂中甲醇的比例过大,生成的3HBP在溶剂中的溶解度增大而不易析出,造成产物收率偏低,生产成本高。因此,为获得较佳收率,混合溶剂V(甲醇):V(水)应为2:8。
|
| 图 4 V(甲醇):V(水)对收率的影响 Fig.4 Effect of volume ratio of methanol and water on yield |
| |
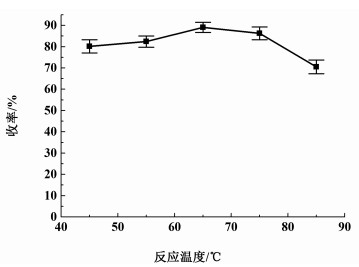
如图 5所示,焦性没食子酸6.3 g,体积比为2:8的甲醇-水混合溶剂为50.0 mL,随着反应温度从45 ℃升高至60 ℃,产物收率由84.2%提高到89.1%,说明适当升高反应温度有利于活化反应物,促进产物的生成[20-22];但是温度继续升高,收率有所降低,这是因为温度过高时会增加副产物的生成,而且生产成本也增加,因此,三氯甲苯滴加完毕后恒温反应的温度控制在65 ℃左右较为合适。
|
| 图 5 反应温度对收率的影响 Fig.5 Effect of reaction temperature on yield |
| |
合成3HBP时,产物的收率除了受到以上3个因素的影响,还与其它因素有关。具体来说,首先应该注意的是整个反应尽量避免光照,尤其是装有三氯甲苯的滴液漏斗要完全避光,三氯甲苯见光易分解,因此,三氯甲苯与焦性没食子酸的比例应根据实际情况适当提高,二者的物质的量之比控制在1.05~1.20较为合适。此外,三氯甲苯的滴加速度也会影响产物的收率,当其滴加速度过快会造成反应液局部浓度过大,副产物增加;而滴加速度过慢,反应时间延长,成本增加,因此,实际运用时要根据原料和溶剂的用量来控制三氯甲苯的滴加速度。最后,原料的质量与混合溶剂的体积之比也应根据实际情况进行考察,二者的比例与原料的用量有关,但不是简单的正比关系。
2.5 溶剂重复利用的结果如图 6所示,混合溶剂在第1次使用后经过滤,滤液不经其它处理,直接添加焦性没食子酸和三氯甲苯后进行反应,可获得收率为65.1%的产物,第3次再利用时产率为31.0%。该方法在一定程度上实现了溶剂和催化剂的回收再利用,方法简便,环境污染小,绿色环保。

|
| 图 6 溶剂使用次数对收率的影响 Fig.6 Effect of solvent usage times on yield |
| |
以焦性没食子酸为原料,甲醇-水为混合溶剂,草酸-磷酸为催化剂,氮气保护的条件下与三氯甲苯反应,合成了2, 3, 4-三羟基二苯酮(3HBP)。通过单因素实验确定了3HBP的最适宜合成工艺条件为:焦性没食子酸的质量为6.3 g(0.05 mol),混合溶剂甲醇-水(V:V=2:8)为50.0 mL,升温至40 ℃时缓慢滴加三氯甲苯(0.055 mol),滴加完毕后升温至65 ℃恒温反应至原料消失。在最适宜条件合成的3HBP,经柱层析后收率为89.1%。
该方法反应条件温和、绿色环保,具有工业化应用的潜力。
| [1] |
Komine T, Asaumi S, Yokota A, et al. Positive-Working o-quinone diazide photoresist composition with 2, 3, 4-trihydroxy-benzophenone: US4738915[P]. 1988-04-09
|
| [2] |
Okabe N, Kyoyama H. 2, 3, 4-Trihydroxybenzophenone monohydrate[J]. Acta Crystallographica Section E Structure Reports Online, 2002, 58(5): o565-o567. DOI:10.1107/S1600536802007109 |
| [3] |
张明森. 精细有机化工中间体全书[M]. 北京: 化学工业出版社, 2008. Zhang Mingsen. Fine organic chemical intermediates[M]. Beijing: Chemical Industry Press, 2008. (in Chinese) |
| [4] |
Harlang T C B, Liu Y, Gordivska O, et al. Iron sensitizer converts light to electrons with 92% yield[J]. Nature Chemistry, 2015, 7(11): 883-889. DOI:10.1038/nchem.2365 |
| [5] |
Li W. Screening strains and conditions of degrading gallic acid to prepare pyrogallol[J]. Fine Chemicals, 2015, 32(1): 52-58. |
| [6] |
张燕平.五倍子资源培育的生物学基础[D].南京: 南京林业大学, 2001 Zhang Yanping. A study on biological basis for resources cultivation of Chinese gallnut[D]. Nanjing: Nanjing Forestry University, 2001(in Chinese) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y371244 |
| [7] |
吕翔, 杨子祥, 邵淑霞, 等. 角倍单宁酸和没食子酸含量的比较及影响因子分析[J]. 林业科学研究, 2010, 23(6): 856-861. Lv Xiang, Yang Zixiang, Shao Shuxia, et al. Comparative analysis of the tannin and Gallic acid contents of Chinese gallnut and the influencing factors[J]. Forest Research, 2010, 23(6): 856-861. (in Chinese) |
| [8] |
王艳萍, 李西营, 张静, 等. 四氯环己酮水解合成邻苯三酚的循环反应工艺[J]. 化工进展, 2015, 34(1): 224-228. Wang Yanping, Li Xiying, Zhang Jing, et al. Cyclic reaction process of synthesis of pyrogallic acid from 2, 2, 6, 6-tetrahalocyclohexanone[J]. Chemical Industry and Engineering Progress, 2015, 34(1): 224-228. (in Chinese) |
| [9] |
王光辉, 徐浩, 黄嘉玲, 等. 多羟基二苯甲酮类化合物合成方法的研究进展[J]. 生物质化学工程, 2009, 43(1): 36-40. Wang Guanghui, Xu Hao, Huang Jialing, et al. Research progress on synthetic methods of ployhydroxybenzophenones[J]. Biomass Chemical Engineering, 2009, 43(1): 36-40. DOI:10.3969/j.issn.1673-5854.2009.01.010 (in Chinese) |
| [10] |
裴文, 李风军, 王海滨, 等. 固体酸催化合成二芳基甲酮化合物的研究进展[J]. 有机化学, 2011, 31(8): 1188-1194. Pei Wen, Li Fengjun, Wang Haibin, et al. Progress in the synthesis of diaryl ketones catalyzed by soild acids[J]. Chinese Journal of Organic Chemistry, 2011, 31(8): 1188-1194. (in Chinese) |
| [11] |
Sartori G, Maggi R. Use of solid catalysts in Friedel-Crafts acylation reactions[J]. Chemical Reviews, 2006, 106(3): 1077-1104. DOI:10.1021/cr040695c |
| [12] |
孟波, 柳玉英, 周丽, 等. 紫外线吸收剂UV-531合成新工艺[J]. 山东化工, 2004, 33(1): 7-8. Meng Bo, Liu Yuying, Zhou Li, et al. A new process for production of ultraviolet absorbent UV-531[J]. Shandong Chemical Industry, 2004, 33(1): 7-8. (in Chinese) |
| [13] |
胡先明, 胡泉源, 苏江涛, 等. 2, 3, 4-三羟基二苯酮的催化合成研究[J]. 林产化学与工业, 2002, 22(2): 47-50. Hu Xianming, Hu Quanyuan, Su Jiangtao, et al. Study on catalytic synthesis of 2, 3, 4-trihydroxybenzophenone[J]. Chemistry & Industry of Forest Products, 2002, 22(2): 47-50. DOI:10.3321/j.issn:0253-2417.2002.02.011 (in Chinese) |
| [14] |
胡应喜, 陈晓玮. 2-羟基-4-苄氧基二苯甲酮的合成[J]. 化学工业与工程, 2009, 26(5): 377-380. Hu Yingxi, Chen Xiaowei. Synthesis of 2-hydroxy-4-benzyloxybenzophenone[J]. Chemical Industry and Engineering, 2009, 26(5): 377-380. (in Chinese) |
| [15] |
黄志良, 靳立群, 雷爱文. 傅-克酰基化反应的机理及动力学研究进展[J]. 有机化学, 2011, 31(6): 775-783. Huang Zhiliang, Jin Liqun, Lei Aiwen. Development of mechanism studies and kinetic investigations in Friedel-Crafts acylation[J]. Chinese Journal of Organic Chemistry, 2011, 31(6): 775-783. (in Chinese) |
| [16] |
伍越寰. 有机化学[M]. 合肥: 中国科学技术大学出版社, 2017.
|
| [17] |
Roberts J L, Calderwood T S, Sawyer D T. Oxygenation by superoxide ion of tetrachloromethane, trichlorofluoromethane, trichloromethane, p, p'-DDT and related trichloromethyl substrates (RCCl3) in aprotic solvents[J]. Journal of the American Chemical Society, 1983, 105(26): 7691-7696. DOI:10.1021/ja00364a039 |
| [18] |
Haiss P, Zeller K P. Loss of isotope labeling in the conversion of[18O2]benzoic acid into[18O]benzoyl chloride with oxalyl chloride[J]. Angewandte Chemie International Edition, 2003, 42(3): 303-305. DOI:10.1002/anie.200390101 |
| [19] |
De Gracia Retamosa M, Ruiz-Olalla A, Bello T, et al. A three-component enantioselective cyclization reaction catalyzed by an unnatural amino acid derivative[J]. Angewandte Chemie International Edition, 2018, 57(3): 668-672. DOI:10.1002/anie.201708952 |
| [20] |
Wagner P J, Truman R J, Puchalski A E, et al. Extent of charge transfer in the photoreduction of phenyl ketones by alkylbenzenes[J]. Journal of the American Chemical Society, 1986, 108(24): 7727-7738. DOI:10.1021/ja00284a041 |
| [21] |
穆曼曼, 陈立功. 固体酸催化芳烃Friedel-Crafts酰基化反应的研究进展[J]. 精细化工, 2017, 34(4): 361-367, 406. Mu Manman, Chen Ligong. Progress of Friedel-Crafts acylation of arenes over solid acid catalysts[J]. Fine Chemicals, 2017, 34(4): 361-367, 406. (in Chinese) |
| [22] |
金灿, 张雪彦, 熊凯, 等. 没食子酸衍生化反应研究进展[J]. 生物质化学工程, 2015, 49(4): 49-56. Jin Can, Zhang Xueyan, Xiong Kai, et al. Progress in preparation and utilization of Gallic acid derivatives[J]. Biomass Chemical Engineering, 2015, 49(4): 49-56. DOI:10.3969/j.issn.1673-5854.2015.04.010 (in Chinese) |
 2019, Vol. 36
2019, Vol. 36





