二氯异氰尿酸钠(dichloroisocyanuric acid sodium,简称DCCNa),分子式Na(CNO)3Cl2,为白色粉末状,其可与水生成二水合物Na(CNO)3Cl2·2H2O,20 ℃以上易溶于水。在同类产品当中,它具有化学性质稳定,易于储存,运输方便等优点,是一种高效、经济环保、使用安全的消毒剂,其理论有效率质量分数为64.5%,工业产品一种是干品,w(有效氯)在62%左右[1],另一种含有结晶水,w(有效氯)为56%左右,后者的稳定性更好。二氯异氰尿酸钠具有极强的杀菌效果,在浓度为20×10-6时,杀菌率可达99%。
二氯异氰尿酸钠的合成主要有3种方法:二氯异氰尿酸法、三氯异氰尿酸复分解法和NaClO法。二氯异氰尿酸法通常由二步法合成:1)物质的量之比1:2混合氰尿酸和NaOH水溶液,通入Cl2后得到二氯异氰尿酸,进行离心过滤得滤饼。2)将过滤得到的滤饼用纯水洗涤除去残留的氯化钠,再补充一定量的纯水,滴加等同物质量的NaOH溶液至溶液呈中性,过滤干燥得到二氯异氰尿酸钠白色固体[2]。其反应式见式(1)和式(2)。
| $ \begin{array}{*{20}{l}} {{{({\rm{CHNO}})}_3} + 2{\rm{NaOH}} + 2{\rm{C}}{{\rm{l}}_2} \to }\\ {{\rm{H}}{{({\rm{CNO}})}_3}{\rm{C}}{{\rm{l}}_2} + 2{\rm{NaCl}} + 2{{\rm{H}}_2}{\rm{O}}} \end{array} $ | (1) |
| $ \begin{array}{*{20}{c}} {{\rm{H}}{{({\rm{CNO}})}_3}{\rm{C}}{{\rm{l}}_2} + {\rm{NaOH}} \to }\\ {{\rm{Na}}{{({\rm{CNO}})}_3}{\rm{C}}{{\rm{l}}_2} + {{\rm{H}}_2}{\rm{O}}} \end{array} $ | (2) |
三氯异氰尿酸复分解法:首先按物质的量之比1:3混合氰尿酸和NaOH溶液得到氰尿酸三钠盐,通入Cl2、离心过滤得到三氯异氰尿酸。之后将过滤得到的三氯异氰尿酸、氰尿酸和NaOH溶液按物质的量之比2:1:3混合,于温度30~40 ℃下进行复分解反应,反应结束后经冷却、过滤、干燥得到二氯异氰尿酸钠白色固体[3]。其反应式见式(3)和式(4)。
| $ \begin{array}{*{20}{l}} {{{({\rm{CHNO}})}_3} + 3{\rm{NaOH}} + 3{\rm{C}}{{\rm{l}}_2} \to }\\ {{{({\rm{CNO}})}_3}{\rm{C}}{{\rm{l}}_3} + 3{\rm{NaCl}} + 3{{\rm{H}}_2}{\rm{O}}} \end{array} $ | (3) |
| $ \begin{array}{*{20}{c}} {2{{({\rm{CNO}})}_3}{\rm{C}}{{\rm{l}}_3} + {{({\rm{CHNO}})}_3} + 3{\rm{NaOH}} \to }\\ {3{\rm{Na}}{{({\rm{CNO}})}_3}{\rm{C}}{{\rm{l}}_2} + 3{{\rm{H}}_2}{\rm{O}}} \end{array} $ | (4) |
NaClO法是在NaOH溶液通入Cl2产生高浓度NaClO溶液,然后与氰尿酸反应制取二氯异氰尿酸钠。分离后的二氯异氰尿酸钠的母液有2种处理方法,一种是通Cl2,可使生成的NaOH转化为NaClO继续参与反应,以提高原料利用率,见式(5)与式(6)。另一种滴加盐酸中和生成的NaOH[2],反应见式(7)与式(8)。
| $ 2{\rm{NaOH}} + 2{\rm{C}}{{\rm{l}}_2} \to {\rm{NaClO}} + {\rm{NaCl}} + {{\rm{H}}_2}{\rm{O}} $ | (5) |
| $ \begin{array}{*{20}{l}} {2{{({\rm{CHNO}})}_3} + 3{\rm{NaClO}} + {\rm{C}}{{\rm{l}}_2} \to }\\ {2{\rm{Na}}{{({\rm{CNO}})}_3}{\rm{C}}{{\rm{l}}_2} + {\rm{NaCl}} + 3{{\rm{H}}_2}{\rm{O}}} \end{array} $ | (6) |
| $ \begin{array}{*{20}{c}} {{{({\rm{CHNO}})}_3} + 2{\rm{NaClO}} \to }\\ {{\rm{Na}}{{({\rm{CNO}})}_3}{\rm{C}}{{\rm{l}}_2} + {\rm{NaOH}} + {{\rm{H}}_2}{\rm{O}}} \end{array} $ | (7) |
| $ {\rm{NaOH}} + {\rm{HCl}} \to {\rm{NaCl}} + {{\rm{H}}_2}{\rm{O}} $ | (8) |
二氯异氰尿酸法和三氯异氰尿酸复分解法具有产品纯度高,原料消耗低的优点,但是酸性的反应环境容易腐蚀设备,对设备材质要求较高、投资较大。
本研究采用NaClO法制备二氯异氰尿酸钠,NaClO法的特点是反应液近似为中性,对设备投资要求不高,且二氯异氰尿酸钠母液可用以生产三氯异氰尿酸,但该法对NaClO浓度的要求较高,否则容易使产物中存有2%~4%的NaCl(质量分数,下同),导致产品纯度不高,干品w(有效氯)低于60%。付永宽等[4]采用高浓度HClO制备二氯异氰尿酸钠,得到的干品w(有效氯)在61%~63%,本研究在此基础上,在氰尿酸的氯化过程中通入Cl2以保证NaClO的充分利用,综合考察了NaClO溶液浓度、Cl2的用量、氯化温度等操作条件对所获得的产物w(有效氯)的影响,目的是为该法的进一步放大试验和工程设计提供基础。
1 实验部分 1.1 实验原料实验所用的原料和化学试剂如表 1所示。
| 名称 | 规格 | 质量分数/% | 生产厂家 |
| 浓HCl | AR | 34.0~36.0 | 国药集团化学试剂有限公司 |
| NaOH | AR | 国药集团化学试剂有限公司 | |
| KMnO4 | AR | 国药集团化学试剂有限公司 | |
| 氰尿酸 | 工业品 | 98.0 | 武汉远成共创科技发展有限公司 |
| NaClO | CP | 6.6 | 上海泰坦化学有限公司 |
| NaClO | CP | 14.5 | 上海泰坦化学有限公司 |
| 去离子水 | 自制 |
实验所用的装置如图 1所示。

|
| 图 1 二氯异氰尿酸钠合成装置及流程图 Fig.1 Flowchart for synthesis of sodium dichloroisocyanurate |
| |
流程说明:将恒压滴液漏斗中的浓盐酸缓慢滴入真空抽滤瓶中,与KMnO4反应生成Cl2,再进入氯化反应釜,Cl2与氯化反应釜内的NaOH溶液进行反应,可制备高浓度的NaClO溶液;再通过反应釜上部的进料口加入氰尿酸固体,与NaClO、Cl2混合搅拌,进行氯化反应生成二氯异氰尿酸钠产品。残余的Cl2用NaOH溶液吸收净化处理。
1.3 操作方法 1.3.1 高浓度NaClO的制备[4]NaClO溶液极不稳定,市售的NaClO溶液质量分数普遍不超过10%,实验用高浓度也仅15%左右,且价格昂贵,不易长期保存。
分别配置好质量分数为30%和40%的NaOH 2种溶液。首先在反应合成釜内加入10 mL的30%NaOH溶液,冰水浴下冷却至10 ℃左右,开启搅拌并通入Cl2至溶液pH值为8左右。然后加入10 mL的40%NaOH溶液,继续通入Cl2至溶液pH值为8左右,此时溶液呈黄绿色,NaClO的质量分数在16%~18%之间。
实验中需要注意的是,若Cl2通入过量,会引起过NaClO进一步分解,导致生成的NaClO溶液分解为氯化钠等其他副产物,其分解反应式为:
| $ {\rm{NaClO}} + {\rm{C}}{{\rm{l}}_2} + {{\rm{H}}_2}{\rm{O}} \to {\rm{NaCl}} + 2{{\rm{H}}_2}{\rm{O}} $ | (9) |
| $ {\rm{NaClO}} + 2{\rm{HClO}} \to {\rm{NaCl}}{{\rm{O}}_3} + 2{\rm{HCl}} $ | (10) |
| $ {\rm{NaClO}} + 2{\rm{HCl}} \to {\rm{NaCl}} + {\rm{C}}{{\rm{l}}_2} + {{\rm{H}}_2}{\rm{O}} $ | (11) |
| $ 3{\rm{NaClO}} \to {\rm{NaCl}}{{\rm{O}}_3} + 2{\rm{NaCl}} $ | (12) |
当Cl2大大过量时,pH值低于7以下,分解反应加剧,反应式为:
| $ {\rm{NaClO}} + {\rm{HCl}} \to {\rm{NaCl}} + {\rm{HClO}} $ | (13) |
| $ 2{\rm{HClO}} \to {{\rm{O}}_2} + 2{\rm{HCl}} $ | (14) |
| $ {\rm{HClO}} + {\rm{HCl}} \to {\rm{C}}{{\rm{l}}_2} + {{\rm{H}}_2}{\rm{O}} $ | (15) |
式(9)~式(15)是制备NaClO溶液时必须避免的反应,否则会导致NaClO溶液浓度降低并生成大量的氯化钠,最终氯化产物的w(有效氯)下降,含盐量上升。
1.3.2 氰尿酸与NaClO反应针对式(6)和式(7)的氰尿酸与NaClO的反应,实验分别尝试了通氯和不通氯反应的2种情况,其操作方法如下:1)不通入Cl2的实验方法:在图 1所示的装置中,直接采用市售NaClO,按物质的量之比为1.0:2.2的氰尿酸与NaClO的量,先加入一定体积的NaClO溶液,再加入一定质量的氰尿酸,反应为不可逆的快速反应,产物为二氯异氰尿酸钠。其在低温下为难溶物,该产物于反应温度下先搅拌5 min,再用冰水浴冷却至10 ℃以下,过滤得到白色固体。将该白色固体铺展于表面皿上,置于40 ℃的烘箱内烘干,测定该产物有效氯的含量。实验考察了NaClO浓度、产物在烘箱中干燥时间等因素对产物w(有效氯)的影响。2)通入Cl2的实验方法:在图 1所示的反应合成釜3中加入30%和40%的NaOH溶液并通入Cl2制备高浓度NaClO。通入自制Cl2的实验方法:利用图 1所示的Cl2发生装置2,反应原料为高锰酸钾和浓盐酸,自制Cl2。随后在合成釜中加入氰尿酸,并在搅拌下持续通入Cl2,反应环境维持冰水浴,温度10 ℃左右,约30 min后过滤,得到白色固体,并置于干燥器中在负压下干燥1 h后,测定其有效率氯的含量。
1.4 产物w(有效氯)的测定采用碘量法[5]测定产物有效氯的含量。其原理和方法为:在酸性环境下,被测样品水解生成次氯酸,次氯酸和过量的碘化钾反应析出一定量的碘,用硫代硫酸钠标准液滴定其中的碘,根据硫代硫酸钠标准液的用量,计算得到样品有效氯的质量分数。反应方程式为:
| $ {\rm{HClO}} + 2{{\rm{I}}^ - } + {{\rm{H}}^ + } \to {{\rm{I}}_2} + {\rm{C}}{{\rm{l}}^ - } + {{\rm{H}}_2}{\rm{O}} $ | (16) |
| $ {{\rm{I}}_2} + 2{{\rm{S}}_2}{\rm{O}}_3^{2 - } \to 2{{\rm{I}}^ - } + {{\rm{S}}_4}{\rm{O}}_6^{2 - } $ | (17) |
步骤:称取0.1 g左右的样品,溶于装有100 mL去离子水的碘量瓶中,依次加入20 mL浓度约为0.3 mol/L的醋酸溶液和20 mL浓度为0.6 mol/L的KI溶液。通常情况下,碘量瓶内溶液呈深红色,若样品的w(有效氯)较低,溶液颜色在淡黄色到橘红色之间。用标定好的硫代硫酸钠溶液进行滴定,当碘量瓶中溶液由深红色变为淡黄色,最后呈无色透明时,即为终点。按式(18)计算有效氯含量。
| $ w({\rm{Cl}}) = \frac{{C\left( {{V_{\rm{b}}} - {V_{\rm{a}}}} \right) \times 0.03545}}{m} \times 100\% $ | (18) |
式(18)中:C为硫代硫酸钠标准液的浓度,mol/L;Va为滴定管的初读数,mL;Vb为滴定管的末读数,mL;m为样品质量,g。
2 结果讨论 2.1 通氯条件对产品w(有效氯)的影响采用NaClO和氰尿酸为原料,在通氯和不通氯条件下,考察了反应物的物质的量之比、NaClO的浓度、反应时间、反应温度、过滤温度、干燥时间以及通氯情况对产物w(有效氯)的影响,结果见表 2。
| No. | n(CA): n(NaClO) |
w(NaClO)/ % |
V1/mL | T0/℃ | T1/℃ | T2/℃ | t/min | 40 ℃烘箱干燥 时间/min |
w(Cl)/ % |
通Cl2 |
| 1 | 1.0:2.2 | 6.6 | 100 | 26.0 | 29.4 | 8.4 | 30 | 40 | 7.44 | 否 |
| 2 | 1.0:2.2 | 6.6 | 100 | 20.0 | 24.6 | 9.0 | 30 | 60 | 6.72 | 否 |
| 3 | 1.0:2.4 | 6.6 | 140 | 27.0 | 29.4 | 8.4 | 70 | 60 | 5.34 | 否 |
| 4 | 1.0:2.4 | 6.6 | 140 | 19.0 | 26.0 | 8.4 | 70 | 120 | 19.20 | 是 |
| 5 | 1.0:2.4 | 14.5 | 120 | 29.5 | 16.0 | 5.0 | 50 | 120 | 40.00 | 是 |
| 6 | 1.0:4.4 | 14.5 | 40 | 8.0 | 12.0 | 12.0 | 50 | 120 | 42.00 | 是 |
| 注:m为质量浓度,V1为加入NaClO的体积,T0为环境温度,T1为反应温度,T2为过滤温度,t为反应时间。 | ||||||||||
表 2的结果表明:在通氯的条件下,产物有效氯的含量有了明显的提高,但所有的产物其w(有效氯)均低于55%,未达到含结晶水产品的标准[1]。比较No.4、No.5和No.6,可看出NaClO溶液的浓度越高,氯化产物w(有效氯)越高。后续实验的氯化过程均通入Cl2参与反应。
2.2 NaClO的浓度对产物w(有效氯)的影响采用NaOH溶液、市购的不同浓度NaClO溶液与自制的Cl2为原料,合成高浓度NaClO,再与氰尿酸反应得到二氯异氰尿酸钠。实验考察了NaOH溶液浓度、市购NaClO溶液的量、反应温度、反应时间、溶液pH值以及NaOH与市购NaClO溶液两者混合加料方式对产物二氯异氰尿酸钠w(有效氯)的影响,结果见表 3所示。
| No. | m(CA)/ g |
V1/mL (30%NaOH) |
V2/mL (14.5%NaClO) |
NaOH加料方式 | pH值 | T | t/ min |
w(Cl)/% (含结晶水) |
| 1 | 13.0 | 20(50%NaOH) | 120 | V1和V2同时放入 | 8 | Ta | 40 | 49.5 |
| 2 | 8.3 | 20 | 80 | 同No.1 | 7 | Ta | 180 | 41.9 |
| 3 | 10.0 | 12 | 120(6.6%NaClO) | 同No.1 | <7 | |||
| 4 | 40.0 | 10 | 40 | 同No.1 | <7 | |||
| 5 | 3.0 | 10 | 20 | 同No.1 | 11 | Ta | 40 | 46.0 |
| 6 | 3.0 | 10 | 20 | 同No.1 | 8 | Ta | 140 | 44.0 |
| 7 | 3.0 | 10 | 20 | 同No.1 | 8 | Tb | 60 | 43.1 |
| 8 | 3.0 | 10 | 20 | V1先通Cl2至溶液呈弱碱性,后加入V2 | 8 | Tb | 28 | 55.3 |
| 9 | 3.0 | 10 | 20 | 同No.8 | 8 | Tb | 34 | 54.0 |
| 10 | 3.3 | 10 | 20 | 同No.8 | 8 | Tb | 60 | 54.1 |
| 11 | 3.6 | 10 | 20 | 同No.8 | 8 | Tb | 70 | 55.7 |
| 12 | 3.0 | 10 | 10(40%NaOH) | 同No.8 | 8 | Tb | 95 | 56.2 |
| 注:V1为制备高浓度NaClO加入NaOH的量(多为30%NaOH,其他另作说明),V2为制备高浓度NaClO加入市购NaClO溶液的量(多为14.5%NaClO,其他另作说明),pH值是指所制备的高浓度NaClO溶液的pH值,T为反应温度,Ta为环境温度(25~30 ℃),Tb为冰水浴冷却后的温度(10 ℃左右),t为反应时间。 | ||||||||
表 3结果表明:No.1~No.7的产物w(有效氯)均低于50%,含NaOH较多。其中,No.3和No.4在高浓度NaClO制备阶段,Cl2过量通入,表现为液料pH < 7,发生式(9)到式(15)一系列副反应,NaClO被消耗,生成大量NaCl结晶,使后续氰尿酸的氯化反应难以进行。
No.8、No.11和No.12产物的w (有效氯)均高于55%,No.9和No.10的w (有效氯)为54%左右。实验操作的共同点在于对高浓度NaClO的制备过程,先加入10 mL30%的NaOH溶液并通Cl2至溶液呈弱碱性,再加入20 mL14.5%市购NaClO溶液,所制得的NaClO浓度可达18%左右(No.8~No.12),控制反应温度在10 ℃左右,在此条件下,后续制得的二氯异氰尿酸钠w (有效氯,含结晶水)在56%以上。No.12中V2直接采用40%NaOH溶液(并2次通氯至溶液呈弱碱性),替代市购的NaClO溶液,也能达到同样的效果。
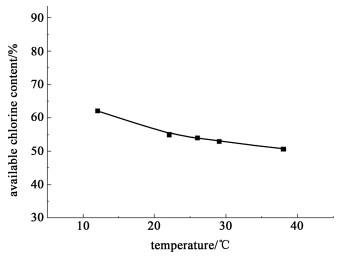
2.3 温度对产品w (有效氯)的影响选定表 3所示的No.12条件,保持NaOH溶液浓度、原料的物质的量配比、氯化反应时间、干燥方式不变,改变氰尿酸氯化反应温度对w (有效氯)的影响,结果见图 2所示。
|
| 图 2 温度对产品w (有效氯)的影响 Fig.2 Influence of temperature on the available chlorine content of DCCNa product |
| |
图 2的结果表明:氯化反应温度在12 ℃时,所制得的二氯异氰尿酸钠干品w (有效氯)可达62%;氯化反应温度的升高导致产品w (有效氯)的下降。其原因是该氯化反应放热,反应体系从冰浴温度2 ℃(实验初始最低温度)缓慢升至12 ℃左右,小试实验温度难以控制,更低的温度可能有利于w (有效氯)的提高,高温不利于得到合格产品。
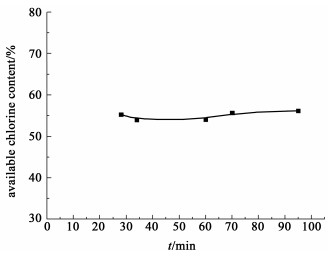
2.4 反应时间对产物w (有效氯)的影响选定表 3中No.8~No.12的实验条件:NaClO浓度(18%左右)、原料物质的量之比(NaClO过量12%~15%)、氯化温度(10 ℃左右)、干燥方法(25 ℃,绝对压力6.7×10-2 Pa下真空干燥)等不变,考察氰氯化反应时间对产品w (有效氯)的影响,结果见图 3所示。
|
| 图 3 反应时间对产品w(有效氯)的影响 Fig.3 Influence of reaction time on the available chlorine content of DCCNa product |
| |
图 3的结果表明:Cl2通入30 min后,产物的w(有效氯,含结晶水)达到56%,其中No.12通氯95 min,产物的w(有效氯)也未发生明显变化。这是因为氰尿酸与高浓度NaClO快速地合成了二氯异氰尿酸钠,残留的NaClO较少,不存在NaClO制备过程过量通入Cl2产生的式(9)~式(15)的副反应,Cl2通入时间对最终产物的有效氯影响较小。
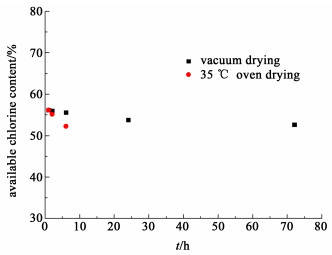
2.5 干燥方式对产物w (有效氯)的影响对同一组实验分别取样,放置于35 ℃的通风干燥烘箱和常温下的真空干燥器,考察干燥方式对产品w (有效氯)的影响,结果见图 4所示。
|
| 图 4 w (有效氯)与干燥时间的关系 Fig.4 Relationship between available chlorine content and drying time |
| |
图 4的结果表明:在35 ℃下通风烘箱干燥10 h后,w (有效氯)下降明显;置于低压环境(25 ℃,绝对压力6.7×10-2 Pa)的干燥器中,抽真空干燥3 d后,产物的w (有效氯)仅下降1%左右。真空操作更有利于产品的干燥。
3 结论采用氰尿酸、NaOH和Cl2为原料,通过NaOH和Cl2反应制得的高浓度NaClO,再和氰尿酸反应合成二氯异氰尿酸钠,考察了原料的加料方式、溶液pH值、反应温度、反应时间和干燥方式对二氯异氰尿酸钠产物w(有效氯)的影响。结果表明,反应温度10 ℃左右,先用30%NaOH溶液通Cl2至溶液呈弱碱性,再加入等量40%的NaOH溶液并继续通Cl2至溶液呈弱碱性可制得18%左右的高浓度NaClO溶液。而后再与氰尿酸在通入Cl2条件下氯化合成二氯异氰尿酸钠,其干品w (有效氯)可达62%左右,氯化阶段的通氯时间对产物w(有效氯)影响不大;真空操作更有适合于产物的干燥。
| [1] |
朱传俊, 白莹, 李琳, 等. 二氯异氰尿酸钠产品的质量检验[J]. 化工标准·计量·质量, 2005(4): 10-12, 45. Zhu Chuanjun, Bai Ying, Li Lin, et al. The production quality test of sodium dichloro-iso-cyanurate[J]. Chemical Industry Standard·Measurement·Quality, 2005(4): 10-12, 45. (in Chinese) |
| [2] |
许延峰. 二氯异氰尿酸钠的生产与应用[J]. 中国氯碱, 2002(2): 28-31. Xu Yanfeng. Production and application of sodium dichloroisocyanurate[J]. China Chlor-Alkali, 2002(2): 28-31. DOI:10.3969/j.issn.1009-1785.2002.02.011 (in Chinese) |
| [3] |
李玉芳. 二氯异氰尿酸钠的生产及应用[J]. 贵州化工, 2003, 28(1): 14-17. Li Yufang. Production and application of sodium dichloroisocyanurate[J]. Guizhou Chemical Industry, 2003, 28(1): 14-17. DOI:10.3969/j.issn.1008-9411.2003.01.004 (in Chinese) |
| [4] |
付永宽, 邓玫梅. 高浓度次氯酸钠生产二氯异氰尿酸钠试验[J]. 氯碱工业, 1996, 32(4): 24-25. Fu Yongkuan, Deng Meimei. Production of sodium dichloro-iso-cyanurate with high concentration sodium hypochlorite[J]. Chlor-Alkali Industry, 1996, 32(4): 24-25. (in Chinese) |
| [5] |
卢晓翠. 碘量法测定二氯异氰脲酸钠有效氯含量[J]. 第一军医大学学报, 2000, 20(4): 314-315. Lu Xiaocui. Determination of available chlorine content of sodium dichloro-iso-cyanurate by iodinetry[J]. Journal of First Military Medical University, 2000, 20(4): 314-315. DOI:10.3321/j.issn:1673-4254.2000.04.032 (in Chinese) |
| [6] |
冯湘波. 高浓度次氯酸钠生产工艺简介[J]. 陕西化工, 1994, 23(3): 41-42. Feng Xiangbo. Brief introduction of production process of high concentration sodium hypochlorite[J]. Shaanxi Chemical Industry, 1994, 23(3): 41-42. (in Chinese) |
| [7] |
雍丽珠, 孙秀武, 吴宗华. 高浓度次氯酸钠水溶液的制备及其稳定性能的探讨[J]. 中国氯碱, 2004(1): 13-15. Yong Lizhu, Sun Xiuwu, Wu Zonghua. Preparation of high-density sodium hypochlorite aqueous solution and investigation of its stability[J]. China Chlor-Alkali, 2004(1): 13-15. DOI:10.3969/j.issn.1009-1785.2004.01.005 (in Chinese) |
| [8] |
蔡跃, 付晔, 李琰, 等. 含氯消毒剂有效氯测定方法探讨[J]. 中国卫生检验杂志, 2009, 19(12): 2815-2816. Cai Yue, Fu Ye, Li Yan, et al. Discussion on method for detection of available chlorine in chlorine-containing disinfectant[J]. Chinese Journal of Health Laboratory Technology, 2009, 19(12): 2815-2816. (in Chinese) |
| [9] |
牛晓雯, 常晓玲. 漂液中有效氯含量检测方法的改进[J]. 黑龙江造纸, 2007, 35(1): 58-60. Niu Xiaowen, Chang Xiaoling. Rationality of the improvement of efficient chlorine content measurement in bleaching liquid[J]. Heilongjiang Pulp & Paper, 2007, 35(1): 58-60. DOI:10.3969/j.issn.1673-0283.2007.01.024 (in Chinese) |
| [10] |
郭杰, 王平生, 张俊杰. 三氯异氰尿酸和二氯异氰尿酸钠联产新工艺技术研究[J]. 煤炭与化工, 2015, 38(4): 74-77. Guo Jie, Wang Pingsheng, Zhang Junjie. New technology research on cogeneration of TCCA and SDIC[J]. Hebei Chemical Industry, 2015, 38(4): 74-77. (in Chinese) |
| [11] |
许静.氰尿酸及其氯代衍生物的合成与研究[D].南京: 南京林业大学, 2003 Xu Jing. Study on production process of cyanuric acid and trichloroisocyanuric acid[D]. Nanjing: Nanjing Forestry University, 2003(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10298-2003082975.htm |
 2019, Vol. 36
2019, Vol. 36





