能源和环境是21世纪人类所需要面临的2个重大的问题,新能源的开发和资源综合回收利用是人类可持续发展的基础和方向。近年来,锂离子电池由于质量轻、体积小、自放电小、无记忆效应、工作温度范围宽、可快速充放电、使用寿命长和环保[1]等优势得到了广泛的应用。最早Whittingham[2-3]利用Li-TiS体系制成首个锂电池,到1990年实现商业化[4],至今已发展四十余年,取得了很大的进步。据统计,2017年1~10月中国锂离子电池累计产量为89.9亿只,累计增长率达34.6%。国际上,锂离子电池在航天电源领域的应用已进入工程化应用阶段,全球一些公司和军事部门对应用于航天的锂离子电池进行了研发[5-9],如美国的“国家航空和航天管理局”(NASA)、Eagle-Picher电池公司、法国的SAFT公司和日本的JAXA公司等。
随着锂离子电池的广泛应用,废旧电池的数量越来越多。预期在2020年前后,我国仅纯电动(含插电式)乘用车和混合动力乘用车动力电池的累计报废量将达到12~17万t[10]。锂电池虽被称为“绿色电池”,不含有Hg和Pb等有害元素,但其正极材料、电解质溶液等会对环境造成很大的污染,同时造成资源的浪费。因此,综述国内外废旧锂电池回收处理的工艺现状,并在此基础上总结废旧锂离子电池回收工艺的发展方向,具有十分重要的现实意义。
1 锂离子电池的主要成分锂离子电池主要成分包含外壳、电解液、阳极材料、阴极材料、胶黏剂、铜箔和铝箔等。其中,Co、Li和Ni质量分数分别为5.0%~15.0%、2.0%~7.0%、0.5%~2.0%,还有Al、Cu和Fe等金属元素;从主要成分价值占比来看,阳极材料和阴极材料约占33%和10%,电解液和隔膜分别约占12%和30%。废旧锂离子电池中主要回收的金属是Co和Li,主要集中在阳极材料上的钴锂膜上。尤其是我国钴资源相对贫乏,开发利用较为困难,而在锂离子电池中钴的质量分数约为15%[11],是伴生钴矿的850倍左右。
目前,以LiCoO2为正极材料的锂离子电池应用较为广泛,其中含有钴酸锂、六氟磷酸锂、有机碳酸酯、碳素材料、铜和铝等化学物质,主要金属含量如表 1所示。
采用湿法工艺处理废旧锂离子电池是目前研究较多且较为成熟的工艺,工艺流程如图 1所示。主要经历3个阶段:1)将回收的废旧锂离子电池进行彻底放电、简单的拆分破碎等预处理,筛分后获得主要电极材料或破碎后经焙烧除去有机物后得到电极材料;2)将预处理后得到的电极材料溶解浸出,使各种金属及其化合物以离子的形式进到浸出液中;3)浸出液中有价金属的分离与回收,这一阶段是废旧锂电池处理过程的关键,也是多年来研究者们研究的重点与难点。目前,分离回收的方法主要有溶剂萃取法、沉淀法、电解法、离子交换法和盐析法等。
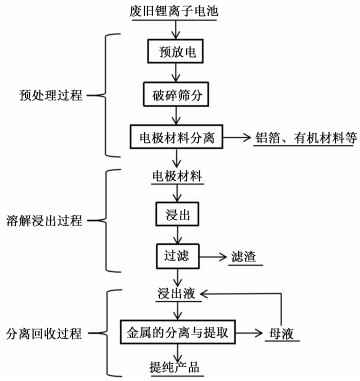
|
| 图 1 废旧锂离子电池湿法回收工艺流程图 Fig.1 Flowchart of recovery in wet process for spent lithium ion batteries |
| |
废旧锂离子电池中大都残余部分电量,在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放出大量的热量,可能会造成安全隐患等不利影响。
废旧锂电池的放电方式可以分为2种,分别是物理放电和化学放电。其中,物理放电为短路放电,通常利用液氮等冷冻液对其先进行低温冷冻,后穿孔强制放电。早期,美国Umicore[13]和Toxco[14]公司采用液氮对废旧锂电池进行低温(-198 ℃)放电,但这种方法对设备的要求较高,不适合大规模工业应用;化学放电是在导电溶液(多为NaCl溶液)中通过电解的方式释放残余能量。早期,南俊民等[15]将单体废旧锂电池置于有水和电子导电剂的钢制容器中进行放电,但由于锂离子电池的电解液中含有LiPF6,与水接触后会反应生成毒性很强的HF[16],给环境和操作人员带来危害,故需要在放电后立即对其进行碱浸。近年来,宋秀玲等[17]利用抗坏血酸的酸性、还原性及稳定性构建了化学性质相对温和的硫酸盐溶液放电体系,确定了最适宜放电条件为:电解液MnSO4浓度0.8 mol/L、pH=2.78、抗坏血酸的浓度2 g/L,放电时间8 h,最终消电电压降低到0.54 V,满足绿色高效的放电要求。相较而言,化学放电成本更低,操作简单,可满足工业大规模放电的应用,但电解液对金属壳体及设备的腐蚀,会在放电流程中带来不利影响。
2.1.2 破碎分离破碎分离的过程主要是为了将电极材料与其它物质(有机物等)在机械作用下通过多级破碎、筛选等分离技术联用,实现电极材料的分离富集,以便于后续利用火法、湿法等工艺从中回收有价金属及化合物。机械分离法是目前普遍采用的预处理方法之一,易于实现废旧锂离子电池大规模工业化回收处理。Shin等[18]通过粉碎、筛分、磁选、精细粉碎和分类的工序以达到LiCoO2的分离富集。结果表明,在较好的条件下可以提高目标金属的回收率,但由于锂电池结构复杂,通过该方法很难将各组分彻底分开;Li等[19]采用了一种新型的机械分离方法,提高了Co的回收效率,同时降低了能耗与污染。对于拆分出的电极材料,在55 ℃水浴中使用超声波进行冲洗和搅拌10 min,结果使得92%的电极材料与集流体金属分离。同时,集流体可以以金属的形式进行回收。
2.1.3 热处理热处理的过程主要是为了除去废旧锂电池中难溶的有机物、碳粉等,以及分离电极材料和集流体。目前采用的热处理方式多为高温常规热处理,但存在分离深度低、环境污染等问题,为进一步改善工艺,近年来,对高温真空热解法的研究越来越多。Sun等[20]采用高温真空热解的方法将废旧电池材料在粉碎之前于真空炉中进行热解,以10 ℃·min-1的速度升温至600 ℃后恒温30 min,有机物以小分子液体或气体的形式分解,可单独收集后用于化学原料,同时,经高温热解后,LiCoO2层变得疏松,易于从铝箔上分离,有利于最终无机金属氧化物的有效分离富集;孙亮[21]采用真空热解的方法预处理废旧锂离子电池正极材料。结果表明,当体系压强低于1.0 kPa,反应温度600 ℃,反应时间30 min时,有机黏结剂可以被基本除去,正极活性物质大部分从铝箔上脱落分离,铝箔保持完好。
相较于常规热处理技术,高温真空热解法可单独回收有机物,提高资源综合利用率,同时可以避免有机材料分解后产生的有毒气体对环境造成污染,但对其设备要求高、操作复杂,工业化推广具有一定的局限性。
2.1.4 溶解法溶解法是根据“相似相溶”的原理,利用正极材料与黏结剂(多为PVDF)、铝箔等杂质在有机溶剂中的溶解性的差异实现分离富集。常选取强极性有机溶剂溶解电极上的PVDF,使正极材料从集流体铝箔上脱落。梁立君[22]选取多种极性有机溶剂对破碎后的正极材料进行溶解分离对比实验,发现最佳溶剂为N-甲基吡咯烷酮(NMP),在最适宜条件下可以使正极材料活性物质LiFePO4及碳的混合物与铝箔彻底分离;Hanisch等[23]采用溶解法对热处理和机械压力分离及筛分过程后的电极进行彻底的分选。将电极在90 ℃下置于NMP中处理10~20 min,重复6次后,电极材料中的黏结剂可以完全溶解,分离效果较为彻底。
溶解法相较于其它前处理方法,操作简单,同时可以有效提高分离效果及回收速率,工业化应用前景较好。目前,黏结剂多采用NMP溶解分离,效果较好,但其价格较高、易挥发等不足在一定程度上限制了其在工业上的推广应用。
2.2 电极材料的溶解浸出溶解浸出过程是对预处理后得到的电极材料进行溶解浸出,使电极材料中的金属元素以离子的形式进入到溶液中,然后通过各种分离技术选择性分离回收其中的主要有价金属Co和Li等。溶解浸出的方法主要包括化学浸出和生物浸出法。
2.2.1 化学浸出传统的化学浸出方法是通过酸浸或碱浸的方式实现电极材料的溶解浸出,主要包括一步浸出法和两步浸出法。
一步浸出法通常采用无机酸HCl、HNO3和H2SO4等作为浸出剂对电极材料直接溶解浸出,但这种方法会产生Cl2和SO2等有害气体,故需要进行尾气处理。研究发现,在浸出剂中加入H2O2和Na2S2O3等还原剂,可有效解决这一问题,同时Co3+被还原成更易于溶解到浸出液中的Co2+,从而提高浸出率。潘晓勇等[24]采用H2SO4-Na2S2O3体系浸出电极材料,分离回收Co和Li。结果表明,H+浓度3 mol/L、Na2S2O3浓度0.25 mol/L、液固比15:1,90 ℃下反应2.5 h,Co和Li的浸出率高于97%;陈亮等[25]采用H2SO4+H2O2为浸出剂对活性物质进行浸出。结果表明:液固比10:1、H2SO4浓度2.5 mol/L、H2O2加入量2.0 mL/g(粉料)、温度85 ℃、浸出时间120 min条件下,Co、Ni和Mn的浸出率分别达到97%、98%和96%;陆修远等[26]采用H2SO4+还原剂体系浸出废旧高镍型锂离子电池正极材料(LiNi0.6Co0.2Mn0.2O2),研究了不同还原剂(H2O2、葡萄糖及Na2SO3)对金属浸出效果的影响。结果表明:在最适宜条件下,采用H2O2作为还原剂,主要金属的浸出效果最好,Li、Co、Ni和Mn的浸出率分别为100%、96.79%和98.62%、97%。综合看来,采用酸-还原剂作为浸出体系,相较于直接酸浸,因浸出率更高、反应速率更快等优点已成为目前工业上处理废旧锂离子电池的主流浸出工艺。
两步浸出法是将废旧锂电池经过简单预处理后先进行碱浸出,使Al以NaAlO2的形式进入到溶液中,之后加入浸出酸,并在其中加入还原剂H2O2或Na2S2O3做为浸出液,得到的浸出液通过调节pH值,选择性沉降Al和Fe并分别回收,将所获得的母液进一步进行Co和Li元素的提取和分离。邓朝勇等[27]采用10% NaOH溶液进行碱浸,Al浸出率为96.5%,用2 mol/L的H2SO4和30%H2O2进行酸浸,Co浸出率为98.8%。浸出原理如下:
| $ \begin{array}{*{20}{l}} {2{\rm{LiCo}}{{\rm{O}}_2} + 3{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} + {{\rm{H}}_2}{{\rm{O}}_2} \to }\\ {{\rm{L}}{{\rm{i}}_2}{\rm{S}}{{\rm{O}}_4} + 2{\rm{CoS}}{{\rm{O}}_4} + 4{{\rm{H}}_2}{\rm{O}} + {{\rm{O}}_2}} \end{array} $ | (1) |
将所获得的浸出液,经多级萃取等工艺,最终Co的回收率达到98%以上。该方法流程简单,易于操作,对设备腐蚀小,污染少。
2.2.2 生物浸出法随着技术的发展,生物冶金技术因其高效环保、成本低等优势有着更好的发展趋势及应用前景。生物浸出法是通过细菌的氧化作用,使金属以离子的形式进入到溶液。
近年来,有研究者研究了采用生物浸出法浸出废旧锂离子电池中的有价金属。Mishra等[28]采用无机酸和嗜酸菌酸氧化亚铁硫杆菌对废旧锂电池进行浸出,利用元素S和Fe2+作为能源,在浸出介质中产生H2SO4和Fe3+等代谢产物,利用这些代谢物溶解废旧锂离子电池中的金属。研究发现,Co的生物溶解速度比Li快。Fe2+可以促进生物菌生长繁殖,Fe3+与残留物中的金属共沉淀。较高的液固比,即金属浓度的增加,会抑制细菌的生长,不利于金属的溶解;Marcinčáková等[29]在2种不同介质下采用嗜酸细菌的聚生体对Li和Co进行生物浸出。富含营养的培养基由细菌生长所需的所有矿物质构成,低营养培养基以H2SO4和元素S作为能源。研究发现,在富营养环境中,Li和Co的生物浸出率分别为80%和67%;而在低营养环境中,仅溶解35.0%的Li和10.5%的Co。
生物浸出法相较于传统的酸-还原剂浸出体系,具有成本低、绿色环保等优势,但主要金属(Co和Li等)的浸出率相对较低,用于工业化大规模处理具有一定的局限性。
2.3 浸出液中有价金属元素的分离回收 2.3.1 溶剂萃取法溶剂萃取法是目前废旧锂电池金属元素分离回收应用较为广泛的工艺,其原理是利用有机溶剂与浸出液中的目标离子形成稳定的配合物,再采用适当的有机溶剂将其分离,从而提取目标金属及化合物。通常采用的萃取剂主要有Cyanex272、Acorga M5640、P507、D2EHPA和PC-88A等。
Swain等[30]研究了Cyanex 272萃取剂浓度对Co、Li分离的影响。结果表明,浓度在2.5~40.0 mol/m3范围内,Co的萃取率从7.15%增加到99.90%,Li的萃取率从1.36%增加到7.80%;浓度在40.0~75.0 mol/m3范围内,Co的萃取率基本不变,Li的萃取率迅速增加到18.00%;浓度高于75 mol/m3时,Co的分离因子随浓度增加而减小,最大分离因子为15 641。吴芳等[31]在两步法浸出后,采用萃取剂P204萃取净化浸出液,P507萃取分离Co和Li,后采用H2SO4反萃,回收后萃取液加入Na2CO3选择性回收Li2CO3。pH值为5.5时,Co和Li分离因子达到1×105,Co的回收率在99%以上;Kang等[32]从成分为5%~20%Co、5%~7%Li、5%~10%Ni、5%有机化学品和7%塑料的废旧锂离子电池中回收硫酸钴,对于Co浓度为28 g/L的浸出液,通过调节pH值至6.5沉降金属离子杂质如Cu、Fe和Al。然后通过Cyanex 272从纯化的水相中选择性地萃取Co,当pH<6时,Co/Li和Co/Ni的分离因子接近750,Co的总回收率约为92%。可以发现,萃取剂的浓度对萃取率有着较大的影响,同时通过控制萃取体系的pH值,可以实现主要金属(Co和Li)的分离。
在此基础上,采用混合萃取体系处理废旧锂离子电池,可以较好地实现主要金属离子的选择性分离回收[33-34]。Pranolo等[33]研究了一种混合萃取体系选择性回收了废旧锂离子电池浸出液中的Co和Li。结果表明,将2%(体积比)Acorga M5640添加到7%(体积比)Ionquest 801中,可以降低萃取Cu的pH值,通过控制体系pH值使Cu、Al、Fe先被萃取到有机相中,实现了与Co、Ni和Li的分离。然后将体系pH值控制在5.5~6.0,采用15%(体积比)的Cyanex 272将Co选择性萃取,萃取液中的Ni和Li可以忽略不计;张新乐等[35]采用酸浸-萃取-沉淀法回收废旧锂离子电池中的Co。结果表明,酸浸液pH值为3.5、萃取剂P507与Cyanex272体积比为1:1的条件下,经2级萃取,Co萃取率为95.5%。后续采用H2SO4反萃,反萃液pH值为4的条件下沉淀反应10 min,Co的沉淀率可达99.9%。
综合看来,溶剂萃取法具有能耗低、分离效果好等优点,酸浸-溶剂萃取法是目前工业上处理废旧锂电池的主流工艺,但对于萃取剂的选择以及萃取条件的进一步优化仍是当前该领域的研究重点,以达到更为高效环保、可循环处理的效果。
2.3.2 沉淀法沉淀法是将废旧锂离子电池预处理后,经溶解、酸溶后获得Co和Li溶液,加入沉淀剂沉降主要目标金属Co和Li等,从而达到金属的分离。
Sun等[36]采用H2C2O4作为浸出剂,同时将溶液中的Co离子以CoC2O4的形式沉淀出来,再通过加入沉淀剂NaOH和Na2CO3,将溶液中的Al和Li分别以Al(OH)3和Li2CO3的形式沉淀分离;潘晓勇等[24]采用NaOH将pH值调至5.0左右,能除去大部分Cu、Al、Ni,经进一步萃取除杂后,依次加入3%H2C2O4和饱和Na2CO3沉降CoC2O4和Li2CO3,Co回收率高于99%,Li回收率高于98%;李金惠等[37]将废旧锂离子电池预处理后筛选出粒径小于1.43 mm的物料与浓度为0.5~1.0 mol/L的H2C2O4按照固液比15~25 g/L反应40~90 min,得到CoC2O4沉淀物和Li2C2O4浸出液,最终CoC2O4和Li2C2O4的回收率超过99%。
沉淀法处理量大,主要金属的回收率较高,控制pH值可以实现金属的分离,易于实现工业化,但容易受杂质离子干扰,相较于萃取法产品纯度较低。因此,该工艺的关键在于选取选择性更好的沉淀剂以及进一步优化工艺条件,控制有价金属离子沉淀析出的顺序,从而提高产品的纯度。
2.3.3 电解法电解法回收废旧锂离子电池中的有价金属,是对电极材料浸出液中的金属离子采用化学电解的方式,使其被还原成单质或沉积物。该方法不需要添加其它物质,不易引入杂质,可以获得纯度较高的产品,但多种离子存在的情况下会发生共沉积,从而会降低产品纯度,同时会消耗较多的电能。
Myoung等[38]以HNO3处理过的废旧锂离子电池正极材料浸出液为原料,采用恒电位法回收钴。电解过程中,O2与NO3-发生还原反应,OH-浓度增加,在Ti阴极表面生成Co(OH)2,经热处理得到Co3O4。化学反应过程如下:
| $ 2{{\rm{H}}_2}{\rm{O}} + {{\rm{O}}_2} + 4{\rm{e}} \to 4{\rm{O}}{{\rm{H}}^ - } $ | (2) |
| $ {\rm{NO}}_3^ - + {{\rm{H}}_2}{\rm{O}} + 2{\rm{e}} \to {\rm{NO}}_2^ - + 2{\rm{O}}{{\rm{H}}^ - } $ | (3) |
| $ {\rm{C}}{{\rm{o}}^{3 + }} + {\rm{e}} \to {\rm{C}}{{\rm{o}}^{2 + }} $ | (4) |
| $ {\rm{C}}{{\rm{o}}^{2 + }} + 2{\rm{O}}{{\rm{H}}^ - }/{\rm{Ti}} \to {\rm{Co}}{({\rm{OH}})_2}/{\rm{Ti}} $ | (5) |
| $ 3{\rm{Co}}{({\rm{OH}})_2}/{\rm{Ti}} + 1/2{{\rm{O}}_2} \to {\rm{C}}{{\rm{o}}_3}{{\rm{O}}_4}/{\rm{Ti}} + 3{{\rm{H}}_2}{\rm{O}} $ | (6) |
Freitas等[39]采用恒电位和动电位技术从废旧锂电池正极材料中回收Co。结果表明:Co的电荷效率随着pH值增大而减小,pH=5.40、电位-1.00 V、电荷密度10.0 C/cm2时,电荷效率最大,达到96.60%。化学反应过程如下:
| $ {\rm{C}}{{\rm{o}}^{2 + }} + 2{\rm{O}}{{\rm{H}}^ - } \to {\rm{Co}}{({\rm{OH}})_2}({\rm{s}}) $ | (7) |
| $ {\rm{Co}}{({\rm{OH}})_2}({\rm{s}}) + 2{\rm{e}} \to {\rm{Co}}({\rm{s}}) + 2{\rm{O}}{{\rm{H}}^ - } $ | (8) |
离子交换法是利用Co和Ni等不同金属离子络合物在离子交换树脂上吸附能力的差异,实现金属的分离及提取。Feng等[40]采用离子交换法从正极材料H2SO4浸出液中分离回收Co。从浸出液pH值、循环次数等因素研究其对钴的回收率及与其它杂质分离的影响。结果表明,使用TP207树脂、控制浸出液pH=2.5、循环10次处理,Cu的去除率达到97.44%,钴的回收率达到90.2%。
该方法对目标离子的选择性较强,工艺简单且易于操作,为废旧锂电池中有价金属的提取、回收提供了新途径,但因成本较高而限制了工业化应用。
2.3.5 盐析法盐析法通过在废旧锂离子电池浸出液中加入饱和(NH4)2SO4溶液和低介电常数溶剂,从而降低浸出液的介电常数,使钴盐从溶液中析出。该方法工艺简单、易于操作且成本低,但在多种金属离子存在的条件下,伴随着其它金属盐的析出,从而会降低产品的纯度。
金玉健等[41]根据电解质溶液现代理论,利用盐析法回收废旧锂离子电池中的有价金属。在从LiCoO2为正极的HCl浸出液中加入饱和(NH4)2SO4水溶液和无水乙醇,当浸出液、饱和(NH4)2SO4水溶液和无水乙醇的体积比为2:1:3时,Co2+的析出率可达到92%以上。所得盐析产品为(NH4)2Co(SO4)2和(NH4)Al(SO4)2,采用分段盐析可使这两种盐分离,从而得到不同的产品。
对于废旧锂离子电池浸出液中有价金属的提取与分离,以上是目前研究较多的几种方法。综合考虑处理量、运行成本、产品纯度及二次污染等因素,表 2总结对比了前文所述的几种金属分离提取的技术方法。
| 技术方法 | 优缺点 | 二次污染分析 |
| 溶剂萃取法 | 处理量一般,运行消耗较高,分离效果好,回收率、产品纯度高 | 有机、无机废液,萃取剂的处理等 |
| 沉淀法 | 处理量大、运行消耗低,产品纯度低 | 无机废料、废液等 |
| 电解法 | 处理量大,回收率较高,产品纯度高,能耗高 | 废液、废气及电解废渣等 |
| 离子交换法 | 处理量一般,操作简单,运行成本高,回收率相对不高 | 无机废液、树脂的处理等 |
| 盐析法 | 处理量大,操作简单,成本低,回收率及产品纯度不高 | 无机废料、废液等 |
目前,锂离子电池在电动能源等方面的应用愈加广泛,废旧锂离子电池数目不容小觑,对废旧锂离子电池中有价金属的回收具有重要的现实意义。现阶段废旧锂离子电池回收工艺主要是前处理-浸出-湿法回收。前处理包括对废旧锂电池进行放电、破碎及电极材料的分离富集等。其中,溶解法操作简单,同时可以有效提高分离效果及回收速率,但目前采用的主要溶剂(NMP)价格昂贵,一定程度上限制了工业化的应用,故寻找更为适合的溶剂是该领域值得研究的方向之一。浸出过程主要是以酸-还原剂作为浸出剂,可以获得较好的浸出效果,但会产生无机废液等二次污染,而生物浸出法具有高效、环保及低成本等优势,但存在主要金属的浸出率相对较低的问题,对于生物菌的选择及浸出条件的优化从而提高浸出率,可能会成为未来浸出过程的研究方向之一。
湿法回收浸出液中的有价金属是废旧锂离子电池回收过程的关键环节,也是近年来研究的重点和难点,主要的方法有溶剂萃取法、沉淀法、电解法、离子交换法和盐析法等。其中,溶剂萃取法是目前应用较多的方法,具有污染小、能耗低、分离效果好及产品纯度高等显著优势,选择和研发更为高效廉价的萃取剂从而有效降低运行成本,以及多种萃取剂协同萃取的进一步探究可能是该领域重点研究的方向之一。另外,沉淀法因其回收率高、成本低、处理量大等优点,也是值得重点研究的另一个方向。现阶段沉淀法存在的主要问题是产品纯度低,因此,对于沉淀剂的选择及工艺条件的优化,控制有价金属离子沉淀析出的顺序,从而提高产品纯度将会有较好的工业化应用前景。同时,在废旧锂离子电池处理过程中,不可避免会产生废液、废渣等二次污染,在资源化最大程度利用的同时要将二次污染的危害降至最低,以实现废旧锂离子电池绿色环保、高效及低成本回收。
| [1] |
Wu Z, Ren W, Wen L, et al. Graphene anchored with Co3O4 nanoparticles as anode of lithium ion batteries with enhanced reversible capacity and cyclic performance[J]. ACS Nano, 2010, 4(6): 3187-3194. DOI:10.1021/nn100740x |
| [2] |
Whittingham M S. Chalcogenide battery: US, 19760673696[P]. 1977-02-22
|
| [3] |
Whittingham M S. Electrical energy storage and intercalation chemistry[J]. Science, 1976, 192(4244): 1126-1127. DOI:10.1126/science.192.4244.1126 |
| [4] |
Nagaura T, Tozawa K. Lithium ion rechargeable battery[J]. Prog Batteries Solar Cells, 1990, 9: 209-217. |
| [5] |
Slimm M, Spurrett R, Thwaite C, et al. Lithium-Ion batteries for space[J]. Space Power, 2002, 502(416): 477-482. |
| [6] |
Isaacson M J, Teofilo V L. Lithium ion aerospace batteries[C]//Seventeenth Annual Battery Conference on Applications and Advances. Proceedings of Conference (Cat. No.02TH8576), Seventeenth Annual Battery Conference on Applications and Advances, Long Beach, CA, USA, 2002
|
| [7] |
Marsh R A, Vukson S, Surampudi S, et al. Li ion batteries for aerospace applications[J]. Journal of Power Sources, 2001, 97/98: 25-27. DOI:10.1016/S0378-7753(01)00584-5 |
| [8] |
Bruce G C, Marcoux L. Large lithium ion batteries for aerospace and aircraft applications[J]. IEEE Aerospace and Electronic Systems Magazine, 2001, 16(9): 24-28. DOI:10.1109/62.949533 |
| [9] |
Martin C T, Kelly C O, Friend H D, et al. Lithium-Ion battery development at Eagle-Picher[C]//Fourteenth Annual Battery Conference on Applications and Advances. Proceedings of the Conference (Cat. No.99TH8371), Fourteenth Annual Battery Conference on Applications and Advances. Proceedings of the Conference (Cat. No.99TH8371), Long Beach, CA, USA, January 12-15, 1999
|
| [10] |
黎宇科. 有效利用并完善我国车用动力电池回收体系[J]. 低碳世界, 2012(3): 30-31. Li Yuke. Effectively using and perfecting the vehicle battery recovery system in China[J]. Low Carbon World, 2012(3): 30-31. (in Chinese) |
| [11] |
金玉健, 梅光军, 李树元. 废旧锂离子电池回收利用的研究现状[J]. 再生资源研究, 2005(6): 22-25. Jin Yujian, Mei Guangjun, Li Shuyuan. Current study status on recycling of spent lithium-ion batteries[J]. Recycling Research, 2005(6): 22-25. (in Chinese) |
| [12] |
欧秀芹, 孙新华, 程耀丽. 废锂离子电池的综合处理方法[J]. 天津化工, 2002, 16(4): 35-36. Ou Xiuqin, Sun Xinhua, Cheng Yaoli. Comprehensive treatment of the waste lithium batteries[J]. Tianjin Chemical Industry, 2002, 16(4): 35-36. DOI:10.3969/j.issn.1008-1267.2002.04.018 (in Chinese) |
| [13] |
Hagelüken C. Recycling of electronic scrap at Umicore's integrated metals smelter and refinery[J]. World of Metallurgy-Erzmetall, 2006, 59(3): 152-161. |
| [14] |
Cardarelli F, Dube J. Method for recycling spent lithium metal polymer rechargeable batteries and related materials: US, 20030129112[P]. 2007-03-20
|
| [15] |
南俊民, 韩东梅, 崔明, 等. 溶剂萃取法从废旧锂离子电池中回收有价金属[J]. 电池, 2004, 34(4): 309-311. Nan Junmin, Han Dongmei, Cui Ming, et al. Recycling of valuable metal from spent Li-ion batteries by solvent extraction[J]. Battery Bimonthly, 2004, 34(4): 309-311. DOI:10.3969/j.issn.1001-1579.2004.04.029 (in Chinese) |
| [16] |
郑洪河, 徐仲榆. 非水电解液中LiPF6的光化学不稳定性[J]. 电池, 2004, 34(1): 4-6. Zheng Honghe, Xu Zhongyu. Photochemical instability of LiPF6 in non-aqueous electrolytes[J]. Battery Bimonthly, 2004, 34(1): 4-6. DOI:10.3969/j.issn.1001-1579.2004.01.002 (in Chinese) |
| [17] |
宋秀玲, 戴书琪, 徐永胜, 等. 废旧锂离子电池放电的实验研究[J]. 应用化工, 2015, 44(4): 594-597. Song Xiuling, Dai Shuqi, Xu Yongsheng, et al. Experimental study on the discharge of the waste lithium ion battery[J]. Applied Chemical Industry, 2015, 44(4): 594-597. (in Chinese) |
| [18] |
Shin S M, Kim N H, Sohn J S, et al. Development of a metal recovery process from Li-ion battery wastes[J]. Hydrometallurgy, 2005, 79(3/4): 172-181. |
| [19] |
Li J, Shi P, Wang Z, et al. A combined recovery process of metals in spent lithium-ion batteries[J]. Chemosphere, 2009, 77(8): 1132-1136. DOI:10.1016/j.chemosphere.2009.08.040 |
| [20] |
Sun L, Qiu K Q. Vacuum pyrolysis and hydrometallurgical process for the recovery of valuable metals from spent lithium-ion batteries[J]. Journal of Hazardous Materials, 2011, 194: 378-384. DOI:10.1016/j.jhazmat.2011.07.114 |
| [21] |
孙亮.废旧锂离子电池回收利用新工艺的研究[D].长沙: 中南大学, 2012 Sun Liang. A novel reclamation process for spent lithium-ion batteries[D]. Changsha: Central South University, 2012(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10533-1012476055.htm |
| [22] |
梁立君.废旧锂离子电池正极材料LiFePO4的回收及合成的研究[D].辽宁大连: 大连交通大学, 2012 Liang Lijun. Study on recovery and synthesis of LiFePO4 cathode materials for spent lithium ion batteries[D]. Liaoning Dalian: Dalian Jiaotong University, 2012(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10150-1013523165.htm |
| [23] |
Hanisch C, Haselrieder W, Kwade A. Recovery of active materials from spent lithium-ion electrodes and electrode production rejects[M]//Hanisch C, Haselrieder W, Kwade A. eds. Glocalized Solutions for Sustainability in Manufacturing. Berlin, Heidelberg: Springer Berlin Heidelberg, 2011
|
| [24] |
潘晓勇, 彭玲, 陈伟华, 等. 废旧锂离子电池中钴和锂的回收及综合利用[J]. 中国有色金属学报, 2013, 23(7): 2047-2054. Pan Xiaoyong, Peng Ling, Chen Weihua, et al. Recovery of Co and Li from spent lithium-ion batteries and their comprehensive utilization[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(7): 2047-2054. (in Chinese) |
| [25] |
陈亮, 唐新村, 张阳, 等. 从废旧锂离子电池中分离回收钴镍锰[J]. 中国有色金属学报, 2011, 21(5): 1192-1198. Chen Liang, Tang Xincun, Zhang Yang, et al. Separation and recovery of Ni, Co and Mn from spent lithium-ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(5): 1192-1198. (in Chinese) |
| [26] |
陆修远, 张贵清, 曹佐英, 等. 采用硫酸-还原剂浸出工艺从废旧锂离子电池中回收LiNi0.6Mn0.2Co0.2O2[J]. 稀有金属与硬质合金, 2017(6): 14-23. Lu Xiuyuan, Zhang Guiqing, Cao Zuoying, et al. Recovery of LiNi0.6Mn0.2Co0.2O2 from spent lithium ion batteries by leaching with H2SO4 and reductants[J]. Rare Metals and Cemented Carbides, 2017(6): 14-23. (in Chinese) |
| [27] |
邓朝勇, 张谊, 杨茂麟, 等. 硫酸-双氧水浸出废旧锂离子电池中的钴[J]. 电池, 2011, 41(3): 170-171. Deng Chaoyong, Zhang Yi, Yang Maolin, et al. Leaching cobalt from spent Li-ion battery by sulfuric acid-hydrogen peroxide[J]. Battery Bimonthly, 2011, 41(3): 170-171. DOI:10.3969/j.issn.1001-1579.2011.03.016 (in Chinese) |
| [28] |
Mishra D, Kim D J, Ralph D E, et al. Bioleaching of metals from spent lithium ion secondary batteries using Acidithiobacillus Ferrooxidans[J]. Waste Management, 2008, 28(2): 333-338. DOI:10.1016/j.wasman.2007.01.010 |
| [29] |
Marcinčáková R, Kaduková J, Mražíková A, et al. Metal bioleaching from spent lithium-ion batteries using acidophilic bacterial strains[J]. Inzynieria Mineralna, 2016, 17(1): 117-120. |
| [30] |
Swain B, Jeong J, Lee J C, et al. Separation of Co(Ⅱ) and Li(Ⅰ) by supported liquid membrane using Cyanex 272 as mobile carrier[J]. Journal of Membrane Science, 2007, 297(1/2): 253-261. |
| [31] |
吴芳. 从废旧锂离子二次电池中回收钴和锂[J]. 中国有色金属学报, 2004, 14(4): 697-701. Wu Fang. Recovery of cobalt and lithium from spent lithium-ion secondary batteries[J]. The Chinese Journal of Nonferrous Metals, 2004, 14(4): 697-701. DOI:10.3321/j.issn:1004-0609.2004.04.031 (in Chinese) |
| [32] |
Kang J, Senanayake G, Sohn J, et al. Recovery of cobalt sulfate from spent lithium ion batteries by reductive leaching and solvent extraction with Cyanex 272[J]. Hydrometallurgy, 2010, 100(3/4): 168-171. |
| [33] |
Pranolo Y, Zhang W, Cheng C Y. Recovery of metals from spent lithium-ion battery leach solutions with a mixed solvent extractant system[J]. Hydrometallurgy, 2010, 102(1/2/3/4): 37-42. |
| [34] |
Zhao J, Shen X, Deng F, et al. Synergistic extraction and separation of valuable metals from waste cathodic material of lithium ion batteries using Cyanex272 and PC-88A[J]. Separation and Purification Technology, 2011, 78(3): 345-351. DOI:10.1016/j.seppur.2010.12.024 |
| [35] |
张新乐, 徐金球, 张晓琳. 酸浸-萃取-沉淀法回收废锂离子电池中的钴[J]. 化工环保, 2016, 36(3): 326-331. Zhang Xinle, Xu Jinqiu, Zhang Xiaolin. Recovery of cobalt from spent lithium ion batteries by acid leaching-extraction-precipitation process[J]. Environmental Protection of Chemical Industry, 2016, 36(3): 326-331. DOI:10.3969/j.issn.1006-1878.2016.03.018 (in Chinese) |
| [36] |
Sun L, Qiu K. Organic oxalate as leachant and precipitant for the recovery of valuable metals from spent lithium-ion batteries[J]. Waste Management, 2012, 32(8): 1575-1582. DOI:10.1016/j.wasman.2012.03.027 |
| [37] |
李金惠, 曾现来, 申冰玉, 等.一种以草酸为提取液的废锂离子电池回收处理方法及装置: CN, 103594754A[P]. 2014-02-19
|
| [38] |
Myoung J, Jung Y, Lee J, et al. Cobalt oxide preparation from waste LiCoO2 by electrochemical-hydrothermal method[J]. Journal of Power Sources, 2002, 112(2): 639-642. DOI:10.1016/S0378-7753(02)00459-7 |
| [39] |
Freitas M B J G, Garcia E M. Electrochemical recycling of cobalt from cathodes of spent lithium-ion batteries[J]. Journal of Power Sources, 2007, 171(2): 953-959. DOI:10.1016/j.jpowsour.2007.07.002 |
| [40] |
冯佳, 章骅, 邵立明, 等. 废旧锂离子电池中钴的离子交换法回收[J]. 环境卫生工程, 2008, 16(6): 1-3. Feng Jia, Zhang Hua, Shao Liming, et al. Cobalt recovery from lithium-ion battery by ion-exchange method[J]. Environmental Sanitation Engineering, 2008, 16(6): 1-3. DOI:10.3969/j.issn.1005-8206.2008.06.001 (in Chinese) |
| [41] |
金玉健, 梅光军, 李树元. 盐析法从锂离子电池正极浸出液中回收钴盐的研究[J]. 环境科学学报, 2006, 26(7): 1122-1125. Jin Yujian, Mei Guangjun, Li Shuyuan. Study on cobaltous recovery from cathode leachate of lithium-ion battery by salting out[J]. Acta Scientiae Circumstantiae, 2006, 26(7): 1122-1125. DOI:10.3321/j.issn:0253-2468.2006.07.013 (in Chinese) |
 2019, Vol. 36
2019, Vol. 36





