2. 山东新时代药业有限公司, 山东 临沂 273400
2. Shandong New Time Pharmaceutical CO., LTD., Shandong Linyi 273400, China
二氧化硫(SO2)是大气的主要污染物之一,SO2会对动植物和建筑物造成危害,还会造成酸雨、土壤酸化等现象。烟气脱硫(FGD)能有效减少烟气中SO2的排放,同时也能显著减少CO2的排放。当前,应用较多的烟气脱硫技术主要有湿法、干法及半干法脱硫,其原理都是将脱硫剂与SO2发生化学反应后,将气态SO2转移至固态的生成物当中,但是这些方法都存在显著的缺点,如湿法脱硫基建占地面积大、投资费用高,副产品石膏大多闲置堆放[1],附加价值较低,易造成二次污染;而干法、半干法脱硫技术则存在脱硫剂再生和更换费用较高以及脱硫效率低等问题。因此,开发可循环使用的环境友好型绿色脱硫剂是使烟气脱硫由传统污染治理模式转向消耗低、污染少、效益高的绿色循环经济型模式的重要途径,也是可持续发展的需要。
离子液体(ILs)作为环境友好型溶剂越来越受到国内外学者的关注[2],目前在气体污染治理领域将离子液体用于烟气中SO2的脱除也成为了研究的热点。作为脱硫,离子液体的优点显著[3]:1)不可燃,使用时较安全;2)具有可设计性,能设计出有效的脱硫剂;3)蒸气压低,难挥发,避免了传统的胺类吸收剂具有的易挥发、易损失等缺点;4)可再生,可重复利用,解吸出的SO2可作为化工产品的硫源;5)无废渣、废水产生,工艺绿色化,避免了二次污染。目前已有许多学者对离子液体脱除SO2的性能进行了研究。张锁江等[4]通过实验合成离子液体并考察了其对SO2的吸收性能;Yang等[5]研究了富里酸对SO2的溶解性能。亦有学者通过分子模拟、量子化学模拟[6-7]等方法研究了离子液体对SO2的吸收性能。碱性离子液体[BMIM]OH具有合成简单、吸收效果明显的特点,用于SO2的脱除具有很好的应用前景。
本研究基于酸碱中和反应,合成了碱性离子液体[BMIM]OH,研究其对模拟烟气和纯SO2的溶解性能,以及温度对吸收性能的影响。为了提高吸收速率,降低成本,将离子液体负载在多孔硅胶上,研究了负载前后离子液体的循环吸收能力。
1 实验部分 1.1 实验原料和脱硫剂的制备溴代正丁烷,分析纯,上海山浦化工有限公司;N-甲基咪唑,99%(质量分数,下同),上海成捷化学有限公司;KOH,分析纯,国药集团化学试剂有限公司;N2,99.99%,SO2,99.99%,均为青岛合利气体有限公司。硅胶,450~650 m2·g-1,青岛海洋化工有限公司。[BMIM]OH按照文献[8]方法合成、纯化;负载离子液体的制备:先将硅胶在400 ℃下烘干2 h,然后称取[BMIM]OH 3.00 g溶于10.00 mL乙醇中,加入硅胶6.00 g,搅拌均匀,90 ℃将乙醇蒸发,然后将样品在80 ℃真空干燥箱中干燥24 h。
1.2 实验装置及方法吸收实验如图 1所示:将恒温水浴锅12调至所需温度,准确称量4.00 g [BMIM]OH离子液体于吸收管中,分别调节减压阀2和减压阀5使SO2和N2流量稳定,2种气体在缓冲瓶7中混合后通至NaOH溶液9中约30 min,待流量计示数稳定后,转动三通阀8使气体与NaOH溶液9之间的管路关闭,气体与吸收管11之间的管路连通,控制气体以稳定的流速鼓泡通至离子液体中以进行吸收实验。定时将吸收管从体系中小心移出并用电子天平(精确至0.01 g)称质量。称质量后再将吸收管连接至系统,继续吸收实验。重复以上操作,直到吸收管的质量恒定不变。吸收前后的质量变化即为SO2吸收量。

|
| 图 1 气体吸收的装置流程图 Fig.1 Device flow chart for gas absorption |
| |
解吸实验:将吸收饱和后的离子液体放入油浴锅中加热到设定的温度,定时称量吸收管的质量,直至恒质量为止。当吸收管达到恒质量时,向解吸后的离子液体中鼓入N2持续15 min,使吸收的SO2充分解吸,也可以使吸收管的温度快速降低,为下一次吸收循环实验做准备。解吸前后的质量变化即为SO2解吸量。解吸量与吸收量之比即为解吸率。平均解吸率为平均解吸SO2质量与平均吸收SO2质量之比。
负载后的离子液体在吸收SO2过程中,为了增大接触面积,将图 1中的吸收管11换成U型管,其它操作均与对纯SO2的吸收和解吸过程相同。
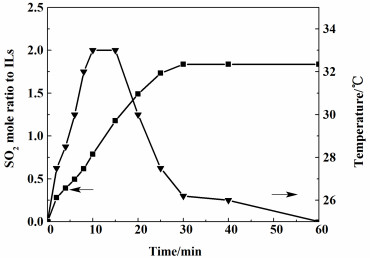
2 结果与讨论 2.1 离子液体对SO2的吸收研究对纯SO2的吸收,SO2的流速为80 mL·min-1,N2的流速为0 mL·min-1。以吸收时间为横坐标,分别以SO2在[BMIM]OH中的摩尔分数和离子液体体系的温度为纵坐标作图,得到SO2在离子液体中的吸收曲线, 如图 2所示。
|
| 图 2 0.1 MPa、25 ℃的SO2在离子液体中吸收的浓度变化和吸收温度变化 Fig.2 Concentration and temperature variation during absorption of SO2 in ILs at 0.1 MPa and 25 ℃ as a function of time |
| |
由图 2可知,[BMIM]OH对SO2的吸收非常迅速,在30 min内即可达到吸收平衡,1 mol ILs平衡吸收量为1.84 mol SO2。吸收过程中放热,温度变化类似抛物线,约15 min后达到最高温度,随后温度迅速下降。放热有2方面作用:1)抑制吸收(由图 3可知,低温有利于吸收,温度升高不利于吸收);2)由于在温度高时离子液体的黏度小,在吸收初期,放热能够降低[BMIM]OH的黏度,减小传质阻力,大大提高吸收速率。实验中可以观察到,随着吸收过程的进行,[BMIM]OH的黏度明显下降,这也使得吸收过程能够更快速进行。在吸收过程中还可观察到,[BMIM]OH由红棕色逐渐变浅并且呈现半透明状,吸收前后离子液体体积有很明显的变化,吸收后体积增加了约25%,这可能是由于SO2分子大于离子液体内部所能够提供的“空穴”,从而使得离子液体体积明显增加。

|
| 图 3 温度对离子液体吸收过程和解吸过程的影响 Fig.3 Influence of temperature on absorption and desorption processes of the ILs |
| |
离子液体的溶解性能可由其结构来解释。Dong等[9]和Liu等[10]分别研究得出,咪唑类离子液体含有的特殊阳离子结构很容易使阴阳离子之间形成氢键,进而在多个阴阳离子之间形成了氢键网络,从而在整个体系中形成了许多能够“容纳”CO2分子的“空穴”,使CO2分子“镶嵌”在其中,因此CO2在离子液体中溶解量较高。由此可推断,本实验中[BMIM]OH对SO2的溶解量较高也可能与其特殊结构有关。
2.2 离子液体对SO2的解吸研究图 3是[BMIM]OH在压力保持为0.1 MPa时,温度分别为25、40和50 ℃时进行吸收,然后在0.1 MPa和130 ℃条件下进行解吸(图 3中的箭头所示)的变化曲线图。
由实验结果可知,吸收过程受温度的影响很大,吸收量与吸收速率随着温度的升高均有所降低,这可能是因为随着温度升高SO2的解吸速率提高,特别是当高温时其解吸作用大于吸收作用,解吸速率更高一些,吸收的SO2有部分逸出,最终使得离子液体的吸收量有所下降。此外,由图 3可见,尽管离子液体在不同温度下吸收,但在相同条件解吸后,SO2的最终残留量相同,这说明解吸达到平衡态并不依赖于吸收条件,而是取决于解吸条件,主要是解吸温度。
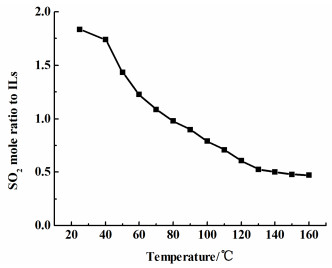
不同温度下的SO2在[BMIM]OH中的饱和吸收量与离子液体的物质的量之比如图 4所示。
|
| 图 4 温度对SO2解吸过程的影响 Fig.4 Effect of temperature on the SO2 desorption process |
| |
由于吸收过程为放热反应,而解吸过程为吸热反应,故解吸时饱和的离子液体能够吸收的热量越多,解吸SO2就越容易,解吸量也就越大。由图 4可知,[BMIM]OH的解吸量随着解吸温度的升高而增大,即温度越高解吸率就越大。当温度超过130 ℃时,SO2在[BMIM]OH中的溶解量随温度的变化已非常小,此时接近气液平衡。从经济性方面考虑,130 ℃是较适宜的解吸温度,即在保证解吸量足够的情况下可有效地降低解吸成本。
2.3 离子液体的循环吸收与解吸由图 3可看出低温有利于离子液体对SO2的吸收,而吸收的SO2能够在高温下解吸。因为吸收与解吸存在着平衡,所以[BMIM]OH在一定条件下吸收SO2后难以完全解吸。图 5表现的是离子液体在气压为0.1 MPa,温度分别为25和40 ℃时进行吸收,而后在130 ℃下进行解吸的循环吸收实验结果。

|
| 图 5 温度对离子液体循环吸收与解吸过程的影响 Fig.5 Effect of temperature on consecutive absorption and desorption of SO2 in recycled ILs |
| |
当温度为40 ℃时[BMIM]OH的循环吸收比在25 ℃时有所延长,但从第2次循环开始,其吸收能力比较稳定,降幅较小,6次循环的平均解吸率都较高,在25和40 ℃时分别为99.3%和96.5%,即6次循环平均每1 g[BMIM]OH可分别分离出0.60和0.40 g SO2,1 mol ILs中SO2物质的量分别为1.47和0.99 mol。说明吸收温度不仅对离子液体吸收的绝对量有影响,而且对离子液体的循环吸收能力有很大的影响。
在0.1 MPa,20 ℃下对模拟烟气进行吸收实验,以考察[BMIM]OH对模拟烟气的脱硫效果。为了减少影响因素,模拟烟气中不加入CO2,并用N2代替空气。模拟烟气中φ(SO2)为8%,混合前的气体流量分别为VN2=420 mL·min-1,VSO2=56 mL·min-1。结果如图 6所示。将其与对纯SO2的吸收结果相比,[BMIM]OH对模拟烟气的吸收量很低,从第2次循环开始,4次循环平均每1 g [BMIM]OH可分离出0.096 g SO2,即平均1 mol的[BMIM]OH可分离出0.23 mol SO2,大约是25 ℃下纯SO2吸收的1/6,这应该与SO2在模拟烟气中的分压低有关,平均解吸率为91.6%。同时,实验中通过称质量发现离子液体对纯N2的吸收量很小,每1 g [BMIM]OH大约能吸收0.01 g N2。

|
| 图 6 0.1 MPa,20 ℃时离子液体对模拟烟气的循环吸收与解吸 Fig.6 Consecutive absorption (0.1 MPa, 20 ℃) and desorption (0.1 MPa, 130 ℃) of simulated flue gas in recycled ILs |
| |
为了降低离子液体的黏度,提高传质速率,同时降低离子液体的成本,我们将离子液体负载在多孔硅胶上, 结果见图 7。

|
| 图 7 0.1 MPa,25 ℃时负载型[BMIM]OH对SO2的循环吸收与解吸循环过程 Fig.7 Consecutive absorption and desorption of SO2 in recycled supported ILs with time at 0.1 MPa and 25 ℃ |
| |
从图 7可以看出,负载后的[BMIM]OH具有很好的吸收能力,吸收过程在1.0~1.5 h内即达到平衡状态;从第2次循环开始,在4次循环中每1 g [BMIM]OH能够解吸出大约0.79 g SO2,1 mol ILs中SO2物质的量为1.92 mol。由于负载离子液体能够回收重复使用,4次循环的平均解吸率为96.6%,实验过程中可观察到,解吸过程中负载离子液体的硅胶由土黄色变成深红棕色,说明解吸效果好。
离子液体与SO2气体接触的表面积决定了纯离子液体和负载硅胶后的离子液体的吸收和解吸时间以及吸收与解吸的SO2量。
3 结论1) SO2在碱性离子液体[BMIM]OH中的溶解量很高,在0.1 MPa,25 ℃时大约30 min即可达到吸收平衡,1 mol ILs中SO2平衡吸收量达1.84 mol。
2) SO2在[BMIM]OH中的溶解量随着温度的升高而降低,不同温度下吸收、相同条件下解吸的离子液体中SO2的残留量取决于解吸条件。
3) 在0.1 MPa下,[BMIM]OH可进行循环的吸收和解吸,6次循环平均每1 g的[BMIM]OH可分离出SO2为0.60 g (25 ℃)和0.40 g(40 ℃),平均解吸率为99.3%(25 ℃)和96.5%(40 ℃)。
4) 在0.1 MPa,20 ℃下,[BMIM]OH对φ(SO2)为8%的模拟烟气的吸收,4次循环平均每1 g [BMIM]OH可分离出SO2为0.096 g,平均解吸率为91.6%。
5) 在0.1 MPa,25 ℃下,硅胶负载后的[BMIM]OH具有很好的循环吸收和解吸能力,4次循环中每1 g [BMIM]OH能够解吸出SO2大约0.79 g。4次循环的平均解吸率为96.6%。
同传统的脱硫剂相比,[BMIM]OH可以重复使用,吸收过程工艺绿色化,无废水和废渣产生,而且解吸的SO2还可作为硫源生产其它化工产品,有望作为可替代的脱硫剂用于工业中烟气SO2的脱除。
| [1] |
Tan E, Vnal S, Do AǧG an A, et al. New "wet type" electron beam flue gas treatment pilot plant[J]. Radiation Physics and Chemistry, 2016, 119: 109-115. DOI:10.1016/j.radphyschem.2015.10.007 |
| [2] |
Herrera C, de Carvalho Costa G, Atilhan M, et al. A theoretical study on aminoacid-based ionic liquids with acid gases and water[J]. Journal of Molecular Liquids, 2017, 225(1): 347-356. |
| [3] |
李建隆, 梁昌娟, 李红海. 离子液体脱除SO2技术的研究进展[J]. 化工进展, 2011, 30(2): 417-424. Li Jianlong, Liang Changjuan, Li Honghai. Research progress of ionic liquids desulfurization technology[J]. Chemical Industry and Engineering Progress, 2011, 30(2): 417-424. (in Chinese) |
| [4] |
Yuan X, Zhang S, Lu X. Hydroxyl ammonium ionic liquids:Synthesis, properties, and solubility of SO2[J]. Journal of Chemical & Engineering Data, 2007, 52(2): 596-599. |
| [5] |
Yang J, Hu G, Gao H. Influence of operating parameters on performance of SO2 absorption in fulvic acid solution[J]. Chemical Engineering Journal, 2016, 288(15): 724-738. |
| [6] |
Mohammadi M, Foroutan M. Molecular investigation of SO2 gas absorption by ionic liquids:Effects of anion type[J]. Journal of Molecular Liquids, 2014, 193(5): 60-68. |
| [7] |
Korotkevich A, Firaha D S, Padua A A H, et al. Ab initio molecular dynamics simulations of SO2 solvation in choline chloride/glycerol deep eutectic solvent[J]. Fluid Phase Equilibria, 2017, 448: 59-68. DOI:10.1016/j.fluid.2017.03.024 |
| [8] |
Ranu B C, Banerjee S. Ionic liquid as catalyst and reaction medium. the dramatic influence of a task-specific ionic liquid, [bmIm]OH, in michael addition of active methylene compounds to conjugated ketones, carboxylic esters, and nitriles[J]. Organic Letters, 2005, 7(14): 3049-3052. DOI:10.1021/ol051004h |
| [9] |
Dong K, Zhang S, Wang D, et al. Hydrogen bonds in imidazolium ionic liquids[J]. The Journal of Physical Chemistry A, 2006, 110(31): 9775-9782. DOI:10.1021/jp054054c |
| [10] |
Liu X, Zhang S, Zhou G, et al. New force field for molecular simulation of guanidinium-based ionic liquids[J]. The Journal of Physical Chemistry B, 2006, 110(24): 12062-12071. DOI:10.1021/jp060834p |
 2019, Vol. 36
2019, Vol. 36





