能源与环境问题是当今人类发展正面临的两大挑战。当前以化石燃料为主的能源结构正面临着资源枯竭和环境污染的双重危机,开发新型清洁能源刻不容缓。氢能具有来源广泛、可长期储存、能量密度高、燃烧产物清洁等优点,是一种十分有前景的二级能源[1-2]。在诸多制氢方法中,电催化水解制氢由于原料来源广泛,能量利用形式多样等优点,逐步成为当下制氢研究的一个焦点。目前,电解水所采用的电极中以铂(Pt)基电极效率最高,但Pt储量稀少、成本高昂,很难满足工业化的需求。因此,研制高效的非贵金属析氢电极材料成为了目前电解水制氢的研究重点[3-5]。
过渡金属二硫化物(TMDs)不仅来源广泛,价格低廉,而且种类繁多,其物理性质和电子结构各不相同,这为开发高性能的复合催化剂提供了广阔的平台。理论[6]与实验研究表明,二硫化钼(MoS2)[7-11]、二硫化钨(WS2)[12-14]等TMDs材料在电析氢方面具有良好的应用潜力。然而,单纯的TMDs材料活性仍有待提高[15-16]。当前,提升TMDs析氢性能主要有以下几种途径:1)通过改变制备方法来改善微观形貌,暴露更多活性位点[17];2)通过多种途径诱导TMDs发生相转变[13],改变其电子结构;3)进行元素掺杂[16],调整材料的电子云密度;4)通过构建复合材料,发挥协同效应。
本研究首次制备并探索了Pd/1T-WS2复合催化剂在电解水制氢方面的应用潜能。首先使用Li插层剥离法[18],制备了金属性的1T相WS2纳米片,再以PVP为模板剂,在WS2纳米片上原位还原并负载了Pd纳米颗粒,形成Pd/WS2复合催化剂。电析氢测试表明,复合后Pd与WS2能发挥良好的协同效应,从而获得了较高的催化活性和稳定性。
1 实验材料与方法 1.1 主要试剂及原料二硫化钨(分析纯)、氯亚钯酸钾(98%,质量分数,下同)、聚乙烯吡咯烷酮(PVP,K30/EA),上海阿拉丁生化科技股份有限公司;正丁基锂正己烷溶液(1.6 mol·L-1),北京百灵威科技有限公司;溴化钾(优级纯),天津市科密欧化学试剂有限公司;抗坏血酸(99%),天津市希恩思奥普德科技有限公司;正己烷(分析纯)、无水乙醇(分析纯)、硫酸(98%),天津光复精细化工研究所;本实验所用水为去离子水。
1.2 WS2纳米片的制备本论文采用改进的锂离子插层法制备1T型的WS2二维纳米片。试验中,取1.15 g WS2粉末加入史莱克管中,在Ar气保护下加入15 mL正丁基锂正己烷溶液(1.6 mol·L-1)。将史莱克管置于66 ℃的水浴中反应48 h,离心分离得黑色粉末,并用正己烷洗涤4次,然后快速加入去离子水,超声剥离30 min。用去离子水多次离心清洗,去除未剥离的硫化钨及其他杂质,再超声分散在去离子水中。取样冻干称质量来标定产物的质量浓度。
1.3 Pd/WS2纳米片的制备本试验使用软模板法制备Pd量子点,同时原位负载在WS2纳米片上,制得Pd/WS2纳米片。试验中,取40 mg剥离的WS2纳米片加入20 mL去离子水中超声分散,转移入50 mL三口烧瓶中并加入260 mg聚乙烯吡咯烷酮(PVP)、150 mg抗坏血酸(AA)和750 mg溴化钾(KBr),水浴加热到80 ℃并电磁搅拌使其溶解。然后取预先配制好的8 mL K2PdCl4水溶液(21 mg·mL-1)加入反应液中,保持80 ℃反应3 h。离心收集产物并用去离子水、乙醇反复离心清洗多次。将产物分散在去离子水中待用。取适量冻干称质量,标定质量浓度。
1.4 Pd/WS2电解水析氢的电极性能测试将Pd/WS2复合物超声分散于去离子水中,配置一定浓度的分散液(本论文为9.3 g·L-1),取50 μL分散液滴在玻碳电极上,晾干得到Pd/WS2复合物电极。使用同样的方法制备WS2、Pd、Pd/C电极,作为对比材料。
电化学析氢测试使用上海辰华仪器有限公司的ChI660E电化学工作站,采用三电极体系,其中工作电极为Pd/WS2复合物电极和对比材料电极,对电极为Pt丝电极,参比电极为Ag/AgCl(饱和KCl溶液),电解液为0.5 mol·L-1的H2SO4溶液。采用伏安法线性扫描(LSV)来测试Pd/WS2电极的制氢性能,并采用循环伏安法(CV)来测试其稳定性。
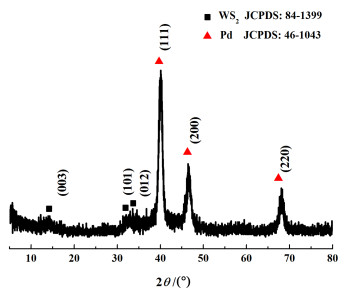
2 结果与讨论 2.1 Pd/WS2复合材料的表征图 1为Pd/WS2纳米片的XRD谱图。
|
| 图 1 Pd/WS2纳米片的XRD谱图 Fig.1 XRD patterns of Pd/WS2 nanosheets |
| |
从图 1中可以看出,根据与标准谱图对比的结果,位于2θ=40.1°、46.6°和68.1°的衍射峰分别对应于Pd的(111)、(200)、(220)晶面,且衍射峰的强度较高,表明成功制备了Pd纳米颗粒,且其结晶度较好。位于2θ=14.4°、33.1°和34.2°的衍射峰对应于WS2的(003)、(101)和(012)晶面。由于WS2纳米片的峰值较小,在复合物中容易被较大的Pd峰掩盖,但仍然可以观察到其特征峰。以上结果表明Pd与WS2成功复合。
图 2是Pd/WS2复合物的扫描电镜图。从图 2a)中可以看出Pd/WS2复合物总体保持了WS2的原有的形貌;从放大后的图 2b)可以清晰地看到WS2表面上负载的Pd金属颗粒。

|
| 图 2 Pd/WS2纳米片的SEM图 Fig.2 SEM images of Pd/WS2 nanosheets |
| |
从图 3a)可以看到WS2的片层结构上负载了圆形纳米Pd颗粒,颗粒分散均匀且尺寸均一,其直径约10 nm。图 3b)为Pd/WS2的高分辨率TEM图,可以看到金属颗粒具有清晰的晶格条纹,晶格间距为0.23 nm,对应于Pd的(111)晶面。此外,图 3b)插图中的选区电子衍射表明该复合材料为多晶结构。由此可见,Pd/WS2复合材料被较好的制备出来,且具有良好的片层和晶体结构。

|
| 图 3 a) Pd/WS2复合物的TEM图;b)Pd/WS2复合物的HRTEM图以及电子衍射 Fig.3 TEM a) and HRTEM b) images of Pd/WS2 nanosheets |
| |
酸性体系中,电解水过程可用如下化学方程式表达。
总反应:
| $ {{\rm{H}}_2}{\rm{O}} \to {{\rm{H}}_2} + \frac{1}{2}{{\rm{O}}_2} $ | (1) |
阴极反应:
| $ 2{{\rm{H}}^ + } + 2{{\rm{e}}^-} \to {{\rm{H}}_2} $ | (2) |
阳极反应:
| $ {{\rm{H}}_{\rm{2}}}{\rm{O}} \to 2{{\rm{H}}^ + } + \frac{1}{2}{{\rm{O}}_2} + 2{{\rm{e}}^-} $ | (3) |
热力学计算表明,电解水产生氢气和氧气理论上所需电压为1.23 V(25 ℃,1.013×105 Pa),实际实验中电极之间的电压必须大于这一理论值才能使电解水反应发生,大于理论值的这部分电压则称为过电位(η)。
电解水的所需要的操作电压(Eop)可表示为[4]:
| $ {E_{{\rm{op}}}} = 1.23 + \eta $ | (4) |
其中过电位η又可表示为:
| $ \eta = {\eta _{\rm{a}}} + {\eta _{\rm{c}}} + {\eta _{\rm{o}}} $ | (5) |
公式(5)中:ηa表示阳极过电位,即在电解阳极产生的过电位;ηc为阴极过电位,ηo为其它过电位,主要来源于溶液电阻和接触电阻。
由法拉第定律可知,产生同等质量的氢气,需要消耗的电量是相同的,因而能耗取决于电解电压的大小。而对于同样的电解功率,如果降低电解所需电压,那么产物生成的效率则会提高。因此,为了降低电解水制氢的能耗,析氢电极材料需具有较低的反应过电位。
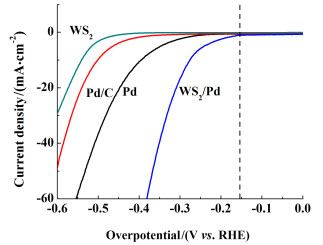
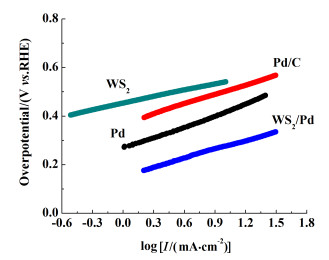
实验中一般采用起始电位(本研究中取电流密度为0.1 mA时对应的电位)来衡量电极材料的整体活性。图 4为Pd/WS2复合材料及各个对比样的析氢极化曲线。与单独的WS2纳米片和Pd颗粒相比,复合后的Pd/WS2起始电位显著降低,约为155 mV。这一结果表明Pd与WS2复合后产生了良好的协同效应,大大提升了催化活性。与商用的Pd/C催化剂相比,Pd/WS2催化剂的催化性能优势明显。图 5为Pd/WS2和各对比材料的塔菲尔曲线图,斜率越低时代表析氢催化过程中的反应动力学越佳。
|
| 图 4 Pd/WS2、WS2、Pd及Pd/C的析氢极化曲线 Fig.4 LSV curves for Pd/WS2 composite, WS2 nanosheets, Pd alone and Pd/C |
| |
|
| 图 5 Pd/WS2、WS2、Pd及Pd/C的Tafel曲线 Fig.5 Tafel plots for Pd/WS2 composite, WS2 nanosheets, Pd alone and Pd/C |
| |
经过拟合计算可得,WS2、Pd/WS2、Pd及Pd/C的塔菲尔斜率分别为89.48、121.79、157.2以及124.7 mV·dec-1。Pd/WS2的塔菲尔斜率虽低于Pd颗粒及商用Pd/C催化剂,但仍高于单纯的WS2纳米片,这可能是由于复合过程中加热诱导WS2部分团聚,或者少量模板剂PVP覆盖于WS2表面导致其导电性下降。然而,由于复合后起始电位降低显著,极大减少了析氢过程中的能量损耗,因此总体上仍然大大提高了催化剂的析氢性能。
综合比较可以看出,本研究所开发的Pd/WS2复合催化剂性能全面优于商用的Pd/C催化剂。与以活性碳为载体的Pd/C相比,Pd/WS2的特性在于使用了片层的WS2作为负载载体。有研究表明,片层状结构可增大电极的有效析氢面积[4];此外,WS2具有较好的电学性能[19],其本身对析氢反应也具有一定活性[7],与Pd复合后,两者可能产生了一定的协同作用,进一步增加了析氢催化活性。
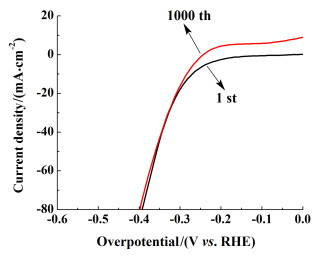
图 6为Pd/WS2复合物使用循环伏安法(CV)循环测试1 000次前后的析氢极化曲线,从图 6中可以看出:在多次循环以后,同等电压下Pd/WS2电极的电流密度并未降低。此外,其起始电位反而略有降低,这可能是电解水过程中,部分被氧化的金属被还原所致。因此,Pd/WS2复合物材料具有良好的稳定性以及长期使用的潜力。
|
| 图 6 Pd/WS2复合物在伏安法循环1 000次前后的极化曲线 Fig.6 LSV curves for the Pd/WS2 composite before and after 1 000 cycles of CV test |
| |
通过简单快捷的原位还原反应,在WS2纳米片上均匀地负载了Pd纳米颗粒。电化学测试表明,复合后的催化剂在电解水析氢过程中具有更低的起始过电位,有利于提高能源利用率和应用广泛性。该复合材料还具有稳定性好、价格相对低廉、贵金属使用量低等优点,是一种经济、节能的电析氢材料。
| [1] |
Turner J A. A realizable renewable energy future[J]. Science, 1999, 285(5428): 687-689. DOI:10.1126/science.285.5428.687 |
| [2] |
Thomas J G N. Kinetics of electrolytic hydrogen evolution and the adsorption of hydrogen by metals[J]. Transactions of the Faraday Society, 1961, 57: 1603-1611. DOI:10.1039/tf9615701603 |
| [3] |
Greeley J, Jaramillo T F, Bonde J, et al. Computational high-throughput screening of electrocatalytic materials for hydrogen evolution[J]. Nat Mater, 2006, 5(11): 909-913. DOI:10.1038/nmat1752 |
| [4] |
Zou X, Zhang Y. Noble metal-free hydrogen evolution catalysts for water splitting[J]. Chemical Society Reviews, 2015, 44(15): 5148-5180. DOI:10.1039/C4CS00448E |
| [5] |
王宏智, 张晓振, 黄波, 等. 碳毡基体上电沉积Ni-Mo合金及其催化析氢性能[J]. 化学工业与工程, 2017, 34(1): 53-59. Wang Hongzhi, Zhang Xiaozhen, Huang Bo, et al. Electrodeposition of Ni-Mo alloy from ionic liquids and its catalytic properties for hydrogen evolution[J]. Chemcial Industry and Engineering, 2017, 34(1): 53-59. (in Chinese) |
| [6] |
Tsai C, Chan K R, Norskov J K, et al. Theoretical insights into the hydrogen evolution activity of layered transition metal dichalcogenides[J]. Surf Sci, 2015, 640: 133-140. DOI:10.1016/j.susc.2015.01.019 |
| [7] |
Li Y, Wang H, Xie L, et al. MoS2 nanoparticles grown on graphene:An advanced catalyst for the hydrogen evolution reaction[J]. Journal of the American Chemical Society, 2011, 133(19): 7296-7299. DOI:10.1021/ja201269b |
| [8] |
Hinnemann B, Moses P G, Bonde J, et al. Biomimetic hydrogen evolution:MoS2 nanoparticles as catalyst for hydrogen evolution[J]. Journal of the American Chemical Society, 2005, 127(15): 5308-5309. DOI:10.1021/ja0504690 |
| [9] |
Zong X, Yan H, Wu G, et al. Enhancement of photocatalytic H2 evolution on CdS by loading MOS2 as cocatalyst under visible light irradiation[J]. Journal of the American Chemical Society, 2008, 130(23): 7176-7177. DOI:10.1021/ja8007825 |
| [10] |
Xiang Q, Yu J, Jaroniec M. Synergetic effect of MoS2 and graphene as cocatalysts for enhanced photocatalytic H2 production activity of TiO2 nanoparticles[J]. Journal of the American Chemical Society, 2012, 134(15): 6575-6578. DOI:10.1021/ja302846n |
| [11] |
秦瑞杰, 张占男, 王宇新. 石墨烯负载MoS2-Ni2P纳米颗粒作为析氢电催化剂[J]. 化学工业与工程, 2017, 34(2): 21-26. Qin Ruijie, Zhang Zhannan, Wang Yuxin. MoS2-Ni2P nanoparticles supported on graphene as electrocatalyst towards hydrogen evolution reaction[J]. Chemcial Industry and Engineering, 2017, 34(2): 21-26. DOI:10.3969/j.issn.1006-7906.2017.02.004 (in Chinese) |
| [12] |
Duan J, Chen S, Chambers B A, et al. 3D WS2 nanolayers@heteroatom-doped graphene films as hydrogen evolution catalyst electrodes[J]. Advanced Materials, 2015, 27(28): 4234-4241. DOI:10.1002/adma.v27.28 |
| [13] |
Lukowski M A, Daniel A S, English C R, et al. Highly active hydrogen evolution catalysis from metallic WS2 nanosheets[J]. Energy & Environmental Science, 2014, 7(8): 2608-2613. |
| [14] |
Yang J, Voiry D, Ahn S J, et al. Two-Dimensional hybrid nanosheets of tungsten disulfide and reduced graphene oxide as catalysts for enhanced hydrogen evolution[J]. Angewandte Chemie International Edition, 2013, 52(51): 13751-13754. DOI:10.1002/anie.201307475 |
| [15] |
Jin J, Zhu Y, Liu Y, et al. CoP nanoparticles combined with WS2 nanosheets as efficient electrocatalytic hydrogen evolution reaction catalyst[J]. International Journal Of Hydrogen Energy, 2017, 42(7): 3947-3954. DOI:10.1016/j.ijhydene.2016.12.019 |
| [16] |
Wang X, Gan X, Hu T, et al. Noble-Metal-Free hybrid membranes for highly efficient hydrogen evolution[J]. Advanced Materials, 2017, 29(4): 1603617-1603625. DOI:10.1002/adma.201603617 |
| [17] |
Li H, Tsai C, Koh A L, et al. Activating and optimizing MoS2 basal planes for hydrogen evolution through the formation of strained sulphur vacancies[J]. Nat Mater, 2016, 15(1): 48-53. |
| [18] |
Cao S, Chen Y, Wang C, et al. Spectacular photocatalytic hydrogen evolution using metal-phosphide/CdS hybrid catalysts under sunlight irradiation[J]. Chemical Communications, 2015, 51(41): 8708-8711. DOI:10.1039/C5CC01799H |
| [19] |
Chhowalla M, Shin H S, Eda G, et al. The chemistry of two-dimensional layered transition metal dichalcogenide nanosheets[J]. Nat Chem, 2013, 5(4): 263-275. DOI:10.1038/nchem.1589 |
 2019, Vol. 36
2019, Vol. 36





