手性识别是手性主体对外消旋客体的识别,对手性化合物的拆分及分离起着重要作用[1-3]。手性主体通过分子间的非共价键作用,可以与外消旋客体形成包结物,从而实现手性识别[4]。经过二十多年的发展,包结络合的方法已经发展成为一种重要的手性拆分方法[4-8]。Shitara等在晶体结构的基础上,发现溶剂诱导的手性转换作用,并将这种双重立体控制技术成功应用于连续拆分过程,无需改变拆分剂即可获得2种对映异构体[9]。Hu等报道了反应溶剂对包结物构型的影响,并通过X射线单晶衍射分析表明了H键对不同类型包结络合物的作用模式,在此基础上实现了对外消旋联二萘酚的手性拆分[10]。
三氟氯菊酸又称功夫酸,是光学活性农药氯氟酚菊酯、联苯菊酯、七氟菊酯等的酸组分,其结构中的2个手性碳原子以及三元环侧链上的双键构成了8个光学异构体[11]。了解不同光学异构体与受体间的关系,更加理性地寻找高度选择性的异构体,可以减少无效构型的分子进入环境,提高农药的杀虫效率,能更好地保护环境,并使高效光学活性农药的开发更加有的放矢。因此,选择合适的方法对三氟氯菊酸进行手性拆分是很有必要的。
1 实验部分 1.1 试剂与仪器 1.1.1 试剂试验中所使用的化学试剂全部购买自化学品试剂公司,并且未经处理直接使用。
1.1.2 仪器Bruker ALPHA FT-IR型红外光谱仪,用溴化钾压片制样法进行红外表征;Bruker Avance Ⅲ 400 MHz型核磁共振仪,以CDCl3为溶剂进行1H NMR表征;XtaLAB mini(600 W,SHINE,CCD,75 mm,0.1 electrons/pisel/sec)型X射线单晶衍射仪测其晶体数据。
搅拌器:IKA磁力搅拌器(RCT Synthese PACKAGE 1)。
1.2 R(+)-α-苯乙胺与三氟氯菊酸包结物的制备取50 mL圆底烧瓶,称取三氟氯菊酸(0.28 g,1.15 mmol)和R(+)-α-苯乙胺(0.14 g,1.15 mmol),溶解于热的甲醇(5 g)中。室温下,磁力搅拌反应2 h。将反应液过滤除去不溶杂质,所得无色透明溶液转移至50 mL锥形瓶中。静置数天,室温下培养晶体。
取少量所得包结物,用蒸馏水少量多次冲洗干净包结物表面的溶剂,在45 ℃真空干燥箱中进行干燥,用溴化钾压片制样法测其红外光谱;并以CDCl3为溶剂进行1H NMR表征。
红外光谱(cm-1): 3 505.92(—O—H),3 432.01、3 505.92(—NH2),3 060.72(Ar—H),1 772.43(C=O),1 617.36(—C6H5),1 463.63(Ar—H弯曲振动),1 264.65(—C—O),1 143.88(C—N),816.55(=C—H),751.77、668.81(Ar—H弯曲振动)。
1H NMR(400 MHz,CDCl3,δ): 7.58~7.85(m,5H;Ar—H),6.84~6.95(m,1H;N—CH),3.15~3.34(d,1H;=CH),7.03~7.21(m,6H;—CH3),4.78~4.97(d,2H;CH2),1.26~1.45(d,3H;CH3)。
2 结果与讨论 2.1 溶剂筛选本研究对R(+)-α-苯乙胺与三氟氯菊酸的反应溶剂做了简单筛选。将物质的量之比为1:1的三氟氯菊酸与R(+)-α-苯乙胺完全溶于热的溶剂中,室温下,磁力搅拌2 h,冷却至室温,培养晶体。表 1列出了在极性质子溶剂(甲醇、乙醇)、极性非质子溶剂(THF、乙酸乙酯)及非极性非质子溶剂(甲苯)等不同溶剂中的对比结果。
| 反应溶剂 | 甲醇 | 乙醇 | THF | 乙酸乙酯 | 甲苯 |
| 包结物 | √ | × | × | × | × |
从表 1中可以得出结论:在所选用的溶剂中,只有极性质子溶剂——甲醇作为反应溶剂时才会得到R(+)-α-苯乙胺与三氟氯菊酸的包结物。而当其他溶剂作为反应溶剂时并不能得到同样的结果。
2.2 红外光谱表征3 505.92 cm-1处吸收峰为羧酸羟基—O—H的伸缩振动吸收峰,1 772.43 cm-1处吸收峰为羧酸羰基C=O的伸缩振动吸收峰,1 264.65 cm-1处吸收峰为羧酸碳氧单键—C—O的伸缩振动吸收峰,816.55 cm-1处吸收峰为三取代双键碳上氢=C—H的面外弯曲振动吸收峰;而3 432.01和3 505.92 cm-1处吸收峰为伯胺—N—H的伸缩振动吸收峰,3 060.72 cm-1处吸收峰为苯环上Ar—H的伸缩振动吸收峰,1 617.36 cm-1处吸收峰(苯环骨架振动)和1 463.63 cm-1处吸收峰(Ar—H弯曲振动)说明苯环的存在,1 143.88 cm-1处吸收峰为脂肪族胺C—N的伸缩振动吸收峰,751.77和668.81 cm-1为单取代Ar—H弯曲振动吸收峰。由以上分析可知,此包结物的组成为R(+)-α-苯乙胺与三氟氯菊酸。
2.3 核磁共振表征化学位移在7.58~7.85处5H的多峰为R(+)-α-苯乙胺中苯环上的氢Ar—H,6.84~6.95处的1H的峰为三氟氯菊酸中双键碳上的氢即:C—H,与文献给出的结果相符合[12]。这个结果同样说明包结物由R(+)-α-苯乙胺和三氟氯菊酸共同组成,又从峰面积得知二者组成比为1:1。
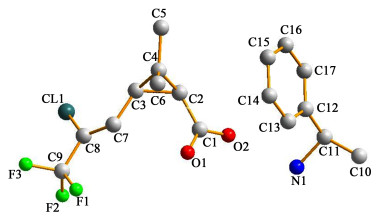
2.4 X射线单晶衍射综上所述,所得晶体为R(+)-α-苯乙胺与三氟氯菊酸,其尺寸为200×180×120 m3,收集θ在3.05°~27.50°范围内的衍射点解其单晶结构。晶体晶胞图如图 1,晶体参数如表 2所示,晶体的部分键长和键角如表 3所示,非氢原子坐标及等效热参数如表 4所示。
|
| 图 1 R(+)-α-苯乙胺与三氟氯菊酸晶胞图 Fig.1 Crystal structure for heterocomplexation of R(+)-α-phenylethylamine toward lambda-cyhalothric acid |
| |
| Entry | heterocomplexation |
| Formula | C17H21ClF3NO2 |
| FW | 363.80 |
| T/K | 113(2) |
| Crystal system | Monoclinic |
| Space group | P2(1) |
| a/nm | 1.01858(16) |
| b/nm | 0.59514(8) |
| c/nm | 1.5480(2) |
| α/(°) | 90 |
| β/(°) | 100.707(3) |
| γ/(°) | 90 |
| V/nm3 | 0.9221(2) |
| Z | 2 |
| ρcalc/(g·m-3) | 1.310×10-3 |
| μ/m-1 | 244 |
| F(000) | 380 |
| Crystal size/m3 | 200×180×120 |
| θ range for data collection/(°) | 3.05~27.50 |
| Index ranges | -13≤h≤13,-7≤k≤6 |
| -20≤l≤19 | |
| Reflections collected | 9 357 |
| Independent reflections | 3 900 [Rint=0.0375] |
| Data/restraints/parameters | 3 900/7/229 |
| Goodness-of-fit (GOF) on F2 | 1.041 |
| Final R indexes [I≥2σ(I)] | R1=0.0304,wR2=0.0782 |
| Final R indexes [all data] | R1=0.0333,wR2=0.0798 |
| Largest difference in peak/hole/(eÅ-3) | 0.195/-0.170 |
| 注:1 Å=0.1 nm。 | |
| 项目 | 数值 | |
| 键长/nm | Cl(1)-C(8) | 0.172 85(18) |
| C(1)-C(2) | 0.149 58(19) | |
| C(2)-C(4) | 0.151 6(2) | |
| C(2)-C(3) | 0.154 94(18) | |
| C(3)-C(4) | 0.151 5(2) | |
| C(3)-C(7) | 0.146 31(19) | |
| C(7)-C(8) | 0.132 3(2) | |
| C(8)-C(9) | 0.149 6(2) | |
| 键角/(°) | C(4)-C(2)-C(3) | 5.922(9) |
| C(1)-C(2)-C(3) | 12.119(11) | |
| C(4)-C(3)-C(2) | 5.929(9) | |
| C(7)-C(3)-C(4) | 12.239(14) | |
| C(8)-C(7)-C(3) | 12.494(15) | |
| C(7)-C(8)-C(9) | 12.339(15) | |
| x | y | z | U(ed) | |
| Cl(1) | 6 082(1) | 10 587(1) | 5 623(1) | 48(1) |
| F(1) | 7 974(1) | 5 318(2) | 6 686(1) | 48(1) |
| F(2) | 8 676(1) | 8 685(3) | 6 626(1) | 59(1) |
| F(3) | 8 043(1) | 6 826(3) | 5 441(1) | 58(1) |
| O(1) | 5 125(1) | 5 501(2) | 8 293(1) | 31(1) |
| O(2) | 4 218(1) | 8 327(2) | 8 923(1) | 28(1) |
| N(1) | 4 110(1) | 7 042(2) | 10 606(1) | 22(1) |
| C(1) | 4 349(1) | 7 140(3) | 8 263(1) | 24(1) |
| C(2) | 3 525(1) | 7 862(3) | 7 405(1) | 23(1) |
| C(3) | 4 108(1) | 7 861(3) | 6 549(1) | 24(1) |
| C(4) | 2 971(1) | 6 302(3) | 6 651(1) | 25(1) |
| C(5) | 1 614(2) | 6 953(4) | 6 135(1) | 37(1) |
| C(6) | 3 176(2) | 3 797(3) | 6 723(1) | 32(1) |
| C(7) | 5 467(1) | 7 048(3) | 6 563(1) | 25(1) |
| C(8) | 6 369(1) | 8 079(3) | 6 190(1) | 27(1) |
| C(9) | 7 759(2) | 7 216(3) | 6 232(1) | 36(1) |
| C(10) | 2 679(1) | 5 522(3) | 11 581(1) | 31(1) |
| C(11) | 2 687(1) | 6 670(3) | 10 706(1) | 24(1) |
| C(12) | 1 949(1) | 5 384(3) | 9 920(1) | 23(1) |
| C(13) | 2 405(1) | 3 306(3) | 9 687(1) | 27(1) |
| C(14) | 1 759(2) | 2 202(3) | 8 943(1) | 34(1) |
| C(15) | 634(2) | 3 147(4) | 8 426(1) | 37(1) |
| C(16) | 156(2) | 5 185(3) | 8 664(1) | 37(1) |
| C(17) | 810(2) | 6 303(3) | 9 409(1) | 30(1) |
| 注:1 Å=0.1 nm。 | ||||
由表 2可知,该单晶位于单斜晶系,P2(1)点群,其分子式为C17H21ClF3NO2,单胞参数为a=10.11858(16) nm,b=0.59514(8) nm,c=1.5480(2) nm,α=90°,β=100.707(3)°,γ=90°。
由图 1可知,构型为Z-(1S, S)-顺式-2, 2-二甲基-3-(2-氯-3, 3, 3-三氟-1-丙烯基)环丙烷羧酸的三氟氯菊酸与R(+)-α-苯乙胺形成盐,三氟氯菊酸中的羧基以羧酸根负离子的形式存在于晶体中,而R(+)-α-苯乙胺则是以铵盐的形式存在。R(+)-α-苯乙胺与Z-(1S, S)-顺式-2, 2-二甲基-3-(2-氯-3, 3, 3-三氟-1-丙烯基)环丙烷羧酸配位比为1:1。
由表 3可知,三氟氯菊酸中2个手性碳C(2)-C(3)之间的键长为0.154 94 nm,其中1个手性碳与不饱和碳C(3)-C(7)之间的键长为0.146 31(19) nm,双键C(7)-C(8)键长为0.132 3(2) nm,与2个手性碳相关的键角为:∠C(4)-C(3)-C(2)=59.29°,∠C(4)-C(2)-C(3)=59.22°,而手性碳与双键之间的键角为:∠C(8)-C(7)-C(3)=124.94°。
3 结论通过合成R(+)-α-苯乙胺与三氟氯菊酸的晶体,实现了对三氟氯菊酸的手性拆分。对所得到的晶体进行FT-IR、1H NMR以及X射线单晶衍射分析表征,结果表明所得的三氟氯菊酸立体异构体为:Z-(1S, S)-顺式-2, 2-二甲基-3-(2-氯-3, 3, 3-三氟-1-丙烯基)环丙烷羧酸。研究中还发现,只有甲醇作反应溶剂,三氟氯菊酸才能与R(+)-α-苯乙胺形成包结物,从而达到拆分的目的。
| [1] |
Izake E L. Chiral discrimination and enantioselective analysis of drugs:An overview[J]. Pharm Sci, 2007, 96(7): 1659-1676. DOI:10.1002/jps.20820 |
| [2] |
Ohrui H. Development of highly potent chiral discrimination methods that have solved the intrinsic problem of the diastereomer method[J]. Bunseki Kagaku, 2004, 53(8): 805-815. DOI:10.2116/bunsekikagaku.53.805 |
| [3] |
Okamoto Y, Yashima E, Yamamoto C. Optically active polymers with chiral recognition ability[J]. Chem Inform, 2004, 35(11): 157-208. |
| [4] |
Feng X, Zeng D, Jiang Y. A novel method of resolution-chiral inclusion complexation[J]. Chin Org Chem, 2000, 20(2): 131-137. |
| [5] |
Aboul-Enein H Y. Enantiomer separation:Fundamentals and practical methods[J]. Chirality, 2006, 18(9): 772-772. DOI:10.1002/(ISSN)1520-636X |
| [6] |
Toda F, Yoshizawa K, Hyoda S, et al. Efficient resolution of 2, 2'-dihydroxy-1, 1'-binaphthyl by inclusion complexation with chiral N-(3-chloro-2-hydroxypropyl)-N, N, N-trimethylammonium chloride[J]. Org Biomol Chem, 2004, 2(40): 449-451. |
| [7] |
Kano K, Nishiyabu R. Chiral recognition by cyclodextrins: A general mechanism[J]. doi: 10.1002/chin.200616256
|
| [8] |
张毅民, 孙聪善, 陈春凤, 等. 2-羟丙基-β-环糊精的制备及其对地塞米松的增溶作用[J]. 化学工业与工程, 2008, 25(6): 487-492. Zhang Yimin, Sun Congshan, Chen Chunfeng, et al. Preparation of hydroxypropyl-β-cyclodextrin and its solubility improvement on dexamethasone[J]. Chemical Industry and Engineering, 2008, 25(6): 487-492. DOI:10.3969/j.issn.1004-9533.2008.06.005 (in Chinese) |
| [9] |
Shitara H, Shintani T, Kodama K, et al. Solvent-Induced reversed stereoselectivity in reciprocal resolutions of mandelic acid and erythro-2-amino-1, 2-diphenylethanol[J]. Journal of Organic Chemistry, 2013, 3(78): 9309-9316. |
| [10] |
Hu X, Yang Y, Shi S, et al. Effects of solvent on inclusion complexation of a chiral dipeptide toward racemic BINOL[J]. Chirality, 2016, 28(12): 784-788. DOI:10.1002/chir.v28.12 |
| [11] |
王鸣华. 拟除虫菊酯化学[M]. 北京: 中国农业科学技术出版社, 2004. Wang Minghua. Pyrethroid chemical[M]. Beijing: China Agricultural Science and Technology Press, 2004. (in Chinese) |
| [12] |
Makoto F, Kiyosi K, Tamejiro H. Practical, stereocontrolled synthesis of polyfluorinated artificial pyrethroids[J]. Bull Chem Soc Jpn, 1987, 60(12): 4385-4394. DOI:10.1246/bcsj.60.4385 |
 2019, Vol. 36
2019, Vol. 36





