工业结晶方法一般可分为溶液结晶、熔融结晶、升华、沉淀等4类[1-2]。反应结晶(反应沉淀)是其中沉淀的主要类型之一, 大多情况是借助化学反应产生不溶或难溶固相物质的过程。反应结晶(反应沉淀)过程是多相传热、传质的过程, 按进行顺序可以分反应和结晶2个基本的步骤, 在实验室化学分析和工业生产中均有很广泛的应用[3]。
磷酸三钙(沉淀磷酸钙)主要有α和β 2种晶型。磷酸三钙产品一般为由不同磷酸钙组成的混合物, 白色无定型粉末, 难溶于水, 易溶于稀盐酸和硝酸, 在空气中稳定[4]。磷酸三钙可作为人体硬组织如牙和骨的理想替代材料, 具有良好的生物降解性、相容性和无毒性。除生物体内植入材料外, 磷酸三钙还可以在食品工业中作凝结剂、缓冲剂、营养增补剂(强化钙)、增香剂和pH值调节剂。磷酸三钙产品按等级分为饲料级、食品级和医药级磷酸三钙3种。经调查, 目前国内生产饲料级磷酸三钙的工艺主要有3种:化学沉淀法、植酸钙水解法和高温烧结法[5-7]。
石灰乳与工业磷酸反应生成磷酸三钙沉淀结晶体系是典型的快速反应成核过程, 反应过程由反应物的扩散环节(速度最慢的环节)所控制。在工业上磷酸三钙生产过程中, 陈化是一个重要的操作步骤, 决定了最终磷酸三钙产品的结晶度和粒度分布等重要指标, 而在实际生产中往往凭经验操作居多, 对于陈化过程发生的晶型转化过程报道较少。
本研究通过对磷酸三钙产物进行X射线衍射测定、扫描电镜以及粒度分布等分析方法, 探讨了陈化过程对反应结晶产物磷酸三钙各性能的影响。
1 试验部分 1.1 试验试剂及装置图 1.1.1 试验试剂及仪器试验试剂包括工业磷酸, 企业提供原料, 质量分数36.6%;高纯去离子水, 市售; 氧化钙, 分析纯, 天津市光复精细化工研究所。
试验仪器包括300 mL玻璃夹套式反应结晶器, 天津市易普佳科技有限公司; CKDC-1006型程序控温恒温槽, 南京凡帝朗信息科技有限公司; JHS-2/90恒速数显搅拌机, 杭州仪表有限公司; BT100-2J型精密型蠕动泵, 兰格恒流泵有限公司; D/max-2500(Rigaku, Japan) X射线粉末衍仪, 日本理学电机株式会社; pH计, 上海恒平科学仪器有限公司; TM-3000日立台式电子显微镜, 天美科技有限公司; MAZ-3000超高速智能粒度分析仪, 英国马尔文仪器有限公司。
1.1.2 试验装置及流程试验装置及流程如图 1所示。该装置由溶解、加料、反应、恒温及搅拌系统4个部分组成。反应结晶器是1个带夹套的玻璃材质的结晶器, 结晶器内置有机械搅拌桨, 搅拌速度由多功能调速器控制。试验采用半连续操作方式, 即先在结晶器中加石灰乳, 然后连续加入磷酸, 不出料进行反应结晶。

|
| 图 1 试验装置图 Figure 1 The experimental device |
| |
首先将氧化钙(分析纯, 质量分数为98%)和去离子水(高纯)按质量比为1:4放入夹套式结晶器中混合, 同时用搅拌桨(转速为300 r/min)匀速搅拌约30 min待氧化钙与水的反应达到平衡, 这样石灰乳就制备完成了。设定程序控温恒温槽至恒定温度20 ℃, 将夹套式结晶器通水浴。使用温度计实测反应温度在20±0.2 ℃。然后使用蠕动泵将磷酸缓慢滴入装有石灰乳的结晶器中, 同时保持搅拌桨(转速为300 r/min)匀速搅拌, 至终点pH值为10左右停止滴加磷酸。将搅拌桨速度调至100 r/min, 陈化10 h。
1.2.2 取样和产物测定物料加毕后开始取样分析(反应时间大致为10 min), 不同陈化时间下取样, 每1 h取1次样, 中间取样共10次。为了尽量减少取样对反应的影响, 每次取样量约为15 mL, 反应达到平衡总的物料量为600 mL左右。取样时, 应提高搅拌速度搅拌几秒钟, 以保证釜内分布均匀。每次取样前对反应溶液进行pH值的测定。取部分样倒入砂芯漏斗中用水循环真空泵进行抽滤, 过滤后的样品放入鼓风干燥机中, 于65 ℃条件下恒温干燥4~6 h。然后将干燥完的样品取出, 放入干燥箱使其自然冷却。为了防止干燥过程中样品发生晶化, 过滤后取部分未干燥的样品直接进行XRD测定。通过扫描电镜观察磷酸三钙粒子的形貌特征, 用马尔文粒度分析仪对磷酸三钙粒子进行粒度分析。
2 试验结果与讨论 2.1 陈化过程中产品结晶度的变化由于磷酸三钙的溶解度S很小, 按公式(1)计算。
| $ V = K\left( {Q-S} \right)/S $ | (1) |
式(1)中, V为沉淀生成的初始速度, 即分散度, 单位为1;Q为加入沉淀剂瞬间沉淀物质的浓度, 单位为g·L-1; S为沉淀的溶解度, 单位为g·L-1; K为常数, 它与沉淀的性质、温度、介质等有关, 单位为1。
形成沉淀的聚集速度很大, 先析出的是无定型磷酸三钙(ACP)。另外沉淀过程中, 会同时形成几种不同的相。按Ostwald-Lussac规则, 稳定相与亚稳相的成核与生长的相对速度决定了哪一相先从溶液中分离出来, 所以首先沉淀的是具有最高溶解度的最不稳定的相, 这是一种动力学现象。在反应终点的高过饱和度下, 非均相成核起到主导的作用, 容易形成无定形沉淀。这些沉淀常含有较多水份(因为沉淀粒子的粒度小, 比表面积大, 吸附母液所多导致)。并且分子的排列很不规则, 须经过脱水、内部重排、二次成核和生长等这些过程才最终变成晶态沉淀。
由于无定型磷酸三钙(ACP)在水溶液中有很高的反应活性和溶解速度, 其无定型很难保持。一般采用稀溶液和快速法[4, 8], 也有人使用复杂的膜渗透控制法[9]获得无定型磷酸三钙。通过在反应中加Mg2+、P2O74-及氧氯化锆等无机物[9]或者某些生物大分子(聚乙二醇、聚丙烯酸)[11-12]来抑制晶核形成的速度, 从而延缓沉淀物的晶化过程。另外, 低温也可以降低无定型磷酸三钙的反应活性和溶解速率[8]。但是上面的这些方法都不能得到稳定的无定型磷酸三钙。所以为了获得无定型磷酸三钙, 本实验操作过程中, 需要在反应终点快速取样抽滤并测定沉淀物的X射线衍射图。
无定型沉淀的结晶转化一般可以从沉淀层体积的变化来观察, 但在搅拌条件下沉淀层观察受到限制。本研究通过测定沉淀物的X射线衍射图谱来判断产物晶化的程度, 扫描速度8(°)/min, 扫描范围20°~60°。
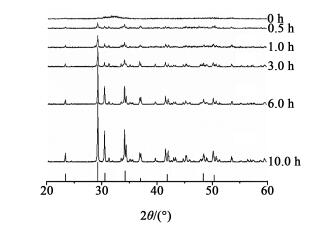
如图 2为不同陈化时间采样的反应沉淀物的XRD图, 图 2中的标准图谱为β-Ca3(PO4)2。由第1个衍射峰(陈化0 h)可以看出波峰呈宽大平坦状, 可以判断为磷酸三钙的无定型沉淀, 验证了上面关于首先析出的是无定型沉淀的分析。陈化0.5 h后, 30°左右处开始隆起尖锐的小峰, 即沉淀物出现晶化现象。陈化1 h后隆起尖锐的峰, 是明显的晶化现象。对比不同陈化时间下产物的衍射峰(随着陈化时间的延长可以看到峰值变大)可以得出结论:陈化过程中无定型沉淀在慢慢消失, 即反应沉淀物在不断晶化。
|
| 图 2 不同陈化时间下磷酸三钙的XRD图谱 Figure 2 XRD patterns of Ca3(PO4)2 with different aging times |
| |
如图 2可以看出, 陈化10 h后的样品同标准的β-Ca3(PO4)2衍射图谱基本相吻合, 峰型尖锐, 说明产物具有良好的结晶度, 晶型为β型磷酸三钙。
由此可以得出结论, 磷酸三钙的反应沉淀过程即为反应结晶过程, 反应首先析出的是介稳的固体相态, 随后才能转变为更稳定的固体相态, 即反应产物由无定型沉淀物转变为晶型产品。
2.2 陈化过程中溶液pH值的变化由于氢氧化钙是强电解质, 磷酸为弱电解质, 所以一般情况下磷酸三钙在水溶液中会微量水解, 其水溶液呈弱碱性。磷酸根离子的水解方程式如下:
| $ {\rm{P}}{{\rm{O}}_4}^{3-} + {{\rm{H}}_{\rm{2}}}{\rm{O}} = {\rm{HP}}{{\rm{O}}_{\rm{4}}}^{{\rm{2-}}}{\rm{ + O}}{{\rm{H}}^{\rm{-}}} $ | (2) |
| $ {\rm{HP}}{{\rm{O}}_{\rm{4}}}^{{\rm{2-}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O = }}{{\rm{H}}_{\rm{2}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}^{\rm{-}}{\rm{ + O}}{{\rm{H}}^{\rm{-}}} $ | (3) |
| $ {{\rm{H}}_{\rm{2}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}^{\rm{-}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O = }}{{\rm{H}}_{\rm{3}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}{\rm{ + O}}{{\rm{H}}^{\rm{-}}} $ | (4) |
当陈化过程中有结晶反应发生时, 由于结晶反应会抑制磷酸三钙粒子的水解而使溶液pH值下降, 若无结晶反应则由于磷酸盐的水解会使溶液pH值升高。所以, 通过测定反应和陈化过程中溶液的pH值变化, 可以判定陈化过程中是否产生了结晶转化。从实验终点开始每陈化2 h测定1次溶液的pH值, 图 3为磷酸三钙沉淀反应溶液在不同陈化时间下的pH值变化曲线图。相同实验条件下, 重复操作实验3次。从3次实验数据曲线可以很好的看出磷酸三钙的陈化过程往往伴随着溶液pH值的降低, 而且陈化前期下降幅度大, 后期趋于平缓。

|
| 图 3 不同陈化时间溶液的pH值 Figure 3 pH values of solution with different aging times |
| |
综合第一部分沉淀物晶化的过程, 可以得出结论, 在无定型磷酸三钙转化为晶型磷酸三钙的过程中:通常伴随着溶液pH值的微微下降, 而且结晶速度越快pH值下降速度越大。
2.3 陈化过程中磷酸三钙晶体的形貌变化本实验用扫描电镜观察了在不同生长时期磷酸三钙粒子的形貌特征。图 4是在不同的陈化时间下磷酸三钙粒子的SEM照片。

|
| 图 4 不同陈化时间下磷酸三钙的SEM图 Figure 4 SEM micrographs of Ca3(PO4)2 with different aging times |
| |
反应刚开始到陈化1 h内出现的沉淀物都是杂乱聚集的无定型粒子, 颗粒大小不一且近似为球状, 见图 4a)。随着陈化时间的加长, 磷酸三钙无定型颗粒不断晶化, 陈化3 h后开始出现粒度较大的片状形态, 见图 4b)右上角。随着陈化时间的增加, 小颗粒逐渐减少, 大颗粒逐渐增多, 即磷酸三钙颗粒逐渐长大。经过10 h的陈化生长后, 类球状颗粒消失, 团聚颗粒基本变成了较大的片状颗粒聚集的形态, 且表面光滑, 见图 4c)。当继续延长陈化时间时, 磷酸三钙颗粒的形貌与粒度已基本不再发生变化。
2.4 陈化过程对粒度分布的影响在反应结晶(反应沉淀)中, 普遍出现聚结现象, 而晶体聚结往往决定产品粒子的重要性质。磷酸三钙反应结晶过程也出现了沉淀物聚结现象, 从图 5磷酸三钙的SEM照片可以明显看到。事实上在粒度范围10~1 000 μm内, 聚结现象很平常。目前对于聚结产生的机理还不明确, 主要描述为3个过程[13]:1)流体运动造成粒子间的碰撞; 2)通过弱作用力(如范德华力)相互黏附; 3)晶体生长产生化学键, 聚结体固化。同时Ostwald认为, 一定粒度范围内, 非均匀分散沉淀体系在热力学上是不稳定的, 粒度小的颗粒具有较大的溶解度, 因此陈化能改变晶体产品的粒度分布, 使粒度分布变狭窄, 结果是小粒子不断溶解而大粒子继续长大。
|
| 图 5 不同陈化时间下样品粒度分布 Figure 5 Grain size distribution of Ca3(PO4)2 with different aging times |
| |
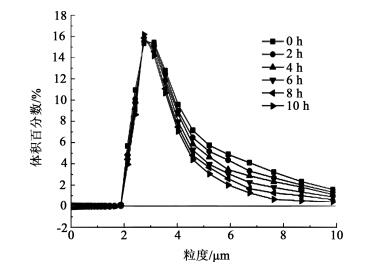
本实验采用英国马尔文仪器公司型号为MAZ-3000的超高速智能粒度分析仪检测了样品的粒度。样品分别是陈化0到10 h(每隔2 h)的样品。图 5是对不同陈化时间下制备的样品粒度分布图, 可以看出随着陈化时间的增加, 沉淀物粒子的粒径分布更均匀, 平均粒径变小。
从图 5中曲线趋势可以得出结论, 随着陈化时间的增加, 小颗粒逐渐溶解大颗粒逐渐长大, 粒度分布变窄。重复试验表明:最大相对偏差均在10%之内。鉴于微粒子检测的困难性及反应结晶系统易受外界干扰的特点, 可以接受这样的偏差。
3 结论在反应结晶生产过程中, 陈化过程是一个重要的操作步骤, 决定了最终产品的结晶度和粒度分布等重要指标。探讨了陈化过程对反应结晶产物磷酸三钙各性能的影响, 我们研究发现陈化对磷酸三钙微结构的形成起着重要而独特的作用。
1) 磷酸三钙的反应沉淀过程为反应结晶过程, 首先析出的是介稳的固体相态, 随后才能转变为更稳定的固体相态, 即由无定型沉淀物转变为晶型产品。
2) 由陈化过程中溶液pH值的变化可以得出结论, 在无定型磷酸三钙转化为晶型磷酸三钙的过程中, 通常都伴随着溶液pH值的微微下降, 而且结晶速度越快pH值下降的幅度越大。
3) Ostwald熟化使磷酸三钙粒子重结晶长大, 形态向簇状团聚体转变, 在磷酸三钙微结构的形成过程中有重要作用。
4) 随着陈化时间的增加, 无定形沉淀小颗粒逐渐减少直至消失, 大颗粒逐渐增加, 粒度分布变窄。这个过程是Ostwald熟化和无定形沉淀颗粒转化共同作用的结果。
| [1] |
王静康. 工业结晶技术前沿[J]. 现代化工, 1996, 10: 19-22. Wang Jingkang. Industrial crystallization technology frontier[J]. Modern Chemical Industry, 1996, 10: 19-22. (in Chinese) |
| [2] |
王静康. 工业结晶的现在与未来[J]. 化学工程, 1992, 20(2): 57-63. Wang Jingkang. The present and future of industrial crystallization[J]. Chemical Engineering, 1992, 20(2): 57-63. (in Chinese) |
| [3] |
陈建峰, 陈甘棠. 混合-反应结晶过程(Ⅰ)实验[J]. 化学学报, 1994, 45(2): 176-182. Chen Jianfeng, Chen Gantang. Mixed-Reactive crystallization process (Ⅰ) Experiment[J]. Acta Chimica Sinica, 1994, 45(2): 176-182. (in Chinese) |
| [4] |
Elliot J C. 18:Structure and chemistry of the apatites and other calcium orthophosphates (Studies in Inorganic Chemistry)[M]. New York: Elsevier Inc., 1994.
|
| [5] |
王磊磊.饲料级磷酸二氢钙、磷酸三钙和磷酸二氢钠的质量和安全特性研究[D].四川农业大学, 2013 Wang Leilei. Study on the quality and safety characteristics of feed-grade calcium dihydrogen phosphate, tricalcium phosphate and sodium dihydrogen phosphate[D]. Sichuan Agricultural University, 2013(in Chinese) |
| [6] |
张瑶, 何岗, 洪建和. 浅谈饲料级脱氟磷酸三钙的生产工艺研究[J]. 中国饲料, 2012, 15: 18-20. Zhang Yao, He Gang, Hong Jianhe. Study on production technology of feed grade defluorination tricalcium phosphate[J]. China Feed, 2012, 15: 18-20. (in Chinese) |
| [7] |
Wzorek Z, Kowalski Z. Calcium feed phosphate production using the low-temperature method[J]. Journal of Loss Prevention in the Process Industries, 2001, 14: 365-369. DOI:10.1016/S0950-4230(01)00018-3 |
| [8] |
Posner A S, Betts F. Synthetic amorphous calcium phophate and its relation to bone mineral structure[J]. Accounts Chem Res, 1975, 8: 273-281. DOI:10.1021/ar50092a003 |
| [9] |
Tadic D, Peters F, Epple M. Continuous synthesis of amorphous carbonated apatite[J]. Biomaterials, 2002, 23: 2553-2559. DOI:10.1016/S0142-9612(01)00390-8 |
| [10] |
Skrtic D, Antonucci J M, Eanes E D, et al. Silica and zirconia-hybridized amorphous calcium phosphate:Effect on transformation to hydroxyapatite[J]. J Biomed Mater Res, 2002, 59: 597-604. DOI:10.1002/(ISSN)1097-4636 |
| [11] |
Bertoni E, Bigi A, Falini G, et al. Hydroxyapatite/polyac-rylic acid nanocrystals[J]. J Mater Chem, 1999, 9: 779-782. DOI:10.1039/a807890d |
| [12] |
宋云京, 李木森, 温树林. 人体密质骨的AFM观察分析[J]. 电子显微学报, 2002, 21: 695-696. Song Yunjing, Li Musen, Wen Shulin. The AFM observation and analysis of human cortical bone[J]. Journal of Chinese Electron Microscopy Society, 2002, 21: 695-696. DOI:10.3969/j.issn.1000-6281.2002.05.115 (in Chinese) |
| [13] |
Nore P H, Mersmann A. Batch precipitation of barium carbonate[J]. Chem Eng Sci, 1993, 48(17): 3083-3088. DOI:10.1016/0009-2509(93)80174-O |
 2018, Vol. 35
2018, Vol. 35





