2. 天津市膜科学与海水淡化技术重点实验室, 天津 300072
2. Tianjin Key Laboratory of Membrane Science and Desalination Technology, Tianjin 300072, China
地球上的纯水资源有限, 随着经济的快速发展、人口的高度集中及水质的严重污染, 水资源已面临严重的短缺威胁。海水占所有水资源的比例约为97.5%, 将海水进行脱盐处理得到淡水被认为是最有吸引力且可靠的纯水生产技术, 如何实现低成本的水脱盐已成为当代全球科学研究所关注的重要问题[1]。新型正渗透(Forward Osmosis, FO)膜分离技术应运而生, 在该过程中, 高浓度驱动液(Draw Solution, DS)和低浓度原料液(Feed Solution, FS)分别流经非对称膜两侧, 以渗透压差为分离驱动力, 实现纯水渗透和盐分阻隔[2]。与传统的膜分离技术相比, 正渗透具有能耗低、污染小、水回收率高(≥75%)等优势[3-5]。理论上正渗透过程可以产生相当高的水通量, 但是在实际过程中由于内浓差极化和外浓差极化的影响, 有效渗透压严重降低, 造成实际结果与理论值有很大偏差[6-8]。正渗透过程中, 影响浓差极化现象的因素主要包括膜分离性能、溶液特性和运行条件, 因此对有效缓解浓差极化效应的简便方法进行研究具有重要意义[9-13]。
实验过程中, 在FO膜和DS确定的前提下, 分离性能主要取决于过程的运行条件, 例如膜朝向、料液流动方式、温度等[14-16]。与其他的膜过程一样, 温度在正渗透过程中发挥着重要的作用, 它直接影响溶液的热力学性质, 与传质、传热、膜污染和浓差极化等现象直接相关[17]。以反渗透过程为例, 有研究表明当原料液温度从20 ℃升至40 ℃时, 水通量增加约60%, 反渗透整体能耗降低15%。因此, 在可获得废热的地方, 通过适度提高系统操作温度, 进而提升水通量和回收率也是现实可行的做法[18]。在FO膜分离过程中, 内外浓差极化分别与传质系数k和溶质扩散阻力系数K有关[19-21]。而这2个参数又受温度的影响, 从而FO过程的驱动力大小直接受温度的影响, 因此研究温度对FO过程性能的影响具有非常重要的意义。此外, 目前大多数FO实验都是在两侧料液温度相等的条件下进行, 关于温差对FO运行性能影响的研究报道较少。
本论文首先优化设计膜池的进出口流道, 通过CFD模拟分析方法, 考察流体在膜池内的均匀分布状态, 最终获得性能优越的膜池结构; 其次, 研究膜朝向和流动方式对过程通量的影响, 确定后续温度实验的基本操作条件; 最后, 分单边温度强化与双边温度强化2种工况, 考察原料液与驱动液温度对FO过程性能的影响, 为提高正渗透分离性能提供理论依据。
1 实验 1.1 实验装置与方法1) 每组实验进行前, 将膜浸泡在去离子水中24 h, 以去除其表面的保护液, 确保正渗透膜支撑层达到水饱和状态。
2) 本实验使用自主加工的具有上下2个对称流道的有机玻璃正渗透膜组件, 其有效膜面积为0.0032 m2。图 1为正渗透实验流程示意图:原料液和驱动液通过2个蠕动泵(兰格BT600-2J)在膜两侧进行闭路循环; 两侧的料液温度由恒温水浴箱(HH-W420)控制。实验过程中驱动液水槽放置于电子天平(ES5000)上, 并与电脑相接连续记录溶液质量的变化。实验中采用电导率仪(DDSJ-308A)实时监测原料液和驱动液的离子浓度变化。待液体充满管路并稳定运行5 min后, 开始记录实验数据, 所有实验重复进行2次以减小实验误差。
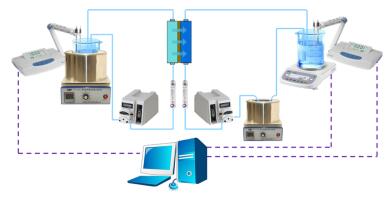
|
| 图 1 正渗透实验装置流程示意图 Figure 1 Schematic representation of FO filtration process |
| |
3) 每组实验结束后, 将管路上的蠕动泵开至流速最大, 用去离子水冲洗管路30 min, 循环至流出液的浓度降至5 μS·cm-1左右为止。
1.2 实验分析 1.2.1 水通量水通量是膜分离过程性能的一个重要指标, 实验中用天平实时记录驱动液侧的质量变化。水通量按公式(1)计算:
| $ {J_{\rm{W}}} = \frac{{\Delta m}}{{\rho S\Delta t}} $ | (1) |
式(1)中:JW为水通量, L·m-2·h-1; Δm为实验运行时间段内驱动液的质量变化, kg; Δt为实验运行时间, h; S为单位有效膜面积, m2; ρ为溶液密度, g·cm-3。
1.2.2 反向盐通量基于渗透的原理, 在系统运行时, 驱动液侧的溶质会在膜两侧浓度差的作用下扩散到原料液侧, 从而造成驱动液的损失, 影响正渗透的整体性能, 增加系统能耗。实验中, 通过电导率仪实时记录料液电导率及相应时刻浓度, 根据物料守恒, 采用公式(2)计算反向盐通量:
| $ {J_{\rm{S}}} = \frac{{\Delta ({C_{\rm{F}}}{V_{\rm{F}}})}}{{S\Delta t}} $ | (2) |
式(2)中:JS为反向盐通量, mol·m-2·h-1; VF为相应时刻的原料液体积, L; CF为相应时刻的原料液浓度, mol·L-1; 公式(2)中的浓度通过测得的溶液电导率值, 并结合不同电极常数(1.0或10.0)及溶液浓度时溶液浓度和电导率拟合曲线计算得到。
1.2.3 溶液性质溶液的特性参数主要包括黏度、渗透压和扩散系数。在正渗透实验中, 通过经验公式计算温度、浓度对溶液特性的影响, 计算公式如式(3)~(6):
1) 理论渗透压计算公式中, 渗透压与浓度、温度呈正比关系, 但是在实际中, 3者之间并非简单的线性关系。论文中渗透压公式为[22]:
| $ \left\{ \begin{array}{l} {\rm{ \mathsf{ π} }}\left( {C, T} \right) = \left( {0.6955 + 0.0025T} \right) \times {10^8}\left( {\frac{C}{\rho }} \right)\\ \rho = 498.4m + \sqrt {248400{m^2} + 752.4mC} \end{array} \right. $ | (3) |
式(3)中:m=1.0039-2.757×10-4 T, T为溶液温度, ℃; C为溶液浓度, mol·L-1; ρ为溶液密度, kg·m-3。
2) 改变溶液温度时, 水的黏度也将发生改变, 其计算公式为[23]:
| $ {v_{\rm{w}}} = 9.607 \times {10^{-8}}{\rm{exp}}\left( {\frac{{2.9}}{{{T_{\rm{R}}}^3}}} \right) $ | (4) |
式(4)中, 标准温度
| $ \frac{v}{{1000\rho {v_{\rm{w}}}}} = 1 + 0.12{C_{{\rm{NaCl}}}}{\rm{exp}}\left( {\frac{{{C_{{\rm{NaCl}}}}^{-0.44}}}{{-3.713{T_{\rm{R}}} + 2.792}}} \right) $ | (5) |
式(5)中:CNaCl为NaCl溶液的浓度, mol·L-1。
3) 改变溶液温度时, NaCl溶液中溶质的扩散系数D(10-9 m2/s)可用公式(6)计算[16]:
| $ \left\{ \begin{array}{l} D = 1.7862 \times {10^{- 9}}\left( {\frac{{{\lambda ^ + }{\lambda ^- }}}{{{\lambda ^ + } + {\lambda ^- }}}} \right)\left( {T + 273.15} \right)\\ {\lambda ^ + } = 0.00435\left[{1 + 0.0244\left( {T-18} \right)} \right]\\ {\lambda ^ - } = 0.00436\left[{1 + 0.0256\left( {T-18} \right)} \right] \end{array} \right. $ | (6) |
式(6)中:λ为离子的当量电导率, S·cm-1·g-1。
2 结果与讨论 2.1 膜池的结构设计作为核心部件, 正渗透膜池的结构设计是提升分离性能的一个重要方面。在正渗透过程中, 水通量主要受膜两侧有效渗透压的影响, 而膜池的结构又会对料液的流体分布状态、过程传质和浓差极化效应产生影响, 因此本论文首先对膜池结构进行设计优化, 以降低组件结构对后续实验效果的影响, 从而达到提高过程性能的目的。图 2给出了2种不同的膜池内部结构设计方案。
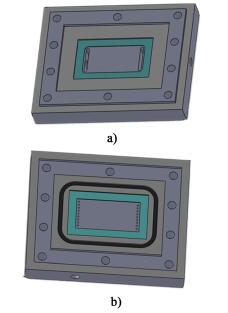
|
| 图 2 膜池内部结构设计方案 Figure 2 Diagram of membrane module internal design |
| |
如图 2所示, 2种膜池结构的主要区别在于两端进出口流道的设计。图 2a)中两侧膜池的料液进出口流道均设计为开放式大尺寸沟槽, 而图 2b)将进出口流道改为均匀排列的圆形小孔。本论文采用CFD模拟研究的方法对膜池腔室内部的液体速度分布状态进行对比分析。图 3为研究2种膜在进口流量为500 mL/min时, 从左向右沿流道方向的膜面速度场云图。
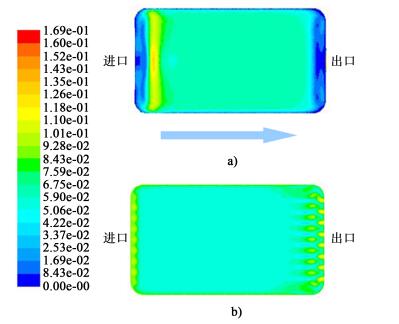
|
| 图 3 膜池流体速度场云图 Figure 3 The field cloud picture of flow rate in membrane module |
| |
由速度云图可知, 图 2a)的结构设计中, 由于沟槽处流体边界层的影响, 膜池进出口的膜面流速分布不均一, 从而会对进出口处膜两侧的溶液传质产生一定的影响。同时, 进出口的开放式大尺寸沟槽可能会导致膜破损, 造成原料液与驱动液之间的串流。从图 3b)中可以发现, 将凹槽设计为均匀排列的九个小圆孔, 可以使膜池两端的进出口实现均匀布液, 从而增加膜两侧的溶液接触效率, 实现溶液渗透压的充分利用。本研究选择图 2b)结构的膜池进行实验。
2.2 膜朝向对正渗透过程的影响正渗透系统的膜池中主要包括由活性层和支撑层组成的非对称膜、低浓度的原料液及高浓度的驱动液, 而膜朝向会对过程中的浓差极化类型和通量性能产生影响。当膜的活性层朝向原料液时, 为FO模式; 而当膜的活性层朝向驱动液时, 为PRO模式。为了避免实验中多种浓差极化的相互影响, 首先以去离子水为原料液, 0.5 mol·L-1 NaCl溶液为驱动液, 记录一定时间段内的通量变化, 研究不同膜朝向中浓差极化对水通量的影响。其次, 保持相同的浓度差, 以0.1 mol·L-1 NaCl溶液为原料液, 研究多种类型的浓差极化共同作用, 对正渗透通量的影响。图 4表示不同膜摆向下水通量随时间的变化曲线。
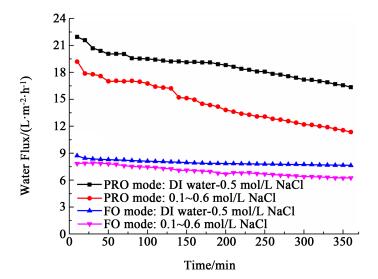
|
| 图 4 不同膜摆向对正渗透水通量的影响 Figure 4 Influence of the membrane orientation on water flux in forward osmosis |
| |
如图 4所示, 以去离子水为原料液时, PRO模式的初始水通量达到21.94 L·m-2·h-1, FO模式的初始水通量只有8.72 L·m-2·h-1; 而当保持浓度差相同, 以0.1 mol·L-1 NaCl溶液为原料液时, PRO模式的初始水通量为19.19 L·m-2·h-1, FO模式的初始水通量为7.84 L·m-2·h-1。在整个渗透过程中, PRO模式的水通量始终高于同条件下的FO模式。此时, 膜两侧的主体渗透压差相等, PRO模式中只发生稀释的外浓差极化, 而FO模式中只发生稀释的内浓差极化, 2种膜朝向下存在的水通量差异说明内浓差极化的不利影响要远远大于外浓差极化。
此外, 2种模式下的水通量均随时间呈衰减趋势, 但是PRO模式的水通量衰减速度总是大于FO模式, 且随着原料液浓度的增大, 这种下降趋势更加明显。造成这种现象的原因是:PRO模式在开始时, 浓差极化现象并不明显, 但是随着时间的推移, 驱动液中的部分NaCl溶质会不断的扩散到原料液, 并在支撑层内积累, 从而产生浓缩的内浓差极化, 使得极化现象越来越严重, 从而造成膜两侧的有效渗透压差不断降低。本研究后续实验采用脱盐效率高、水通量相对稳定的FO模式作为主要的操作模式。
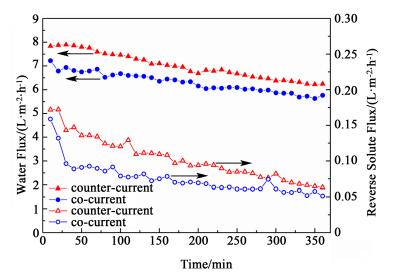
2.3 流动方式对正渗透过程的影响正渗透过程中, 膜的两侧均有溶液循环流动, 根据两侧溶液流动方向的不同, 可以将料液的流动方式分为逆流和并流两种。逆流即原料液和驱动液在流道中沿相反方向流动, 而并流即为2种溶液沿相同方向循环流动。在FO模式下, 以0.1 mol·L-1 NaCl为原料液, 0.6 mol·L-1 NaCl为驱动液, 流速控制在500 mL·min-1, 考察流动方式对水通量和反向盐通量的影响。图 5表示不同流动方式下的正渗透通量变化。
|
| 图 5 不同流动方式下的正渗透通量变化 Figure 5 The flux variation under different flow direction |
| |
由图 5可知, 随着时间的推移两种流动方式下水通量随着时间变化均呈现下降趋势。这主要是因为实验是在闭路循环系统中进行的, 随着纯水的不断渗透, 原料液的浓度逐渐增加, 驱动液的浓度逐渐降低, 使得膜两侧的有效浓度差不断减小, 即渗透压驱动力不断降低。
如图 5所示, 逆流时的水通量高于并流。主要原因是逆流时沿流道方向, 膜两侧的平均溶液浓度差较大, 过程传质驱动力较大, 同时, 逆流可以在两侧溶液间产生较大的相对速度, 有利于缓解浓差极化; 而并流时, 沿流道方向原料液不断被浓缩, 驱动液不断被稀释, 使得沿流动方向膜两侧的有效驱动力逐渐下降。此外从图 5中还可以发现, 逆流时的反向盐通量也略高于并流, 这主要是因为逆流时整个膜池流程中膜两侧的有效浓度差比并流时大, 从而在浓度差的驱动下, 导致反向盐通量出现略微升高。综合考虑水通量JW和反向盐通量JS, 对JS/JW进行分析发现, 产生单位渗透水时, 逆流方式下由驱动液向原料液渗透的溶质量小于并流方式, 因此本论文后续实验采用逆流操作。
2.4 温度对正渗透过程的影响 2.4.1 温度对溶液性质的影响温度对溶液的渗透压及其他热力学参数(黏度、扩散系数等)有着直接影响, 因此可以通过温度的优化强化传质, 缓解浓差极化效应的不利影响。由公式(6)可知, 当溶液温度为20、25和30 ℃时, NaCl溶质的扩散系数分别为1.19、1.36和1.81, 说明溶质的扩散系数随溶液温度的增加呈增大趋势, 且温度越高, 影响越显著。本论文2.2小节中指出, 影响水通量性能的主要因素是内浓差极化, 因此可通过升高驱动液侧的溶液温度, 增大驱动液中溶质的扩散系数, 进而有效地减小内浓差极化现象的影响。
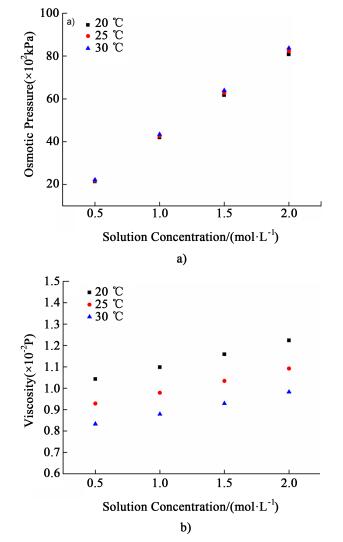
此外由公式(3)和(5)可知, 溶液的渗透压和黏度与温度和浓度均相关, 因此温度对具有不同浓度的原料液和驱动液的影响一定存在差异。图 6表示不同浓度NaCl溶液在不同温度下的渗透压和黏度变化情况。
|
| 图 6 NaCl溶液渗透压a)及黏度b)随浓度与温度的变化情况 Figure 6 The variations of NaCl solution osmotic pressure a) and viscosity b) at different concentrations and temperatures |
| |
从图 6a)中可以发现, 当溶液浓度为0.5 mol·L-1时, 将温度从20 ℃升高至25 ℃, 渗透压增加约1.80%, 而升温至30 ℃时, 增加约1.82%, 说明升高温度可以增加溶液渗透压, 但程度比较微弱; 当溶液浓度为2.0 mol·L-1时, 将温度从20 ℃升高至25 ℃, 渗透压的增幅为3.60%, 而升温至30 ℃, 其增幅为3.63%, 说明高浓度时溶液的渗透压对温度较低浓度时更敏感。因此, 在正渗透过程中驱动液侧的渗透压随温度的变化一定大于原料液侧, 因此可以通过升高温度增加膜两侧的渗透压差, 从而提高水通量。
如图 6b)所示, 当溶液浓度为0.5 mol·L-1时, 将温度从20 ℃升高至25 ℃及30 ℃时, NaCl溶液的黏度分别降低10.97%和20.14%;当溶液浓度为2.0 mol·L-1时, 将温度从20 ℃升高至25 ℃及30 ℃时, 溶液的黏度分别降低10.72%和19.72%。这说明溶液黏度随温度的升高呈现明显降低的趋势, 且其变化程度远远大于渗透压。因此, 可以通过升温来降低溶液黏度, 从而增加边界层中的传质扩散速度, 缓解浓差极化, 提高过程水通量。
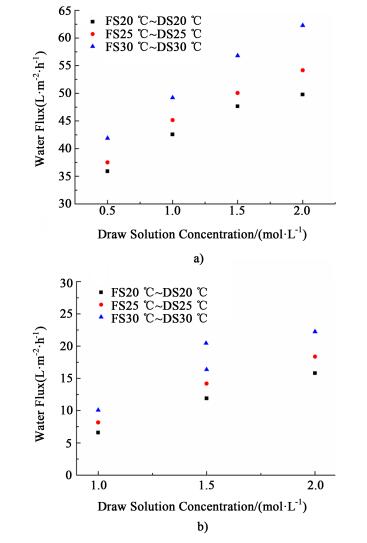
2.4.2 溶液温度同步升高对水通量的影响首先, 在两侧溶液温度相同的条件下, 设定原料液和驱动液温度分别为20、25和30 ℃, 研究不同浓度条件下, 温度对FO过程水通量性能的影响规律。图 7表示在FO操作模式下, 以去离子水[图 7a)]及以0.5 mol·L-1NaCl溶液[图b)]为原料液, 不同浓度的NaCl溶液为驱动液时, 温度对水通量性能的影响。
|
| 图 7 以去离子水为原料液a)及以0.5 mol·L-1 NaCl为原料液b)FO过程水通量的变化情况 Figure 7 The variations of water flux with feed solution of DI water a) and 0.5 mol·L-1 NaCl b) in FO process |
| |
如图 7a)所示, 以去离子水为原料液, 当驱动液浓度为0.5 mol·L-1时, 将温度从20 ℃升高至25 ℃, 水通量增加4.46%, 而升温至30 ℃时, 水通量增加19.69%;当驱动液浓度增加至1.5 mol·L-1时, 将温度从20 ℃升高至25 ℃, 水通量增加约5.08%, 而升温至30 ℃时, 水通量增加约24.91%;由上可知升高溶液温度可以增加过程水通量。这主要是因为升温增加了驱动液侧的渗透压, 使得过程中的有效驱动力增加; 同时, 升温造成原料液侧去离子水的黏度降低, 更有利于原料液中的纯水快速渗透; 另外, 升温也降低了驱动液侧的溶液黏度, 增加了NaCl溶质的扩散系数, 从而削弱支撑层侧的浓差极化现象。
从图 7b)中可以发现, 以0.5 mol·L-1 NaCl溶液为原料液, 当驱动液浓度为1.0 mol·L-1时, 升温至25 ℃, 水通量增加23.67%, 而升温至30 ℃时, 水通量增加52.81%;当驱动液浓度为2.0 mol·L-1时, 升温至25 ℃, 水通量增加16.82%, 而升温至30 ℃时, 水通量增加40.79%;因此升高两侧的溶液温度可以明显增加水通量, 且增幅大于以去离子水为原料液时的值。在本研究2.4.1中指出, 溶液浓度越大, 升温对黏度、渗透压的影响越大, 因此在图 7b)中同时增加原料液和驱动液温度, 驱动液的渗透压增加程度大于原料液, 最终表现为膜两侧渗透压差随温度的升高而增加; 此外, 温度升高使得原料液侧浓缩的外浓差极化边界层中的溶质扩散速度增加, 使得活性层表面的溶液浓度降低, 同时, 支撑层侧的溶质和渗透水也在温度的作用下更容易实现相互混合, 有效地削弱了内浓差极化的影响, 最终造成活性层两侧的有效浓度差增加。
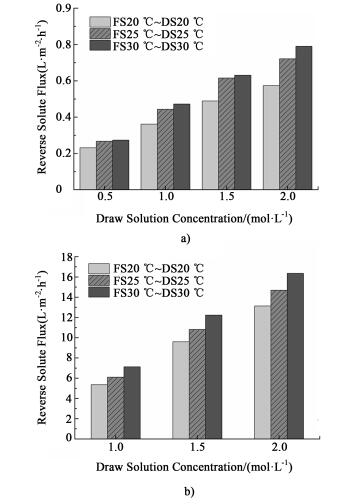
图 8表示以去离子水[图 8a)]及以0.5 mol·L-1 NaCl溶液[图 8b)]为原料液, 不同浓度的NaCl溶液为驱动液时, 温度对反向盐通量性能的影响。由图可知, 在FO过程中, 随着温度的升高, 膜两侧的有效浓度差增大, 在分子扩散和对流扩散的共同作用下, 反向盐通量也呈现上升的趋势。
|
| 图 8 以去离子水为原料液a)及以0.5 mol·L-1 NaCl为原料液b)FO过程反向盐通量的变化情况 Figure 8 The variations of specific reverse flux with feed solution of DI water a) and 0.5 mol·L-1 NaCl b) in FO process |
| |
为了进一步分析温度改变所带来的利弊影响, 对FO过程的比盐通量JS/JW(单位产水情况下, 从驱动液侧渗透至原料液侧的溶质物质的量)进行分析。图 9表示在FO操作模式下, 以去离子水[图 9a)]及以0.5 mol·L-1 NaCl溶液[图 9b)]为原料液, 不同浓度的NaCl溶液为驱动液时, 温度对比通量性能的影响。
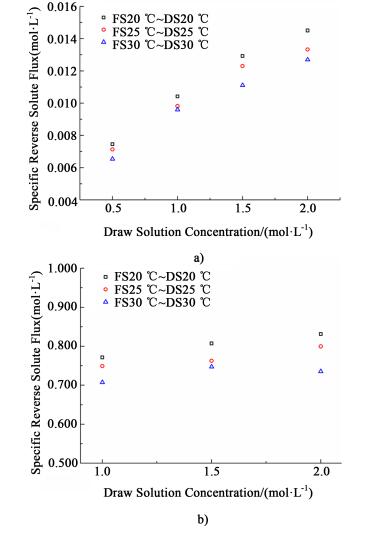
|
| 图 9 以去离子水为原料液a)及以0.5 mol·L-1 NaCl为原料液b)FO过程比通量的变化情况 Figure 9 The variations of specific reverse flux with feed solution of DI water a) and 0.5 mol·L-1 NaCl b) in FO process |
| |
结果表明, 在相同溶液配对体系条件下, 随着温度的升高, 比通量呈现下降的趋势, 这说明温度的升高对水通量的增加程度要大于反向盐通量, 从而有利于正渗透性能的提升。其可能的原因是, 首先升温可以降低水的黏度, 提高膜支撑层中有效孔隙的润湿性, 从而增加水通量; 其次, 升温可以降低支撑层中的溶质扩散阻力系数, 从而有利于驱动液溶质从活性层沿渗透水方向反向扩散, 从而降低溶质从驱动液向原料液渗透; 最后, 温度可能对水分子扩散影响大于溶质扩散。总而言之, 在膜的耐受温度范围内, 可以通过升温改变溶液的特性, 减小浓差极化的影响, 达到增加水通量的目的。
2.4.3 溶液温度单边升高对水通量的影响温度的改变对FO过程性能产生重要的影响, 但是由于在FO过程中, 膜的两侧都存在流动的溶液, 温度对不同侧溶液的影响程度是否存在差异, 这一问题值得研究。
实验保持一侧料液温度维持在20 ℃, 增加另一侧料液温度至30 ℃, 研究单侧溶液温度改变对正渗透水通量性能的影响。图 10表示保持膜两侧的浓度差为0.5 mol·L-1, 以去离子水[图 10a)]及以0.5 mol·L-1 NaCl溶液[图 10b)]为原料液, 改变单侧溶液温度, 水通量随时间的变化情况。
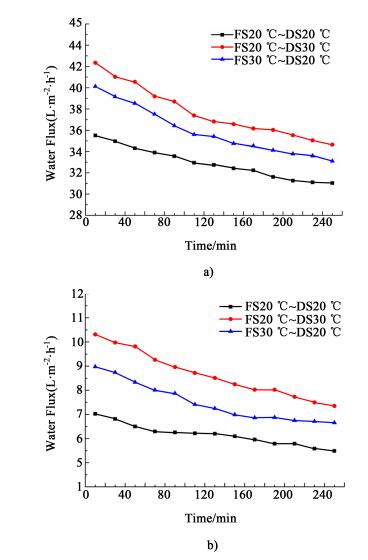
|
| 图 10 以去离子水为原料液a)及以0.5 mol·L-1 NaCl为原料液b)FO过程单侧溶液温度对水通量的变化情况 Figure 10 The variations of water flux with feed solution of DI water a) and 0.5 mol·L-1 NaCl b) in FO process when temperature changed in single side |
| |
图 10中, 当以去离子水为原料液, 保持原料液温度维持在20 ℃, 升高驱动液温度至30 ℃, 初始水通量由35.51 L·m-2·h-1增加至42.14 L·m-2·h-1, 增幅约为18.67%;而当保持驱动液温度为20 ℃, 升高原料液温度至30 ℃时, 水通量增加至40.11 L·m-2·h-1, 增幅约为12.95%。当以0.5 mol·L-1 NaCl溶液为原料液时, 单独升高驱动液温度至30 ℃, 初始水通量由7.02 L·m-2·h-1增加至10.31 L·m-2·h-1, 增幅约为46.87%;而当保持驱动液温度为20 ℃, 升高原料液温度至30 ℃时, 水通量增加至8.97 L·m-2·h-1, 增幅约为27.78%。上述两组结果表明, 单独升高驱动液的温度所带来的水通量增加幅度明显大于单独升高原料液温度所带来的变化。造成这种现象的原因主要是, 驱动液的浓度较大, 升高驱动液侧的温度, 可以显著降低黏度, 增加NaCl溶质的扩散系数, 从而使得边界层的极化阻力变小, 有效地降低内浓差极化所带来得渗透压损失, 从而大幅度地增加水通量。
温度在改变水通量的同时也会改变反向盐通量。通过实验发现, 以去离子水为原料液, 膜两侧溶液均为20 ℃时, 反向盐通量为0.232 L·m-2·h-1, 当单独升高驱动液温度至30 ℃时, 反向盐通量增至0.271 L·m-2·h-1, 增幅约为16.81%;保持驱动液侧温度为20 ℃, 单独升高原料液温度至30 ℃, 反向盐通量增至0.265 L·m-2·h-1, 增幅约为14.22%。当以0.5 mol·L-1 NaCl溶液为原料液时, 单独升高驱动液温度, 反向盐通量由6.35 L·m-2·h-1增加至6.60 L·m-2·h-1, 增幅约为3.94%;而单独升高原料液温度, 反向盐通量增加至6.54 L·m-2·h-1, 增幅约为2.99%。研究表明, 单独升高一侧溶液的温度时, 反向盐通量均有所增加, 但是增加幅度并不明显。
在考察溶液温度单边升高对水通量的影响过程中, 发现单独升高驱动液温度可以达到较好的水通量水平, 同时反向盐通量随单边温度升高的增幅小于双侧温度升高时的值。本研究最后对驱动液温度单边强化和溶液温度双边强化的水通量结果进行比较分析。当以去离子水为原料液, 0.5 mol·L-1 NaCl为驱动液时, 升高双侧溶液温度至30 ℃, 水通量增加19.69%, 而单独升高驱动液温度至30 ℃, 水通量增加18.24%;当以0.5 mol·L-1 NaCl为原料液, 1.0 mol·L-1 NaCl为驱动液时, 升高双侧溶液温度至30 ℃, 水通量增加52.81%, 而单独升高驱动液温度至30 ℃, 水通量增加46.87%。通过比较发现, 双边温度强化的效果确实优于驱动液单边温度强化, 但是两种方法的优化结果相差并不明显。在综合考虑过程能耗和水通量性能的前提下, 本研究认为单独升高驱动液温度更加具有实际意义。
3 结论正渗透膜分离技术以渗透压差为驱动力, 具有能耗低、截盐率高及环境友好等特点。本论文采用水流分布较佳的新型结构膜池, 对膜朝向、流动方式、温度进行研究, 主要得到以下结论:
1) PRO模式的水通量明显高于FO模式, 但其衰减程度较大; 当溶液浓度差相等时, 逆流操作由于其膜两侧的浓度差和速度差较大, 更有利于水通量的提高。
2) 同时升高膜两侧溶液的温度时, 正渗透过程的水通量和反向盐通量均增加, 但是水通量的增加幅度大于反向盐通量。
3) 单独升高驱动液温度, 水通量的增幅约为46.87%, 明显大于单独升高原料液温度时的水通量增幅27.78%, 证明驱动液温度对水通量性能的提升效果优于原料液。
4) 相同浓度条件下, 双边温度强化的水通量增幅约为52.81%;综合考虑过程能耗和系统性能, 认为单独升高驱动液温度更具实用价值。
| [1] |
Liu W, Su R. Analysis of trend and development on seawater utility in China and abroad[J]. Advances in Marine Sciences, 2015(2): 1-6. |
| [2] |
Roy D, Rahni M, Pierre P, et al. Forward osmosis for the concentration and reuse of process saline wastewater[J]. Chemical Engineering Journal, 2015, 287: 277-284. |
| [3] |
Hoover L A, Phillip W A, Tiraferri A, et al. Forward with osmosis:Emerging applications for greater sustainability[J]. Environmental Science & Technology, 2011, 45(23): 9824-9830. |
| [4] |
Cath T Y, Childress A E, Elimelech M. Forward osmosis:Principles, applications, and recent developments[J]. Journal of Membrane Science, 2006, 281(1/2): 70-87. |
| [5] |
Coday B D, Pei X, Beaudry E G, et al. The sweet spot of forward osmosis:Treatment of produced water, drilling wastewater, and other complex and difficult liquid streams[J]. Desalination, 2014, 333(1): 23-35. DOI:10.1016/j.desal.2013.11.014 |
| [6] |
Benavides S, Phillip W A. Water recovery and solute rejection in forward osmosis modules:Modeling and bench-scale experiments[J]. Journal of Membrane Science, 2016, 505: 26-35. DOI:10.1016/j.memsci.2016.01.026 |
| [7] |
Nguyen T P N, Jun B M, Park H G, et al. Concentration polarization effect and preferable membrane configuration at pressure-retarded osmosis operation[J]. Desalination, 2016, 389: 58-67. DOI:10.1016/j.desal.2016.02.028 |
| [8] |
Kuang W, Liu Z, Yu H, et al. Investigation of internal concentration polarization reduction in forward osmosis membrane using nano-CaCO3 particles as sacrificial component[J]. Journal of Membrane Science, 2015, 497(4): 485-493. |
| [9] |
Zhao S, Zou L, Tang C, et al. Recent developments in forward osmosis:Opportunities and challenges[J]. Journal of Membrane Science, 2012, 396(1): 1-21. |
| [10] |
Chung T S, Li X, Rui C, et al. Emerging forward osmosis (FO) technologies and challenges ahead for clean water and clean energy applications[J]. Current Opinion in Chemical Engineering, 2012, 1(3): 246-257. DOI:10.1016/j.coche.2012.07.004 |
| [11] |
Alsvik I L, May-Britt H. Pressure retarded osmosis and forward osmosis membranes:Materials and methods[J]. Polymers, 2013, 5(1): 303-327. DOI:10.3390/polym5010303 |
| [12] |
Ge Q, Ling M, Chung T S. Draw solutions for forward osmosis processes:Developments, challenges, and prospects for the future[J]. Journal of Membrane Science, 2013, 442(9): 225-237. |
| [13] |
Wong M C Y, Martinez K, Ramon G Z, et al. Impacts of operating conditions and solution chemistry on osmotic membrane structure and performance[J]. Desalination, 2012, 287(5): 340-349. |
| [14] |
Phuntsho S, Sahebi S, Majeed T, et al. Assessing the major factors affecting the performances of forward osmosis and its implications on the desalination process[J]. Chemical Engineering Journal, 2013, 231: 484-496. DOI:10.1016/j.cej.2013.07.058 |
| [15] |
Shim S M, Kim W S. A numerical study on the performance prediction of forward osmosis process[J]. Journal of Mechanical Science & Technology, 2013, 27(4): 1179-1189. |
| [16] |
You S, Wang X, Zhong M, et al. Temperature as a factor affecting transmembrane water flux in forward osmosis:Steady-State modeling and experimental validation[J]. Chemical Engineering Journal, 2012, s 198/199(8): 52-60. |
| [17] |
Zhao S, Zou L. Effects of working temperature on separation performance, membrane scaling and cleaning in forward osmosis desalination[J]. Desalination, 2011, 278(1): 157-164. |
| [18] |
钟铭, 尤世界, 王秀蘅, 等. 温度对正向渗透的影响机制与数值模拟[J]. 化工学报, 2012, 63(10): 3143-3151. Zhong Ming, You Shijie, Wang Xiuheng, et al. Effect of temperature on forward osmosis and its numerical simulation[J]. CIESC Journal, 2012, 63(10): 3144-3151. (in Chinese) |
| [19] |
Mccutcheon J R, Elimelech M. Influence of concentrative and dilutive internal concentration polarization on flux behavior in forward osmosis[J]. Journal of Membrane Science, 2006, 284(1/2): 237-247. |
| [20] |
Suh C, Lee S. Modeling reverse draw solute flux in forward osmosis with external concentration polarization in both sides of the draw and feed solution[J]. Journal of Membrane Science, 2013, 427(1): 365-374. |
| [21] |
Sagiv A, Christofides P D, Cohen Y, et al. On the analysis of FO mass transfer resistances via CFD analysis and film theory[J]. Journal of Membrane Science, 2015, 495: 198-205. DOI:10.1016/j.memsci.2015.08.022 |
| [22] |
Miyake Y. Chemical studies of the western pacific ocean. Ⅲ. Freezing point, osmotic pressure, boiling point, and vapour pressure of sea water[J]. Bull Chem Soc Jpn, 1939, 14: 58-62. DOI:10.1246/bcsj.14.58 |
| [23] |
Chenlo F, Moreira R, Pereira G, et al. Viscosities of aqueous solutions of sucrose and sodium chloride of interest in osmotic dehydration processes[J]. Journal of Food Engineering, 2002, 54(4): 347-352. DOI:10.1016/S0260-8774(01)00221-7 |
 2018, Vol. 35
2018, Vol. 35





