2. 精馏技术国家工程研究中心, 天津 300072
2. National Engineering Research Centre of Distillation Technology, Tianjin 300072, China
异佛尔酮(Isophorone,简写IP),化学名称为3, 5, 5-三甲基-2-环己烯-1-酮,是丙酮的重要衍生品之一。其具有高沸点、低吸湿性、低挥发速率、高溶解能性及良好的分散性和流动性,作为一种性能良好的酮类溶剂在工业生产中得到广泛应用。此外,异佛尔酮还是一种重要的化学品中间体,其下游产品在涂料、塑料、医药、农药等领域中具有广泛的用途[1-3]。
目前工业上生产异佛尔酮主要采用丙酮液相缩合法,但该工艺需要在高压条件下进行,反应釜结构复杂,碱性溶液催化剂容易腐蚀设备,废碱液后处理困难,对环境危害较大。国内外科学研究者开始转向研究固体碱催化丙酮气固相缩合法,该工艺反应条件为常压,产品和催化剂容易分离,操作简单,工艺易于放大,同时符合绿色化学生产原则,生产过程中不产生污染,对环境友好[4]。
近年来,丙酮气固相催化主要研究的催化剂有钙氢氧化物及氧化物[5]、镁铝氢氧化物及氧化物[6-8]、钛基催化剂[9-10]、分子筛[11-12]和碳纳米催化剂[13]等,其中关于镁铝体系催化剂的研究最为详细和深入,其表现出比较好的催化活性,是目前最常用的一类催化剂,但仍有许多问题亟待解决,如催化剂热稳定性不高,易于失活,再生困难等。
分子筛固体碱除了具有固体碱的特性外,还具有规则的孔道、较高的比表面积、较好的热稳定性和再生方便等优点,对丙酮缩合制备异佛尔酮表现出一定的催化性能,但目前的研究比较少。本实验通过离子交换法和浸渍法引入碱金属元素对分子筛进行改性,以期提高其反应活性。
1 实验部分 1.1 催化剂的制备 1.1.1 离子交换法制备过程将NaX分子筛与0.2 mol/L的CsNO3溶液按固液比1:10均匀混合,在80 ℃水浴中恒温搅拌6 h,再经真空抽滤、洗涤,在110 ℃条件下干燥10 h,重复1次上述过程,即完成2次交换,最后在马弗炉中500 ℃煅烧5 h,得到白色粉末状固体,记做CsX-IE。
1.1.2 浸渍法制备过程首先测定NaX分子筛的饱和吸水量,并根据分子筛负载的Cs元素量,配制相应浓度的CsAc浸渍液。采用等体积浸渍法,用配好的浸渍液浸渍NaX分子筛并搅拌均匀。将浸渍好的样品放在室温下干燥6 h,之后在110 ℃下烘干10 h,最后在马弗炉中500 ℃煅烧5 h,得到白色粉末状固体,记做CsX-IMP。
1.2 催化剂的表征SEM分析采用SU8010日本日立(Hitachi)型扫描电子显微镜,先经过喷金等常规前处理过程,后放入样品台,观察催化剂的表面形貌特征。
XRD测试在日本理学株式会社Rigaku D/max-2500型X射线衍射仪上进行。以Cu_Kα(λ=0.154 nm)作为射线源,工作电压为40 kV,工作电流为100 mA,扫描范围2θ为2°~50°,扫描步长0.02°,扫描速度8 (°)/min。
FT-IR分析在Thermo Scientific Nicolet 6700傅里叶红外光谱仪上进行检测,样品先与光谱纯KBr混合,研磨压片后,放入样品架中开始检测,谱图检测范围为400~4 000 cm-1。
BET测试在美国康塔仪器公司Autosorb-iQ2-MP型双站全自动比表面和孔径分析仪上进行。测定前,样品在300 ℃下,真空脱气预处理3 h,之后在-196 ℃进行N2低温吸附和脱附过程。采用BET法计算样品的比表面积,用DFT法计算孔径和孔容。
TG-DTA分析在NETZSCH STA 449F3 TG-DSC热分析仪上进行,将样品放在热天平上,载气和保护气均为空气,气体流速分别为50和20 mL/min,以10 ℃/min升温速率从35 ℃升至900 ℃,记录样品的热失量情况。
CO2-TPD采用天津市先权工贸发展有限公司的TP-5080型全自动化学吸附仪进行检测。称取0.10 g 40~60目催化剂样品装入U型石英管,通入氦气至焙烧温度预处理1 h,待温度降至50 ℃,关闭氦气,恒温连续进行CO2吸附直至吸附饱和。吸附结束后,打开氦气,吹扫使基线平稳。以10 ℃/min的升温速率自50 ℃开始升温至焙烧温度,进行气体的脱附,检测在升温过程中CO2分子脱附信号,即得相应的TPD曲线。
1.3 催化剂的活性评价催化剂的活性评价在固定床微反应装置上进行。将3 mL 40~60目的催化剂装填到不锈钢反应管(Φ20 mm×50 mm)中,在氮气气氛下以10 ℃/min的升温速率升至反应温度,吹扫1 h除去催化剂表面吸附的CO2和H2O。丙酮通过微量进样泵,经预热器预热气化后进入反应器,进行催化反应,产物经冷凝管冷却后进入收集瓶。
反应产物采用Agilent7890 A气相色谱仪进行定量分析,采用FID检测器,HP-5毛细管柱(30 m柱长×0.32 m内径×0.25 μm膜厚)。载气为高纯氮气,燃气为高纯氢气,助燃气为空气。柱温采用程序升温:初始温度60 ℃,保持1 min,升温速率10 ℃/min,升温至160 ℃,保持10 min。进样器温度250 ℃,检测器温度250 ℃。
2 结果与讨论 2.1 催化剂的表征结果 2.1.1 SEM分析结果对未改性的NaX分子筛、CsX-IE分子筛和CsX-IMP分子筛进行扫描电镜分析,结果如图 1所示。

|
| 图 1 分子筛催化剂的SEM图 Figure 1 SEM images of molecular sieve catalysts |
| |
从图 1a)和1b)中可以看出未改性的NaX分子筛分布比较均匀,颗粒大小相近。观察图 1c)和图 1d)可发现分子筛分散均匀,颗粒形状没有明显变化,这说明Cs元素能够均匀的分散在NaX分子筛内部。观察图 1e)和图 1f),可知经浸渍法改性后的分子筛分布也比较均匀,形状也没有明显变化,但能看到表面有一些纳米级的颗粒,这是由于浸渍法制备的分子筛表面有比较多的Cs离子经过煅烧形成Cs2O颗粒。
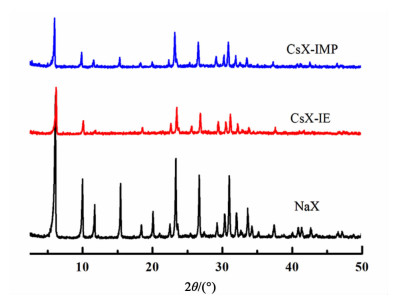
2.1.2 XRD分析结果图 2为未改性的NaX分子筛、CsX-IE分子筛和CsX-IMP分子筛的XRD图。
|
| 图 2 分子筛催化剂的XRD图 Figure 2 XRD patterns of molecular sieve catalysts |
| |
从图 2中可以看出,无论CsX-IE分子筛还是CsX-IMP分子筛衍射峰位置与NaX分子筛衍射峰位置基本一致,没有出现新的衍射峰,说明分子筛晶体结构没有明显变化,Cs元素在催化剂中分散良好,但衍射峰的强度都有降低,这是因为离子半径较大的Cs离子取代了原来分子筛骨架中的Na离子,对分子筛结构造成了一定的影响,使结晶度降低。同时可以发现制备改性分子筛的方法基本不会对分子筛晶体结构产生影响。
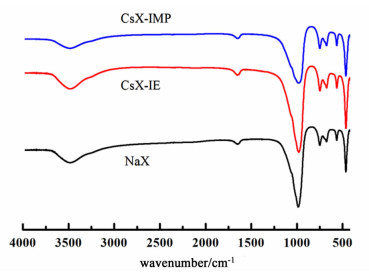
2.1.3 FT-IR分析结果图 3为未改性的NaX分子筛、CsX-IE分子筛和CsX-IMP分子筛的FT-IR谱图。
|
| 图 3 分子筛催化剂的FT-IR谱图 Figure 3 FT-IR spectras of molecular sieve catalysts |
| |
从NaX分子筛的红外谱图中可以看出,在3 450 cm-1很强的吸收峰,1 650 cm-1处出现的较弱的吸收峰,这2个位置的峰分别是由于分子筛吸附的水分子的羟基伸缩振动和弯曲振动所致。在980 cm-1处的吸收峰是由于骨架Si—O—Si和Al—O—Al的反对称伸缩振动引起的,在750、694和671 cm-1处的吸收峰均是由于骨架Si—O—Si和Al—O—Al的对称伸缩振动引起的,464 cm-1的吸收峰为骨架Si—O—Si和Al—O—Al的弯曲振动吸收峰,563 cm-1处的吸收峰为骨架次级结构的振动吸收峰。
相比于未改性的NaX分子筛,CsX-IE和CsX-IMP的吸收峰的位置和数目没有变化,强度略有变化,谱图形状基本不变,说明改性后分子筛的骨架结构未发生明显变化。
2.1.4 BET分析结果未改性NaX分子筛、CsX-IE分子筛和CsX-IMP分子筛的比表面积和孔结构数据见表 1。
| 催化剂 | 比表面积/(m2·g-1) | 孔容/(mL·g-1) | 孔径/nm |
| NaX | 685 | 0.278 | 0.576 |
| CsX-IE | 621 | 0.256 | 0.548 |
| CsX-IMP | 661 | 0.271 | 0.573 |
从表 1中可以看出,NaX分子筛具有很高的比表面积685 m2/g,远远高于目前常用催化丙酮缩合的镁铝催化剂(一般的比表面积为200 m2/g)。较大的比表面积能够提供更多的活性反应中心,使反应速率和反应活性增加。此外,分子筛的孔径为0.576 nm,对反应产物有很好的选择性。
与未改性的NaX分子筛相比,CsX-IE和CsX-IMP的比表面积、孔容、孔径都略有降低,但差别不大,可见改性后的分子筛依然保持着很高的比表面积。
2.1.5 TG分析结果图 4中3条曲线分别为未改性的NaX分子筛、CsX-IE分子筛和CsX-IMP分子筛在35~900 ℃范围内的热重分析曲线。

|
| 图 4 分子筛催化剂的热重图 Figure 4 TG-DTA profiles of molecular sieve catalysts |
| |
NaX分子筛在50~190 ℃范围内脱去表面吸附的水分,质量急剧下降;到190 ℃之后质量下降趋势平缓,该范围内脱除的是分子筛内部的结晶水和一些挥发性物质。总的来说,NaX分子筛具有良好的热稳定性。
与X型分子筛相比,CsX-IE分子筛和CsX-IMP分子筛也在50~190 ℃内有明显失量,情况与NaX分子筛相同;但190 ℃之后质量几乎不变,这是由于制备改性分子筛时,分子筛经过高温焙烧,分子筛内部的结晶水和挥发性的物质早已脱除。通过对比热重分析图可以看出,2种方法改性的分子筛仍然保持良好的热稳定性。
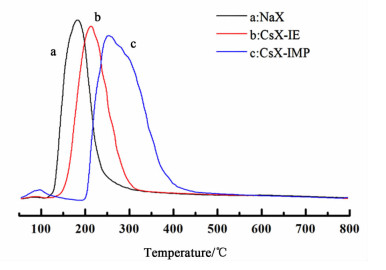
2.1.6 CO2-TPD分析结果图 5中3条曲线分别为未改性的NaX分子筛、CsX-IE分子筛和CsX-IMP分子筛在50~800 ℃范围内CO2脱附曲线。
|
| 图 5 分子筛催化剂的CO2-TPD图 Figure 5 CO2-TPD profiles of molecular sieve catalysts |
| |
可以看出图 5的3条曲线各自有1个脱附峰,未改性的NaX分子筛的脱附峰为189 ℃,为弱碱性位。相较于未改性的NaX分子筛,CsX-IE的脱附峰后移为239 ℃,且峰面积有所增加,说明碱性位强度和碱量均增加。而CsX-IMP的脱附峰出现的最晚,为265 ℃,且峰面积最大,说明碱性位强度和碱量最大。总之,经过碱金属Cs元素改性后的分子筛,碱性位强度和碱量均增加。
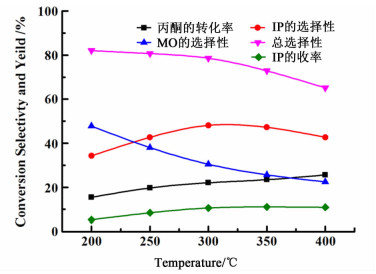
2.2 催化剂的活性评价分析 2.2.1 反应温度对催化剂性能的影响为考察反应温度对催化剂反应性能的影响,采用CsX-IE催化剂,在反应压力为0.1 MPa、液时空速为2 h-1的情况下,改变反应温度并对其活性评价,结果见图 6。
|
| 图 6 反应温度对催化剂性能的影响 Figure 6 The effect of reaction temperature on the catalytic performance |
| |
由图 6可以看出,反应温度对分子筛催化丙酮缩合生成异佛尔酮的反应活性影响较大。随着反应温度的升高,丙酮的转化率一直在增加,不过反应温度达到300 ℃以后,丙酮转化率增加幅度减缓;异佛尔酮的选择性先增加后降低,在300 ℃时达到最大,为48.09%;异佛尔酮的收率也是先增加降低,在350 ℃时达到最大,为11.08%;异丙叉丙酮的选择性逐渐降低,异佛尔酮和异丙叉丙酮的选择性逐渐降低。综合考虑丙酮的转化率和异佛尔酮的收率,反应温度为350 ℃比较适宜。
随着反应温度的增加,丙酮分子的运动加剧,发生有效碰撞进行反应的几率增加,因此丙酮的转化率随着反应温度的上升逐渐增加。由于低温有利于低聚物(如异丙叉丙酮及其同分异构体)生成,高温有利于大分子高聚物生成,因此在较低的温度下,异丙叉丙酮的选择性比较高,随着反应温度逐渐升高,异丙叉丙酮选择性逐渐下降,这时异佛尔酮选择性在逐渐升高,但若反应温度继续升高,超过300 ℃,高聚物的含量明显增加,导致异佛尔酮选择性下降,异丙叉丙酮和异佛尔酮的总选择性下降,高聚物等副产物的选择性增加。
2.2.2 液时空速对催化剂性能的影响为考察反应温度对催化剂反应性能的影响,采用CsX-IE催化剂,在反应压力为0.1 MPa、反应温度为350 ℃的情况下,改变液时空速并对其活性评价,结果见图 7。

|
| 图 7 液时空速对催化剂性能的影响 Figure 7 The effect of LHSV on the catalytic performance |
| |
由图 7可以看出,液时空速对分子筛催化丙酮缩合生成异佛尔酮的反应活性有一定的影响。随着液时空速的升高,即在不改变催化剂用量的情况下,丙酮的进料量增加,发现丙酮的转化率明显降低,异佛尔酮的选择性先增加后降低,基本维持在42%~49%之间,异丙叉丙酮的选择性逐渐增加,总选择性先增加后基本不变,异佛尔酮的收率逐渐降低。
液时空速的增加,相当于反应物丙酮分子在催化剂上的停留时间减少。丙酮缩合制备异佛尔酮为连串反应,最初丙酮先二聚生成异丙叉丙酮及其同分异构体,再进一步聚合才会生成三聚物异佛尔酮,因此,停留时间太短,会导致反应物丙酮来不及反应就随着产物流走,使丙酮的转化率下降;或者只能生成低聚物,如异丙叉丙酮及其同分异构体,使异佛尔酮选择性不高。但若停留时间过长,也会使反应产物在催化剂表面进一步聚合,产生高聚物等副产物。尽管降低液时空速有利于提高丙酮的转化率和产物的选择性,但是考虑实际生产的问题,为保证异佛尔酮的生产能力,液时空速不宜过低,最适宜的液时空速为2.0 h-1。
2.2.3 不同制备方法的催化剂性能为考察制备方法对催化剂反应性能的影响,分别采用未改性的NaX催化剂、CsX-IE催化剂和CsX-IMP催化剂,在反应压力为0.1 MPa、反应温度为350 ℃、液时空速为2 h-1的情况下,对3类催化剂进行活性评价,结果见表 2、图 8和图 9。
| 催化剂 | CACE/% | SIP/% | SMO/% | SIP+MO/% | YIP/% |
| NaX | 14.86 | 26.75 | 44.08 | 70.83 | 3.98 |
| CsX-IE | 23.47 | 47.2 | 25.65 | 72.85 | 11.08 |
| CsX-IMP | 26.05 | 52.27 | 22.74 | 75.01 | 13.62 |
| 注:CACE为丙酮的转化率,SIP为异佛尔酮的选择性,SMO为异丙叉丙酮的选择性,SIP+MO为异佛尔酮和异丙叉丙酮的选择性之和,YIP为异佛尔酮的收率。 | |||||

|
| 图 8 不同催化剂的丙酮转化率和异佛尔酮收率 Figure 8 The conversion of acetone and yield of IP by different molecular sieve catalysts |
| |

|
| 图 9 不同催化剂的产物选择性 Figure 9 The selectivity of products by different molecular sieve catalysts |
| |
从图 8和图 9中可以看出,通过离子交换法和浸渍法引入碱金属元素对分子筛进行改性,可以明显提高催化剂的反应活性。离子交换法和浸渍法使丙酮的转化率分别提高至未改性分子筛的1.58和1.75倍,异佛尔酮的选择性分别提高至未改性分子筛的1.76和1.95倍。
3 结论1) 离子交换法制备的CsX-IE催化剂和浸渍法制备的CsX-IMP催化剂均具有完整的晶体结构,较大的比表面积、适当的碱性位和良好的热稳定性,催化活性比较高。
2) 丙酮在改性X型分子筛催化剂上缩合生成异佛尔酮的工艺条件为反应温度350 ℃,进料液时空速2.0 h-1,在此条件下,催化剂具有较好的反应活性,丙酮的转化率可达26.05%,异佛尔酮的选择性可达52.27%。
| [1] |
吕咏梅. 异佛尔酮合成技术进展与应用开发[J].
化学推进剂与高分子材料, 2005, 35(2): 20–22.
Lü Yongmei. Synthetic technology progress and application development of isophorone[J]. Chemical Propellants & Polymeric Materials, 2005, 35(2): 20–22. |
| [2] |
谢丽莎, 陈霄榕. 固体酸碱性质对丙酮缩合生成异佛尔酮反应的影响[J].
化工进展, 2010, 29(7): 1230–1234.
Xie Lisha, Chen Xiaorong. Effect of solid base properties on acetone condensation to isophorone over Mg-Al-O catalyst[J]. Chemical Industry and Engineering Progress, 2010, 29(7): 1230–1234. |
| [3] |
苑丽质. 催化剂制备方法对丙酮气相合成异佛尔酮的影响[J].
化学世界, 2015, 56(3): 136–139.
Yuan Lizhi. Effect of catalyst preparation methods on sy-nthesis of isophorone from vapour phase acetone[J]. Chemical World, 2015, 56(3): 136–139. |
| [4] |
马春香, 刘钢, 朱万春, 等. 共沉淀法制备的镁铝氧化物催化剂上丙酮气相缩合反应[J].
高等学校化学学报, 2009, 30(12): 2429–2433.
Ma Chunxiang, Liu Gang, Zhu Wanchun, et al. Gas-Phase aldol condensation of acetone over Mg-Al oxides prepared by co-precipitation methods[J]. Chemical Journal of Chinese Universities, 2009, 30(12): 2429–2433. DOI: 10.3321/j.issn:0251-0790.2009.12.021 |
| [5] |
王玉环, 王国甲, 肖军华, 等. 丙酮在固体碱催化剂上的缩合反应[J].
高等学校化学学报, 1993(10): 1448–1450.
Wang Yuhuan, Wang Guojia, Xiao Junhua, et al. The condensation of acetone over solid base catalyst[J]. Chemical Journal of Chinese Universities, 1993(10): 1448–1450. DOI: 10.3321/j.issn:0251-0790.1993.10.036 |
| [6] | Cosimo J I D, DiEz V K, Apestegui A C R. Synthesis of α, β-unsaturated ketones over thermally activated Mg-Al hydrotalcites[J]. Applied Clay Science, 1998, 13(5/6): 433–449. |
| [7] | Kelkar C P, Schutz A A. Efficient hydrotalcite-based catalyst for acetone condensation to α-isophorone-Scale up aspects and process development[J]. Applied Clay Science, 1998, 13(5/6): 417–432. |
| [8] |
王芳珠, 杨坤, 柴永明, 等. 以镁铝水滑石为前驱体制备复合氧化物催化丙酮气相缩合反应[J].
无机化学学报, 2008, 24(9): 1417–1423.
Wang Fangzhu, Yang Kun, Chai Yongming, et al. Acetone gas phase condensation on Mg-Al composite oxides catalysts prepared via Mg-Al hydrotalcites precursor[J]. Chinese Journal of Inorganic Chemistry, 2008, 24(9): 1417–1423. DOI: 10.3321/j.issn:1001-4861.2008.09.009 |
| [9] | Zamora M, López T, Gómez R, et al. Oligomerization of acetone over titania-doped catalysts (Li, Na, K and Cs):Effect of the alkaline metal in activity and selectivity[J]. Catalysis Today, 1999, 23(11): 1101–1119. |
| [10] | Zamora M, López T, Gómez R, et al. Acetone gas phase condensation on alkaline metals doped TiO2 sol-gel catalysts[J]. Applied Surface Science, 2005, 252(3): 828–832. DOI: 10.1016/j.apsusc.2005.02.061 |
| [11] |
郑平, 阮济之. 丙酮在沸石催化剂上的缩合反应[J].
精细化工, 1993(1): 32–35.
Zheng Ping, Ruan Jizhi. Study of acetone condensation on zeolite catalysts[J]. Fine Chemicals, 1993(1): 32–35. |
| [12] | Fukada I, Matsuba K. Preparation of dehydrated condensates of acetone with zeolite catalysts: JP, 9059204 A[P].1997-12-24 |
| [13] | Stevens M G, Chen D, Foley H C. Oxidized caesium/nanoporous carbon materials:Solid-Base catalysts with highly-dispersed active sites[J]. Chemical Communications, 1999, 3(3): 275–276. |
| [14] | Flego C, Perego C. Acetone condensation as a model reaction for the catalytic behavior of acidic molecular sieves:A UV-Vis study[J]. Applied Catalysis A-General, 2000, 192(192): 317–329. |
| [15] | Salvapati G S, Ramanamurty K V, Janardanarao M. Selective catalytic self-condensation of acetone[J]. Journal of Molecular Catalysis, 1989, 54(1): 9–30. DOI: 10.1016/0304-5102(89)80134-8 |
| [16] | Reichle W T. Pulse microreactor examination of the vapor-phase aldol condensation of acetone[J]. Journal of Catalysis, 1980, 63(2): 295–306. DOI: 10.1016/0021-9517(80)90082-2 |
| [17] | Tsou J, Magnoux P, Guisnet M, et al. Catalytic oxidation of methyl-isobutyl-ketone over basic zeolites[J]. Applied Catalysis B Environmental, 2004, 51(2): 129–133. DOI: 10.1016/j.apcatb.2004.02.010 |
| [18] | Kovacheva P, Arishtirova K, Davidova N. Effect of preparation of a CsX zeolite catalyst on the oxidative conversion of methane[J]. Applied Catalysis A General, 1997, 163(1): 255–260. |
| [19] | Krauze A, Duburs G. Effect of preparation of a CsX zeolite catalyst on the oxidative methylation of toluene with methane[J]. Applied Catalysis A General, 1998, 167(2): 271–276. DOI: 10.1016/S0926-860X(97)00313-X |
| [20] | Romero M D, Ovejero G, Rodríguez A, et al. Impregnation of X zeolite with alkaline hydroxide during the synthesis[J]. Journal of Porous Materials, 2003, 11(1): 31–39. |
 2018, Vol. 35
2018, Vol. 35





