2. 清华大学材料学院, 北京 100083;
3. 清华大学电机系, 北京 100083
2. Department of Materials Science and Engineering, Tsinghua University, Beijing 100084, China;
3. Department of Electrical Engineering, Tsinghua University, Beijing 100083, China
能源和环境问题是当今人类社会面临的两大主要问题。为了应对日益严峻的能源危机和环境问题,各国纷纷进行了对清洁可再生能源的开发和研究。
硫具有很高的理论比容量2 600 Wh/kg(1 675 mAh/g)[1]。金属锂的比容量在现有的负极材料中最高(3 861 mAh/g),电位最负(-3.045 V),电化学性能最活泼,所以锂硫电池在理论上具有很高的比能量[2]。除了具有较高的理论比容量,硫的储量丰富,成本低廉,硫电极材料本身和使用过程中很少产生对环境有害的物质,因此,锂硫电池是一种更廉价更环保的电池。另外,常规的锂离子电池在过充时正极会析出氧,会将电解液氧化,从而引起燃烧、爆炸,存在安全隐患。而以硫为活性物质的正极材料不含氧元素,不会出现此类问题,在安全方面会有明显的优势。锂硫电池凭借其高能量密度、较好的安全性、绿色环保和低成本等特点,成为未来动力电池最具吸引力的体系之一。
1 背景介绍 1.1 硫的性质常温下,硫磺粉为淡黄色粉末,存在多种同素异形体,多以斜方硫为主,密度2.07 g/cm3,熔点115.21 ℃,沸点444.6 ℃,此时硫蒸汽由S2组成。当温度超过95.6 ℃,斜方硫将慢慢转化为淡黄色针状同素异形体单斜硫;当温度低于95.6 ℃,则缓缓变为之前的斜方硫[2]。此外,硫在开始熔解时表现为苍黄色的流动液体,继续受热后转变为棕色黏稠液体,再加热该液体后,其黏度会变小,会发生流动,接着在约160 ℃时黏度显著增加,这是S8环开口和聚合的结果,直到约190 ℃时硫开始解聚,黏度减小[3-4]。因此在快到160 ℃时硫的黏度是最小的,这个性质被广泛应用于浸渍硫导入多孔材料来制备硫复合材料。
硫原子的价电子层结构为3s23p4,还有可以利用的空3d轨道,因此S原子在形成化合物时有如下的价键特征:1)形成离子键。S原子可以从电负性较小的原子接受2个电子,形成S2-,生成离子型硫化物,例如Na2S、CaS、(NH4)2S等。2)形成共价键。S原子可以与电负性相近的原子形成共价键,另外,它的3s和3p中的成对电子可以拆开进入它的3d空轨道,然后参与成键。根据S原子采取的不同杂化态,可以分成sp、sp2、sp3、sp3d、sp3d2 5种杂化情况。3)形成多硫链。从单质S的结构特征看,S原子有形成长硫链—Sn-的习性,长硫链也可以成为形成化合物的结构基础。这个特点是其他元素中少见的。当长硫链中S原子的个数n=2时,也可以叫做过硫化物,类似于O原子的过氧化物[5]。
1.2 放电原理锂硫二次电池以硫为正极反应物质,以锂为负极。放电时负极反应为锂失去电子变为锂离子,正极反应为硫与锂离子及电子结合生成硫化物,正极和负极反应的电势差即为锂硫电池所提供的放电电压。在外加电压作用下,锂硫电池的正极和负极反应逆向进行,即为充电过程。根据单位质量的单质硫完全变为S2-所能提供的电量可得出硫的理论放电比容量为1 675 mAh/g,同理可得出单质锂的理论放电比容量为3 860 mAh/g。锂硫电池的理论放电电压为2.287 V,当硫与锂完全反应生成硫化锂(Li2S)时,理论放电比能量为2 600 Wh/kg[2, 6-8]。
硫电极的充电和放电反应过程比较复杂,存在一系列可逆的多硫离子中间产物,硫电极的放电过程主要包括2个步骤,分别对应2个放电平台:1) 2.4~2.1 V区间的放电平台对应S8的环状结构变为Sn2-(4≤n≤8)离子的链状结构, 并与Li+结合生成Li2Sn;(2) 2.1~1.8 V区间较长的放电平台对应Sn2-离子的链状结构变为S2-与Li+结合生成Li2S,该平台是锂硫电池的主要放电区域。反之,充电时硫电极中Li2S按此逆过程逐步被氧化为S8。但在全固态锂硫电池中,一般仅观察到第2个低电位放电平台,预示着可能和液态电池不同的反应机理。
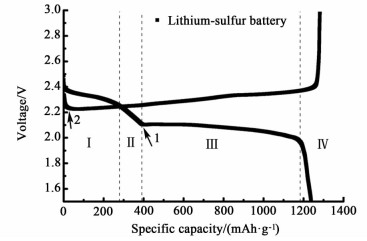
锂硫电池放电的4个阶段,如图 1。
|
| 图 1 锂硫电池充放电曲线图 Figure 1 Schematic of Li-S battery discharge-charge |
| |
第Ⅰ阶段:固-液两相反应,从元素硫到Li2S8。这个阶段体现在较高的电压平台——2.2~2.3 V。在这个阶段形成的Li2S8溶解在电解液中变成了1个液态阴极。这个过程在阴极上留下了许多空洞。
| $ {{\rm{S}}_8}{\rm{ + }}2{\rm{Li}} \to {\rm{L}}{{\rm{i}}_2}{{\rm{S}}_8} $ | (1) |
第Ⅱ阶段:液-液单相反应,从溶解的Li2S8到低位聚硫化合物。这个阶段电池的电压会迅速降低,溶液的黏度会随着硫-硫链长度的减小和聚硫阴离子数量的增加而变大。溶液的黏度会在这个放电阶段的最后达到最大值。
| $ {\rm{L}}{{\rm{i}}_2}{{\rm{S}}_8} + 2{\rm{Li}} \to {\rm{L}}{{\rm{i}}_2}{{\rm{S}}_{8 - n}} + {\rm{L}}{{\rm{i}}_2}{{\rm{S}}_n} $ | (2) |
以上2个阶段为第1平台,第1平台不能超过419 mAh/g,在2.4 V左右,原因是S8全部转化为Li2S4的放电理论值为419 mAh/g[9-10]。
第Ⅲ阶段:液-固两相反应,从溶解的低位聚硫化合物到不溶的Li2S2或Li2S。方程式(3)和(4)互相竞争。这个阶段形成第2个即低一些的电压平台:1.9~2.1 V。这个平台也和测试的电流密度有关,一般来说电流密度越大此平台的出现时的电压越低。这个阶段在锂硫电池放电过程中贡献了主要的比容量。
| $ 2{\rm{L}}{{\rm{i}}_2}{{\rm{S}}_n} + \left( {2n - 4} \right){\rm{Li}} \to n{\rm{L}}{{\rm{i}}_2}{{\rm{S}}_2} $ | (3) |
| $ {\rm{L}}{{\rm{i}}_2}{{\rm{S}}_n} + \left( {2n - 2} \right){\rm{Li}} \to n{\rm{L}}{{\rm{i}}_2}{\rm{S}} $ | (4) |
第Ⅳ阶段:固-固反应,从不溶的Li2S2到Li2S。这个阶段是缓慢进行的,因为Li2S2及Li2S不导电和不溶解的性质普遍地经历了高度极化。
| $ {\rm{L}}{{\rm{i}}_2}{{\rm{S}}_2} + 2{\rm{Li}} \to 2{\rm{L}}{{\rm{i}}_2}{\rm{S}} $ | (5) |
以上2阶段为第2平台,一般在2.1 V以下总量不会超过1 256 mAh/g,原因是Li2Sx转化为Li2S的放电理论值1 256 mAh/g[11-15]。
通常,放电和充电的电压分别显示了1个小峰,由图 1的箭头1和2所示。箭头1对应于一点,是聚硫溶液具有最高黏度聚硫阴离子的硫-硫链长度和数量(浓度)组合的结果。如果电解液用量过少会导致电解液中聚硫阴离子的浓度变大,以致黏度过高使电压过低。箭头2反映了一个变小的极化,是从不溶物Li2S2和Li2S转化为溶解的聚硫化合物的相变的结果。在放电阶段,碳表面会覆盖着固体Li2S2/Li2S层,使电池里的硫产生高极化。
2 面临的挑战和解决方法就目前发展的技术而言,锂硫电池仍存在制约其发展的不足之处:1)硫单质的导电率很差(室温下为5×10-30 S/cm),利用率低,并且锂化前后体积变化大,随着充放电循环的进行,电极容易出现粉化现象,导致其循环性能极差;2)锂化的中间产物多硫化锂(Li2Sn,1≤n≤8)导电性极差,使得深层次放电变得困难,因而电极的循环稳定性差、比容量下降;3)多硫化锂在电解液中具有一定的溶解性,易扩散到负极与锂金属反应生成低级多硫化物[二硫化二锂(Li2S2)和硫化锂(Li2S)],此物质扩散回正极后又会与硫发生反应,周而复始产生“穿梭效应(shuttle effect)”,影响电池的放电及寿命;4)金属锂做电池的电极,在有机电解液中通常会有枝晶生成,如果枝晶生长过长刺穿隔膜,枝晶接触了电池正极就会造成电池的内部短路。
为了解决锂硫电池以上的几个问题,研究人员进行了大量的研究和实验并且取得了突出的进展,在关于锂硫电池正极导电等问题已得到了很好的解决,现在的研究重点主要集中于抑制穿梭效应和负极枝晶等问题上。
2.1 隔膜处抑制聚硫化合物的穿梭效应 2.1.1 碳纤维薄膜作为内夹层(interlayer)对锂硫电池性能的提升及作用2012年Su等[16]报道了一种具有微孔的碳纤维内夹层(interlayer)并将其放置于正极与隔膜之间,有助于改善电池的循环稳定性(如图 2)。电化学测试中显示,在1 C的倍率下循环100周期依然能到1 000 mAh/g。将碳内层放入硫正极和隔膜之间,碳内层起到的作用有:1)作为伪集流体,以确保有效的电子传输,从而保证电化学反应的充分进行;2)导电的碳纤维薄膜减小了电池的阻抗,使电池在高倍率下有更好的表现;3)促使电池内部的硫在正极和碳内层中重新分布,提升硫的利用率。
|
| 图 2 在正极与隔膜之间加入碳内夹层的锂硫电池示意图 Figure 2 Schematic configuration of a Li-S cell with a carbon interlayer inserted between the sulphur cathode and the separator |
| |
2013年,Zhang等[17]将90 μm厚的泡沫镍箔放置在60%硫含量的碳硫正极和隔膜之间充当interlayer,在0.2 C的倍率下,装有泡沫镍的电池首次放电为819 mAh/g,循环80圈后依旧可得604 mAh/g。
2014年Song等[18]将2层柔性多孔碳膜中间夹1层球磨硫和炭黑(7/3)的混合层制成了三明治结构电极。在0.2 C的倍率下,首次放电可得1 494.7 mAh/g的放电比容量,这几乎是理论放电比容量的90%,循环100周期后依旧可以得到1 100 mAh/g的放电比容量。
2015年Huang等[19]在PAN溶液中加入Fe3+,用高压静电纺丝技术,将溶液制成无纺布,再将无纺布碳化生成碳化铁(Fe3C)/碳纤维薄膜。将Fe3C和碳纤维作为interlayer放置在质量比为70%的碳硫电极和隔膜之间,直径14 mm的碳硫电极载硫量为2.3~2.8 mg/cm2。在电化学测试中我们可以看到,在200 mA/g的倍率下初始放电可得到1 177 mAh/g的放电比容量,循环100周期后依旧可以得到893 mAh/g的比容量。分析其原因,主要是因为镶嵌在六元环中的石墨化的氮元素可以额外的提供自由电子,从而提高碳的导电性,并且在纳米纤维薄膜中存在大孔,可以增强离子迁移率和电解质渗透率,碳纳米纤维上的氮元素还可以有效的吸附溶解在电解液中的聚硫化合物。
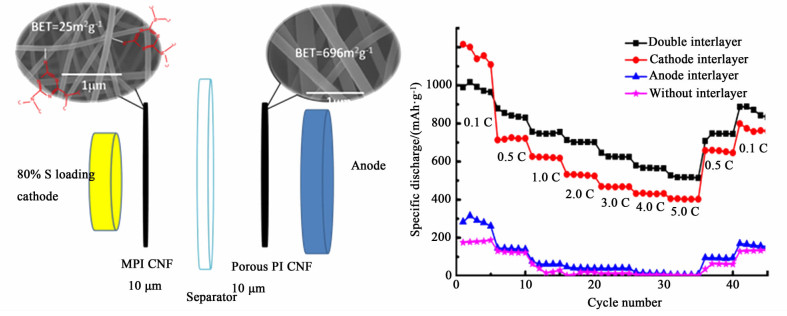
2017年,Gao等[20]利用高压静电纺丝技术,制得富含氮元素(5.11%)的掺氮碳纳米纤维无纺布(MCNF),将MCNF和没有掺氮的碳纳米纤维无纺布(CNF)分别夹入正极与隔膜、负极与隔膜之间,制得双夹层结构的锂硫电池(如图 3)。其正极为含硫质量比80%(4.2 mg/cm2)的纯硫电极,首次放电为969 mAh/g,在0.1 C的倍率下充放电100循环后依旧可以得到651 mAh/g,在1.0 C的大倍率下放电,600循环后依旧可以得到380 mAh/g。可以看出利用此结构的电池高倍率下的电化学性能良好。探究其可以抑制穿梭效应的原因是正极的MCNF富含氮元素,氮元素的极性结构会吸引电解液中的锂离子,从而间接的吸引电解液中的聚硫化锂,并与负极的CNF一起制约聚硫化合物的穿梭作用(如图 4)。

|
| 图 4 在H型电解池中进行的聚硫化合物扩散试验 Figure 4 The optical images of the diffusion process of polysulfides of separator, cathode interlayer with separator |
| |
在负极表面加上碳纤维的原因是:1)CNF是导体,可以起到集流体的作用,在充电的时候,使锂离子在电池内氧化得到的锂金属更加均匀;2)CNF导电也直接增大了锂电极在充电过程中氧化反应的场所,使得生成枝晶的位点大大增加,原本生成大枝晶的锂金属表面分散到CNF中,分散成无数个小枝晶(如图 5),从而抑制了大枝晶的生成。

|
| 图 5 有无碳夹层的负极锂片SEM照片 Figure 5 SEM images of the anode with and without interlayer |
| |
以上几种方法,均是利用碳材料作为内夹层,放置于锂硫电池正极与隔膜之间,利用碳材料良好的导电性来增大正极活性物质硫的利用率,以及部分内夹层对于聚硫化合物的吸附性来抑制聚硫化合物的穿梭作用,但是此种方法使电池的整体能量密度降低,如若添加过大的碳材料内夹层会使锂硫电池在能量密度上的优势降低。
2.1.2 修饰隔膜2012年Jin等[21]将全氟磺酸(Nafion)薄膜在80 ℃下进行锂化反应,并将成品用作锂硫电池的隔膜,实验显示,经过锂化处理的全氟磺酸隔膜有促进电流平稳的作用,并且提升了锂离子穿过全氟磺酸隔膜的离子迁移率,使其达到0.986,这就表明,穿过全氟磺酸隔膜的几乎只有锂离子,聚硫化合物极少。在电化学测试中显示,使用全氟磺酸隔膜首次放电可达1 185 mAh/g,在循环50周期之后,容量保持可达69%。
因为全氟磺酸的价格昂贵,2014年Huang等[22]将1层较薄的全氟磺酸涂层(1 μm厚,密度为0.7 mg/cm2)涂敷在聚合物隔膜的内部。这个厚度被认为是最佳的厚度,如果再薄一些,全氟磺酸的作用将会降低,而再厚一些将会导致极化现象的增加。
2014年Wei等[23]先将PVDF溶于NMP中,再加入一定量的Super P搅拌,然后将浆料均匀的涂覆在隔膜上。电化学测试表示,在0.5 C的倍率下100、200和500次循环后分别可得到918.6、827.2和669.1 mAh/g,甚至在5.0 C的倍率下容量依旧可以保持在393 mAh/g。
2014年Zhang等[24]将Al2O3涂覆在隔膜上,Al2O3能帮助隔膜提升电解液的浸润性并且可以有效的阻挡聚硫化合物的穿梭,因此用Al2O3修饰的隔膜可以有效的提升电池的循环稳定性。在电化学测试中可以看到,0.2 C的倍率下首次放电可达到967 mAh/g,循环50圈之后,容量依旧可以达到593.4 mAh/g,所以这是一种有效的抑制聚硫物质穿梭的方法。
2015年,Ma等[25]将聚吡咯纳米管当做内夹层添加到正极和隔膜之间,电极载硫量为2.5~3.0 mg/cm2,在0.5 C的倍率下,初始放电可达1 102 mAh/g,在循环300周期之后依旧可以得到712 mAh/g的容量,并且库伦效率可达92%。
在电池内添加内夹层的方法来增加电池放电效果的突出问题是内夹层的质量占电极的质量比。内夹层大多数为碳,因此这也间接的在正极内引入了过多的碳,导致硫碳比降低。如何控制好内夹层的质量是重中之重。
2.2 抑制锂负极的枝晶锂金属的相对原子质量只有6.94,并且相对于氢电极来说,锂的电极电位最负,只有-3.045 V[26]。锂的这些特性决定了它是一种高比能量的电池负极材料,其理论比容量高达3 860 mAh/g,远远高于传统的铅、镉和镍等金属负极。因此,若以金属锂、锂合金或可嵌锂材料为负极,配以适当的正极材料和电解液体系组成电池,与其它电池体系相比,将具有放电电压高,比能量大等显著优势[26]。但是锂作为电池的电极在充放电过程中会有枝晶生成,枝晶生长过大会刺穿隔膜从而发生电池内部短路现象。
2.2.1 锂枝晶生长机制首先,金属锂在负极表面不均匀溶解和沉积, 使其容易在某个区域或沿某个方向择优生长,从而产生锂枝晶现象。随着枝晶不断生长,其会穿透隔膜与正极相连接,从而造成电池内部短路,进而诱发电池局部过热,甚至起火爆炸[27]。

|
| 图 6 锂枝晶生长原理示意图 Figure 6 Schematic of lithium dendritic growth |
| |
枝晶的生长原理主要是:首先金属锂在锂硫电池放电过程中失去电子变成锂离子,锂离子进入电解液,金属锂失去了一部分锂从而导致表面粗糙不平,在充电过程中锂离子会在尖端择优生长[28-29]。
一般的对于锂金属的修饰方法是在表面形成聚合物薄层、无机盐沉积层或玻璃电解质溅射层,也可以在电解质中加入添加剂与金属锂表面反应形成离子导电的致密保护层。具体实施方式有2种,一种是非原位保护,即在组装锂硫电池前对金属锂负极进行保护,或直接采用其它新型负极材料(如锂合金)代替金属锂负极;另一种是原位保护,即通过在有机电解液中加入添加剂与金属锂反应生成更稳定的固体电解质相界面膜(SEI)。但是,SEI不能防止Li阳极被进一步腐蚀,多硫化物离子可以与SEI中的Li2S/Li2S2反应形成较短链的多硫化物离子扩散进入电解质,从而产生“清洁的”Li表面。部分清洁Li阳极可与多硫化物发生离子反应再次形成Li2S/Li2S2。因此,SEI处于动态平衡,该过程会重复地进行,这导致Li阳极会被连续腐蚀。这些反应导致阳极侧的多硫化物离子的浓度增加,促进穿梭现象[30]。
2.2.2 非原位保护因为氮气会与锂金属直接反应生成氮化锂(Li3N),氮化锂是一种导离子体。2014年,Ma等[31]利用这种原位保护层(200~300 nm厚)不仅可以有效的阻挡聚硫化合物侵蚀锂金属表面,而且还可以让锂离子通过(离子传导率大约为10-3 S/cm)。应用这种体系的电池在0.2 C的倍率下充放电,库伦效率可达91.4%,相对于未保护的金属锂电极(80.7%),其效果十分明显。在0.5 C的倍率下首次放电可得1 087 mAh/g的比容量,循环500周期之后,容量保持可达71%。
2014年Cheng等[32]做了一个Li7B6的3D结构纤维栏,将其置于锂负极上起到一个保护的作用,其原理是SEI膜在Li7B6上均匀铺开,减小了锂表面的不均匀程度,使得锂在充电沉积时更加平稳。其电化学性能良好,在循环2 000周期之后依旧可以得到36.3%的初始容量。
2015年,Jing等[33]将多孔的Al2O3纳米颗粒(0.23,0.58和0.73 mg/cm2)涂覆在锂金属表面。实验表明0.23 mg/cm2的Al2O3不能有效地保护锂金属被聚硫化合物侵蚀,而0.73 mg/cm2却会堵住锂金属离子的传输。0.58 mg/cm2的保护层表现出了很好的电化学表现。在0.1 C的倍率下首次放电可得到1 215 mAh/g,循环50周期后容量保持为70%。
非原位保护的优点在于能制造一个我们已知的保护层,这样更有利于我们对电池反应的研究,但是缺点就是操作复杂,有的非原位保护层需要制作得非常薄,并且需要的实验条件苛刻(真空或者是隔绝氧气及水分),这也是影响非原位保护技术发展的原因之一。
2.2.3 原位保护固体电解质相界面膜(SEI膜)通常是不导电的,并且只允许锂离子通过。这种SEI膜的保护形势为原位保护,其主要突破是在发现了锂盐添加剂硝酸锂(LiNO3)[34],将硝酸锂添加到电解液中主要的作用是:硝酸锂会和硫化物发生氧化反应生成LixSOy,此物质和氧化反应均有助于钝化电解液中的多硫化合物,从而导致穿梭效应的降低,提高库伦效率。
2013年,Ling等[35]将P2S5当做电解液添加剂加入到锂硫电池电解液中,其可以在金属锂表面生成SEI膜保护层Li3PS4。这种钝化层不仅可以让锂离子通过,而且还会防止聚硫化合物与金属锂片表面直接接触,抑制了金属锂的流失。在电化学测试中,0.1 C的放电倍率下循环20圈依旧可以得到1 334 mAh/g的放电容量,并且库伦效率保持在90%~98%之间。
2013年,Suo等[36]提出了一种“盐溶液”体系,即将7 mol/L三氟甲磺酰基亚胺锂溶入DME/DOL体积比为1: 1的溶液中,这种电解液对锂离子的溶解度很小,从而限制了溶解的多硫化合物的量来保护锂金属负极。在0.2 C的倍率下,首次放电会得到1 041 mAh/g的容量,并且循环100周期后,容量保持率为74%。
2014年,Li等[37]将Li2S8作为添加剂加入1 mol/L双三氟甲烷磺酰亚胺锂(LiTFSI)DOL/DME体积比为1: 1的溶液中,再加入少量硝酸锂。结果发现这种电解液会和锂金属发生反应,生成一种新的SEI膜,其对锂金属的保护性能要比不加聚硫化合物的电解液生成的SEI膜好得多。2016年Zhang等[37]将0.020 mol/L Li2S5 (0.10 mol/L sulfur)和5.0% LiNO3加入电解液中,其可以使锂电极表面生成新的SEI膜。新的SEI膜对锂负极的保护性能良好,次体系可实用度很高。这种在电解质中加入聚硫化锂来得到新的SEI膜的方法颠覆了以前对锂硫电池中因穿梭作用负极侧电解质中的聚硫化合物会导致锂负极消耗的观念。
相对于非原位保护,原位保护的优点在于,通过电解液生成的SEI膜会比直接在负极片上面制造一层保护膜来说更加的简便。但是由于添加剂的原因,导致了成本增加反应机理复杂,有的会影响电池的循环表现,有的更是会加大了穿梭效应使电池的循环稳定性降低[38]。
3 未来与展望随着环保意识的提升以及对电池的电量要求日益增高,锂硫电池等一系列新能源成为了大家关注的焦点。虽然锂硫电池的开发已经取得了显著的进展,但这些进展中的大多数集中在电池的正极的研发。现在负极、电解质以及现有的多部件组件的研究也正在开展,尽管在过去几十年里取得了相当大的改进,但仍然会在较长一段时间不能用于实际生产和使用。实现高容量与长期周期稳定性并存,且保持高硫负载依旧面临着很多的挑战。
首先要解决的是锂负极的安全问题,在锂硫电池的实际应用中,锂负极枝晶刺穿隔膜会导致易燃的电解质燃烧,所以如何抑制锂负极的枝晶依旧是个需要长期关注的问题,最近比较火热的固态电解质可以很好的解决这个问题;其次抑制聚硫化合物的穿梭可以提高锂硫电池的循环稳定性以及循环寿命,这个也是当前世界上研究锂硫电池的研究重点;最后,正极活性物质硫的导电以及防止其体积改变破坏电极的问题虽然得以解决,但是提高载硫量依旧是以后锂硫电池发展的重要方向。
| [1] | Suo L, Hu Y, Li Hong, et al. Progress on high-energy density lithium-sulfur batteries[J]. Chinese Science Bulletin, 2013, 58(31): 3172–3188. |
| [2] | Rosenman A, Markevich E, Salitra G, et al. Review on Li-sulfur battery systems:An Integral perspective[J]. Advanced Energy Materials, 2015, 5(16): 1–21. |
| [3] | Manthiram A, Fu Y, Chung S, et al. Rechargeable lithium-sulfur batteries[J]. Chemical Reviews, 2014, 114(23): 11751–11787. DOI: 10.1021/cr500062v |
| [4] | Meyer B. Solid allotropes of sulfur[J]. Chemical Reviews, 1964, 64(4): 429–451. DOI: 10.1021/cr60230a004 |
| [5] | Wang D, Zeng Q, Zhou G, et al. Carbon-Sulfur composites for Li-S batteries:Status and prospects[J]. Journal of Materials Chemistry A, 2013, 1(33): 9382–9394. DOI: 10.1039/c3ta11045a |
| [6] | Pope M A, Aksay I A. Structural design of cathodes for Li-S batteries[J]. Advanced Energy Materials, 2015, 5(16): 1–24. |
| [7] | Li Z, Huang Y, Yuan L, et al. Status and prospects in sulfur-carbon composites as cathode materials for rechargeable lithium-sulfur batteries[J]. Carbon, 2015, 92: 41–63. DOI: 10.1016/j.carbon.2015.03.008 |
| [8] | Manthiram A, Chung S, Zu C. Lithium-Sulfur batteries:Progress and prospects[J]. Advanced Materials, 2015, 27(12): 1980–2006. DOI: 10.1002/adma.v27.12 |
| [9] | Liang J, Sun Z, Li F, et al. Carbon materials for Li-S batteries:Functional evolution and performance improvement[J]. Energy Storage Materials, 2016, 2: 76–106. DOI: 10.1016/j.ensm.2015.09.007 |
| [10] | Xu R, Belharouak I, Li J, et al. Role of polysulfides in self-healing lithium-sulfur batteries[J]. Advanced Energy Materials, 2013, 3(7): 833–838. DOI: 10.1002/aenm.v3.7 |
| [11] | Cañas N A, Wolf S, Wagner N, et al. In-Situ X-ray diffraction studies of lithium-sulfur batteries[J]. Journal of Power Sources, 2013, 226: 313–319. DOI: 10.1016/j.jpowsour.2012.10.092 |
| [12] | Yeon J T, Jang J Y, Han J, et al. Raman spectroscopic and X-ray diffraction studies of sulfur composite electrodes during discharge and charge[J]. Journal of the Electrochemical Society, 2012, 159(8): A1308–A1314. DOI: 10.1149/2.080208jes |
| [13] | Shin E S, Kim K, Oh S H, et al. Polysulfide dissolution control:The common ion effect[J]. Chemical Communications, 2013, 49(20): 2004–2006. DOI: 10.1039/C2CC36986A |
| [14] | Chen L, Shaw L L. Recent advances in lithium-sulfur batteries[J]. Journal of Power Sources, 2014, 267: 770–783. DOI: 10.1016/j.jpowsour.2014.05.111 |
| [15] | Xu G, Ding B, Pan J, et al. High performance lithium-sulfur batteries:Advances and challenges[J]. Journal of Materials Chemistry A, 2014, 2(32): 12662–12676. DOI: 10.1039/C4TA02097A |
| [16] | Su Y, Manthiram A. Lithium-Sulphur batteries with a microporous carbon paper as a bifunctional interlayer[J]. Nature Communications, 2012, 3(1166): 1–6. |
| [17] | Zhang K, Qin F, Fang J, et al. Nickel foam as interlayer to improve the performance of lithium-sulfur battery[J]. Journal of Solid State Electrochemistry, 2014, 18(4): 1025–1029. DOI: 10.1007/s10008-013-2351-5 |
| [18] | Song J, Yu Z, Xu T, et al. Flexible freestanding sandwich-structured sulfur cathode with superior performance for lithium-sulfur batteries[J]. Journal of Materials Chemistry A, 2014, 2(23): 8623–8627. DOI: 10.1039/C4TA00742E |
| [19] | Huang J, Zhang B, Xu Z, et al. Novel interlayer made from Fe3C/carbon nanofiber webs for high performance lithium-sulfur batteries[J]. Journal of Power Sources, 2015, 285: 43–50. DOI: 10.1016/j.jpowsour.2015.02.140 |
| [20] | Gao T, Le T, Yang Y, et al. Effects of electrospun carbon nanofibers' interlayers on high-performance lithium-sulfur batteries[J]. Materials, 2017, 10(376): 1–19. |
| [21] | Jin Z, Xie K, Hong X, et al. Application of lithiated Nafion ionomer film as functional separator for lithium sulfur cells[J]. Journal of Power Sources, 2012, 218: 163–167. DOI: 10.1016/j.jpowsour.2012.06.100 |
| [22] | Huang J, Zhang Q, Peng H, et al. Ionic shield for polysulfides towards highly-stable lithium-sulfur batteries[J]. Energy & Environmental Science, 2014, 7(1): 347–353. |
| [23] | Wei H, Ma J, Li B, et al. Enhanced cycle performance of lithium-sulfur batteries using a separator modified with a PVDF-C layer[J]. ACS Applied Materials & Interfaces, 2014, 6(22): 20276–20281. |
| [24] | Zhang Z, Lai Y, Zhang Z, et al. Al2O3-Coated porous separator for enhanced electrochemical performance of lithium sulfur batteries[J]. Electrochimica Acta, 2014, 129: 55–61. DOI: 10.1016/j.electacta.2014.02.077 |
| [25] | Ma G, Wen Z, Wang Q, et al. Enhanced performance of lithium sulfur battery with self-assembly polypyrrole nanotube film as the functional interlayer[J]. Journal of Power Sources, 2015, 273: 511–516. DOI: 10.1016/j.jpowsour.2014.09.141 |
| [26] | Tarascon J M, Armand M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414(6861): 359–367. DOI: 10.1038/35104644 |
| [27] | Kim H, Jeong G, Kim Y U, et al. Metallic anodes for next generation secondary batteries[J]. Chemical Society Reviews, 2013, 42(23): 9011–9034. DOI: 10.1039/c3cs60177c |
| [28] | Monroe C, Newman J. Dendrite growth in lithium/polymer systems a propagation model for liquid electrolytes under galvanostatic conditions[J]. Journal of the Electrochemical Society, 2003, 150(10): A1377–A1384. DOI: 10.1149/1.1606686 |
| [29] | Ely D R, García R E. Heterogeneous nucleation and growth of lithium electrodeposits on negative electrodes[J]. Journal of the Electrochemical Society, 2013, 160(4): A662–A668. DOI: 10.1149/1.057304jes |
| [30] | Yamin H, Peled E. Electrochemistry of a nonaqueous lithium/sulfur cell[J]. Journal of Power Sources, 1983, 9(3): 281–287. DOI: 10.1016/0378-7753(83)87029-3 |
| [31] | Ma G, Wen Z, Wu M, et al. A lithium anode protection guided highly-stable lithium-sulfur battery[J]. Chemical Communications, 2014, 50(91): 14209–14212. DOI: 10.1039/C4CC05535G |
| [32] | Cheng X, Peng H, Huang J, et al. Dendrite-Free nanostructured anode:entrapment of lithium in a 3d fibrous matrix for ultra-stable lithium-sulfur batteries[J]. Small, 2014, 10(21): 4257–4263. |
| [33] | Jing H, Kong L, Liu S, et al. Protected lithium anode with porous Al2O3 layer for lithium-sulfur battery[J]. Journal of Materials Chemistry A, 2015, 3(23): 12213–12219. DOI: 10.1039/C5TA01490E |
| [34] | Zhang S. Liquid electrolyte lithium/sulfur battery:Fundamental chemistry, problems, and solutions[J]. Journal of Power Sources, 2013, 231: 153–162. DOI: 10.1016/j.jpowsour.2012.12.102 |
| [35] | Lin Z, Liu Z, Fu W, et al. Phosphorous pentasulfide as a novel additive for high-performance lithium-sulfur batteries[J]. Advanced Functional Materials, 2013, 23(8): 1064–1069. DOI: 10.1002/adfm.v23.8 |
| [36] | Suo L, Hu Y, Li H, et al. A new class of solvent-in-salt electrolyte for high-energy rechargeable metallic lithium batteries[J]. Nature Communications, 2013, 4(1481): 1–9. |
| [37] | Li W, Yao H, Yan K, et al. The synergetic effect of lithium polysulfide and lithium nitrate to prevent lithium dendrite growth[J]. Nature Communications, 2015, 6: 1–8. |
| [38] | Yan C, Cheng X, Zhao C, et al. Lithium metal protection through in-situ formed solid electrolyte interphase in lithium-sulfur batteries:The role of polysulfides on lithium anode[J]. Journal of Power Sources, 2016, 327: 212–220. DOI: 10.1016/j.jpowsour.2016.07.056 |
 2018, Vol. 35
2018, Vol. 35