室温离子液体(Room Temperature Ionic Liquids)或室温熔盐(Room Temperature Molten Salt)是由特定的阴阳离子构成的在室温或近室温下呈现为液态的熔盐体系。它和固态、传统的液态材料相比较,表现出独特的物理化学性质及特有的功能,称其为一类新型的介质和“软”功能材料。离子液体几乎无蒸汽压、难挥发性、低熔点、稳定性强和可设计的特点,日益受到人们的关注,具有广阔的应用潜力和前景。以离子液体为介质的催化反应、分离分析、吸收过程的进行,其主要作用在相互接触形成的相界面处,表面张力是界面状态性能的最主要物理量,是界面反应的重要数据。王建英等[1]、纪俊荣[2]、王双平3]和谷明信等[4]研究了室温下系列的咪唑类离子液体的表面张力,然而没有研究咪唑离子液体[emim][Tf2N]表面张力的变化规律;Almeida等[5]采用悬浮液滴体积方法测量研究大气压力,温度范围为298.15~343.15 K条件下的阳离子为1-烷基-3-甲基咪唑和[SCN]-、[N(CN)2]-、[C(CN)3]-、[B(CN)4]-阴离子组成离子液体时表面张力减小的顺序是[N(CN)2]- > [SCN]- > [C(CN)3]- > [B(CN)4]-,表明阴离子的影响比较复杂;Geppert-Rybczyńska等[6]利用悬滴法测定[bmim][NTf2]及[emim][NTf2]离子液体和四氟氢喃、乙腈、二甲基亚砜混合的二元混合物的热力表面性质;Rilo等[7]采用液滴体积张力计测定研究了1-乙基-3-甲基咪唑烷基硫酸盐(emim-CnS,n=2、4、6、8)离子液体分别和水、乙醇二元溶液的表面张力,研究结果表明2个二元离子液体混合物的表面张力完全不同,离子液体和乙醇体系表面张力随着乙醇含量增加而减小,离子液体和水体系表面张力与乙醇体系的相反;Jiang等[8]和李吉广等[9]采用密度计和数字显示张力计测量研究了温度范围在293.15~338.15 K,在常压下离子液体1-丁基-3-甲基咪唑L-乳酸([bmim][L-lactate])、[C6mim][PF6]和[C8mim][PF6]的密度和表面张力以及二元混合溶液的表面张力和密度的特性,结果显示该离子液体的密度和表面张力均随温度的升高而降低;Rilo等[10]测定了常压,25 ℃下的[Cnmim][BF4]离子液体分别与水和醇组成混合物的表面张力和密度值,进一步补充了离子液体和醇混合物的实验数据;Sattari等[11]采用基团贡献模型预测了含氟离子液体黏度随温度变化,结果表明模型预测含氟离子液体黏度,能够选择设计在所需温度范围内合适黏度值的离子液体;Cheng等[12]用实验和理论的方法从表面张力、导电率、荧光光谱和动态光散射方面测量比较C4mim-AOT、C4mim-DEHP与Na-AOT、Na-DEHP在水溶液中的聚集性能,研究结果表明C4mim-AOT、C4mim-DEHP的活性优于Na-AOT、Na-DEHP的活性;胡玉才[13]、杨许召等[14]分别合成离子液体1-烷基-3-甲基咪唑硫酸甲酯、[bmin][(BuO)2P(O)O],研究了其电导率随温度的影响,结果显示温度升高,离子液体的电导率也增加。
综上所述,学者们进行实验测量在常温常压下对咪唑类离子液体的表面张力、密度、黏度和电导率等性质的研究大多集中于含有[BF4]-、[PF6]-、烷基硫酸盐等阴离子的咪唑类离子液体以及含上述咪唑类离子液体的混合物,然而对咪唑类离子液体[emim][Tf2N]的表面张力、密度、黏度及电导率性质的研究比较少。文中作者自主合成的离子液体[emim][Tf2N](合成质量分数为99%),研究中采用Wilhelmy白金板法、自动密度仪、黏度计、电导率仪测定该离子液体在温度范围为298.15~338.15 K、压力为0.1 MPa条件下的表面张力,密度、黏度及电导率,为研究该离子液体的物理性质提供了理论基础。
1 实验部分 1.1 实验设备干燥箱(DZF-6020型真空干燥箱;上海一恒科技有限公司),全自动表面张力仪(BZY-1型号,上海衡平仪器仪表厂,测量范围是0~400 mN/m,测量精度为±0.1 mN/m);自动密度仪(型号为ZMD-2,测量精度为0.0001 g/cm3,上海方瑞仪器有限公司);SPY-Ⅲ玻璃恒温水浴(温度均匀度0.01 ℃,温度范围为室温~95 ℃,温度波动度±0.02 ℃,南京桑力电子设备厂)。旋转黏度计(广州沪瑞明仪器有限公司生产的SNB-1型号,测量精度在±1%);数显电导率仪(上海仪田精密仪器有限公司生产的DDS-307 A型电导率仪,测量精度在±0.5%FS);圆底烧瓶体积为250 mL,烧杯体积为100 mL,蒸馏水。
1.2 表面张力、密度、黏度及电导率测量的实验过程采用BZY-1全自动表面张力仪、ZMD-2密度仪、旋转黏度计、数显电导仪分别测定离子液体表面张力、密度、黏度和电导率。小烧杯用蒸馏水冲洗干净后烘干,将待测离子液体[emim][Tf2N]倒入烘干的小烧杯中,并放入控温精度为±0.01 ℃的SPY-Ⅲ玻璃恒温槽中,待烧杯中离子液体温度达到设定值且可维持20 min不变时,即可进行离子液体物性的测定,且每个温度点所测离子液体的物性参数测量值应取5次测量值的平均值。
为了验证测试仪器的准确性和可靠性,在进行正式实验之前,我们对文献中曾报道蒸馏水的表面张力和密度进行了重复实验验证,并测量了蒸馏水的电导率值。实验用蒸馏水为靖江市恒信环保设备有限公司生产,质量分数高于99.99%,实验结果表明采用BZY-1全自动表面张力仪测量蒸馏水的表面张力值,实验值72.0 mN/m和文献值71.9 mN/m的相对误差是0.14%,采用ZMD-2密度仪测量蒸馏水的密度值,实验值0.9981 g/cm3和文献值0.9975 g/cm3的相对误差是0.06%,采用数显电导仪测量蒸馏水的电导率值,实验值是1.201 μS/cm,文献值是1.0~1.5 μS/cm,实验值在文献值的范围之内[1, 15],由此可知,本测试设备所得到的实验数据和文献数据吻合度非常高,从而证明本测试的实验设备具有很好的可靠性。
2 结果与讨论离子液体具有特殊的物理性质, 使得离子液体在萃取、分离及吸收等反应中具有特殊性能,然而对于离子液体的物性参数的研究比较缺少,研究中对离子液体的表面张力、黏度、密度及电导率物性参数进行测量,为进一步研究离子液体提供基础数据,为离子液体的工业化应用及实验研究提供参考。
实验分别采用白金板法、黏度计、电导仪、密度仪测定离子液体[emim][Tf2N]在温度范围为298.15~338.15 K、压力为0.1 MPa时表面张力、密度、黏度和电导率数据,并与相同实验工况下文献[16]、[17]、[18]、[19]、[20]、[21]和[22]中所测离子液体的表面张力、密度、黏度和电导率数据进行对比实验研究,研究结果如图 1~图 5所示。
|
| 图 1 不同阳离子和温度对表面张力影响 Figure 1 Different cations and temperature effect on the surface tension |
| |
|
| 图 2 不同阴离子和温度对表面张力影响 Figure 2 Different anions and temperature effect on the surface tension |
| |
|
| 图 3 温度对离子液体密度影响 Figure 3 Temperature effect on ionic liquids density |
| |

|
| 图 4 温度对离子液体黏度影响 Figure 4 Temperature effect on ionic liquids viscosity |
| |
|
| 图 5 温度对离子液体电导率的影响 Figure 5 Temperature effect on ionic liquid conductivity |
| |
表面张力测量采用白金板法,实验所得数据采用最小二乘法处理,得到离子液体[emim][Tf2N]表面张力和温度关系的回归方程如式(1)所示:
| $ \sigma {\rm{ = }}49.6949{\rm{ - }}0.046T $ | (1) |
式(1)中:σ为离子液体表面张力,mN/m;T为实验温度,K。
密度测量采用自动密度仪,实验所测得数据采用最小二乘法处理,得到离子液体[emim][Tf2N]的密度和温度关系的回归方程如式(2)所示:
| $ \rho {\rm{ = }}1.70452659{\rm{ - }}0.00069858T $ | (2) |
式(2)中:ρ为离子液体密度,g/cm3;T为实验温度,K。
黏度值将所测得实验数据采用基团贡献法计算,基团贡献法是指同种基团在体系中对物性的贡献值是一样的,离子液体的黏度的影响主要考虑阴阳离子结构和温度。基团的划分和基团贡献值如表 1所示。
| 序号 | 基团 | 贡献值 |
| 1 | C3H4N2 | 15.537 |
| 2 | —CH3 | 3.846 |
| 3 | —CH2— | 7.056 |
| 4 | —CF3 | 4.023 |
| 5 | O=S=O | 0.600 |
| 6 | —N < | 0.693 |
黏度计算的数学模型为:
| $ \eta {\rm{ = }}\sum\limits_{k = 1}^n {\left[ {{T_{\rm{g}}}\left( k \right) \times n\left( k \right)} \right]} \times \left( {\frac{{298.15}}{T}} \right) $ | (3) |
式(3)中:Tg(k)为k基团对黏度的贡献值;n(k)为k基团在该离子液体中的数目;T为待计算物质的温度,K;η为待计算离子液体的黏度,mPa·s。相对误差(RE)计算方法如式(4)所示为:
| $ {\rm{RE}} = \frac{{\left| {{\eta _{\exp }} - {\eta _{{\rm{cal}}}}} \right|}}{{{\eta _{\exp }}}} \times 100\% $ | (4) |
式(4)中:RE为相对误差;ηexp为实验值;ηcal为计算值。
对298.15 K条件下离子液体表面张力、密度和黏度进行计算值与实验值比较,计算可得到离子液体[emim][Tf2N]表面张力相对误差为0.22%,密度的相对误差为0.1%,离子液体[emim][Tf2N]、[hmim][Tf2N]、[omim][Tf2N]的黏度相对误差分别为6.5%、4.8%、7.9%。相对误差值在误差范围要求内。
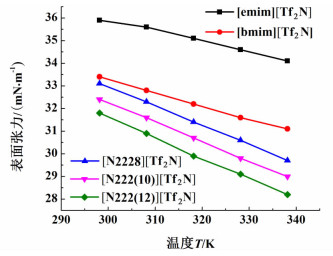
2.2 离子液体的表面张力特性在实验工况压力为0.1 MPa时,温度变化范围为298.15~338.15 K时,离子液体[emim][Tf2N]、离子液体[bmim][Tf2N][16]、离子液体[N2228][Tf2N][17]、[N222(10)][Tf2N][17]、[N222(12)][Tf2N][17]的表面张力随阳离子链长的变化曲线如图 1所示。
由图 1可知,首先,在相同实验工况下,[emim][Tf2N]离子液体和[bmim][Tf2N]、[N2228][Tf2N]、[N222(10)][Tf2N]和[N222(12)][Tf2N]离子液体的表面张力随温度的升高而逐渐减小。这是由于离子液体分子间的相互作用力会随着温度的升高而逐渐减弱,从而导致表面势能减小,因此离子液体表面张力随着温度的升高而降低。
其次,当阴离子相同时,离子液体的阳离子碳链长度关系为[N222(12)]+>[N222(10)]+>[N2228]+>[bmim]+>[emim]+,离子液体的表面张力随离子液体阳离子类型的变化规律如图 1所示,上述表面张力按数值升序排列,其结果为[emim][Tf2N]>[bmim][Tf2N]>[N2228][Tf2N]>[N222(10)][Tf2N]>[N222(12)][Tf2N]。可知,当离子液体阴离子保持不变,随着离子液体中阳离子结构的变化,离子液体的表面张力随着阳离子碳链长度增加而减小。这是由于烷基链长度影响离子液体中阴阳离子间的相互作用,阳离子碳链越长阻碍作用越强,使得离子液体中阴阳离子越难以相互接近,导致阴阳离子间的相互作用力越弱,因此离子液体阳离子烷基碳链越长导致离子液体的表面张力就相对越小。
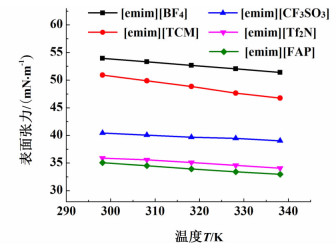
由图 2可知,首先,在相同实验工况下,阳离子相同时离子液体表面张力随温度的升高而逐渐减小。因为离子液体分子间相互作用随着温度的降低而增加,所以温度升高导致离子液体表面张力减小。
其次,在相同实验工况下,离子液体[emim][BF4][18]、[emim][CF3SO3][18]、[emim][TCM][19]和[emim][FAP][20]表面张力数据由文献中获得。当阳离子相同时,上述的离子液体阴离子尺寸关系为[BF4]-<[TCM]-<[CF3SO3]-<[Tf2N]-<[FAP]-,由图 2可知,上述离子液体表面张力按数值由大到小的顺序排列,其排列的结果为[emim][BF4]>[emim][TCM]>[emim][CF3SO3]>[emim][Tf2N]>[emim][FAP]。由上述可知,当阳离子相同时离子液体表面张力值随着其阴离子尺寸的增大而减小。这是因为阴离子尺寸增大使得阴离子的负电荷扩散作用增加,从而导致电离域效应增强,对阴离子氢键作用能力是减弱的效果,从而使得离子液体的表面张力就越小。在所研究的离子液体中,[emim][Tf2N]离子液体的阴离子尺寸相对较大,因此表面张力值相对较小。
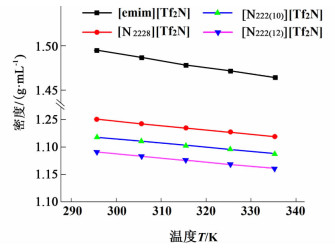
2.3 温度对离子液体密度影响当温度范围为298.15~338.15 K时、压力为0.1 MPa时,离子液体[emim][Tf2N]、离子液体[N2228][Tf2N][17]、[N222(10)][Tf2N][17]和[N222(12)][Tf2N][17]密度随温度的变化曲线如图 3所示。
由图 3可知,在实验工况下,离子液体[emim][Tf2N]和离子液体[N2228][Tf2N][17]、[N222(10)][Tf2N][17]和[N222(12)][Tf2N][17]的密度随温度升高而逐渐降低。这是因为随着温度的升高导致离子液体的体积发生膨胀,单位体积内质量减小,从而使得离子液体密度随温度的升高而降低。
其次,在相同的实验工况下,阴离子相同的时候,离子液体的密度随着阳离子的碳链长度变化规律可由图 3知,离子液体的密度随着阳离子的变化顺序是[emim]+>[N2228]+>[N222(10)]+>[N222(12)]+,这是因为随着阳离子碳链长度的增加,烃链间的偶极相互作用的阻碍效果增强,导致单位体积增大,使得离子液体的密度减小。
2.4 温度对离子液体黏度影响当温度范围为296.15~328.15 K时、压力为0.1 MPa时,离子液体[emim][Tf2N]、离子液体[hmim][Tf2N][21]和[omim][Tf2N][21]的黏度随温度变化曲线如图 4所示。
由图 4可以看出在相同工况下,离子液体随着温度升高黏度值迅速减小。因为离子液体的黏度是由氢键和范德华力决定的,温度的升高使得分子的活动效果增强,从而导致分子间的作用力减小,当温度上升的时候,离子液体的黏度会迅速的下降,温度是影响离子液体黏度的重要因素。
其次,在相同实验工况下,离子液体黏度的变化趋势不同,[emim][Tf2N]的黏度减小速率小于[hmim][Tf2N]和[omim][Tf2N]的减小速率,说明[hmim][Tf2N]和[omim][Tf2N]的黏度随温度影响效果强于[emim][Tf2N]的黏度随温度的影响。
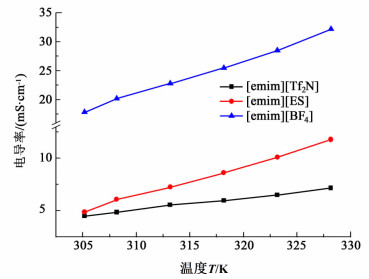
2.5 温度对离子液体电导率影响当温度范围为301.15~328.15 K时、压力为0.1 MPa时,离子液体[emim][Tf2N]、离子液体[emim][ES][22]和[emim][BF4][22]的电导率随温度变化如图 5所示。
由图 5可知在实验工况下,离子液体[emim][Tf2N]、[emim][ES]和[emim][BF4]的电导率均受温度的影响变化显著,随着温度的升高而出现电导率增大的趋势,并且增大的趋势相同。因为离子液体的黏度相对较高,随着温度的升高,离子液体的黏度迅速降低,离子液体的离子迁移速度增大,从而使得电导率增大。
其次,离子液体[emim][BF4]的黏度相对离子液体[emim][Tf2N]和[emim][ES]而言较小,流动性能好,离子液体的离子移动性能较高,因此其电导率较大。
3 结论离子液体是一种很有应用前景的绿色溶剂之一。离子液体在萃取、催化、吸收等过程中有较好的应用,通过研究离子液体[emim][Tf2N]的密度、表面张力、黏度及电导率的性质,能够为进一步研究该离子液体物理性质提供理论基础数据。
1) 在温度范围为298.15~338.15 K、压力为0.1 MPa实验工况下研究离子液体的表面张力物性,离子液体阳离子烷基链越长表面张力相对越小,离子液体阴离子尺寸增加表面张力相对也减小。
2) 在温度范围为298.15~338.15 K、压力为0.1 MPa实验工况下,离子液体[emim][Tf2N]的表面张力、密度随实验温度的升高都呈现降低的趋势。
3) 在温度范围为296.15~328.15 K、压力为0.1 MPa的实验工况下,离子液体[emim][Tf2N]、[hmim][Tf2N]和[omim][Tf2N]的黏度均随着温度升高而降低,且离子液体[hmim][Tf2N]和[omim][Tf2N]的黏度值随温度的变化强于[emim][Tf2N],温度是影响离子液体黏度的重要因素。
4) 在温度范围为305.15~328.15 K时、压力为0.1 MPa的实验工况下,离子液体[emim][Tf2N]的电导率随着温度的升高而增大。
| [1] |
王建英, 赵风云, 刘玉敏, 等. 1-烷基-3-甲基咪唑系列室温离子液体表面张力的研究[J].
化学学报, 2007, 65(15): 1443–1448.
Wang Jianying, Zhao Fengyun, Liu Yumin, et al. Study on surface tension of a series of 1-alkyl-3-methylimidazolium room temperature ionic liquids[J]. Acta Chimica Sinica, 2007, 65(15): 1443–1448. DOI: 10.3321/j.issn:0567-7351.2007.15.007 |
| [2] | 纪俊荣. 离子液体表面/界面性能的研究[D]. 石家庄: 河北科技大学, 2010 Ji Junrong. Study on surface and interfacial tension of ionic liquid[D]. Shijiazhuang: Hebei University of Science and Technology, 2010(in Chinese) |
| [3] |
王双平, 张晓燕, 潘奇伟, 等. 咪唑盐离子液体的微波合成、表征及性质研究[J].
化学试剂, 2009, 31(12): 1015–1017.
Wang Shuangping, Zhang Xiaoyan, Pan Qiwei, et al. The microwave-assisted synthesis, characterization and study on behavior of chlorinated imidazolium ionic liquids[J]. Chemical Reagents, 2009, 31(12): 1015–1017. DOI: 10.3969/j.issn.0258-3283.2009.12.016 |
| [4] |
谷明信, 秦涵书, 孟祥丹, 等. 系列离子液体的表面张力研究[J].
材料导报, 2014, 28(24): 244–250.
Gu Mingxin, Qin Hanshu, Meng Xiangdan, et al. Study on the refractive index of series of ionic liquids[J]. Materials Review, 2014, 28(24): 244–250. |
| [5] | Almeida H F D, Carvalho P J, Kurnia K A, et al. Surface tensions of ionic liquids:Non-regular trend along the number of cyano group[J]. Fluid Phase Equilibria, 2016, 409: 458–465. DOI: 10.1016/j.fluid.2015.10.044 |
| [6] | Geppert-Rybczyńska M, Lehmann J K, Safarov J, et al. Thermodynamic surface properties of [BMIM] [NTf2] or[EMIM] [NTf2] binary mixtures with tetrahydrofuran, acetonitrile or dimethylsulfoxide[J]. J Chem Thermodynamics, 2013, 62: 104–110. DOI: 10.1016/j.jct.2013.02.021 |
| [7] | Rilo E, Domínguez-Pérez M, Vila J, et al. Surface tension of four binary systems containing (1-ethyl-3-methyl imidazolium alkyl sulphate ionic liquid+water or+ethanol)[J]. Thermodynamics, 2012, 49: 165–171. DOI: 10.1016/j.jct.2012.01.023 |
| [8] | Jiang H, Zhao Y, Wang J, et al. Density and surface tension of pure ionic liquid 1-butyl-3-methylimidazolium l-Lactate and its binary mixture with alcohol and water[J]. Thermodynamics, 2013, 64: 1–13. DOI: 10.1016/j.jct.2013.04.015 |
| [9] |
李吉广, 胡玉峰, 褚洪达, 等. 离子液体[C6mim] [PF6]和[C8mim] [PF6]的热力学性质研究[J].
黑龙江大学自然科学学报, 2009, 26(5): 674–679.
Li Jiguang, Hu Yufeng, Chu Hongda, et al. Study on the thermodynamic properties of ionic liquids[C6mim] [PF6] and[C8mim] [PF6][J]. Journal of Natural Science of Heilongjiang University, 2009, 26(5): 674–679. |
| [10] | Rilo E, Pico J, García-Garabal S, et al. Density and surface tension in binary mixtures of CnMIM-BF4 ionic liquids with water and ethanol[J]. Fluid Phase Equilibria, 2009, 285: 83–89. DOI: 10.1016/j.fluid.2009.07.010 |
| [11] | Sattari M, Kamari A, Hashemi H, et al. A group contribution model for prediction of the viscosity with temperature dependency for fluorine-containing ionic liquids[J]. Journal of Fluorine Chemistry, 2016, 186: 19–27. DOI: 10.1016/j.jfluchem.2016.04.001 |
| [12] | Cheng N, Ma X, Sheng X, et al. Aggregation behavior of anionic surface action liquids with double hydrocarbon chains in aqueous solution:Experimental and theoretical investigations[J]. Colloids and Surface A:Physicochem Eng Aspects, 2014, 453: 53–61. DOI: 10.1016/j.colsurfa.2014.03.083 |
| [13] |
杨许召, 王军, 李刚森, 等. 室温离子液体1-烷基-3-甲基咪唑硫酸甲酯的合成及电导率研究[J].
精细与专用化学品, 2007, 15(10): 16–18.
Yang Xuzhao, Wang Jun, Li Gangsen, et al. Study on preparation of room temperature ionic liquids 1-alkyl-3-methylimidazole, ethyl sulfate and its electrical conductivity investigation[J]. Fine and Specialty Chemicals, 2007, 15(10): 16–18. DOI: 10.3969/j.issn.1008-1100.2007.10.005 |
| [14] |
胡玉才, 殷平, 魏建德, 等. 室温离子液体1-丁基-3-甲基咪唑磷酸二丁酯的电导率研究[J].
广州化工, 2006, 34(5): 26–29.
Hu Yucai, Yin Ping, Wei Jiande. Study of electrical conductivity of room temperature ionic liquid 1-butyl-3-methylimidazolium dibutyl phosphate[J]. Guangzhou Chemical Industry, 2006, 34(5): 26–29. |
| [15] |
吴松海, 孙永利, 贾绍义. 磁场对蒸馏水蒸发过程的影响[J].
石油化工高等学校学报, 2006, 19(1): 10–12.
Wu Songhai, Sun Yongli, Jia Shaoyi. Effects of magnetic field on evaporation of distilled water[J]. Journal of Petrochemical Universities, 2006, 19(1): 10–12. |
| [16] | Freire M G, Carvalho P J, Fernandes A M., et al. Surface tensions of imidazolium based ionic liquids:Anion, cation, temperature and water effect[J]. Colloid and Interface Science, 2007, 314: 621–630. DOI: 10.1016/j.jcis.2007.06.003 |
| [17] | Ghatee M H, Bahrami M, Khanjari N. Measurement and study of density, surface tension, and viscosity of quaternary ammonium-based ionic liquids ([N222(n)]Tf2N)[J]. J Chem Thermodynamics, 2013, 65: 42–52. DOI: 10.1016/j.jct.2013.05.031 |
| [18] | Součková M, Klomfar J, Pátek J. Surface tension of 1-alkyl-3-methylimidazolium based ionic liquids with trifluoromethanesulfonate and tetrafluoroborate anion[J]. Fluid Phase Equilibria, 2011, 303: 184–190. DOI: 10.1016/j.fluid.2011.01.027 |
| [19] | Domańska U, Królikowska M, Walczak K. Effect of temperature and composition on the density, viscosity surface tension and excess quantities of binary mixtures of 1-ethyl-3-methylimidazolium tricyanomethanide with thiophene[J]. Colloids and Surfaces A:Physicochem Eng Aspects, 2013, 436: 504–511. DOI: 10.1016/j.colsurfa.2013.07.011 |
| [20] | Součková M, Klomfar J, Pátek J. Temperature dependence of the surface tension and 0.1 MPa density for 1-Cn-3-methylimidazolium tris(pentafluoroethyl)trifluorophosphate with n=2, 4, and 6[J]. J Chem Thermodynamics, 2012, 48: 267–275. |
| [21] | Snežana P, Bešter-Rogač M, Vraneš M, et al. The effect of the alkyl chain length on physicochemical features of (ionic liquids+γ-butyrolactone) binary mixtures[J]. J Chem Thermodynamics, 2016, 99: 1–10. DOI: 10.1016/j.jct.2016.03.034 |
| [22] | Vila J, Ginés P, Pico J M, et al. Temperature dependence of the electrical conductivity in EMIM-based ionic liquids Evidence of Vogel-Tamman-Fulcher behavior[J]. Fluid Phase Equilibria, 2006, 242: 141–146. DOI: 10.1016/j.fluid.2006.01.022 |
 2018, Vol. 35
2018, Vol. 35





