多晶型是指同一种分子在固态晶格中具有不同的填充与排列方式[1]。同一药物的不同晶型在溶解度、溶出速率、熔点、密度、硬度、外观等方面有显著差异[2-3],从而影响药物的稳定性、生物利用度及疗效的发挥。当更多的晶型被确定时,企业可以选择出最有利于开发且具有良好物理性能的固体产品[4],从而加强最终产品的知识产权,延长专利药的市场独占。
美国药典明确列出大约有40%的药物存在多晶型现象,但受制于多晶型筛选方法的限制而不能被发现[5]。微流体技术为系统化、小型化筛选结晶条件提供了新的工具。这种技术一次操作可以产生数百至上千个微小液滴,因此只需要少量的原料就可以进行大量的实验[6]。这种系统可以精准控制温度、浓度、空间和时间等条件,并且由于液滴体积小,亚稳态晶型形成后消耗了过饱和度,阻止了其进一步向稳态晶型转化,因此有利于观察得到传统方法中不能或难得到的晶型。Yashina等[7]使用微流体设备研究了碳酸钙的结晶过程。在液滴中,4 mmol的反应试剂只生成了方解石;8 mmol的反应试剂中只有球霰石;而10 mmol反应试剂中是方解石和球霰石的混合物。相同条件下,结晶实验在大容器反应器中进行时得到的是方解石和球霰石的混合物。此外,与传统结晶方法相比,液滴-微流体系统具有更大的比表面积[8],这对晶体的成核与生长都会产生影响。Shinohara等[8]利用Y型微通道中的有机/乙醇界面,及不同的结晶条件得到了C60的多个亚稳态晶型,如球状、星星状、管状、两端开口的空心柱状、树状和分支状。这种系统可以精准控制温度、浓度、空间和时间等条件。
L-谷氨酸是人体所需的氨基酸之一,在食品、医药、农业等方面有着重要的应用。它存在两种晶型,即亚稳态α型和稳态β型。α晶型为棱柱型颗粒,颗粒较大,易过滤分离,产品纯度高;β型晶体为薄皮状或针状,颗粒小,难于分离,且在抽滤时易发生阻塞,纯度低[9-10]。
在本研究中,我们将使用液滴-微流体装置,研究微尺度下温度、液滴大小及溶剂组成对L-谷氨酸的多晶型现象的影响。
1 实验设备和方法 1.1 实验药品及设备L-谷氨酸,购自上海笛柏化学品技术有限公司;硅油,购自上海阿拉丁生化科技股份有限公司。注射泵购自保定兰格恒流泵有限公司。无水乙醇购自天津市江天化工技术有限公司。
图 1为定制的玻璃芯片。芯片的微通道内径尺寸均为500 μm (W)×500 μm(H)。

|
| 图 1 玻璃微通道 Figure 1 The photographs of glass chip |
| |
本研究中,L-谷氨酸的溶液作为分散相,硅油作为连续相。
1.2.1 结晶温度对晶型的影响准确称取一定量的L-谷氨酸溶解于蒸馏水中,制备过饱和溶液。将L-谷氨酸溶液与硅油分别注入配有0.22 μm过滤膜的2.5 mL注射器中。用Teflon管将注射器的针头与微通道进口相连,并将注射器固定在注射泵上。调节2个注射泵的流速,将两相溶液注入微通道,在通道中生成液滴。当通道中充满液滴时,停止注射,密封芯片的进口和出口。然后将其放置在恒温箱中进行冷却结晶,结晶时间为20 h。实验结束后,用注射器将晶体从通道中打出,无水乙醇洗涤后,在60 ℃下进行干燥。
1.2.2 液滴大小对晶型的影响通过改变分散相与连续相的流速,在微通道中得到了不同大小的液滴,研究了液滴大小对L-谷氨酸晶型的影响。液滴的体积V由公式(1)计算得到。
| $V = Q/\mathit{f} $ | (1) |
其中Q为分散相消耗量,f为液滴对生成频率。其他步骤与1.2.1相似。
1.2.3 溶剂组成对晶型的影响准确称取一定量的L-谷氨酸溶解于蒸馏水中,制备10 ℃下过饱和度为2的溶液。然后向溶液中加入一定体积的无水乙醇。其他步骤与1.2.1相似。
在上述过程中,过饱和度(S)的定义为:
| $S = C/{C^ * } $ | (2) |
C是指实验溶液中β型L-谷氨酸的质量浓度,C*为结晶温度下β型L-谷氨酸的平衡质量浓度。
1.3 粉末晶体的表征采用配备照相机的显微镜(Olympus U-CMAD3)对所得L-谷氨酸晶体的形貌进行观察。
采用粉末X-射线衍射(PXRD,Rigaku D/max-2500)检测L-谷氨酸的晶型。测试条件为:扫描速度为8(°)/min,扫描范围为5°~40°。
2 实验结果与讨论 2.1 结晶温度对晶型的影响L-谷氨酸的β型晶体在高的过饱和度下容易发生二次成核,生成晶体聚集物。因此无法数液滴中α型及β型晶体的个数。为了能更好的计算2种晶型的比例,使用含有α型晶体的液滴数(N1)与含有晶体总液滴数(N0)的比值来定义α型晶体的含量,即P=N1/N0。
本工作研究了4、10和20 ℃ 3种结晶温度,过饱和度分别为2、3、4、5和6,5种条件下的L-谷氨酸的结晶过程。实验结果如图 2所示。
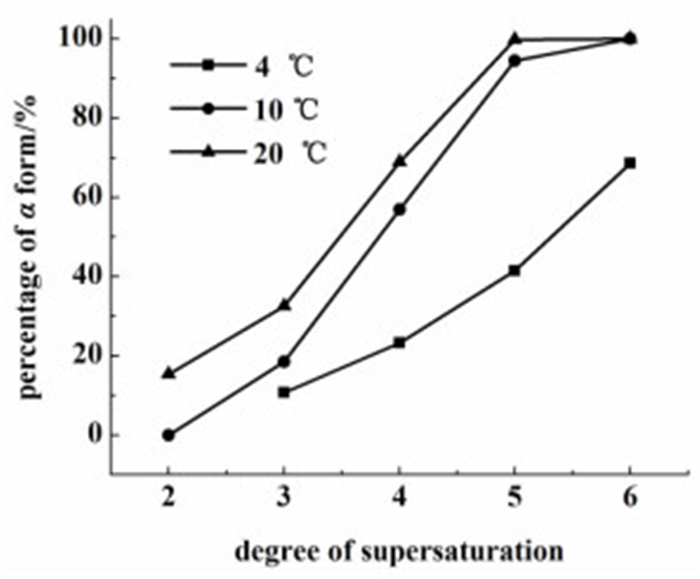
|
| 图 2 不同温度下,过饱和度与α型晶型的关系 Figure 2 The relationship between the degree of supersaturation and α form under different temperature |
| |
从图 2中可以看出,3种结晶温度下,α型晶体的比例均随着过饱和度的增加而增加。当过饱和度相同时,温度越高,α型晶体的比例越大。例如,过饱和度为5时,20 ℃条件下α型晶体的比例为100%,10 ℃条件下α型晶体的比例为94.5%,4 ℃时α型晶体的比例仅为41.4%。此外,结晶温度为4 ℃时,过饱和度为2的条件下没有晶体生成。原因可能是液滴体积较小,且没有其他的外界推动力,成核速率较慢,所以在20 h内没有生成晶体。
墨玉欣[11]曾用传统结晶法研究发现结晶温度低于25 ℃时,无论过饱和度为多少都无法生成β晶型。但本研究的3个结晶温度中都有得到β晶型。这表明液滴-微流体在控制晶型生成方面有很大的优势。
用显微镜观察得到的结果如图 3a)和图 3b)所示。α型晶体成棱柱状,β型晶体为针状或片状。两种晶型的晶习与传统结晶方法中得到的晶习[12]基本相同,如图 3c)和图 3d)所示。表明在微流体环境下,L-谷氨酸的晶习并没有发生变化。PXRD结果如图 4所示,α型晶体的特征峰为18.3°,β型晶体的特征峰为10.2°。
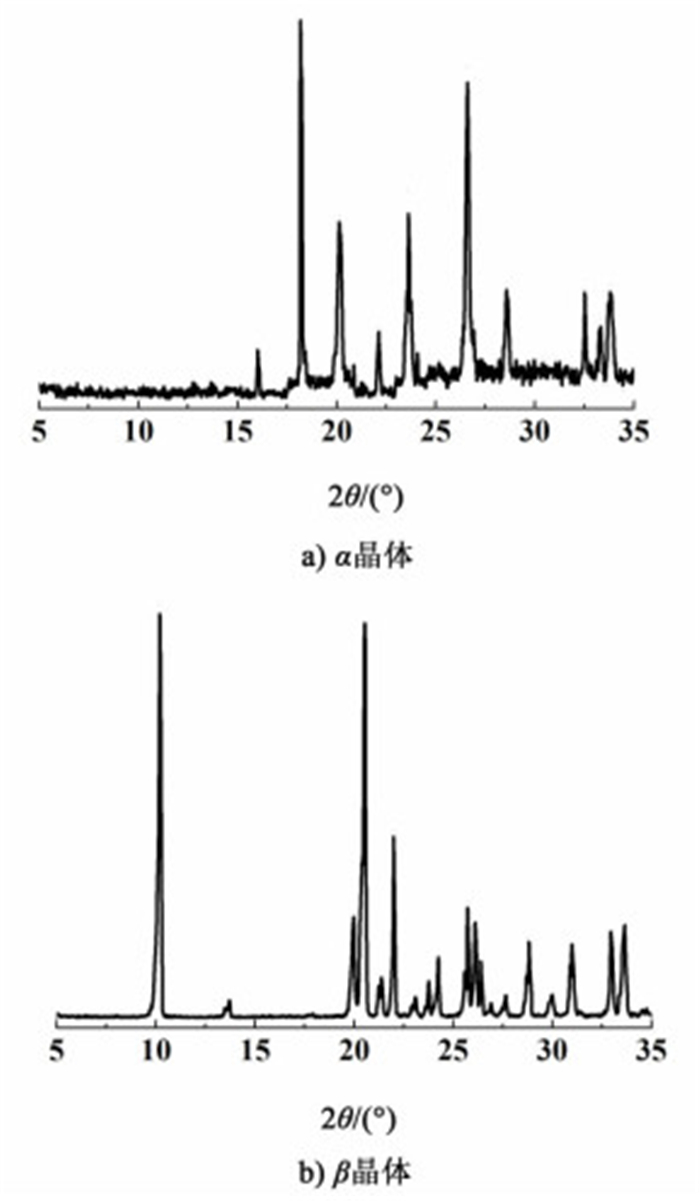
|
| 图 4 L-谷氨酸2种晶体的PXRD图 Figure 4 The PXRD patterns of two forms of L-glutamic acid |
| |
从2.1的实验结果中可知,结晶温度为10 ℃,过饱和度为6的条件下得到的晶体100%为α型晶体,且α型晶体不会出现晶体聚集物。所以本工作研究了10 ℃,过饱和度为6时的结晶过程。实验结果表明,在相同的实验条件下,不同长度的液滴中得到的晶体晶型并未发生变化,均为α型晶体,如图 6所示。由此可知液滴的大小并不会影响晶型。
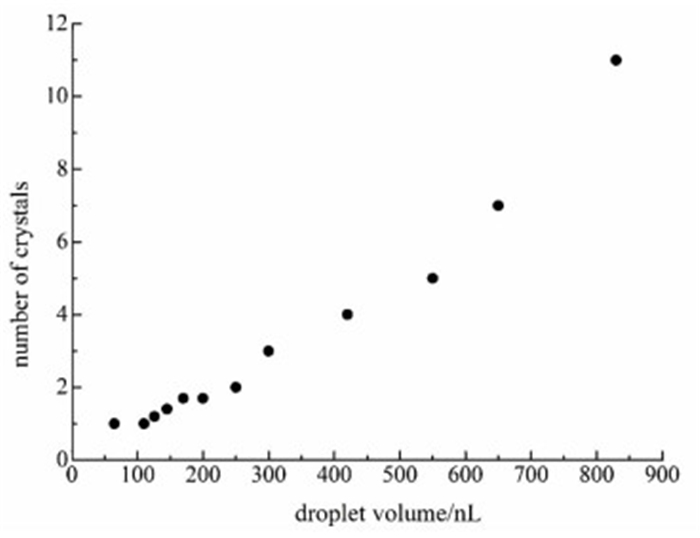
|
| 图 6 液滴大小与晶体个数的关系 Figure 6 The relationship between droplet volume and number of crystals |
| |
从图 5中可以看出虽然晶体的晶型并未随液滴大小发生变化,但生成的晶体个数发生了变化。所以考察了液滴大小与晶体个数的关系,结果如图 6所示。液滴越大,生成的α型晶体个数越多。这是因为大的液滴中含有的L-谷氨酸分子数更多,可以生成更多的晶体。

|
| 图 5 液滴大小对晶型的影响 Figure 5 The effect of droplets volumes on polymorphism |
| |
此外,由图 5可知,不同的晶体并没有聚结在一起,而是在液滴内部的不同位置生长。这是因为在液滴中,Ra(瑞利数,与自然对流关联的无量纲参数,Ra与通道直径的三次方成正比)值较小,自然对流受到限制,物质主要以扩散的形式进行运动[13-14]。当1个晶核形成后,晶体的生长会消耗周围的液体浓度,由于扩散的速度较慢,所以在晶核周围形成浓度梯度。这个浓度梯度区域成为扩散边界层。如果液滴的长度大于扩散边界层,在远离已形成的晶体的L-谷氨酸的过饱和溶液会形成第2个晶核。
2.3 溶剂组成对晶型的影响本实验考察了乙醇与水的不同比例混合溶剂对L-谷氨酸晶型的影响。乙醇的摩尔分数分别为:0、0.0202、0.0300和0.0417。图 7是L-谷氨酸亚稳态晶型的含量与不同组成混合溶剂的关系。
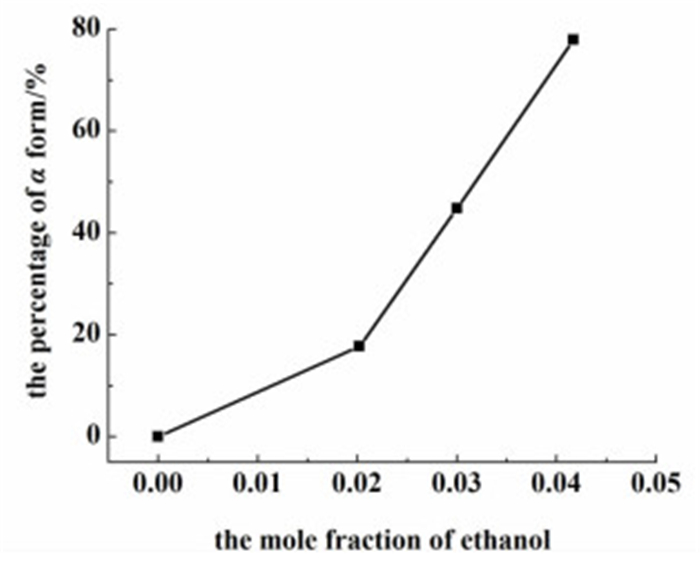
|
| 图 7 混合溶剂中亚稳态α晶体的百分比 Figure 7 The percentage of α form in different mixed solvents |
| |
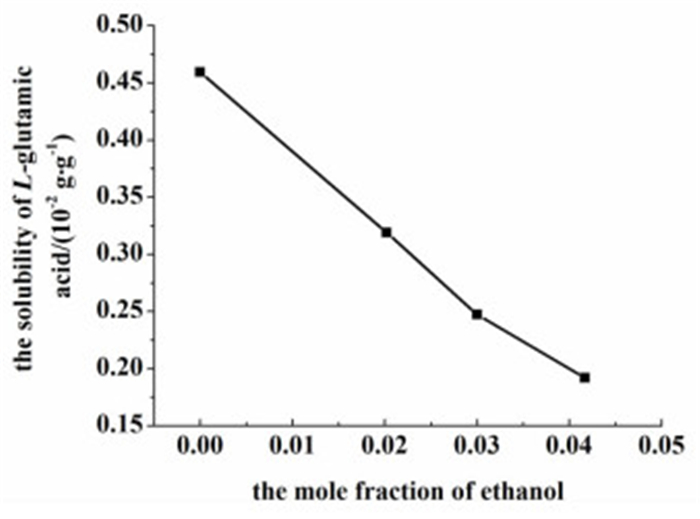
从图 7中可看出,随着乙醇摩尔分数的增加,L-谷氨酸α型晶体的含量不断增加。原因可能如下:L-谷氨酸可以与水形成氢键。L-谷氨酸不溶于乙醇,而乙醇与水能形成更强的缔合体,从而破坏了原来的L-谷氨酸-水氢键,挣脱了氢键束缚的谷氨酸分子可以迅速碰撞成核[15]。此外,L-谷氨酸的溶解度随乙醇摩尔分数的增加而减少,如图 8所示。因此乙醇含量的增加间接提高了溶液的过饱和度,从而生成了更多α型晶体。
|
| 图 8 10 ℃时L-谷氨酸在混合溶剂中的溶解度 Figure 8 The solubility of L-glutamic acid in different mixed solvents |
| |
罗文波等[15]研究发现乙醇的加入能提高α型晶体的比例,这与本实验结果相同。
3 结论影响药物多晶型的因素很多,温度、溶剂组成等均是重要的因素。本研究利用液滴-微流体法研究了3种因素对L-谷氨酸多晶型的影响,结果如下:
1) L-谷氨酸亚稳态晶型的比例会随着过饱和度的增加而增加。在相同过饱和度下,温度越高越有利于亚稳态晶型的生成;反之,温度越低越有利于稳态晶型的生成。
2) 液滴的大小虽然对晶型不会产生影响,但影响晶体的生成个数。液滴越大,生成的晶体个数越多。
3) 混合试剂中乙醇含量的增加,间接提高了溶液的过饱和度,从而更有利于亚稳态晶型的生成。
| [1] | Giron D. Thermal analysis and calorimetric methods in the characterization of polymorphs and solvates[J]. Thermochimica Acta, 1995, 248: 1–5. DOI: 10.1016/0040-6031(94)01953-E |
| [2] | Ono T, ter Horst J H, Jansens P J. Quantitative measurement of the polymorphic transformation of L-glutamic acid using in-situ Raman spectroscopy[J]. Crystal Growth & Design, 2004, 4(3): 465–469. |
| [3] | Bernstein J. Polymorphism in molecular crystals[M]. Oxford: Clarendon Press, 2002. |
| [4] | Michael R, Thorson, Sachit Goyal, et al. Microfluidic approach to polymorph screening through antisolvent crystallization[J]. Cryst Eng Comm, 2012, 14: 2404–2412. DOI: 10.1039/c2ce06167h |
| [5] | Singhal D, Curatolo W. Drug polymorphism and dosage form design:A practical perspective[J]. Advanced Drug Delivery Reviews, 2004, 56: 335–347. DOI: 10.1016/j.addr.2003.10.008 |
| [6] | Laval P, Giroux C, Leng J, et al. Microfluidic screening of potassium nitrate polymorphism[J]. Journal of Crystal Growth, 2008, 310: 3121–3124. DOI: 10.1016/j.jcrysgro.2008.03.009 |
| [7] | Yashina A, Meldrum F, deMello A. Calcium carbonate polymorph control using droplet-based microfluidics[J]. Biomicrofluidics, 2012, 6: 1–10. |
| [8] | Shinohara K, Fukui T, Abe H, et al. Screening of C60 crystallization using a microfluidic system[J]. Langmuir, 2006, 22(15): 6477–6480. DOI: 10.1021/la0614177 |
| [9] |
哈志瑞, 郭宝芹, 陈崇安, 等. 谷氨酸分离提取工艺进展[J].
发酵科技通讯, 2012, 41(2).
Ha Zhirui, Guo Baoqin, Chen Chongan, et al. The progression of glutamic acid extraction[J]. Bulletin of Fermentation Science and Technology, 2012, 41(2). |
| [10] |
江立新, 李立标. L-谷氨酸结晶条件对晶型影响的研究[J].
河南科技, 2013, 7: 216–217.
Jiang Lixing, Li Libiao. The effects of crystallization conditions on L-glutamic acid crystal shape[J]. Journal of Henan Science and Technology, 2013, 7: 216–217. |
| [11] | 墨玉欣. L-谷氨酸多晶型成核及晶型转化机理的研究[D]. 天津: 天津大学, 2011 Mo Yuxin. Nucleation and polymorphic transformation mechanism studies of L-glutamic acid[D]. Tianjin: Tianjin University, 2011(in Chinese) |
| [12] | Cashell C, Corcoran D, Hodnett B K. Control of polymorphism and crystal size of L-glutamic acid in the absence of additives[J]. Journal of Crystal Growth, 2004, 273: 258–265. DOI: 10.1016/j.jcrysgro.2004.08.020 |
| [13] | Maeki M, Yamaguchi H, Yamashita K, et al. Analysis of kinetic behavior of protein crystallization in nanodroplets[J]. Chemistry Letters, 2011, 40: 825–827. DOI: 10.1246/cl.2011.825 |
| [14] | Nitahara S, Maeki M, Yamaguchi H, et al. Three-Dimensional Raman spectroscopic imaging of protein crystals deposited on a nanodroplet[J]. Analyst, 2012, 137: 5730–5735. DOI: 10.1039/c2an35942a |
| [15] |
罗文波, 王弘, 于淑娟, 等. 磁场-溶剂协同作用对谷氨酸结晶过程的影响[J].
华南理工大学学报(自然科学版), 2001, 29(2): 70–72.
Luo Wenbo, Wang Hong, Yu Shujuan, et al. The effect of the synergism of magnetic field & solvents on the crystallization of glutamic acid[J]. Journal of South China University of Technology (Natural Science Edition), 2001, 29(2): 70–72. |
 2018, Vol. 35
2018, Vol. 35






