2. 中海油天津化工研究设计院, 天津 300131
2. CNOOC Tianjin Chemical Research & Design Institute, Tianjin 300131, China
相同物质因分子构象不同导致晶型不同的现象叫做构象多晶型[1]。由于药物分子普遍存在可旋转单键,药物晶体中存在大量的构象多晶型案例[2],利托那韦就是其中之一。利托那韦,分子式C37H48N6O5S2,CAS 155213-67-5。它是一种免疫缺陷病毒的有效抑制剂,用于治疗HIV病毒感染[3]。1996年FDA批准其口服溶液制剂和软胶囊2种剂型上市。2年后,2种剂型均被发现疗效有不同程度的减弱甚至无效,并且都出现了沉淀。究其原因是药物发生了晶型转变,由最初的晶型Ⅰ转变另一种分子构象的、溶解度更低、热力学更稳定的晶型Ⅱ[4]。
Chemburkar等[5]分析表明具有顺式构象的晶型Ⅱ有更稳定的堆积排列。即使在有Ⅱ晶型晶种的溶液中仍然很难得到晶型Ⅱ,但是在高过饱和溶液中分解产物诱导异相成核可导致出现晶型Ⅱ。Galek等[6]利用LHP (Logit Hydrogen-bonding Propensity)方法,基于氢键供体和受体属性及其所属的分子环境,评估了可能形成和不可能形成氢键的连接,证明了晶型Ⅱ中存在的一系列长短氢键使其比晶型Ⅰ稳定。
近年来利用哈氏表面(Hirshfeld surface)方法分析分子晶体结构的报道越来越多[7]。不同于传统的从分子间距离、键长、键角和分子堆积方式展现近距离分子间作用力的思路,该方法以有机分子为整体,通过计算哈氏表面指纹图谱、形状指数和曲率讨论密切接触的分子间相互作用。Hirshfeld surfaces定义为分子中原子带电的加权函数,由式(1)演变而来[8]:
| ${{\rm{W}}_a}\left( \mathit{r} \right) = \sum\limits_{i \in {\rm{molecule}}} {\rho _i^{at}\left( r \right)/\sum\limits_{i \in {\rm{crystal}}} {\mathit{\rho }_i^{at}\left( r \right)} } $ | (1) |
式(1)中,ρiat(r)表示各原子的平均球形电子密度,Wa(r)是分子的整体电荷密度权重函数,取值范围(0, 1)。软件Crystalexplorer以Hirshfeld surfaces为基础,可视化的给出分子间相互作用的情况和各种相互作用的贡献。Hirshfeld surface方法为多晶型结构研究提供了一个崭新的途径。Seth等[9]利用Hirshfeld surface方法,分析了吡啶衍生物分子间的相互作用,并用指纹图谱指导吡啶衍生物晶体结构的预测和筛选。López-Mejías等[10]利用Hirshfeld surface方法分析了托芬那酸不同晶型结构的差异,并且直观的呈现了分子间不同的相互作用强度。
理解分子间相互作用和分子堆积方式,对指导晶型筛选和结晶过程控制都具有重要意义。到目前为止,对利托那韦的研究多在新晶型实验筛选和表征上,对分子结构和晶体结构的研究报道较少。本研究以利托那韦为模型药物,在晶型Ⅰ和Ⅱ的单晶结构数据基础上,采用传统的晶体工程方法和最新的Hirshfeld surfaces方法分析分子间相互作用对分子构象的影响,分子构象的微小差异对晶体结构造成巨大差异的原因,以及晶型稳定的结构基础。
1 模拟计算从CSD(Cambridge structural database)中提取利托那韦晶型Ⅰ[4](YIGPIO02)和晶型Ⅱ[4](YIGPIO03)的分子。对分子晶体利托那韦通过MOPAC2012[11]进行初步的几何优化,所用的力场为PM7;计算分子间势和堆积能量使用UNI(Unified pair-potential parameters)力场[12];用PLATON软件[13]分析分子间氢键和晶体堆积指数,用软件Crystalexplorer[8]计算Hirshfeld Surfaces和形状指数、曲率等,球形“探针”半径为0.12 nm,近似网格间距为0.1 nm。
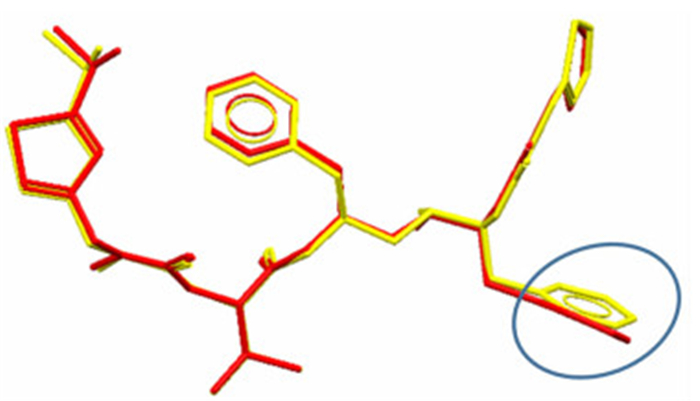
2 结果与讨论 2.1 分子构象分析图 1为利托那韦晶型Ⅱ的分子构象。为了比较利托那韦晶型Ⅰ(YIGPIO02)和晶型Ⅱ(YIGPIO03)分子构象的不同,将2种分子尽可能的重叠。如图 2所示,2种分子构象的最显著差异表现为,利托那韦分子链末端苯环旋转角度不同,两者相差7.5度。计算得到,2种分子最大的对应原子间距为0.094 nm,对应原子间距均方根偏差为0.034 nm。2分子中各原子距离均方根偏差较小、最大距离较小,说明2种分子结构非常相似[14]。就是如此细微不同的2个构象异构体形成了显著不同的2种晶体结构。

|
| 图 1 利托那韦晶型Ⅱ中的分子构象 Figure 1 The molecular conformation of ritonavir Form Ⅱ |
| |
|
| 图 2 利托那韦晶型Ⅰ(黄色)和晶型Ⅱ(红色)中分子构象 Figure 2 The different conformational structure of ritonavior Form Ⅰ(yellow)and Form Ⅱ(red) |
| |
纯物质的晶体从溶液中结晶出来,是热力学熵减的过程,那么此过程必然焓值增加。同样,利托那韦从晶型Ⅰ转化到更稳定的晶型Ⅱ[4],也是熵减的过程。焓值的增加将从晶体中分子之间吸引力和排斥力不同的平衡方式中产生[15]。氢键作为吸引力的一种,对分子的排列起关键作用。
本研究通过PLATON计算得到利托那韦2种晶型中的分子间氢键数据如表 1和表 2所示。晶型Ⅰ能形成3种强的氢键(表 1中前3行)、7种弱的氢键(表 1中后7行)。晶型Ⅱ能形成4种强的氢键,7种弱的氢键。2种晶型分子间氢键连接方式的不同主要表现在以下几个方面。首先,在不同的分子间氢键作用下,晶型Ⅰ中的分子同向平行连接成链状,而晶型Ⅱ中的分子反方向平行形成链状连接;其次,形成氢键链的方向不同,晶型Ⅰ中沿着矢量方向[1 0 0]形成一维氢键链,而晶型Ⅱ中按矢量方向[0 1 0]形成一维氢键链;最重要的是,2种方式的连接强度差异显著,晶型Ⅰ中沿[1 0 0]方向的相邻2分子几何中心距离为0.522 nm,相邻2个分子间相互作用势为-141.6 kJ/mol。晶型Ⅱ中沿[0 1 0]方向相邻2分子的几何中心距离为0.537 nm,分子间相互作用势为-187.1 kJ/mol。可见,晶型Ⅱ中的分子间氢键具有更低的分子间相互作用势,形成氢键连接更稳定。
| Donor | H | Acceptor | D—H/nm | H…A/nm | D…A/nm | ∠D—H…A/(°) |
| N(3) | H(1) | O(1) | 0.086 | 0.245 | 0.327 | 160 |
| N(4) | H(2) | O(2) | 0.086 | 0.221 | 0.303 | 160 |
| N(5) | H(3) | O(4) | 0.086 | 0.234 | 0.313 | 152 |
| C(10) | H(20) | O(1) | 0.097 | 0.222 | 0.319 | 177 |
| C(13) | H(24) | O(1) | 0.098 | 0.232 | 0.276 | 106 |
| C(18) | H(32) | O(2) | 0.098 | 0.246 | 0.285 | 103 |
| C(25) | H(39) | O(3) | 0.093 | 0.248 | 0.331 | 149 |
| C(26) | H(40) | O(3) | 0.097 | 0.233 | 0.328 | 164 |
| C(28) | H(43) | O(4) | 0.098 | 0.253 | 0.290 | 103 |
| C(37) | H(53) | O(5) | 0.093 | 0.251 | 0.336 | 151 |
| Donor | H | Acceptor | D—H/nm | H…A/nm | D…A/nm | ∠D—H…A/(°) |
| O(3) | H(1) | O(1) | 0.082 | 0.190 | 0.269 | 161 |
| N(3) | H(2) | O(4) | 0.086 | 0.212 | 0.294 | 157 |
| N(4) | H(3) | O(3) | 0.086 | 0.225 | 0.300 | 146 |
| N(5) | H(4) | O(2) | 0.086 | 0.222 | 0.288 | 134 |
| C(7) | H(13) | O(1) | 0.097 | 0.227 | 0.273 | 108 |
| C(10) | H(18) | O(1) | 0.098 | 0.237 | 0.276 | 103 |
| C(15) | H(26) | O(2) | 0.098 | 0.243 | 0.283 | 104 |
| C(19) | H(30) | N(1) | 0.093 | 0.261 | 0.353 | 171 |
| C(23) | H(34) | O(2) | 0.097 | 0.234 | 0.329 | 169 |
| C(25) | H(37) | O(5) | 0.098 | 0.236 | 0.274 | 103 |
| C(25) | H(37) | O(1) | 0.098 | 0.247 | 0.325 | 136 |
利托那韦2种晶型不同的分子堆积方式对应不同的晶胞结构,从剑桥晶体数据库中读取晶型Ⅰ和Ⅱ的晶胞参数,如表 3所示。晶型Ⅰ为单斜晶系、P21空间群,1个晶胞中包含2个利托那韦分子。晶型Ⅱ为正交晶系、P212121空间群,1个晶胞中含有4个利托那韦分子。由于分子间相互作用的差异,晶型Ⅱ的分子为反方向平行连接,所以其晶胞中的不对称单元数为晶型Ⅰ的2倍。计算得到晶型Ⅰ和晶型Ⅱ的堆积能分别为-259.5和-368.3 kJ/mol,晶型Ⅱ的堆积能量显著低于晶型Ⅰ,所以晶型Ⅱ更稳定。

|
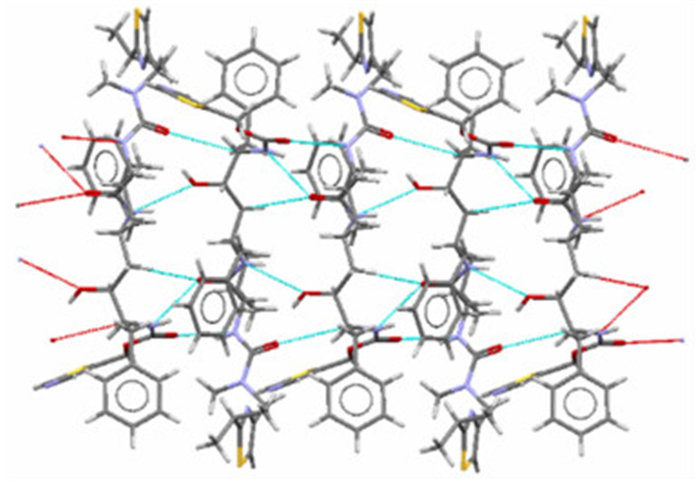
| 图 3 晶型Ⅰ利托那韦分子沿[1 0 0]方向(图中水平方向)形成的氢键链 Figure 3 The hydrogen bonding chain of ritonavir Form Ⅰ along with [1 0 0] (Horizontal direction in the figure) |
| |
|
| 图 4 晶型Ⅱ中利托那韦分子沿[0 1 0]方向(图中水平方向)形成的部分氢键链 Figure 4 The hydrogen bonding chain of ritonavir Form Ⅱ along with [0 1 0] (Horizontal direction in the figure) |
| |
| Form I | Form Ⅱ | |
| CSD refcodes | YIGPIO02 | YIGPIO03 |
| crystal system | monoclinic | orthorhombic |
| space group | P21 | P212121 |
| a/nm | 1.3344(2) | 0.9831(6) |
| b/nm | 0.52150(8) | 1.8485(11) |
| c/nm | 2.6693(4) | 2.0261(12) |
| β/(°) | 103.456(2) | 90 |
| volume/nm3 | 1.80655 | 3.68195 |
| Z | 2 | 4 |
| z′ | 1 | 1 |
| R/% | 5.18 | 6.47 |
利托那韦2种晶型以归一化距离dnom为基准的Hirshfeld surface如图 5所示,红色区域表示分子间的氢键连接,其他颜色区域表示比氢键距离更长的连接。

|
| 图 5 利托那韦晶型Ⅰ和晶型Ⅱ的Hirshfeld surface Figure 5 Hirshfeld surface of ritonavir Form I and Form Ⅱ |
| |
从图 5可以看出2种晶型分子间作用力的状况有显著的不同,主要是C—O及其相连的噻唑环分子间连接不同(图 5中黑圈标注的区域)。
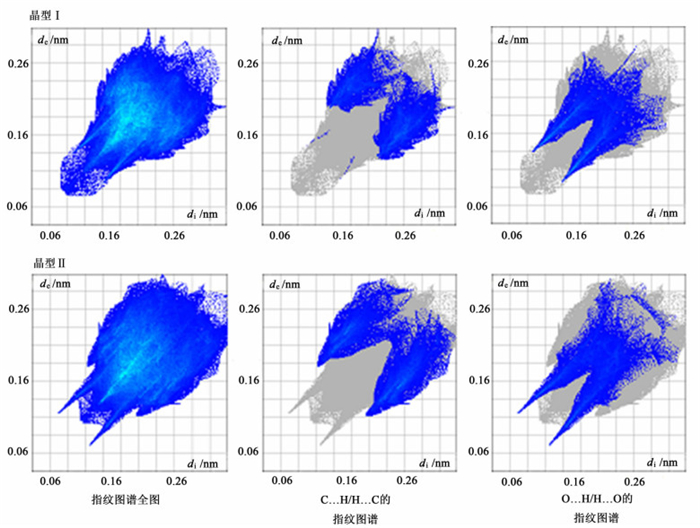
Hirshfeld surface 2D指纹图谱对分子环境十分敏感,不同分子间相互作用有不同的2D指纹区,这些不同分子间相互作用的贡献汇聚在一起,组成了指纹图谱的全图。因此,Hirshfeld surface 2D指纹图可用来反映不同晶型内部的分子间相互作用,各连接作用对整体的相互作用的贡献程度。图 6所示利托那韦晶型Ⅰ和晶型Ⅱ的Hirshfeld surface 2D指纹图谱直观地反映出,2种晶型中C…H和O…H的相互作用出现在明显不同的指纹区域,这些区域成为了2种晶型全谱不同的主要区域。
分子间各相互作用对利托那韦分子Hirshfeld surface的不同贡献如表 4所示。
| Form | Relative contributions/% | |||||
| S…H | O…H | N…H | C…H | H…H | Other | |
| I | 7.9 | 15.3 | 4.3 | 13.6 | 57.6 | 1.3 |
| Ⅱ | 7.9 | 13.2 | 5.0 | 16.7 | 55.8 | 1.4 |
|
| 图 6 利托那韦晶型Ⅰ晶型Ⅱ的2D指纹图谱,(di, de)~0.06~0.30 nm Figure 6 Fingerprint plots of ritonavir Form I and Form Ⅱ, (di, de) —0.06~0.30 nm |
| |
由表 4分析,利托那韦由晶型Ⅰ转化为晶型Ⅱ,O…H间相互作用对形成晶体的贡献降低了2.1%,C…H相互作用的贡献升高了3.1%。分子间相互作用贡献的不同体现了2种晶型分子间相互作用方式的不同。转晶后由晶型Ⅰ的10对氢键,变为晶型Ⅱ的11对氢键,使得更多的氢键配对被满足,所以晶型Ⅱ的稳定性更高。
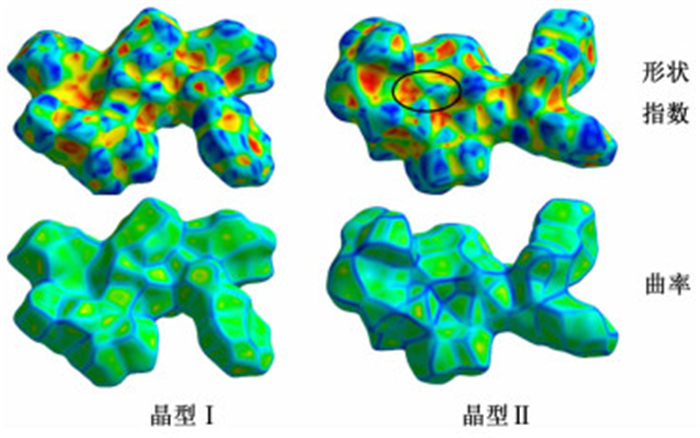
图 7揭示了利托那韦晶型Ⅰ和晶型Ⅱ的形状指数和曲率的显著差异。这种差异主要反映了平面堆积排列方式和分子连接方式的不同。曲率曲面图中宽的、相对平坦的区域,表示分子间更容易紧密堆积。与晶型Ⅰ相比,晶型Ⅱ曲率图上显示有更大的平坦区域,表明比晶型Ⅰ更容易紧密堆积。依据密堆积原理,这说明晶型Ⅱ比晶型Ⅰ更稳定。形状指数曲面图可以更清楚地反映分子堆积方式和分子间连接的不同。图 7形状指数图中,仅在晶型Ⅱ的分子上存在黑圈所示的特征斑块。这些特征斑块表示该区域有另一个相同的分子和它连接。可见,晶型Ⅰ和晶型Ⅱ分子的2个侧面与相邻分子的连接不同。
|
| 图 7 利托那韦晶型Ⅰ和晶型Ⅱ分子的形状指数和曲率曲面图 Figure 7 Hirshfeld surface for Forms I and Ⅱ mapped with shape index and curvedness |
| |
晶型Ⅰ和晶型Ⅱ中距离最近的相邻2分子利托那韦的堆积方式如图 8所示。晶型Ⅱ 2分子在堆积时有更多表面重叠的区域,说明形成了更紧密的堆积结构。晶型Ⅰ和Ⅱ 2种方式的堆积指数分别是0.83和0.84,晶型Ⅱ的堆积指数更高,堆积效率更高[16]。

|
| 图 8 晶型Ⅰ和晶型Ⅱ中相邻2分子利托那韦形状指数曲面图 Figure 8 Hirshfeld surfaces for a cluster of two molecules in Form Ⅱ and Ⅱ mapped with shape index |
| |
定量分析了利托那韦晶型Ⅰ(YIGPIO02)和晶型Ⅱ(YIGPIO03)结构的差异,解释了晶型Ⅱ稳定的原因。利托那韦晶型Ⅰ和晶型Ⅱ中分子构象的显著差异表现为苯环旋转角相差7.5°。晶型Ⅱ中分子间氢键具有更低的相互作用势,形成的氢键连接更稳定。晶型Ⅱ的分子间O…H相互作用的贡献比晶型Ⅰ降低了2.1%,C…H相互作用的贡献升高了3.1%。分子间相互作用方式的不同导致2种晶型中分子构象不同、晶体结构不同。与晶型Ⅰ相比,晶型Ⅱ中利托那韦分子具有更低的分子间作用势、更低的堆积能和更高的堆积指数,能形成更稳定的堆积结构。
| [1] | Cruz-Cabeza A J, Bernstein J. Conformational polymorphism[J]. Chemical Reviews, 2013, 114(4): 2170–2191. |
| [2] | Nangia A. Conformational polymorphism in organic crystals[J]. Accounts of Chemical Research, 2008, 41(5): 595–604. DOI: 10.1021/ar700203k |
| [3] | Sham H L, Zhao C, Stewart K D, et al. A novel, picomolar inhibitor of human immunodeficiency virus type 1 proteas[J]. Journal of Medicinal Chemistry, 1996, 39(2): 392–397. DOI: 10.1021/jm9507183 |
| [4] | Bauer J, Spanton S, Henry R, et al. Ritonavir:An extraordinary example of conformational polymorphism[J]. Pharmaceutical Research, 2001, 18(6): 859–866. DOI: 10.1023/A:1011052932607 |
| [5] | Chemburkar S R, Bauer J, Deming K, et al. Dealing with the impact of ritonavir polymorphs on the late stages of bulk drug process development[J]. Organic Process Research & Development, 2000, 4(5): 413–417. |
| [6] | Galek P T, Chisholm J A, Pidcock E, et al. Hydrogen-bond coordination in organic crystal structures:statistics, predictions and applications[J]. Crystal Engineering and Materials, 2014, 70(1): 91–105. |
| [7] | McKinnon J J, Jayatilaka D, Spackman M A. Towards quantitative analysis of intermolecular interactions with Hirshfeld surfaces[J]. Chemical Communications, 2007, 37(1): 3814–3816. |
| [8] | Spackman M A, Jayatilaka D. Hirshfeld surface analysis[J]. Cryst Eng Comm, 2009, 11(1): 19–32. DOI: 10.1039/B818330A |
| [9] | Seth S K, Saha N C, Ghosh S. Structural elucidation and electronic properties of two pyrazole derivatives:A combined X-ray, Hirshfeld surface analyses and quantum mechanical study[J]. Chemical Physics Letters, 2011, 506(4): 309–314. |
| [10] | González A, Murcia M, Benhamú B, et al. The importance of solvation in the design of ligands targeting membrane proteins[J]. Med Chem Comm, 2011, 2(3): 160–164. DOI: 10.1039/c0md00258e |
| [11] | Stewart J J. MOPAC:A semiempirical molecular orbital program[J]. Journal of Computer-Aided Molecular Design, 1990, 4(1): 100–103. |
| [12] | Gavezzotti A, Filippini G. Geometry of the intermolecular XH...... Y (X, Y=N, O) hydrogen bond and the calibration of empirical hydrogen-bond potentials[J]. The Journal of Physical Chemistry, 1994, 98(18): 4831–4837. DOI: 10.1021/j100069a010 |
| [13] | Spek A. Single-Crystal structure validation with the program PLATON[J]. Journal of Applied Crystallography, 2003, 36(1): 7–13. DOI: 10.1107/S0021889802022112 |
| [14] | Macrae C F, Edgington P R, McCabe P, et al. Mercury:Visualization and analysis of crystal structures[J]. Journal of Applied Crystallography, 2006, 39(3): 453–457. DOI: 10.1107/S002188980600731X |
| [15] | Jones W, Rao C N R. Supramolecular organization and materials design[M]. Cambridge University Press, 2008. |
| [16] | Spek A L. Structure validation in chemical crystallography[J]. Acta Crystallographica Section D:Biological Crystallography, 2009, 65(2): 148–155. DOI: 10.1107/S090744490804362X |
 2018, Vol. 35
2018, Vol. 35





