2. 国家工业结晶工程技术研究中心, 天津 300072;
3. 天津大学化学工程联合晶体工程与药物传递系统国家重点实验室, 天津 300072
2. National Engineering Research Center of Industrial Crystallization Technology, Tianjin University, Tianjin 300072;
3. Key Laboratory of Crystal Engineering and Drug Delivery System in Tianjin University, Tianjin 300072
药物共晶是指由活性药物成分(active pharmaceutical ingredient, API)和共晶配体(cocrystal former, CCF)以氢键或其他非共价键的形式相结合,得到的新的晶体产物[1]。由于配体的引入,药物共晶在一定程度上可以改善母体药物的性能[2]。近年来,其在药物研究领域一直备受关注。
多晶型现象广泛存在于各类固体药物中,它是影响药物稳定性和疗效的重要因素之一[3]。然而,从首次发现多晶型现象以来,大部分关于药物多晶型的研究往往集中于单组分药物,相比之下很少有文献报道多组分药物(如共晶药物)的多晶型。
在早期的共晶研究中,研究人员曾经一度认为共晶药物相比于单组分药物不倾向出现多晶型现象[4-5]。甚至有学者认为,共晶出现多晶型的低概率恰恰是共晶的一大优点,它能有效避免单组分药物由于存在多晶型现象所带来的不稳定性[6]。
但是,近年来随着共晶研究的深入,越来越多文献报道了研究人员在制备药物共晶过程中意外发现了药物共晶的多晶型行为。例如,止痛药乙水杨胺与龙胆酸的共晶(3种多晶型)[7];利尿药呋塞米与烟酰胺的共晶(5种多晶型)[8];甚至3组分的共晶体系也出现了多晶型现象[9-10]。同时,也不断有学者[11-14]表明,“共晶药物相比于单组分药物不倾向于出现多晶型现象”这一观点有待进一步的考察。更为重要的是,与单组分药物的多晶型现象相似,同一种共晶药物的不同晶型在溶解度、熔点、稳定性等方面也表现出了不同的性能。因此,研究共晶药物的多晶型行为与研究单组分药物的多晶型行为同等重要,甚至会成为共晶药物研究领域的新方向。
一直以来,共晶的研究热点往往集中在共晶的设计以及共晶的制备与表征上[15-17],而忽略了对共晶多晶型和共晶稳定性的研究。随着多晶型共晶药物不断被发现,筛选和表征共晶药物的不同晶型、掌握共晶药物多晶型的构效关系,将是共晶药物成功研发过程中不可或缺的步骤。
本论文将以近些年共晶药物多晶型的案例为基础,介绍目前共晶药物多晶型的类别和各自的特点,晶型的制备和控制的方法以及多晶型对共晶药物性能的影响,为药物共晶多晶型的进一步研究提供参考。
1 药物共晶多晶型的概念与分类药物共晶是指由药物分子与共晶配体在非共价键作用下结合而成的新的晶体。而单组分药物的多晶型现象指同一种药物分子在结晶时可以形成不同的晶体结构。因此,药物共晶多晶型是指由药物分子与共晶配体形成的2种或2种以上具有不同晶体结构的共晶,如图 1所示。
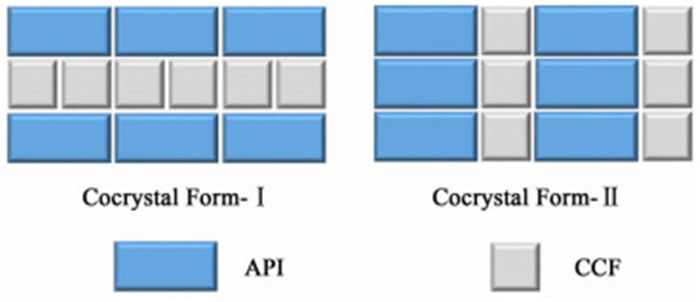
|
| 图 1 药物共晶多晶型示意图 Figure 1 The schematic diagram of polymorphism in pharmaceutical cocrystals |
| |
与单组分药物的多晶型分类[18-19]相似,药物共晶多晶型也可以分为合成子多晶型(synthon polymorph)、堆积多晶型(packing polymorph)、构象多晶型(conformational polymorph)以及互变异构多晶型(tautomeric polymorph)。
1.1 合成子多晶型药物共晶是由药物分子和配体分子通过分子间作用力组装形成的晶体结构。当共晶的不同晶型中连接分子的作用力不同时,这类多晶型被称为合成子多晶型[20-21]。
例如,Li等[22]报道的抗代谢药5-氟尿嘧啶与对羟基苯甲酸共晶的2种晶型就属于合成子多晶型。其中晶型Ⅰ最主要的合成子结构为N—H…O和O—H…O 2种氢键形成的酰胺-羧酸环状合成子。而晶型Ⅱ中的合成子则为单一的O—H…O氢键合成子,如图 2所示。

|
| 图 2 5-氟尿嘧啶与对羟基苯甲酸共晶2种晶型的合成子 Figure 2 Synthons of two forms of 1:1 co-crystal which consist of 5-fluorouracil and 4-hydroxybenzoic acid |
| |
在共晶多晶型的研究中,这类多晶型较为常见。因为,相比于单组分药物的晶体结构中只存在药物分子与药物分子之间的作用力,药物共晶的结构中会存在3种不同的作用力,即药物分子与药物分子、配体分子与配体分子以及最为关键的药物分子与配体分子之间的作用力。这极大地丰富了共晶结构中合成子的多样性。通常,如果API和CCF分子结构中含有多种不同的氢键供体或受体,那么共晶将会更倾向于形成合成子多晶型。
1.2 堆积多晶型堆积多晶型则是指共晶中的药物分子和配体分子由于空间排列方式的不同所形成的不同晶体结构[23-24]。通常,刚性分子或者构象灵活度较小的分子容易形成堆积多晶型。
Sarcevica等[23]报道的肉桂酸与异烟肼共晶的晶型Ⅰ和晶型Ⅱ便属于堆积多晶型。在这2种晶型中都可以观察到由2个肉桂酸分子和2个异烟肼分子所形成的酸-碱-酸-碱环状合成子,但是由于其空间排列方式的不同,造成了晶体结构的差异,如图 3所示。
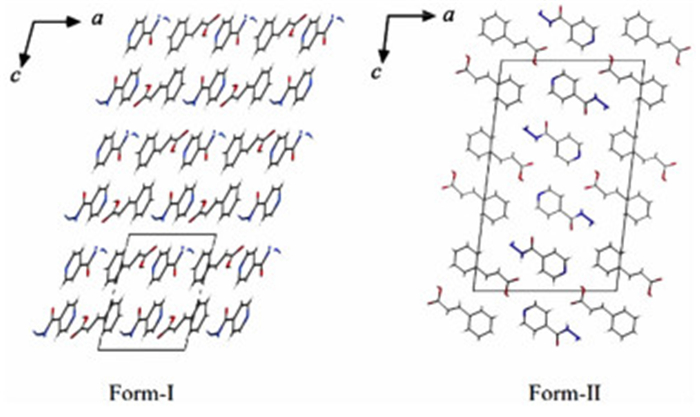
|
| 图 3 肉桂酸与异烟肼共晶的2种晶型的空间排列 Figure 3 Spatial arrangements of two polymorphs of cinnamic acid-isoniazid cocrystal |
| |
由于API或CCF的分子构象不同而导致晶体结构不同时,这类多晶型被称之为构象多晶型[25-26]。通常,具有柔性结构的药物分子更容易表现出构象多晶型。
止痛药乙水杨胺和乙基丙二酸共晶的2种多晶型具有完全相同的超分子合成子,但是2种晶型中乙基丙二酸分子的构象却完全不同[26]。因此乙水杨胺和乙基丙二酸共晶的多晶型属于构象多晶型。
1.4 互变异构多晶型互变异构是指由分子内质子和相应的双键的迁移而造成结构的差异。当共晶组分在不同的晶型中以不同的互变异构体形式存在时,这类多晶型即被称为互变异构多晶型。
这类共晶多晶型并不常见,目前文献报道过的例子来自于抗炎药吡罗昔康与对羟基苯甲酸的共晶[27]。由于吡罗昔康分子存在互变异构现象(图 4所示),因此在溶液结晶过程中,吡罗昔康的2种异构体分别与共晶形成物对羟基苯甲酸形成了共晶,出现了2种不同的晶型,即为互变异构多晶型。而且,这2种晶型在外观颜色上表现出了显著的差异,一者为无色,另一者则呈现为黄色。
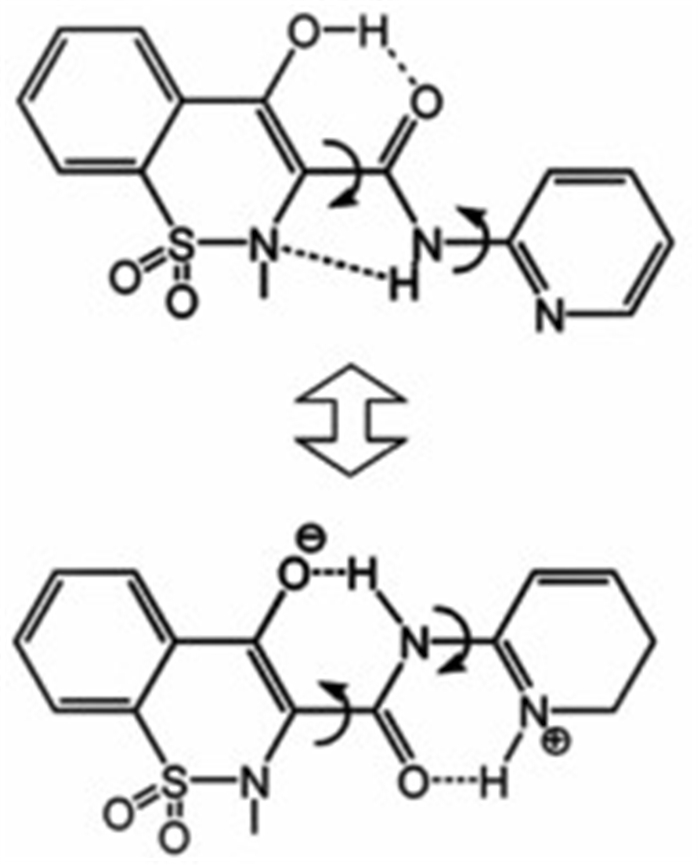
|
| 图 4 吡罗昔康的2种互变异构形式 Figure 4 Two tautomeric forms of Piroxicam |
| |
由于共晶药物也存在多晶型现象,因此对于共晶药物多晶型的研究,其首要问题就是要通过不同的筛选技术尽可能多地获得共晶药物的多种晶型。
尽管目前已经有许多共晶体系被发现存在新的晶型。但是,这些共晶的新晶型往往是在制备共晶的过程中意外被发现的。换句话说,大部分实验的出发点往往是为了筛选共晶或者重复被报道过的共晶的制备过程,结果在无意中获得了新的晶型。可见,目前药物共晶多晶型的制备主要是基于常规的共晶制备方法,并没有形成一个科学的筛选系统。
本部分内容将根据近几年来关于共晶多晶型的研究,介绍目前报道过的共晶多晶型的制备方法以及影响多晶型的因素,从而为系统地建立共晶多晶型筛选方法提供参考。
2.1 溶液结晶法溶液结晶法是目前最为常用的筛选共晶的方法之一,这类方法主要包括了混悬法、溶剂挥发法、冷却结晶法以及反溶剂法等[28]。由于在溶液结晶的过程中人为可控制和改变的实验条件较多(例如溶剂的种类、结晶温度、冷却速率等),因此这大大增加了共晶形成的几率。也正是由于溶液法在筛选共晶方面的高效性,造就了这类方法在发现共晶多晶型方面的独特优势。
例如,Leyssens等[29]利用溶液法来筛选咖啡因与二元羧酸类物质的共晶时,不仅成功制备了7种共晶,还获得了咖啡因和甲基延胡索酸2:1共晶体系的3种晶型以及1种溶剂化物。Bevill等[30]在溶剂挥发法制备共晶的过程中,通过改变溶剂的种类,发现了对香豆酸与烟酰胺1 :1共晶的3种多晶型。可见,溶液结晶法是探索共晶系统多样性的有效手段。
特别要强调的是,在溶液结晶法中,使用不同极性的溶剂往往可以实现对共晶药物晶型的有效调控。Ueto等[8]在研究呋塞米药物与烟酰胺共晶时,通过使用不同极性的溶剂发现了呋塞米和烟酰胺共晶的4种多晶型,其中晶型Ⅰ、Ⅱ、Ⅲ、Ⅳ分别在乙醇、乙醇+四氢呋喃、乙醇+丙酮、异丙醇这4种不同极性的溶剂或溶剂混合物中获得。止痛药乙水杨胺与龙胆酸共晶的3种多晶型也是从不同的溶剂中筛选出来的[7]。由此可见,在溶液结晶法中使用一系列不同性质的溶剂或者溶剂混合物将有助于多晶型的发现。
此外,Lee等[31]在通过反溶剂结晶法制备卡马西平和糖精的共晶时发现,过程的动力学参数(如反溶剂的添加速率、搅拌速率)也会影响共晶的晶型。实验结果表明,较低的反溶剂添加速率和较低的搅拌速率有利于晶型Ⅱ的生成,而随着添加速率和搅拌速率的不断增大,共晶产物逐渐以晶型Ⅰ的形式出现。
当然,溶液结晶法也存在着明显的不足之处。一旦形成共晶的API和CCF之间溶解度相差较大,或者溶剂与API或CCF的相互作用力远远大于API与CCF之间的作用力,容易造成单组分API或CCF结晶析出,无法形成共晶。因此,使用溶液结晶法时,还要充分考虑共晶组分在特定溶剂中的溶解度。
2.2 研磨法研磨法是另一类筛选共晶的重要方法。它是指将API和CCF混合于研钵或球磨机中,共同研磨一段时间,借助机械力来促进共晶的形成[32]。这一方法相比于溶液结晶法,步骤简便,绿色环保,且不需要考虑共晶组分的溶解度问题。此外,在研磨过程中,加入少量适当的溶剂,可以提高分子的移动性,有利于共晶的生成,这种方法也被称为溶剂辅助研磨法。目前,有许多文献报道了利用研磨法来制备共晶的多晶型。
早期就有研究发现,研磨法中添加适量不同极性的溶剂可以实现对共晶多晶型的调控[33]。在咖啡因和戊二酸的共晶体系中,通过干磨法或者加入少量非极性溶剂,如正己烷、环己烷、正庚烷等,可以获得咖啡因和戊二酸共晶的晶型Ⅰ,而加入少量极性溶剂,如氯仿,二氯甲烷,乙腈,水,则可以获得晶型Ⅱ。其原因是晶型Ⅰ的结构中具有非极性的解理面,因此非极性溶剂的加入有利于晶型Ⅰ的形成。最近,Fischer等[34]在茶碱与苯甲酰胺形成的共晶体系中也发现了类似的规律。研磨过程中,不添加溶剂或者添加非极性溶剂时,体系会生成了晶型Ⅰ;而在研磨前加入极性溶剂,茶碱与苯甲酰的共晶将以晶型Ⅱ的形式出现。实验结果如表 1所示。
| solvent | dipole moment/ (10-30C·m) |
polymorph |
| cyclohexane | 0 | Form Ⅰ |
| heptane | 0 | Form Ⅰ |
| pentane | 0 | Form Ⅰ |
| 1, 4-dioxane | 1.3 | Form Ⅱ |
| 1-butanol | 1.7 | Form Ⅱ |
| 1-hexanol | 1.7 | Form Ⅱ |
| 1-propanol | 1.6 | Form Ⅱ |
| acetone | 10.0 | Form Ⅱ |
| acetonitrile | 11.7 | Form Ⅱ |
| acetophenone | 9.7 | Form Ⅱ |
| dichlormethane | 6.0 | Form Ⅱ |
| diethyl ether | 4.2 | Form Ⅱ |
| dimethylform-amide | 12.7 | Form Ⅱ |
| ethanol | 5.7 | Form Ⅱ |
| methanol | 5.5 | Form Ⅱ |
| tetrahydrofuran | 5.7 | Form Ⅱ |
| toluol | 0.4 | Form Ⅱ |
| water | 6.2 | Form Ⅱ |
此外,Hasa等[35]从溶剂的添加量作为切入点,研究其对咖啡因与邻氨基苯甲酸共晶晶型的影响。结果表明,当采用醇的同系物作为溶剂时,加入不同量的溶剂将获得不同的晶型。同样,丙酮,2-丁酮,乙酸乙酯,1, 4-二氧六环这4种溶剂也表现出了相似的规律。因此,在溶剂辅助研磨法筛选多晶型的过程中,溶剂往往能起到很关键的作用。实验过程中,不仅可以通过改变溶剂的种类,也可以改变溶剂的添加量。
尽管溶剂研磨法在加快反应速率的同时又能够很好地控制晶型的产出,但它同样存在1个明显的缺点,即加入的溶剂容易与药物分子形成溶剂化物[36]。例如,Madusanka等[37]利用溶剂辅助研磨法对咖啡因和邻氨基苯甲酸共晶体系进行多晶型筛选的过程中,意外出现了5种不同的共晶溶剂化物。
对此,Hasa等[38-39]在最近提出了高分子辅助研磨法,即在研磨的过程中,加入特定的高分子聚合物。这一方法不仅可以避免研磨过程中溶剂化物的形成,同时还能有效控制共晶产物的晶型。实验以咖啡因和戊二酸作为共晶模型,研磨前加入相对分子质量不同的聚乙二醇。当聚乙二醇的相对分子质量为最小时,即二甘醇,得到的共晶产物全为晶型Ⅰ,随着加入的聚乙二醇的相对分子质量不断增大,共晶产物中晶型Ⅰ含量不断减小,而晶型Ⅱ的含量不断增多。当聚乙二醇的分子量到达一定程度时,得到的共晶全为晶型Ⅱ。进一步的分析发现,随着聚乙二醇相对分子质量的不断增大,其极性会随之不断减小,从而诱导出了晶型Ⅱ。
由此可见,高分子辅助研磨法在保留溶剂研磨法优点的同时,又克服了溶剂研磨法的不足。在未来,还可以尝试改变高聚物的种类或者修饰高聚物的官能团来对共晶多晶型进行筛选和调控。作为一种新型的研磨方法,高分子辅助研磨不仅为机械化学法制备共晶开辟了新的途径,也为研究人员探寻研磨法制备共晶的机理提供了新的思路。
2.3 其他方法除了溶液结晶法和研磨法这两类常规的方法之外,近年来研究人员还提出了一些非常规的方法来寻找共晶的多晶型,同样取得了很好的效果。
Eddleston等[40]提出了一种新的共晶多晶型的制备方法,即利用2种互不相溶的溶液的相界面来制备共晶。当共晶在2种溶液中的溶解度小于API和CCF时,共晶将会在相界面结晶析出,因此这种方法获得的共晶晶型的溶解度往往更小,但在热力学上则表现得更为稳定。实验分别以吩嗪的二甲苯溶液和甲基延胡索酸的水溶液作为两相,在相界面成功筛选出了吩嗪和甲基延胡索酸1 :1共晶的另一种晶型,这一晶型相对于原先的晶型在热力学上更为稳定。值得一提的是,这一技术的最大优点在于,API和CCF在其各自的溶液中不处于过饱和状态,因此可以有效避免单一组分结晶析出。
Matzger课题组在利用聚合物调控单组分药物多晶型方面做了大量的研究工作,并取得了很多成果[41-43]。与此同时,他们也将聚合物调控晶型的策略应用到了药物共晶体系当中[44]。实验采用功能化的交联聚合物来诱导共晶多晶型的非均相成核。结果发现,卡马西平和烟酰胺体系在高分子聚合物的作用下,产生了晶型Ⅰ和晶型Ⅱ。而卡马西平与糖精的共晶在许多其他的筛选方法下只表现出单一的晶型。但是通过使用高聚物诱导的策略,该体系出现了另一种新的晶型。
喷雾干燥技术一直以来被视为理想的工业化粉末生产方法,它也可以用于共晶的制备。早期就有文献报道过研究人员利用喷雾干燥法成功制备了茶碱-尿素、茶碱-糖精、茶碱-烟酰胺这3种共晶[45]。最近,Grossjohann等[46]利用喷雾干燥法来制备磺胺二甲嘧啶与4-氨基水杨酸共晶时,获得了该共晶的新晶型。
此外还有课题组利用高压这种极端条件来筛选共晶的多晶型[47-48]。由于多晶型的出现往往是筛选实验中动力学和热力学因素共同作用下的结果。因此将高压应用到多晶型的筛选中,将会大大增加新晶型出现的概率。Lee等[48]在压力为1 420 MPa的条件下,发现了吡啶和甲酸1 :4共晶的另一种晶型。这一晶型与在常压低温下获得的晶型相比,具有更高的晶体堆积密度。值得注意的是,由于高压筛选法对设备和操作的要求高,耗时耗力,实验成本高,因此在利用高压条件筛选多晶型时,往往需要在实验前先进行计算晶体结构预测,来确定多晶型可能存在的压力范围,再开展具体的实验,以避免盲目试验造成实验资源的浪费[49]。
特别要强调的是,单纯靠一种筛选方法是很难发现共晶药物的所有晶型的。只有结合不同的方法,才能尽可能多地筛选出共晶的不同晶型。例如,研究人员筛选出吩嗪和甲基延胡索酸共晶的3种多晶型的过程中,共采用了6种不同的方法[40]。可见,采用多元筛选方法对于多晶型的发现至关重要。
在未来,对于共晶药物领域的挑战,将不仅仅在于成功制备出共晶药物,而且还要尽可能多地筛选出共晶药物可能存在的晶型。其实,共晶多晶型的制备其本质就是共晶的筛选。这也正是为何目前大部分共晶多晶型是在研究人员制备共晶过程中偶然出现的原因。因此,共晶多晶型的筛选完全可以基于目前共晶的筛选策略,同时再借鉴单组分药物多晶型的筛选方法。
3 多晶型对药物共晶性能的影响药物多晶型行为的研究一直是药物研发过程中的关键部分,其原因在于同一种药物的不同晶型会显著影响药物的各项性能。与单组分药物相同,不同晶型的共晶药物,由于其内部晶体结构的差异,也会表现出溶解度、溶出速率、熔点、外观以及生物利用度等理化性质的不同,从而进一步影响了共晶药物的稳定性和疗效。
药物的溶解度和溶出速率是评价药物药效的重要指标。目前已经有文献报道了共晶药物的不同晶型在溶解度和溶出速率方面表现出的显著差异。例如,抑菌剂磺胺醋酰与乙酰胺以相同化学计量比形成的共晶有2种不同的晶型,其中晶型Ⅰ为稳定相,晶型Ⅱ为亚稳定相。两者的溶出速率实验表明,晶型Ⅰ和晶型Ⅱ在pH值为7的缓冲溶液中的溶出速率相比于纯磺胺醋酰分子分别提高了1.6和1.3倍[50]。在另一个共晶药物的例子[51]中,二氨基二苯砜与黄酮1 :1共晶的晶型Ⅰ在pH值为6.8的缓冲溶液中的溶出速率是晶型Ⅱ的2倍,晶型ⅡI的8倍。
Trask等[52]则以咖啡因与戊二酸的共晶作为模型药物,对共晶药物不同晶型的稳定性进行了探究。通常,咖啡因在一定的湿度条件下稳定性较差,很容易转化成的咖啡因水化物。实验结果发现咖啡因和戊二酸共晶的2种晶型在外界环境湿度不断增加的情况下,表现出了不同的稳定性。晶型Ⅰ的稳定性较差,随着湿度的不断增加,最终会完全转化为咖啡因水化物。与之相反,晶型Ⅱ即使在较高的湿度条件下也不会形成水化物。
此外,不同的晶型同样还会影响药物的外观形貌。最近,Sangtani等[53]从呋塞米与4, 4′-联吡啶共晶体系中制备出的2种晶型表现出了完全不同的颜色和形状。其中晶型Ⅰ为黄色针状晶体,而晶型Ⅱ则表现为橘红色块状晶体。2种晶体在颜色和形貌上的差异归因于不同晶型中呋塞米分子与4, 4′-联吡啶分子之间氢键作用以及π-π堆积作用模式的不同。
由于目前大部分关于共晶多晶型的研究依然停留在发现共晶多晶型这一阶段,因此针对多晶型影响共晶药物性能的文献报道相对较少。但是就目前已有的文献而言,它们无不在强调多晶型在影响共晶药物性能方面的重要性。而且只有弄清楚共晶多晶型的构效关系,才能有助于在共晶药物开发过程中选择出共晶药物的最佳晶型。
4 结论与展望随着越来越多的药物共晶体系被发现存在多晶型现象,共晶药物相对于单组分药物不倾向于出现多晶型的观点越来越受到质疑。在未来,对药物共晶多晶型进行系统的研究将是共晶研究的一个重要方向。
药物共晶技术的目的就是为了改善母体药物分子的性能,而对共晶进行多晶型的筛选并研究不同晶型的性能,将会有助于筛选出共晶中的最优晶型。这是一种“优中取优”的策略,有助于将共晶技术在改善药物性能中的作用发挥到极致。
与单组分药物的多晶型相似,药物共晶多晶型也可以分为合成子多晶型、构象多晶型、堆积多晶型以及互变异构多晶型。目前,有很大比例共晶多晶型的发现是出于偶然因素。共晶多晶型的制备方法也主要是基于共晶的制备方法。其中,溶液结晶法和研磨法在共晶多晶型的筛选中起到了很好的效果。在这2种方法中,溶剂往往能发挥极其关键的作用。无论是溶剂种类还是溶剂的添加量都会显著影响最终的晶型。而高分子辅助研磨法是1种新的筛选方法,它在有效调控共晶晶型的同时,还能很好地防止溶剂化物的产生。此外,一些非常规的筛选方法也能起到很好的效果,例如相界面结晶法、交联高聚物诱导法、高压筛选法等。总而言之,对于共晶多晶型的筛选方法,完全可以基于目前共晶的制备方法,同时借鉴单组分药物的多晶型筛选策略。
然而,目前大部分关于药物共晶多晶型的研究局限在新晶型的发现上,缺乏对不同晶型理化性质的研究以及药效的对比。因此,未来更为紧迫的是要掌握药物共晶多晶型与药物性能的构效关系,只有这样,才能为药物共晶研发过程中晶型的选择提供科学的依据。
| [1] | Bolla G, Nangia A. Pharmaceutical cocrystals:Walking the talk[J]. Chemical Communications, 2016, 52(54): 8342–8360. DOI: 10.1039/C6CC02943D |
| [2] | Schultheiss N, Newman A. Pharmaceutical cocrystals and their physicochemical properties[J]. Crystal Growth & Design, 2009, 9(6): 2950–2967. |
| [3] | Cruz-Cabeza A J, Reutzel-Edens S M, Bernstein J. Facts and fictions about polymorphism[J]. Chemical Society Reviews, 2015, 44(23): 8619–8635. DOI: 10.1039/C5CS00227C |
| [4] | Almarsson O, Zaworotko M J. Crystal engineering of the composition of pharmaceutical phases. Do pharmaceutical co-crystals represent a new path to improved medicines?[J]. Chemical Communications, 2004(17): 1889–1896. DOI: 10.1039/b402150a |
| [5] | Vishweshwar P, Mcmahon J A, Peterson M L, et al. Crystal engineering of pharmaceutical co-crystals from polymorphic active pharmaceutical ingredients[J]. Chemical Communications, 2005(36): 4601–4603. DOI: 10.1039/b501304f |
| [6] | Vishweshwar P, Mcmahon J A, Bis J A, et al. Pharmaceutical co-crystals[J]. Journal of Pharmaceutical Sciences, 2006, 95(3): 499–516. DOI: 10.1002/jps.20578 |
| [7] | Aitipamula S, Chow P S, Tan R B H. Trimorphs of a pharmaceutical cocrystal involving two active pharmaceutical ingredients:Potential relevance to combination drugs[J]. Cryst Eng Comm, 2009, 11(11): 1823–1827. |
| [8] | Ueto T, Takata N, Muroyama N, et al. Polymorphs and a hydrate of furosemide-nicotinamide 1:1 cocrystal[J]. Crystal Growth & Design, 2012, 12(1): 485–494. |
| [9] | Nanubolu J B, Ravikumar K. Designing a new cocrystal of olanzapine drug and observation of concomitant polymorphism in a ternary cocrystal system[J]. Cryst Eng Comm, 2017, 19(2): 355–366. DOI: 10.1039/C6CE02227H |
| [10] | Bolla G, Nangia A. Binary and ternary cocrystals of sulfa drug acetazolamide with pyridine carboxamides and cyclic amides[J]. IUCrJ, 2016, 3(2): 152–160. DOI: 10.1107/S2052252516000543 |
| [11] | Aitipamula S, Chow P S, Tan R B H. Polymorphs and solvates of a cocrystal involving an analgesic drug, ethenzamide, and 3, 5-dinitrobenzoic acid[J]. Crystal Growth & Design, 2010, 10(5): 2229–2238. |
| [12] | Lemmerer A, Adsmond D A, Esterhuysen C, et al. Polymorphic co-crystals from polymorphic co-crystal formers:Competition between carboxylic acid…pyridine and phenol…pyridine hydrogen bonds[J]. Crystal Growth & Design, 2013, 13(9): 3935–3952. |
| [13] | Sun C C. Cocrystallization for successful drug delivery[J]. Expert Opinion on Drug Delivery, 2013, 10(2): 201–213. DOI: 10.1517/17425247.2013.747508 |
| [14] | Aitipamula S, Chow P S, Tan R B H. Polymorphism in cocrystals:A review and assessment of its significance[J]. Cryst Eng Comm, 2014, 16(17): 3451–3465. DOI: 10.1039/c3ce42008f |
| [15] | 张婷婷. 药物共晶的设计、合成与性质研究[D]. 长春: 吉林大学, 2014 Zhang Tingting. Pharmaceutical co-crystal: Design, synthesis and characterization[D]. Changchun: Jilin University, 2014(in Chinese) |
| [16] | Douroumis D, Ross S A, Nokhodchi A. Advanced methodologies for cocrystal synthesis[J]. Advanced Drug Delivery Reviews, 2017, 117: 178–195. DOI: 10.1016/j.addr.2017.07.008 |
| [17] | Pindelska E, Sokal A, Kolodziejski W. Pharmaceutical cocrystals, salts and polymorphs:Advanced characterization techniques[J]. Advanced Drug Delivery Reviews, 2017, 117: 111–146. DOI: 10.1016/j.addr.2017.09.014 |
| [18] | Bernstein J. Polymorphism in molecular crystals[M]. Oxford: Oxford University Press, 2002. |
| [19] | Hilfiker R. Polymorphism in the pharmaceutical industry[M]. Weinheim, Germany: Wiley-VCH, 2006. |
| [20] | Mukherjee A, Desiraju G R. Synthon polymorphism and pseudopolymorphism in co-crystals. The 4, 4[prime or minute]-bipyridine-4-hydroxybenzoic acid structural landscape[J]. Chemical Communications, 2011, 47(14): 4090–4092. DOI: 10.1039/c0cc05857b |
| [21] | Schultheiss N, Roe M, Boerrigter S X M. Cocrystals of nutraceutical p-coumaric acid with caffeine and theophylline:Polymorphism and solid-state stability explored in detail using their crystal graphs[J]. Cryst Eng Comm, 2011, 13(2): 611–619. DOI: 10.1039/C0CE00214C |
| [22] | Li S, Chen J, Lu T. Synthon polymorphs of 1:1 co-crystal of 5-fluorouracil and 4-hydroxybenzoic acid:Their relative stability and solvent polarity dependence of grinding outcomes[J]. Cryst Eng Comm, 2014, 16(28): 6450–6458. DOI: 10.1039/C4CE00221K |
| [23] | Sarcevica I, Orola L, Veidis M V, et al. Cinnamic acid hydrogen bonds to isoniazid and N'-(propan-2-ylidene) isonicotinohydrazide, an in situ reaction product of isoniazid and acetone[J]. Acta Crystallographica, 2014, 70(4): 392–395. |
| [24] | Susano M A, Martín-Ramos P, Maria T M R, et al. Co-Crystal of suberic acid and 1, 2-bis(4-pyridyl)ethane:A new case of packing polymorphism[J]. Journal of Molecular Structure, 2017, 1147: 76–83. DOI: 10.1016/j.molstruc.2017.06.043 |
| [25] | Braga D, Palladino G, Polito M, et al. Three polymorphic forms of the co-crystal 4, 4'-bipyridine/pimelic acid and their structural, thermal, and spectroscopic characterization[J]. Chemistry-A European Journal, 2008, 14(32): 10149–10159. DOI: 10.1002/chem.v14:32 |
| [26] | Aitipamula S, Chow P S, Tan R B H. Conformational and enantiotropic polymorphism of a 1:1 cocrystal involving ethenzamide and ethylmalonic acid[J]. Cryst Eng Comm, 2010, 12(11): 3691–3697. DOI: 10.1039/c004491a |
| [27] | Childs S L, Hardcastle K I. Cocrystals of piroxicam with carboxylic acids[J]. Crystal Growth & Design, 2007, 7(7): 1291–1304. |
| [28] | Qiao N, Li M, Schlindwein W, et al. Pharmaceutical cocrystals:An overview[J]. International Journal of Pharmaceutics, 2011, 419(1/2): 1–11. |
| [29] | Leyssens T, Tumanova N, Robeyns K, et al. Solution cocrystallization, an effective tool to explore the variety of cocrystal systems:CAFFEINE/dicarboxylic acid cocrystals[J]. Cryst Eng Comm, 2014, 16(41): 9603–9611. DOI: 10.1039/C4CE01495B |
| [30] | Bevill M J, Vlahova P I, Smit J P. Polymorphic cocrystals of nutraceutical compound p-coumaric acid with nicotinamide:Characterization, relative solid-state stability, and conversion to alternate stoichiometries[J]. Crystal Growth & Design, 2014, 14(14): 1438–1448. |
| [31] | Lee M J, Wang I C, Kim M J, et al. Controlling the polymorphism of carbamazepine-saccharin cocrystals formed during antisolvent cocrystallization using kinetic parameters[J]. Korean Journal of Chemical Engineering, 2015, 32(9): 1–8. |
| [32] | Newman A. Specialized solid form screening techniques[J]. Organic Process Research & Development, 2013, 17(3): 457–471. |
| [33] | Trask A V, Motherwell W D S, Jones W. Solvent-Drop grinding:Green polymorph control of cocrystallisation[J]. Chemical Communications, 2004(7): 890–891. DOI: 10.1039/b400978a |
| [34] | Fischer F, Heidrich A, Greiser S, et al. Polymorphism of mechanochemically synthesized cocrystals:A case study[J]. Crystal Growth & Design, 2016, 16(3): 1701–1707. |
| [35] | Hasa D, Miniussi E, Jones W. Mechanochemical synthesis of multicomponent crystals:One liquid for one polymorph? A myth to dispel[J]. Crystal Growth & Design, 2016, 16(8): 4582–4588. |
| [36] | Bhattacharya S, Saha B K. Guest-Induced isomerization of net and polymorphism in trimesic acid-arylamine complexes[J]. Crystal Growth & Design, 2011, 11(6): 2194–2204. |
| [37] | Madusanka N, Eddleston M D, Arhangelskis M, et al. Polymorphs, hydrates and solvates of a co-crystal of caffeine with anthranilic acid[J]. Acta Crystallographica, 2014, 70(70): 72–80. |
| [38] | Hasa D, Schneider R G, Voinovich D, et al. Cocrystal formation through mechanochemistry:From neat and liquid-assisted grinding to polymer-assisted grinding[J]. Angewandte Chemie International Edition, 2015, 54(25): 7371–7375. DOI: 10.1002/anie.v54.25 |
| [39] | Hasa D, Carlino E, Jones W. Polymer-Assisted grinding, a versatile method for polymorph control of cocrystallization[J]. Crystal Growth & Design, 2016, 16(3): 1772–1779. |
| [40] | Eddleston M D, Sivachelvam S, Jones W. Screening for polymorphs of cocrystals:A case study[J]. Cryst Eng Comm, 2013, 15(1): 175–181. DOI: 10.1039/C2CE26496J |
| [41] | Lang M, Grzesiak A L, Matzger A J. The use of polymer heteronuclei for crystalline polymorph selection[J]. Journal of the American Chemical Society, 2002, 124(50): 14834–14835. DOI: 10.1021/ja0286526 |
| [42] | López-Mejías V, Knight J L, Brooks C L, et al. On the mechanism of crystalline polymorph selection by polymer heteronuclei[J]. Langmuir, 2011, 27(12): 7575–7579. DOI: 10.1021/la200689a |
| [43] | Frank D S, Matzger A J. Influence of chemical functionality on the rate of polymer-induced heteronucleation[J]. Crystal Growth & Design, 2017, 17(8): 4056–4059. |
| [44] | Porter I W W, Elie S C, Matzger A J. Polymorphism in carbamazepine cocrystals[J]. Crystal Growth & Design, 2008, 8(1): 14–16. |
| [45] | Alhalaweh A, Kaialy W, Buckton G, et al. Theophylline cocrystals prepared by spray drying:Physicochemical properties and aerosolization performance[J]. AAPS Pharm Sci Tech, 2013, 14(1): 265–276. DOI: 10.1208/s12249-012-9883-3 |
| [46] | Grossjohann C, Serrano D R, Paluch K J, et al. Polymorphism in sulfadimidine/4-aminosalicylic acid cocrystals:Solid-State characterization and physicochemical properties[J]. Journal of Pharmaceutical Sciences, 2015, 104(4): 1385–1398. DOI: 10.1002/jps.24345 |
| [47] | Zakharov B A, Losev E A, Boldyreva E V. Polymorphism of "glycine-glutaric acid" co-crystals:The same phase at low temperatures and high pressures[J]. Cryst Eng Comm, 2013, 15(9): 1693–1697. DOI: 10.1039/c3ce27013k |
| [48] | Lee R, Firbank A J, Probert M R, et al. Expanding the pyridine-formic acid cocrystal landscape under extreme conditions[J]. Crystal Growth & Design, 2016, 16(7): 4005–4011. |
| [49] | Neumann M A, Van J D S, Fabbiani F P, et al. Combined crystal structure prediction and high-pressure crystallization in rational pharmaceutical polymorph screening[J]. Nature Communications, 2015, 6: 7793. DOI: 10.1038/ncomms8793 |
| [50] | Goud N R, Nangia A. Synthon polymorphs of sulfacetamide-acetamide cocrystal based on N-H…OS and N-H…OC hydrogen bonding[J]. Cryst Eng Comm, 2013, 15(37): 7456–7461. DOI: 10.1039/c3ce41179f |
| [51] | He H, Jiang L, Zhang Q, et al. Polymorphism observed in dapsone-flavone cocrystals that present pronounced differences in solubility and stability[J]. Cryst Eng Comm, 2015, 17(34): 6566–6574. DOI: 10.1039/C5CE01208B |
| [52] | Trask A V, Motherwell W D S, Jones W. Pharmaceutical cocrystallization:Engineering a remedy for caffeine hydration[J]. Crystal Growth & Design, 2005, 5(3): 1013–1021. |
| [53] | Sangtani E, Sahu S K, Thorat S H, et al. Furosemide cocrystals with pyridines:An interesting case of color cocrystal polymorphism[J]. Crystal Growth & Design, 2015, 15(12): 5858–5872. |
 2018, Vol. 35
2018, Vol. 35





