磷酸二氢铵是一种应用非常广泛的肥料原材料。工业级磷酸二氢铵是湿法磷酸和氨通过料浆法而制得。然而,湿法磷酸中包含许多杂质,比如硫酸、铁、铝和镁等,它们严重影响了磷酸二氢铵的质量。一些方法比如离子交换法、溶液萃取和结晶被广泛应用于提纯湿法磷酸[1-4]。在这些方法中,溶液萃取由于其高效率和操作简便而被广泛应用,磷酸三丁酯是萃取剂。
磷酸二氢铵的生产过程是结晶的过程,这个过程严重受介稳区的影响。而介稳区则通常受冷却速率、温度以及杂质的影响。在这些因素中,杂质是通过改变晶体的成核和生长机制来影响介稳区,并且杂质的影响很难预测[5-9]。资料显示一些杂质会增大介稳区的宽度,而在同样的溶液中,一些杂质会使介稳区变窄。此外,杂质的浓度也会对介稳区的大小造成影响。
Srinivasan等通过加入螯合剂EDTA的方法增大了结晶介稳区的宽度[10]。Rajesh等研究了硫脲对磷酸二氢钾溶液成核的影响[11]。结果显示,硫脲的加入增大了磷酸二氢铵的介稳区和诱导期。为了有效的控制磷酸二氢铵的介稳区以及成核过程,本工作从添加剂的角度考虑,因为磷酸三丁酯是磷酸二氢铵中的杂质成分,故研究该杂质对磷酸二氢铵的介稳区以及成核过程的作用。到目前为止,磷酸三丁酯对磷酸二氢铵的影响尚未有人研究。
在本研究中,用激光法研究磷酸二氢铵在水中的介稳区和诱导期。测定了不同温度、降温速率以及不同浓度磷酸三丁酯下的磷酸二氢铵水溶液的介稳区及诱导期。此研究对磷酸二氢铵结晶过程的控制和优化非常重要。
1 实验部分 1.1 实验试剂与仪器磷酸二氢铵(优级纯,质量分数≥99.0%,江天化工试剂有限公司),磷酸二氢铵经过重结晶使其纯度超过99.5%;磷酸三丁酯(优级纯,质量分数≥99.0%,江天化工试剂有限公司);蒸馏水通过水净化系统(UPT-Ⅱ-20T,成都超纯科技有限公司)提纯。
磷酸二氢铵的介稳区和诱导期通过激光法进行测定。激光法由于其稳定性和精确性,经常被用于确定介稳区和诱导期。设备如图 1所示。结晶器是400 mL夹套式腔体结构玻璃结晶器,温度是由德国LAUDA Proline增强型恒温循环水浴,精确性是±0.1 K。磁力搅拌装置用来确保在一定速度下溶液混合均匀。He-Ne激光发射器(北京大学物理学院)通过发射光到溶液中来检测晶核的形成。固体质量用分析天平称量,精确度为±1×10-4 g。
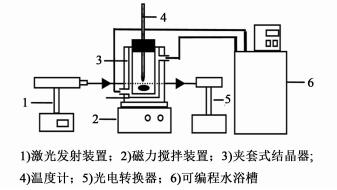
|
| 图 1 介稳区和诱导期的测量设备 Figure 1 Apparatus for the MSZW and induction time measurements |
| |
介稳区宽度的测定是通过在一定的搅拌速度下冷却饱和溶液直到晶核的出现。仪器如图 1所示。为了测量介稳区,一定质量的磷酸二氢铵溶液被加热至高于其平衡温度,并持续搅拌1 h,以确保固体完全溶解。搅拌速度保持在140 r/min。接下来,以12 K·h-1的固定速度降温,直到晶核的出现。在不同的饱和温度313.15、323.15和333.15 K以及不同的降温速率18、25、40和60 K·h-1下重复实验。为保证实验的准确性,每次测试重复3次。记录相应的温度(成核温度),介稳区宽度通过式(1)确定。
| $ {T_{{\rm{max}}}} = {T^*}-{T^{\rm{n}}} $ | (1) |
式(1)中T*是溶液平衡温度,Tn成核温度。
所有的实验均是在常压下进行的。溶解度测量精确度为±0.03 g,温度测量精确度为±0.01 K,介稳测量精确度为±0.01 K。
1.3 诱导期的测定诱导期实验在如图 1所示的设备中实施。取一定质量的磷酸二氢铵溶解在水中,加热使温度高于平衡温度,并持续搅拌1 h,使其完全溶解。一旦激光信号持续保持不变,将溶液快速冷却到实验温度,同时开始计时。激光信号会随着析出的晶核开始变化。记录从开始达到实验所需的过饱和度到粒子产生的时间,这就是诱导期。为保证实验的精确性,重复实验3次。分别在不同的过饱和度以及不同的磷酸三丁酯浓度下重复实验。
2 结果与讨论 2.1 磷酸二氢铵的溶解度采用激光法测得磷酸二氢铵在水溶液中的溶解度,如图 2。对比文献[15]中磷酸二氢铵溶液的溶解度曲线,基本一致,可知激光法测溶解度可行,故本实验均采用激光法。
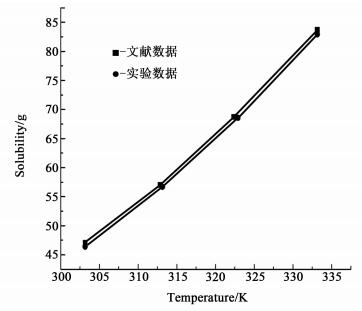
|
| 图 2 磷酸二氢铵的溶解度 Figure 2 Solubility of ADP |
| |
在12、25和60 K·h-1的不同降温速度下,磷酸二氢铵在水中的超溶解度如图 3所示,介稳区宽度如图 4所示。实验表明,介稳区宽度随着温度的升高逐渐变窄。高温可以加速离子运动,增强离子碰撞的频率以及加快质量传递;此外,温度高时,饱和溶液的浓度较大,溶质分子密度较大,碰撞频率高,促进成核。
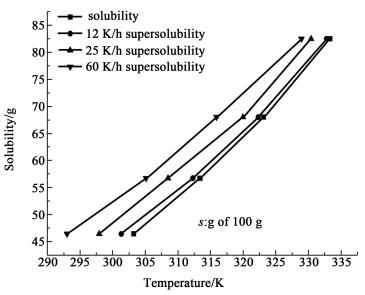
|
| 图 3 不同冷却速度下的磷酸二氢铵的过饱和度 Figure 3 Supersolubility of ADP at different cooling rates |
| |

|
| 图 4 不同降温速率下磷酸二氢铵的介稳区 Figure 4 The MSZW of ADP at different cooling rates |
| |
在本研究中,磷酸三丁酯被选为添加剂来研究其对磷酸二氢铵介稳区的影响。其中,磷酸三丁酯的浓度分别为0, 0.050%、0.075%和0.100%,以及在不同降温速率12、18、25、40和60 K·h-1的条件下。结果见图 5。

|
| 图 5 不同浓度磷酸三丁酯以及不同温度下,冷却速率对介稳区的影响 Figure 5 Effects of cooling rate on the MSZW of ADP at different TBP concentrations and different temperatures |
| |
从图 5a)和图 5b)可以观察到,磷酸二氢铵的介稳区随着冷却速率的增大而变大。因为,在较低的降温速率下,过饱和溶液有足够的时间形成晶核,所以低降温速率下,结晶温度较高,介稳区宽度较窄。
2.4 磷酸三丁酯对磷酸二氢铵介稳区宽度的影响为了进一步讨论磷酸三丁酯对磷酸二氢铵介稳区宽度的影响,对不同浓度的磷酸三丁酯下的磷酸二氢铵的介稳区宽度进行了测量,测量条件分别为不同的饱和温度313.15、323.15和333.15 K以及冷却速度12、18、25和60 K·h-1。结果见图 6。从图 6a)、图 6b)和图 6c)可以得到,随着磷酸三丁酯浓度的增加,介稳区宽度增加直至杂质浓度到达了0.075%。当浓度继续增加时,介稳区宽度开始变小。
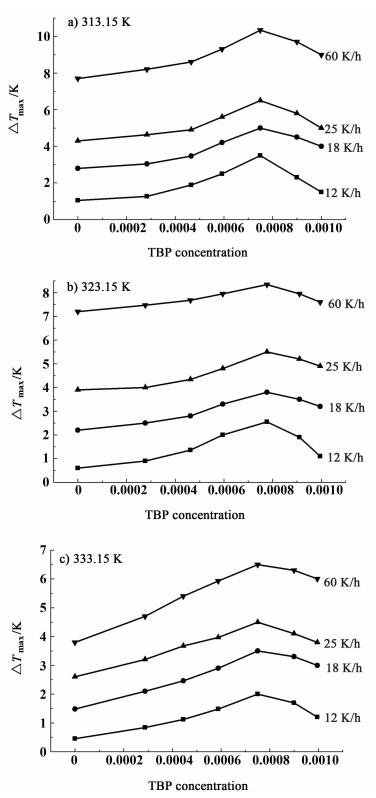
|
| 图 6 不同降温速率以及不同温度下,磷酸三丁酯对磷酸二氢铵介稳区的影响 Figure 6 Effects of TBP concentration on the MSZW of ADP at different cooling rates and different temperatures |
| |
介稳区宽度受杂质影响的机制是不同的[16-19]。为了分析杂质的影响,我们需要区分其是对晶体成核的影响还是对晶体生长的影响。一般来说,介稳区宽度的增加是由于成核的延迟以及生长速度的降低造成的。如果,在适当的生长速度下,杂质的作用是加强成核速率,那么,相比于没有杂质的情况下,介稳区变窄[18]。杂质既能通过降低表面张力加强成核速率,又能通过占据成核的活性位来削弱成核速率[20-21]。成核被2个相反的因素共同影响。杂质对晶体生长速率的影响可以通过晶体表面的吸附平衡来解释。针对本论文研究,从图 6可知,在不同的温度以及不同的降温速率下,磷酸三丁酯的添加使介稳区宽度变大,说明磷酸三丁酯能够通过占总成核的活性位来抑制成核。然而,当磷酸三丁酯浓度增加时,成核速率逐渐降低。由于表面覆盖率的增加,也会导致生长速率的降低。因此,在生长速率降低的情况下,抑制的成核导致了介稳区宽度的增加。另一方面,逐渐增加的杂质使溶液有较高的浓度。在较高的磷酸三丁酯浓度下,晶体表面被大量的覆盖,介稳区宽度并不随着增长的过饱和度而变大。相反,较高的过饱和度既提高成核速率又促进生长速率。这就解释了介稳区宽度有1个最大值,然后又变小的原因。
2.5 表观成核级数的计算(m)根据经典成核理论,冷却速率和介稳区宽度的关系如公式(2)[20]。
| $ \ln \Delta {T_{{\rm{max}}}} = \frac{{1-m}}{m}\ln \left( {\frac{{{\rm{d}}{c^*}}}{{{\rm{d}}T}}} \right)-\frac{{\ln {K_{\rm{N}}}}}{m} + \frac{1}{m}\ln \beta $ | (2) |
其中,ΔTmax是介稳区宽度值,β是降温速率,KN是关于成核速率的常数。dc*/dT是溶解度随着温度变化的速率。m是表观成核级数。在lnΔTmax和lnβ之间存在线性关系。线性关系可以表达为:y=A+Bx。其中x=lnβ; y=lnΔTmax。表观成核级数m能够拟合该直线获得[21]。
磷酸二氢铵的lnΔTmax与lnβ的线性关系如图 7所示。图 7的磷酸三丁酯的浓度为0.05%。

|
| 图 7 根据Nývlt理论用式(2)得到不同饱和温度下的ln(ΔTmax)与lnβ的关系曲线 Figure 7 Dependence of ln(ΔTmax) versus lnβ for different saturation temperatures using Nyývlt's theory according to Eq.(2) |
| |
从图 7可以看出,在不同的温度下,通过实验得到的所有直线是平行的,其他浓度磷酸三丁酯添加下的变化规律是相似的。在林晶等[15]对磷酸二氢铵结晶介稳区的研究中能找到相似的结果。为了获得更准确的结果,m可以通过下面的公式计算[14]。
| $ \frac{1}{m} = \frac{{\sum _{_{j = 1}}^{^p}[{\sum _i}{x_i}{y_i}-{\sum _i}{x_i}/{N_j}\cdot{\sum _i}{y_i}]}}{{\sum _{_{j - 1}}^{^p}[{\sum _i}x_{_i}^{^2}-{{({\sum _i}{x_i})}^2}/{N_j}]}} $ | (3) |
其中xi=lnβi, yi=ln(ΔTmax)i,p是直线的总数量,Nj是每条直线测量的点数。
不同浓度磷酸三丁酯下的表观成核级数被列在表 1中。
| Temperature | Concentration | Nucleation equation | R2 | m |
| 313.15 K | 0 | ln(ΔTmax)=1.1350lnβ-2.48 | 0.94 | 0.88101 |
| 0.050% | ln(ΔTmax)=1.0547lnβ-2.12 | 0.96 | 0.94813 | |
| 0.075% | ln(ΔTmax)=0.68401lnβ-0.41 | 0.97 | 1.46200 | |
| 0.100% | ln(ΔTmax)=0.91792lnβ-1.75 | 0.97 | 1.08940 | |
| 323.15 K | 0 | ln(ΔTmax)=1.1779lnβ-2.88 | 0.97 | 0.84896 |
| 0.050% | ln(ΔTmax)=1.0694lnβ-2.27 | 0.96 | 0.93510 | |
| 0.075% | ln(ΔTmax)=0.68720lnβ-0.59 | 0.99 | 1.45510 | |
| 0.100% | ln(ΔTmax)=0.89703lnβ-1.53 | 0.92 | 1.11480 | |
| 333.15 K | 0 | ln(ΔTmax)=1.1410lnβ-3.15 | 0.94 | 0.87642 |
| 0.050% | ln(ΔTmax)=1.0324lnβ-2.45 | 0.98 | 0.96862 | |
| 0.075% | ln(ΔTmax)=0.69703lnβ-0.91 | 0.93 | 1.43460 | |
| 0.100% | ln(ΔTmax)=0.90108lnβ-1.80 | 0.96 | 1.10980 |
由表 1可以看出对于一个特定的溶液系统,在误差范围内,m的值与饱和温度无关,这一观点与ln(ΔTmax)和lnβ的线性关系互相平行是一致的。在不同浓度磷酸三丁酯,0、0.050%、0.075%和0.100%下的磷酸二氢铵的表观成核级数分别为0.865、0.948、1.443和1.091。磷酸三丁酯的加入增大了表观成核级数。当磷酸三丁酯的浓度是0.075%,效果最为显著,这与其对介稳区宽度的影响是一致的。
2.6 成核特征参数的计算诱导期(tind)是非常重要的成核参数,能被用来描述成核速率(J), 并且与成核速率成反比。诱导期和过饱和度之间的关系可以表示如式(4):
| $ \ln {t_{{\rm{ind}}}} = K + \frac{{16{\rm{ \mathsf{ π} }}{\gamma ^3}V_{\rm{m}}^{^2}}}{{3{\nu ^2}{\kappa ^3}{T^3}{{(\ln S)}^2}}} $ | (4) |
其中,K是常数,κ是波尔兹曼常数,T是绝对温度,S是过饱和度,Vm分子体积,γ是表面张力,ν是1 mol磷酸二氢铵中离子的物质的量。
在常温下,以lntind对(lnS)-2作图应为直线[12]:
| $ {\rm{ln}}{t_{{\rm{ind}}}} \propto \frac{1}{{{{(\ln S)}^2}}} $ | (5) |
直线的斜率为:
| $ \alpha = \frac{{16{\rm{ \mathsf{ π} }}{\gamma ^3}V_{\rm{m}}^{^2}}}{{3{\upsilon ^2}{\kappa ^3}{T^3}}} $ | (6) |
因此,表面张力可以通过(7)得到:
| $ \gamma = {\left( {\frac{{3\alpha {\nu ^2}{\kappa ^3}{T^3}}}{{16{\rm{ \mathsf{ π} }}V_{\rm{m}}^{^2}}}} \right)^{1/3}} $ | (7) |
| $ \Delta {G^*} = \frac{{16{\rm{ \mathsf{ π} }}{\gamma ^3}}}{{3\Delta G_{_\upsilon }^{^2}}} $ | (8) |
其中,ΔG*是临界自由能,ΔGν是单位体积下的自由能,计算公式如(9)[13-14]:
| $ \Delta {G_\upsilon } =-(\kappa T\ln S/{V_{\rm{m}}}) $ | (9) |
在式(4)~(9)中,Vm是晶体的摩尔体积。
不同浓度磷酸三丁酯下,lntind与(lnS)-2的线性关系如图 8所示。根据结果,当过饱和度S较大时,结晶过程是均相成核。然而,当S较小时,结晶过程是非均相成核。
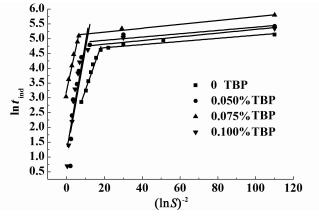
|
| 图 8 不同磷酸三丁酯浓度下的诱导期与过饱和度的关系 Figure 8 Linear regression of induction period tind data of ADP at different TBP concentration |
| |
从图 8可以看出,在均相成核与非均相成核之间的区域大概是过饱和度在1.20~1.48。当S>1.48,均相成核是主要影响因素;当S < 1.20,非均相成核是主要的影响因素。在本研究中,在S=1.20~1.48之间的平均过饱和度S=1.34是临界过饱和度。
通过公式(6)、(7)和(9),可以得到成核的特征参数,分别列在表 2和表 3中。
| Concentration | α | γc/(10-4mJ·m-2) | rc/10-2nm | ΔGc/(10-4J·mol-1) |
| 0 | 0.181 | 9.38 | 0.223 | 0.124 |
| 0.050% | 0.357 | 11.8 | 0.279 | 0.245 |
| 0.075% | 0.374 | 11.9 | 0.283 | 0.256 |
| 0.100% | 0.367 | 11.9 | 0.282 | 0.252 |
| Concentration | α | γc/(10-4 mJ·m-2) | rc/10-2 nm | ΔGc/(10-6 J·mol-1) |
| 0 | 0.005 29 | 2.89 | 0.068 6 | 0.363 |
| 0.050% | 0.005 56 | 2.94 | 0.069 7 | 0.382 |
| 0.075% | 0.006 50 | 3.10 | 0.073 4 | 0.446 |
| 0.100% | 0.006 27 | 3.06 | 0.072 6 | 0.430 |
加入磷酸三丁酯后,表面张力的的值增大。当磷酸三丁酯的浓度是0.075%时,表面张力达到了最大值。这表明在没有磷酸三丁酯的溶液中,成核过程更加容易。临界成核自由能和临界成核半径从微观上反应成核速率。而诱导期则是这些特征参数的宏观表现。结合诱导期,我们可以得出,诱导期越长,临界成核自由能和临界成核半径越大,反之,临界成核自由能和临界成核半径越小。
3 结论磷酸二氢铵的介稳区和诱导期通过激光方法测定,结果显示:介稳区随着温度的升高而降低,随着搅拌速率的增大而增大;在磷酸三丁酯存在的情况下,介稳区变大,当磷酸三丁酯的浓度为0.075%时,介稳区宽度达到一个最大值。此外,计算了表观成核级数和成核特征参数。同样,当磷酸三丁酯浓度为0.075%,诱导期达到了最大值,表明理论值与实验现象一致。
| [1] | Huang W. Progress in the field of purifying wet-process phosphoric acid by solvent precipitation[J]. Chemical Industry & Engineering Progress, 1997, 6(9): 39–43. |
| [2] | Huang T H. Making strong phosphoric acid by a modified wet-process using solvent extraction[J]. Industrial & Engineering Chemistry, 1961, 53(1): 31–32. |
| [3] | Monser L, Amor M B, Ksibi M. Purification of wet phosphoric acid using modified activated carbon[J]. Chemical Engineering & Processing, 1999, 38(3): 267–271. |
| [4] | Touaibia D, Kerdjoudj H, Cherif A T. Concentration and purification of wet industrial phosphoric acid by electrodialysis[J]. Journal of Applied Electrochemistry, 1996, 26(10): 1071–1073. |
| [5] | Polenske D, Lorenz H. Solubility and metastable zone width of the methionine enantiomers and their mixtures in water[J]. Journal of Chemical & Engineering Data, 2009, 54(8): 2277–2280. |
| [6] | Ma Y, Zhou W, Zhou J. Effects of impurity ions on the metastable zone width of phosphoric acid in tributyl phosphate[J]. Journal of Chemical & Engineering Data, 2014, 59(9): 2909–2913. |
| [7] | Dang L, Wang Z, Liu P. Measurement of the metastable zone width of phosphoric acid hemihydrate in the presence of impurity ions[J]. Journal of Chemical Engineering Data, 2007, 52(5): 1545–1547. DOI: 10.1021/je600544k |
| [8] | Jin Y, An L, Chen X, et al. Experimental determination of metastable zone width, induction period, and primary nucleation kinetics of cytidine 5'-monophosphate disodium salt in an ethanol-aqueous mixture[J]. Journal of Chemical & Engineering Data, 2013, 58(5): 1244–1248. |
| [9] | Zhang D, Wang Y, Ma S, et al. Determination of solubility and induction time of ceftazidime[J]. Journal of Chemical & Engineering Data, 2013, 58(1): 176–182. |
| [10] | Peng J, Dong N, Dong Y, et al. Solubility, metastable zone width, and nucleation kinetics of boric acid in the Na-KCl-CaCl2-H2O system[J]. Journal of Chemical & Engineering Data, 2015, 60(11): 3341–3346. |
| [11] | Rajesh N P, Kannan V, Raghavan P S, et al. Nucleation studies and crystal growth of (NH4)H2PO4, doped with thiourea in supersaturated aqueous solutions[J]. Materials Chemistry & Physics, 2002, 76(2): 181–186. |
| [12] | Bromberg L, Rashba-Step J, Scott T. Insulin particle formation in supersaturated aqueous solutions of poly(ethylene glycol)[J]. Biophysical Journal, 2005, 89(5): 3424–3433. DOI: 10.1529/biophysj.105.062802 |
| [13] | Zheng X, Fu J, Lu X. Solubility and induction period study of asiaticoside and madecassoside in a methanol+water mixture[J]. Journal of Chemical & Engineering Data, 2012, 57(11): 3258–3263. |
| [14] | Wang J, Zhang X, Liu Y, et al. Interfacial tensions of imidazolium-based ionic liquids with N-alkanes and cyclohexane[J]. Journal of Chemical & Engineering Data, 2011, 56(10): 3734–3737. |
| [15] |
林晶, 党亚固, 费德君, 等. 磷酸二氢铵结晶介稳区的研究[J].
无机盐工业, 2007, 39(10): 21–23.
Lin Jing, Dang Yagu, Fei Dejun, et al. Metastable zone study of ammonium dihydrogen phosphate[J]. Inorganic Chemicals Industry, 2007, 39(10): 21–23. DOI: 10.3969/j.issn.1006-4990.2007.10.007 |
| [16] | Nielsen A E, Sarig S. Homogeneous nucleation of droplets and interfacial tension in the liquid system methanol water-tribromomethane[J]. Journal of Crystal Growth, 1971, 8(1): 1–7. |
| [17] | Sangwal K, Mielniczek-Brzóska E. Effect of impurities on metastable zone width for the growth of ammonium oxalate monohydrate crystals from aqueous solutions[J]. Journal of Crystal Growth, 2004, 267(3/4): 662–675. |
| [18] | Rauls M, Bartosch K, Kind M, et al. The influence of impurities on crystallization kinetics:A Case study on ammonium sulfate[J]. Journal of Crystal Growth, 2000, 213(1/2): 116–128. |
| [19] | Sangwal K. Effect of impurities on the metastable zone width of solute-solvent systems[J]. Journal of Crystal Growth, 2009, 311(16): 4050–4061. DOI: 10.1016/j.jcrysgro.2009.06.045 |
| [20] | Buchfink R, Schmidt C, Ulrich J. Fe3+ as an example of the effect of trivalent additives on the crystallization of inorganic compounds, here ammonium sulfate[J]. Cryst Eng Comm, 2011, 13(4): 1118–1122. DOI: 10.1039/C0CE00107D |
| [21] | Kulkarni S A, Kadam S S, Meekes H, et al. Crystal nucleation kinetics from induction times and metastable zone widths[J]. Crystal Growth & Design, 2013, 13(6): 40–49. |
 2018, Vol. 35
2018, Vol. 35





