2. 天津大学化学化工协同创新中心, 天津 300072;
3. 天津市功能精细化学品技术工程中心, 天津 300072;
4. 美国南伊利诺伊州大学卡本代尔分校化学与生物化学系, 卡本代尔 IL 美国 62901
2. Collaborative Innovation Center of Chemical Science and Engineering, Tianjin University, Tianjin 300072, China;
3. Tianjin Engineering Research Center of Functional Fine Chemicals, Tianjin 300072, China;
4. Department of Chemistry and Biochemistry, Southern Illinois University, Carbondale IL 62901, Illinois, USA
在能源危机日益加深的背景下,太阳能作为可再生的清洁能源受到各界关注,而利用太阳能的最有效的方法之一就是将太阳能转化为电能。有机太阳能电池具有成本低,制备简易,柔性等优点,近年来有很多研究者对提高有机太阳能电池光电转化效率做了多方面的研究[1-4]。太阳能电池的光电转化效率与开路电压(Voc)、短路电流(Jsc)以及填充因子(FF)相关。而Voc主要与LUMO能级和能隙(Eg)有关[5-6]。2014年,Liu等的理论计算结果表明,在受体上引入强吸电子基团氟原子或氰基时,能够明显降低分子的HOMO和LUMO能级,提高电荷转移能力,从而提高Voc和光电转化效率[7]。同年,Chan等合成了2个共轭化合物,对比受体基团上含有氰基和不含氰基化合物的光电性能。研究结果表明,强吸电子基团氰基的引入能够降低HOMO和LUMO能级,从而提高开路电压,降低电子从给体基团到受体基团的能量损失[8]。2015年,Fu等通过理论计算,在D-π-A结构中的π桥上做修饰,分别引入H,CH3,OCH3和CN,研究结果表明,向π桥上引入氰基能明显影响化合物的空穴传输能力及光电性能[9]。
三苯胺类化合物具有特殊的螺旋状结构和强的给电子能力。近年来,研究者以三苯胺为电子给体基团设计出多种具有优异光电性能的化合物[10-13]。本课题组前期合成了三苯胺衍生物MTPA-TRC(结构见图 1),发现该化合物具有长达80 ns的电荷分离态寿命,在太阳能电池中具有良好的应用前景。本研究进一步在MTPA-TRC上引入氰基,研究了化合物的合成,并通过理论计算和实验测试探讨氰基对化合物光物理性能的影响,为之后化合物的性能优化以及扩大其在有机太阳能电池中的应用提供一定的指导意义。化合物合成路线见图 1。
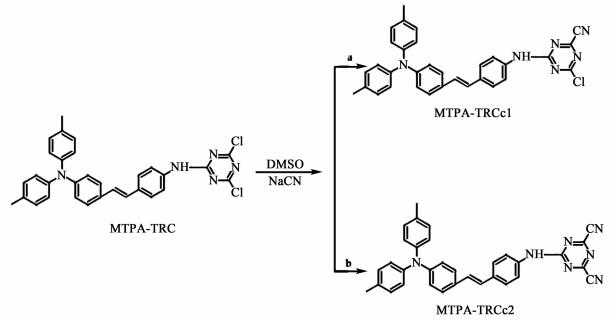
|
| 图 1 化合物的合成路线 Figure 1 Synthetic route of compounds |
| |
实验所用溶剂:二甲基亚砜,正己烷,二氯甲烷,乙酸乙酯,无水硫酸镁,氯化钠,氰化钠均购于天津市江天化工有限公司,并经过相应的纯化。实验所用原料MTPA-TRC为实验室所制,经过1H NMR和高分辨质谱确定结构[10]。溶剂由巩义市予华仪器有限责任公司提供的20 L旋转蒸发仪旋干;核磁由美国Varian公司提供的INOVA-500 MHz型核磁共振波谱仪测定;质谱由美国的Temrmo fisher公司提供的LCQ advantage MAX型液相色谱-ESI质谱联用仪测定;紫外-可见分光光度计由美国的Temrmo fisher公司提供的EVOLUTION 300BB型紫外-可见分光光度计测定;循环伏安曲线由上海辰华仪器公司提供的CHI600E电化学分析仪测定。
1.2 合成方法 1.2.1 MTPA-TRCc1的合成合成路线如图 1。在100 mL三口瓶中依次加入25 mL无水DMSO,70 mg (0.13 mmol) MTPA-TRC,通入N2,水浴控制反应温度为10 ℃,磁力搅拌至完全溶解,15 min后,加入3.2 mg (0.065 mmol) NaCN。反应液由亮黄色逐渐变红,并且随着时间的延长,反应液颜色加深。3 h后停止反应。将反应母液溶于50 mL二氯甲烷,并用饱和食盐水水洗4遍,有机相用无水硫酸镁干燥6 h,过滤,旋转蒸发仪旋干[14-15]。以环己烷为溶剂重结晶,得到橙红色针状晶体41 mg,产率为60%。1H NMR(500 MHz,CDCl3),δ:7.94(s,1H),7.53(dd,J=8.5,8.5 Hz,4H),7.35(d,J=8.5 Hz,2H),7.12-6.92(m,12H),2.33(s,6H)。HRMS(ESI):m/z=529.1905 [(M+H)+](calcd for C32H26ClN6+:m/z=529.1906)。IR(KBr),υ/cm-1:3 435.31,3 325.49,2 922.03,2 855.04,1 710.68,1 612.72,1 551.97,1 498.23,1 390.74,1 270.01,962.38,908.11,821.72,795.07,711.05。
1.2.2 MTPA-TRCc2的合成在100 mL三口瓶中依次加入25 mL无水DMSO,70 mg (0.13 mmol) MTPA-TRC,通入N2,水浴控制反应温度为25 ℃,磁力搅拌至完全溶解,15 min后,加入19 mg (0.39 mmol) NaCN。反应液由亮黄色逐渐变红,并且随着时间的延长,反应液颜色加深。反应3 h后停止反应。将反应母液溶于50 mL二氯甲烷,并用饱和食盐水水洗4遍,有机相用无水硫酸镁干燥6 h,过滤,旋转蒸发仪旋干。用柱层析法分离产物,洗脱剂为正己烷和乙酸乙酯(体积比为5:1),得到暗红色产物61 mg,产率为90%。1H NMR(500 MHz,CDCl3),δ:8.27(s,1H),7.57-7.48(m,4H),7.35(d,J=8.5 Hz,2H),7.13-6.89(m,12H),3.33(s,6H)。HRMS(ESI):m/z=520.2247 [(M+H)+](calcd for C33H26N6+:m/z=520.2244)。IR(KBr),υ/cm-1:3 448.72,3 291.97,2 919.41,2 847.47,1 723.28,1 600.28,1 550.84,1 503.46,1 312.96,1 285.05,956.29,864.78,833.19,803.33,747.29,719.39。
1.3 理论计算为了探讨所合成化合物的结构与其光物理性能之间的关系,进行了相关化合物的理论计算。本实验采用的是Gaussian 09计算软件[16],基态下采用密度泛函理论(DFT),计算方法为B3LYP,基组为6~31G(d,p);激发态下采用含时密度泛函理论(TD-DFT),计算方法为WB97XD,基组为6~311G(d,p)。
2 结果与讨论 2.1 化合物的结构表征图 2为MTPA-TRCc1、MTPA-TRCc2的1H NMR谱图,当在MTPA-TRC上连入1个氰基时,由于氰基的强吸电子性,与TRC相连的氨基氢的化学位移由7.45[10]移向低场7.94[图 2a)];当连上2个氰基时移向更低场8.27[图 2b)],表现出更强的吸电子效应。高分辨质谱ESI的结果进一步确认了所合成化合物的结构。
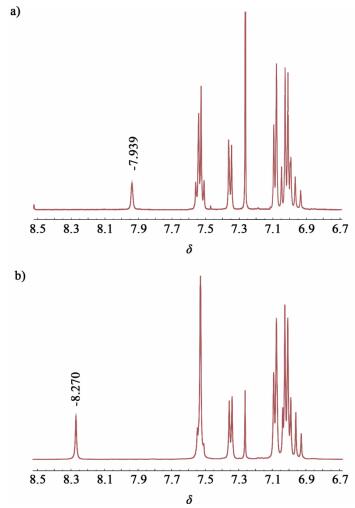
|
| 图 2 MTPA-TRCc1 a)、MTPA-TRCc2 b)的1H NMR谱图(溶剂为CDCl3) Figure 2 1H NMR spectroscopy of MTPA-TRCc1 a), MTPA-TRCc2 b) (The solvent is CDCl3) |
| |
因为本反应为亲核取代反应,一般选择非质子型溶剂,结合已报道的反应,本研究选择THF、DMF和DMSO作为反应溶剂,在25 ℃下,控制原料投料比为1:1,反应时间3 h,来选择合适的溶剂。发现在DMSO中,2种产物的总产率最高,因此,选用DMSO做反应溶剂,选择最适宜反应条件。
由于MTPA-TRC上的2个氯反应活性强,容易离去,因此,在进行取代反应时,图 1a和图 1b的2个反应都较容易进行。为了更好的控制反应进程,本研究在DMSO溶剂中,通过改变反应温度,控制投料比以及反应时间进行实验,实验结果记录于表 1。
| n(MTPA-TRC):n(NaCN) | 10 ℃ | 25 ℃ | 40 ℃ | ||||||||||||||
| 1 h | 3 h | 1 h | 3 h | 1 h | 3 h | ||||||||||||
| Y1 | Y2 | Y1 | Y2 | Y1 | Y2 | Y1 | Y2 | Y1 | Y2 | Y1 | Y2 | ||||||
| 2:1 | 35 | 5 | 55 | 10 | 50 | 20 | 30 | 60 | 40 | 40 | 20 | 61 | |||||
| 1:1 | 30 | 10 | 35 | 15 | 40 | 25 | 25 | 65 | 35 | 45 | 15 | 67 | |||||
| 1:2 | 25 | 15 | 28 | 20 | 30 | 30 | 10 | 70 | 25 | 60 | 5 | 71 | |||||
| 1:3 | 15 | 20 | 16 | 25 | 20 | 60 | 0 | 90 | 10 | 80 | 0 | 91 | |||||
| 注:Y为产率,下标1表示化合物MTPA-TRCc1,下标2表示化合物MTPA-TRCc2。 | |||||||||||||||||
通过对表 1数据进行分析,发现当反应时间为1 h时,随着反应温度的升高,MTPA-TRCc1的产率先升高后下降;而当延长反应时间时,MTPA-TRCc1的产率随着温度的升高反而下降。对于化合物MTPA-TRCc2而言,其产率总是随着反应时间的延长而提高。从25 ℃升温至40 ℃,MTPA-TRCc2的产率虽然有所提高,但是提高的不明显。总结表 1的规律,本研究将10 ℃,n(MTPA-TRC):n(NaCN)=2:1,反应3 h定为MTPA-TRCc1的最适宜反应条件,将25 ℃,n(MTPA-TRC):n(NaCN)=1:3,反应3 h定为MTPA-TRCc2的最适宜反应条件。
在合成MTPA-TRCc1时,伴随着MTPA-TRCc2的生成,而且在最适宜反应条件下原料MTPA-TRC反应不完全。并且这3个化合物极性相近,难以用柱层析法分离,但是实验结果发现MTPA-TRCc1为橙色针状晶体,且在环己烷中溶解性随温度变化很大,因此,本研究考虑用重结晶的方法将MTPA-TRCc1进行提纯。在粗产物中加入2 mL环己烷,升温到80 ℃,至完全溶解,将粗产物环己烷溶液放于冰箱中,4 h后,MTPA-TRCc1完全析出。用玻璃滤板漏斗将含杂质的滤液滤掉,并用事先预冷好的环己烷冲洗漏斗上的固体,得到橙色的纯MTPA-TRCc1化合物。
2.3 紫外-可见吸收光谱结果图 3a)和图 3b)分别为MTPA-TRC、MTPA-TRCc1、MTPA-TRCc2在甲苯和二氯甲烷中测得的紫外-可见吸收光谱。
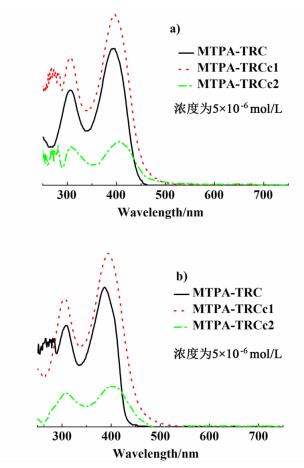
|
| 图 3 化合物MTPA-TRC、MTPA-TRCc1和MTPA-TRCc2分别在甲苯a)和二氯甲烷b)中的紫外-可见吸收光谱 Figure 3 Absorption spectra of MTPA-TRC, MTPA-TRCc1 and MTPA-TRCc2 in toluene a) and dichloromethane b) |
| |
如图 3a),化合物在300 nm附近出现的吸收峰则应归属于分子内共轭体系的π-π*跃迁,而在396 nm左右出现的最大吸收峰主要是由电子给体基团和相应电子受体基团之间的分子内电荷转移(ICT)所产生的。当在MTPA-TRC上连入1个氰基时,不仅在一定程度上拓宽了紫外吸收光谱,而且最大吸收波长由MTPA-TRC的386 nm红移至396 nm,说明当MTPA-TRC上的氯被氰基取代后,由于氰基的强吸电子作用,分子内的ICT作用得到了增强。当MTPA-TRC上的2个氯都被氰基取代时,MTPA-TRCc2最大吸收波长红移至403 nm,相比于MTPA-TRCc1的最大吸收峰也发生了7 nm的红移。在二氯甲烷中的吸收规律与在甲苯中的相似。通过紫外-可见吸收光谱带边波长(λonset)计算得到光学能隙Eg, op列于表 2。从表 2中可知,氰基的引入可以降低化合物的Eg, op,但这个作用只在引入第1个氰基时比较明显,第2个氰基的进一步降低效果几乎可以忽略。根据朗伯比尔定律计算公式[式(1)],MTPA-TRCc1的摩尔消光系数比MTPA-TRCc2的大1个数量级,说明1个氰基取代的化合物对太阳光的吸收能力更强。因此,在之后的研究中,应注意选择反应条件,使反应控制在1个氰基取代为好。
| Compounds | E1/2+/0/eV | E1/20/-/eV | EHOMO/eV | ELUMO/eV | Eg, el/eV | Eg, op/eV |
| MTPA-TRC | 0.55 | -1.19 | -5.48 | -3.74 | 1.74 | 2.89 |
| MTPA-TRCc1 | 0.50 | -1.11 | -5.43 | -3.82 | 1.61 | 2.66 |
| MTPA-TRCc2 | 0.51 | -1.13 | -5.44 | -3.80 | 1.64 | 2.64 |
| 注:Eg, el=ELUMO-EHOMO,Eg, el为电化学能隙;Eg, op=1241/λonset,其中λonset为紫外吸收光谱带边波长。 | ||||||
| $ \varepsilon = \frac{A}{{cl}} $ | (1) |
式(1)中:ε为摩尔消光系数;A为吸光度;c为样品浓度;l为光程。
2.4 循环伏安测试结果将待测化合物溶于色谱纯二氯甲烷,配成浓度为5×10-3mol·L-1的溶液,再加入四丁基六氟磷酸铵(TBAF),使其浓度为0.1 mol·L-1,本实验采用的是三电极体系测试,以玻碳电极作为工作电极,以铂丝电极作为辅助电极,以Ag/AgNO3作为参比电极。测试前将氮气通入到待测溶液中20~30 min除氧,在室温下测试,扫描速度为0.1 V/s,循环伏安曲线见图 4。
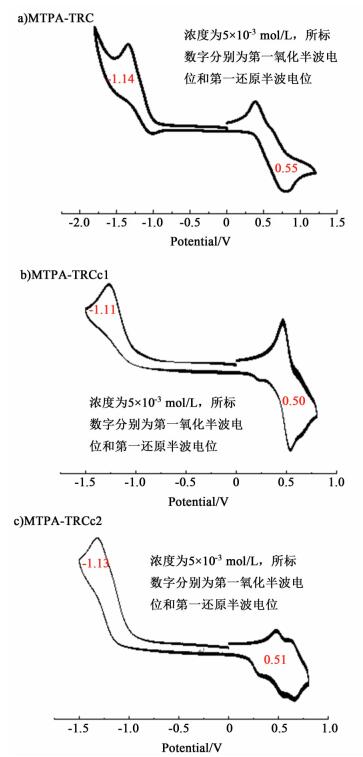
|
| 图 4 不同化合物分别在二氯甲烷中的循环伏安曲线 Figure 4 Cyclic voltammograms of compounds in dichloromethane |
| |
如图 4b),0.50 V处的峰属于MTPA的1对可逆氧化峰,与MTPA-TRC中0.55 V中的可逆氧化峰相对应。而-1.11 V处的峰归属于TRC的不可逆还原峰,同样与MTPA-TRC中的TRC峰相对应。在MTPA-TRCc2中0.51 V处的可逆氧化峰,和-1.13 V处的不可逆还原峰分别归属于MTPA和TRC基团。使用公式EHOMO=-E1/2+/0-4.93 eV,ELUMO=-E1/20/--4.93 eV,Eg, el=ELUMO-EHOMO计算各化合物的HOMO能级、LUMO能级和电化学能隙Eg, el,其中,E1/2+/0和E1/20/-分别为第一氧化半波电位和第一还原半波电位,计算得到3个化合物的HOMO能级,LUMO能级以及Eg, el数据,列于表 2。从表 2中数据看出,当在MTPA-TRC上连入强吸电子基团时,化合物的LUMO能级和Eg, el都有所降低。因此,将MTPA-TRCc1和MTPA-TRCc2作为给体材料应用到有机太阳能电池中时,有望降低电子从给体基团到受体基团转移过程中的能量损失,从而提高太阳能电池的光电转化效率。
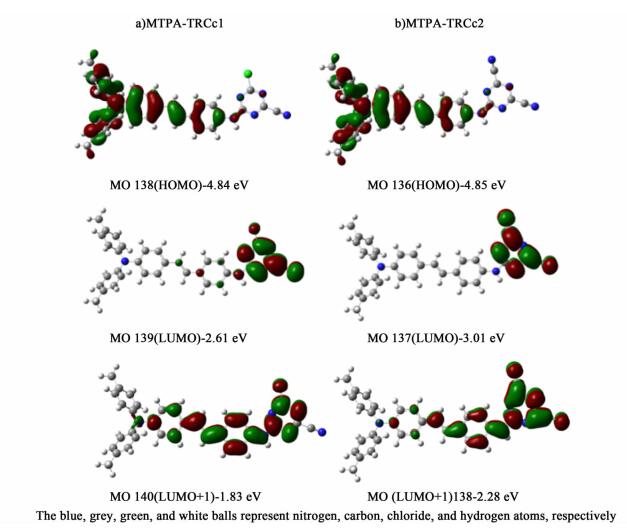
2.5 理论计算图 5是化合物MTPA-TRCc1,MTPA-TRCc2的HOMO,LUMO和LUMO+1分子轨道图及各个对应的能级。与MTPA-TRC的研究结果一致[10],2个化合物的HOMO轨道位于MTPA基团,LUMO轨道分布于TRCc1(TRCc2)基团,存在着电子从HOMO轨道激发到LUMO+1轨道,然后电子转移到LUMO轨道的趋势。比较HOMO和LUMO+1轨道,可以发现:随着氰基数目的增加,这2个轨道的电子云重叠程度越来越小。这表明氰基的引入能够增强MTPA的ICT作用,并有利于促进电子转移作用。进一步研究化合物的分子能级,结果显示MTPA-TRCc1的LUMO能级由MTPA-TRC的-1.98 eV降低至-2.61 eV,计算能隙Eg, cal也由MTPA-TRC的3.00 eV降低至MTPA-TRCc1的2.23 eV;同时,MTPA-TRCc2的LUMO能级和Eg, cal也分别进一步降低至-3.01和1.84 eV。以上结果进一步证明强吸电子基团氰基的引入能够降低化合物的LUMO能级和Eg, cal。
|
| 图 5 分子轨道图和相应能级 Figure 5 Molecular orbitals and the corresponding energies |
| |
以MTPA-TRC作为母体,对其进行氰基取代修饰。由于氰基取代反应活性较高,不易控制反应进程,因此,本论文探索了该反应的最适宜反应条件。本研究发现将反应温度控制在10 ℃,延长反应时间能提高MTPA-TRCc1的产率,而将反应温度控制在25 ℃,n(MTPA-TRC):n(NaCN)=1:3,反应3 h时,MTPA-TRCc2的产率较高。染料的紫外-可见吸收光谱测试结果表明,受体上取代1个氰基时,不仅能够增强吸光度,而且还能拓宽紫外吸收谱带,增强分子内的ICT作用,降低Eg, op;通过将新型化合物MTPA-TRCc1和母体化合物MTPA-TRC的循环伏安曲线进行对比,发现氰基的引入能够在一定程度上降低LUMO能级,减小Eg, el。这一结果也从理论计算上得到了验证。MTPA-TRCc1和MTPA-TRCc2的实验结果对比显示以上作用只在引入第1个氰基时比较明显,第2个氰基的进一步作用效果却很小。这一研究发现为后续将其应用到有机太阳能电池上做了重要铺垫,也为太阳能电池中光活性材料的合成提供指导性意义。
| [1] | Bandi V, Gobeze H B, Lakshmi V, et al. Vectorial charge separation and selective triplet-state formation during charge recombination in a pyrrolyl-bridged BODIPY-fullerene Dyad[J]. The Journal of Physical Chemistry C, 2015, 119(15): 8095–8102. DOI: 10.1021/acs.jpcc.5b02712 |
| [2] | Nagamani S, Kumarasamy G, Song M, et al. Optical absorption and electrical properties of enhanced efficiency in organic solar cells as interfacial layer with Au NPs[J]. Synthetic Metals, 2016, 217: 117–122. DOI: 10.1016/j.synthmet.2016.03.025 |
| [3] | Zhao Y, Zhou X, Wu K, et al. Diketopyrrolopyrrole based A2-D-A1-D-A2 type small molecules for organic solar cells:Effects of substitution of benzene with thiophene[J]. Dyes & Pigments, 2016, 130: 282–290. |
| [4] |
刘扬, 杨乐, 陈志坚. 小分子给体型有机光伏材料[J].
化学工业与工程, 2014, 31(2): 72–78.
Liu Yang, Yang Le, Chen Zhijian. Small molecular electron donors for organic photovoltaics[J]. Chemical Industry and Engineering, 2014, 31(2): 72–78. |
| [5] | Shibata Y, Kono T, Usui H, et al. Development of novel n-type materials based on benzothiadiazole derivatives for organic photovoltaics:Effects of acceptor terminal substituents[J]. Chemistry Letters, 2015, 44(5): 680–682. DOI: 10.1246/cl.141155 |
| [6] | Bagheri O, Dehghani H, Afrooz M. Pyridine derivatives; New efficient additives in bromide/tribromide electrolyte for dye sensitized solar cells[J]. RSC Advances, 2015, 5(105): 86191–86198. DOI: 10.1039/C5RA15894J |
| [7] | Liu X, Li M, He R, et al. Theoretical investigations on fluorinated and cyano copolymers for improvements of photovoltaic performances[J]. Physical Chemistry Chemical Physics, 2014, 16(1): 311–323. DOI: 10.1039/C3CP53268B |
| [8] | Chan H, Kim H N, An T, et al. Effects of Cyano-substituents on the molecular packing structures of conjugated polymers for bulk-heterojunction solar cells[J]. ACS Applied Materials & Interfaces, 2014, 6(18): 15774–15782. |
| [9] | Fu Z, Shen W, He R, et al. Theoretical studies on the effect of a bithiophene bridge with different substituent groups (R=H, CH3, OCH3 and CN) in donor-π-acceptor copolymers for organic solar cell applications[J]. Physical Chemistry Chemical Physics, 2015, 17(3): 2043–2053. DOI: 10.1039/C4CP04103H |
| [10] | Wang T, Weerasinghe K C, Liu D, et al. Ambipolar organic semiconductors with cascades of energy levels for generating long-lived charge separated states:A donor-acceptor1-acceptor2 architectural triarylamine dye[J]. Journal of Materials Chemistry C, 2014, 2(28): 5466–5470. DOI: 10.1039/C4TC00860J |
| [11] | Karamshuk S, Caramori S, Manfredi N, et al. Molecular level factors affecting the efficiency of organic chromophores for p-type dye sensitized solar cells[J]. Energies, 2016, 9(1): 33. DOI: 10.3390/en9010033 |
| [12] | Somasundaram S, Jeon S, Park S. Triphenylamine and benzothiadiazole-based DA-A' and A'-ADDA-A' type small molecules for solution-processed organic solar cells[J]. Macromolecular Research, 2016, 24(3): 226–234. DOI: 10.1007/s13233-016-4035-3 |
| [13] | Idígoras J, Sobus' J, Jancelewicz M, et al. Effect of different photoanode nanostructures on the initial charge separation and electron injection process in dye sensitized solar cells:A photophysical study with indoline dyes[J]. Materials Chemistry and Physics, 2016, 170: 218–228. DOI: 10.1016/j.matchemphys.2015.12.042 |
| [14] | Mott B T, Ferreira R S, Simeonov A, et al. Identification and optimization of inhibitors of trypanosomal cysteine proteases:Cruzain, rhodesain, and TbCatB[J]. Journal of Medicinal Chemistry, 2009, 53(1): 52–60. |
| [15] | 森泰智, 川上聡, 橋田洋二. シアノ-1, 3, 5-トリアジンの合成と反応[J]. 日本化学会誌, 1990(4): 396–400. |
| [16] | Trucks G W, Schlegel H B, Scuseria G E, et al. Gaussian 09, revision D. 01[M]. CT: Wallingford, 2009. |
 2018, Vol. 35
2018, Vol. 35





