汽车给人类的生活带来了巨大的便利,但汽车尾气排放造成的空气污染也日益严重,造成严重的环境危机。汽车尾气中含有上百种不同的化合物,其中的污染物主要有固体悬浮微粒、一氧化碳(CO)、氮氧化物(主要指一氧化氮和二氧化氮)、碳氢化合物(HC)、铅和二氧化硫(SO2)等[1]。这些污染物直接降低空气质量,在空气中容易引发光化学反应,产生光化学烟雾及酸雨等二次污染物。近几年来,我国多地被雾霾笼罩,空气污染指数不断攀升,中东部地区连续发生了多次中度、重度或极重度的雾霾天气,汽车尾气的排放是造成雾霾的主要原因之一。
稀薄燃烧技术是减少汽车尾气排放的有效措施。相对于传统发动机,稀燃发动机可减少15%~20%的燃油,汽车尾气中CO、碳氢化合物和CO2的排放也大大减少。然而,在稀燃条件下,由于过量氧的存在,不可避免的造成了高浓度氮氧化物(主要指NO和NO2)的产生与排放。在高空燃比下,传统的三效催化剂对NOx的脱除效率很低[2],无法满足日益严格的排放标准[3]。到目前为止,最有效的脱除NOx的方法是氮氧化物储存还原(NSR)技术[4-6]。在稀燃条件下,NOx以硝酸盐和亚硝酸盐的形式储存下来,富燃条件下,被还原成N2。NSR催化剂主要包括3部分:1)起氧化还原作用的活性组分,主要有贵金属(例如Pt、Pd、Rh)和非贵金属(例如Co、Mn、Cu);2)起储存作用的碱金属或碱土金属(例如Ba和K);3)载体,常见的载体主要有Al2O3、ZrO2、CeO2和TiO2。
最典型的NSR催化剂是Pt/Ba/Al体系。近年的研究发现,锰的氧化物对NO有很强的氧化能力[7-9],可以替代贵金属Pt,而且作为非贵金属,价格比Pt要便宜得多,因此本实验选用锰作为活性组分。在储存方面,K比Ba有更好的储存性能[10]。本研究考察了不同锰的负载量对催化活性的影响。通过浸渍法,制备了不同锰负载量的NSR催化剂Mn-K2CO3/γ-Al2O3。并考察了水和CO2对储存性能的影响,采用XRD、EXAFS、H2-TPR和CO2-TPD等技术对催化剂进行表征。
1 实验部分 1.1 催化剂的制备采用等体积浸渍法制备催化剂。首先将商业γ-Al2O3在马弗炉中500 ℃焙烧5 h,得到载体。然后采用等体积浸渍法负载锰,用硝酸锰作为锰源,其中Mn/Al2O3的质量比为x(x=0.02、0.05、0.08、0.10、0.12)。浸渍完成后,室温下放置12 h,然后120 ℃烘干,500 ℃焙烧5 h,得到不同比例的Mn/Al2O3。第3步,采用等体积浸渍法负载K2CO3,其中K2CO3/(Mn+Al2O3)的质量比为0.10,浸渍完成后,室温下放置12 h,然后120 ℃烘干,500 ℃焙烧5 h,得到不同锰负载量的催化剂,标记为xMn-K2CO3/γ-Al2O3(x=0.02、0.05、0.08、0.10、0.12)。
1.2 催化剂表征催化剂的比表面积测试在Quantachrome NOVA-2000物理吸附仪上进行,在液氮温度77 K下进行氮气吸附/脱附测试。测试前样品于350 ℃进行脱气预处理4 h。采用BET方法计算样品的比表面积。
X射线粉末衍射(XRD)测试在德国布鲁克AXS有限公司生产的D8-Focus型多晶粉末衍射仪上进行。采用Cu_Kα(λ=0.15418 nm)作为射线源,操作电压40 kV,电流40 mA,扫描范围为2θ=10°~90°,步长为0.033°。
CO2程序升温分解测试(CO2-TPD)测试在Thermo-Finnigan公司生产的TPDRO 1100SERIES动态吸附仪上进行,采用TCD检测器进行检测。样品用量200 mg,He气氛下以10 ℃·min-1升温至900 ℃,尾气进TCD检测器前通过干燥剂Mg(ClO4)2除H2O。
H2程序升温还原(H2-TPR)实验在天津先权公司生产的TP-5079SERIES动态吸附仪上进行,采用TCD检测器进行检测。样品用量30 mg,以8% H2/N2混合气为还原气,气体流速为30 mL·min-1,以10 ℃·min-1的从室温升至900 ℃。尾气进入TCD检测器前通过CaO和NaOH的混合物进行除H2O和CO2处理。
Mn-K边X射线吸收精细结构测试在上海同步辐射装置(SSRF)的14 W-1工作站的光束线上进行。储存环电子能量为3.5 GeV,平均环电流为250 mA,能量分辨率为0.3 eV。在常温常压下采用透射模式对标样(MnO2、Mn2O3和Mn3O4)及催化剂样品进行Mn-K边X射线吸收谱的测定。采用Ifeffit软件包中Athena软件对采集的原始数据进行处理,原始数据经过背景扣除、归一化后得到EXAFS函数,再通过傅里叶变换到R空间得到样品的径向结构函数(k=25~140 nm-1,3次方加权,窗函数为hanning)。
1.3 催化剂活性测试 1.3.1 储存性能测试NOx储存量测试(NSC)在微型常压固定床反应器上进行,新鲜催化剂样品(40~60目)用量为500 mg,置于内径为8 mm石英管反应器中,反应温度为350 ℃。通入含有0.04%NOx+5%O2+N2平衡气的混合气体,混合气的流速为400 mL·min-1, 空速约为95 000 h-1。采用化学发光式NO-NO2-NOx监测仪(Model 42i-HL,Thermo Scientific)连续在线监测反应器出口的NO、NO2和总NOx浓度变化。
1.3.2 储存-还原性能测试NOx储存-还原性能测试在微型常压固定床反应器上进行,新鲜催化剂样品(40~60目)用量为250 mg,置于内径为8 mm石英管反应器中,反应温度为350 ℃。稀燃和富燃阶段时间长度分别采用7 min和1 min,其中稀燃气氛组成为0.04%NOx+5%O2+N2平衡气的混合气,富燃气氛组成为0.1%C3H6+N2平衡气的混合气。气体流速均为150 mL·min-1,空速约为36 000 h-1。
1.3.3 抗水抗CO2性能测试抗水抗CO2性能测试在微型常压固定床反应器上进行,新鲜催化剂样品(40~60目)用量为500 mg,置于内径为8 mm石英管反应器中,反应温度为350 ℃。抗水性能测试的气氛组成为0.04%NOx+5%O2+5%H2O+N2平衡气的混合气体;抗CO2性能测试的气氛组成为0.04%NOx+5%O2+5%CO2+N2平衡气的混合气体;同时通入水和CO2的气氛组成为0.04%NOx+5%O2+5%H2O+5%CO2+N2平衡气的混合气体。以上混合气的流速均为400 mL·min-1,空速约为95 000 h-1。
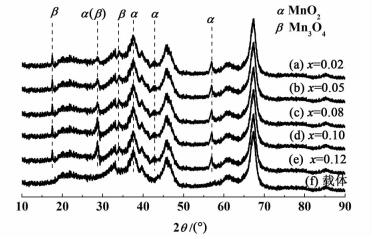
2 实验结果和讨论 2.1 催化剂表征 2.1.1 XRD表征新鲜催化剂和载体的XRD谱图如图 1所示。其中曲线(f)是载体γ-Al2O3[JCPDS 04-0877]的XRD谱图。曲线(a)~(e)是新鲜催化剂的XRD谱图。
|
| 图 1 催化剂xMn-K2CO3/γ-Al2O3和载体的XRD谱图 Figure 1 XRD patterns of the catalysts xMn-K2CO3/γ-Al2O3 and support |
| |
从图 1可以看出,催化剂与载体的XRD相比,在2θ为28.7°,37.5°,42.9°, 56.8°的位置多出了1组衍射峰(标记为α),α峰归属为MnO2[JCPDS 65-2821]。同时,在2θ为17.5°,28.7°,34.0°的位置多出了另1组衍射峰(标记为β),β峰归属为Mn3O4[JCPDS 04-0732]。仔细对比可以发现,随着锰负载量的增加,α峰和β峰的强度也逐渐增加。说明焙烧之后,锰的存在形式有MnO2和Mn3O4。
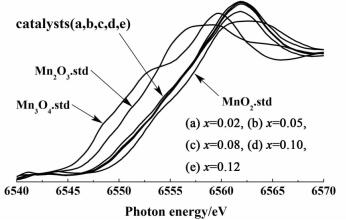
2.1.2 EXAFS表征为了考察锰的配位结构和锰的精细结构,做了X射线吸收精细结构(XAFS)表征。包括扩展X射线吸收精细结构(EXAFS)和X-射线吸收近边结构(XANES)。图 2是锰标样(Mn3O4、Mn2O3和MnO2)和新鲜催化剂xMn-K2CO3-Al2O3(x=0.02、0.05、0.08、0.10、0.12)的Mn-K边径向结构函数谱图。图 3是锰标样和催化剂样品的X射线吸收近边结构谱图。

|
| 图 2 锰标样(MnO2、Mn3O4和Mn2O3)和新鲜催化剂xMn-K2CO3/γ-Al2O3的Mn-K边径向结构函数图 Figure 2 Mn K-edge radial structure functions of the reference compounds (MnO2, Mn3O4 and Mn2O3) and the catalysts xMn-K2CO3/γ-Al2O3 |
| |
|
| 图 3 锰标样(MnO2,Mn3O4和Mn2O3)和新鲜催化剂xMn-K2CO3/γ-Al2O3的X射线吸收近边结构谱图 Figure 3 X-ray absorption near edge structure of the reference compounds(MnO2, Mn3O4 and Mn2O3)and the catalysts xMn-K2CO3/γ-Al2O3 |
| |
从图 2可以看出,催化剂样品在0.150 nm附近的位置出现了1个很强的配位峰,这个强峰可以归属为第1壳层Mn—O键的配位峰[11-12],在0.248 nm附近出现了较弱的配位峰,这个峰可以归属为第2壳层Mn—Mn键的配位峰[12-13]。对比锰标样后发现,催化剂样品的第1壳层Mn—O键的位置与标样MnO2的Mn—O键的位置重合,说明锰主要是以MnO2的形式存在。第2壳层配位峰相对标样MnO2的峰位置发生了偏移,结合XRD表征,这是因为除了MnO2,还含有Mn3O4(通过近边拟合,还含有少量Mn2O3),第2壳层相互影响,造成峰位置的偏移。
从图 3也可以看出,催化剂样品的近边几乎重合,非常接近MnO2的近边,也说明锰主要是MnO2的形式存在。通过EXAFS近边的线性拟合,每个催化剂样品中还有少量的Mn2O3(含量小于5%),但在XRD谱图中,没有检测到Mn2O3的衍射峰,这说明Mn2O3在催化剂中以高分散的形式存在。结合XRD和EXAFS表征结果,可以说明锰主要是以MnO2的形式存在,其次还有Mn3O4和少量的Mn2O3。
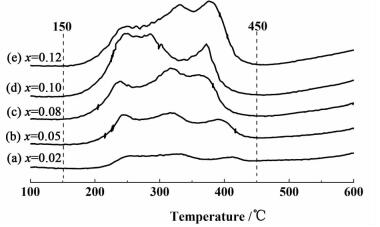
2.1.3 H2-TPR表征催化剂的氧化还原性能跟催化剂的催化活性有很大的关系[13]。图 4是新鲜催化剂的H2-TPR谱图。
|
| 图 4 新鲜催化剂xMn-K2CO3/γ-Al2O3的H2-TPR谱图 Figure 4 H2-TPR profiles of the catalysts xMn-K2CO3/γ-Al2O3 |
| |
从图 4可以看出,在150~450 ℃的范围内,出现了很强的还原峰。从前面的分析可知,锰主要是以MnO2的形式存在,其次是Mn3O4和少量的Mn2O3。因此,还原峰主要是这3种锰氧化物的还原,即MnO2到Mn2O3的还原,Mn2O3到Mn3O4的还原,还有Mn3O4到MnO的还原。随着锰负载量的增加,锰氧化物还原峰的峰强度和峰面积也逐渐增加,说明催化剂的氧化还原性能也是逐渐增强的。
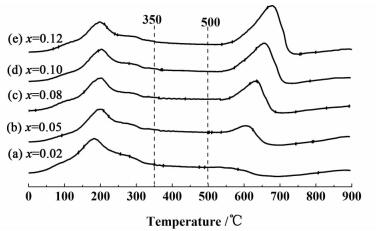
2.1.4 CO2-TPD表征为了表征K2CO3的分布情况,做了CO2的程序升温脱附实验(CO2-TPD),结果如图 5所示。
|
| 图 5 催化剂xMn-K2CO3/γ-Al2O3的CO2-TPD谱图 Figure 5 CO2-TPD profiles of the catalysts xMn-K2CO3/γAl2O3 |
| |
从图 5可以看出,CO2-TPD曲线有2组明显的脱附峰:小于350 ℃和大于500 ℃。小于350 ℃的峰可认为是表相K2CO3的分解,大于500 ℃的峰可认为是体相K2CO3的分解。
从图 5中可以看出,当锰的负载量较低时(x=0.02),曲线(a)在高温段(大于500 ℃)几乎是没有脱附峰,表明几乎没有体相K2CO3的存在。随着锰负载量的增加,可以看出,从曲线(a)到曲线(e),体相K2CO3的脱附峰从无到有,由弱变强。表明随着锰负载量的增加,K2CO3的分散性逐渐降低,K2CO3逐渐由表面分散的K2CO3向体相K2CO3转化。这是因为随着锰负载量的增加,催化剂的比表面积逐渐减小(如表 1所示),造成K2CO3的分散性逐渐降低。
| x | NSC/(mmol·g-1) | NRP/% | BET/(m2·g-1) | NO to NO2Conversion/% |
| 0.02 | 0.51 | 91.35 | 67 | 13.65 |
| 0.05 | 0.86 | 96.24 | 56 | 19.58 |
| 0.08 | 1.08 | 98.61 | 48 | 25.42 |
| 0.10 | 1.30 | 99.28 | 40 | 29.86 |
| 0.12 | 1.21 | 99.87 | 35 | 31.32 |
不同锰负载量的催化剂,在350 ℃下的NOx储存性能曲线如图 6所示。

|
| 图 6 不同锰负载量的催化剂xMn-K2CO3/γ-Al2O3的等温NOx储存曲线 Figure 6 Isothermal NOx storage of catalysts xMn-K2CO3/γ-Al2O3 with different manganese content |
| |
从图 6可以看出,几秒之内,NOx的浓度从0.04%迅速降到几乎为0,说明该系列催化剂对NOx有很好的储存性能。当NOx的储存量达到饱和的时候,NOx的浓度又回到起始浓度。储存饱和后,计算了NOx的储存量如表 1所示。从计算结果可以看出,当锰的负载量较低(x=0.02)时,储存量较小,只有0.51 mmol·g-1,随着锰的负载量的加大,储存量也增加。当Mn/Al2O3由0.02逐渐增加到0.10的时候,储存量也逐渐增加,由0.51 mmol·g-1增加到1.30 mmol·g-1。但是,随着锰负载量的进一步增加,Mn/Al2O3由0.10增加到0.12的时候,储存量反而开始下降,由1.30 mmol·g-1下降为1.21 mmol·g-1。储存饱和后,根据尾气中的NO浓度,计算出了NO到NO2的转化率,结果如表 1所示。计算结果表明,随着锰负载量的增加,NO到NO2的转化率也逐渐增加,说明随着锰负载量的增加,催化剂的催化氧化性能逐渐增强。
由于NO到NO2的转化是NOx储存过程的决定性步骤[14],因此随着锰负载量的增加,NO到NO2的转化率增加,NOx的储存量增加。但当锰的负载量太大时,储存量反而开始下降,这是因为NOx的储存量除了与NO到NO2的转化率有关外,还与K2CO3的分布有关。结合BET和CO2-TPD的结果,当锰的负载量较低(x=0.02)时,比表面积较大,此时K2CO3的分散性较好,主要以表面分散的形式存在,储存达饱和后,储存曲线上升的非常快,在很短的时间内即回到起始浓度(储存曲线的斜率很大)。而随着锰负载量的增加,比表面积减小,K2CO3的分散性降低,逐渐由表相K2CO3转化为体相K2CO3。在NOx的储存过程中,体相K2CO3存在扩散阻力,不利于硝酸盐或亚硝酸盐的形成,造成储存量下降,储存曲线上升的越来越慢(储存曲线的斜率越来越小)。因此当锰的负载量太大时(x=0.12), 储存量反而会下降。
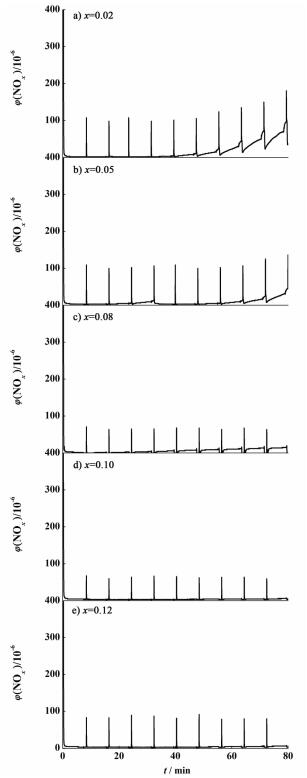
2.2.2 储存-还原性能测试为了考察催化剂对NOx的储存-还原性能,对新鲜催化剂在350 ℃进行了稀燃/富燃(7 min/1 min)交替循环气氛下的NOx储存还原性能测试,10个循环的出口NOx浓度随时间的变化曲线如图 7所示。
|
| 图 7 不同锰负载量的催化剂xMn-K2CO3/γ-Al2O3的NOx储存-还原曲线 Figure 7 NOx storage and reduction of catalysts xMn-K2CO3/γ-Al2O3 with different manganese content |
| |
在稀燃阶段,NOx以硝酸盐或亚硝酸盐的形式储存下来,切换到富燃状态下,在稀燃阶段储存的热力学上不稳定的硝酸盐和亚硝酸盐释放出NOx,NOx的浓度瞬间升高,接着被C3H6还原成N2,NOx的浓度迅速降低。经过10个循环后,计算了最后3个循环的出口NOx浓度值,根据进口的NOx浓度,可以计算出最后3个循环的NOx的平均消除效率(NRP),结果如表 1所示。
从结果可以看出,当锰的负载量较低时(x=0.02),对NOx的还原效率较低,只有91.35%,随着锰负载量的增加,还原效率也依次增加。当锰的负载量最大时(x=0.12),对NOx的还原效率也达到最大值(99.87%),这是因为随着锰负载量的增加,锰的氧化物的含量也增多,氧化还原性能增强,因此对NOx的还原效率依次增加。结合NO到NO2的转化率,说明锰负载量的增加即增强了催化剂的催化氧化能力也增强了催化剂的催化还原能力。
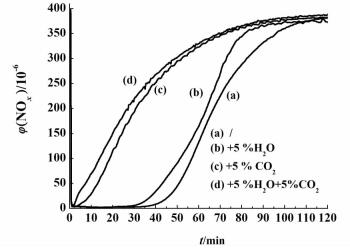
2.2.3 抗水抗CO2性能测试为了考察水和CO2对催化剂储存性能的影响,选择储存量最大的催化剂(x=0.10)。反应气氛为0.04%NOx+5%O2+N2,分别向混合气中加入5%的水蒸气和5%的CO2,储存曲线如图 8所示。
|
| 图 8 催化剂xMn-K2CO3/γ-Al2O3(x=0.10)的抗水抗CO2性能测试 Figure 8 Resistance test to water and carbon dioxide for the catalyst xMn-K2CO3/γ-Al2O3(x=0.10) |
| |
根据尾气中的NO浓度,计算出了NO到NO2的转化率,结果如表 2所示。可以看出,单独加入水蒸气,储存量由1.30 mmol·g-1下降到1.12 mmol·g-1,下降了13.84%。单独加入CO2,储存量由1.30 mmol·g-1下降到0.72 mmol·g-1,下降了44.62%。同时加入水蒸气和CO2, 储存量由1.30 mmol·g-1下降到0.60 mmol·g-1,下降了53.85%。通过对比发现,CO2对催化剂的影响比水蒸气更大。通入水蒸气和CO2后,NO到NO2的转化率也大幅下降。这是因为水蒸气主要影响NO到NO2的氧化,CO2不仅影响NO到NO2的氧化,同时还和NO2形成竞争吸附,因此造成NOx储存量的下降[15]。
| H2O, CO2 | NSC/(mmol·g-1) | NO to NO2 conversion/% |
| (a)/ | 1.30 | 29.86 |
| (b)+5%H2O | 1.12 | 26.79 |
| (c)+5%CO2 | 0.72 | 21.02 |
| (d)+5%H2O+5%CO2 | 0.60 | 18.56 |
通过浸渍法,制备了负载型非贵金属NSR催化剂,考察了不同锰的负载量对催化剂结构和活性的影响。结果发现,锰主要是以MnO2的形式存在,其次是Mn3O4,还有少量的Mn2O3。随着锰负载量的增加,催化剂比表面积降低,K2CO3逐渐由表相K2CO3向体相K2CO3转化。活性测试结果表明,该系列催化剂对NOx有很好的氧化还原性能,可以用来替代贵金属催化剂。随着锰负载量的增加,对NOx的还原效率逐渐增加。当锰的负载量太大时,储存能力反而下降。当Mn/Al2O3的质量比为0.10时,催化剂的储存量最大,对NOx的还原效率达到99%以上。水和CO2对NOx的储存量有较大的影响,其中CO2的影响比水的影响大。
| [1] |
杨新兴, 冯丽华, 尉鹏. 汽车尾气污染及其危害[J].
前沿科学, 2012, 6(3): 10–22.
Yang Xinxing, Feng Lihua, Wei Peng. Automobile exhaust pollution and its harm[J]. Frontier Science, 2012, 6(3): 10–22. |
| [2] | Matsumoto S. Catalytic reduction of nitrogen oxides in automotive exhaust containing excess oxygen by NOx storage-reduction catalyst[J]. Cattech, 2000, 4(2): 102–109. DOI: 10.1023/A:1011951415060 |
| [3] | Wögerbauer C, Maciejewski M, Baiker A. Structure sensitivity of NO reduction over iridium catalysts in HC-SCR[J]. Journal of Catalysis, 2002, 205(1): 157–167. DOI: 10.1006/jcat.2001.3437 |
| [4] | Forzatti P, Lietti L, Nova I. On board catalytic NOx control:Mechanistic aspects of the regeneration of lean NOx traps with H2[J]. Energy & Environmental Science, 2008, 1(2): 236–247. |
| [5] | Piacentini M, Maciejewski M, Baiker A. Supported Pt-Ba NOx storage-reduction catalysts:Influence of support and Ba loading on stability and storage efficiency of Ba-containing species[J]. Applied Catalysis B:Environmental, 2006, 66(1): 126–136. |
| [6] | Cao L, Ratts J L, Yezerets A, et al. Kinetic modeling of NOx storage/reduction on Pt/BaO/Al2O3 monolith catalysts[J]. Industrial & Engineering Chemistry Research, 2008, 47(23): 9006–9017. |
| [7] | Guo L, Xian H, Li Q, et al. NO adsorption behaviors of the MnOx catalysts in lean-burn atmospheres[J]. Journal of Hazardous Materials, 2013, 260(1): 543–551. |
| [8] | Wang W, McCool G, Kapur N, et al. Mixed-Phase oxide catalyst based on Mn-mullite (Sm, Gd) Mn2O5 for NO oxidation in diesel exhaust[J]. Science, 2012, 337(6096): 832–835. DOI: 10.1126/science.1225091 |
| [9] | Wu X, Liang Q, Weng D, et al. Synthesis of CeO2-MnOx mixed oxides and catalytic perfromance under oxygen-rich condition[J]. Catalysis Today, 2007, 126(3): 430–435. |
| [10] | Castoldi L, Lietti L, Nova I, et al. Alkaline-and alkaline-earth oxides based lean NOx traps:Effect of the storage component on the catalytic reactivity[J]. Chemical Engineering Journal, 2010, 161(3): 416–423. DOI: 10.1016/j.cej.2009.10.065 |
| [11] | Tang Q, Huang X, Wu C, et al. Structure and catalytic properties of K-doped manganese oxide supported on alumina[J]. Journal of Molecular Catalysis A:Chemical, 2009, 306(1): 48–53. |
| [12] | Li Q, Meng M, Xian H, et al. Hydrotalcite-Derived MnxMg3-x AlO catalysts used for soot combustion, NOx storage and simultaneous soot-NOx removal[J]. Environmental Science & Technology, 2010, 44(12): 4747–4752. |
| [13] | Zhang Y, Liu D, Meng M, et al. A highly active and stable non-platinic lean NOx trap catalyst MnOx-K2CO3/K2Ti8O17 with ultra-low NOx to N2O selectivity[J]. Industrial & Engineering Chemistry Research, 2014, 53(20): 8416–8425. |
| [14] | Kim C H, Qi G, Dahlberg K, et al. Strontium-Doped perovskites rival platinum catalysts for treating NOx in simulated diesel exhaust[J]. Science, 2010, 327(5973): 1624–1627. DOI: 10.1126/science.1184087 |
| [15] | Corbos E C, Duprez D, Courtois X, et al. Impact of support oxide and Ba loading on the NOx storage properties of Pt/Ba/support catalysts:CO2 and H2O effects[J]. Applied Catalysis B Environmental, 2007, 76(3/4): 357–367. |
 2018, Vol. 35
2018, Vol. 35





