近些年,随着石油资源的日渐减少,中国空气污染日趋严重,天然气作为清洁能源,在能源消费结构中的比重逐步增加[1]。但是我国天然气资源相对较少,根据我国的能源结构“贫油、少气、富煤”的特点,如果以煤作为原料,通过煤制甲烷化技术合成天然气,将会是解决我国清洁能源问题的有效途径;随着天然气设施逐渐完善,天然气工业将会迎来一个高速发展的时代,因此,合理利用天然气资源,已成为一个重要的能源战略问题。
在甲烷化反应中,Ni基催化剂以其活性高,选择性好和廉价易得的特点,成为当前被研究最多的工业化催化剂[2-4]。但Ni基催化剂也有其缺点,在反应过程中,催化剂容易形成积碳,并产生烧结现象,致使催化剂逐渐失活。为了提高催化剂性能,可以通过添加助剂的方法,提高其催化性能,并减少积碳的产生。La2O3作为助剂用于甲烷化催化剂有人曾报道过。罗来涛等[5]研究表明,La2O3的引入提高了Ni-Mo/γ-Al2O3催化剂在CO和CO2甲烷化反应中的活性,有利于Ni的分散,提高了催化剂活性表面积以及催化剂表面Ni原子的浓度,同时削弱了电子结合能,使其更多被还原。刘新华等[6]研究结果显示La2O3的加入抑制了镍铝尖晶石的形成,并在CO甲烷化反应过程中削弱了C—O键的结合力,提高了CO甲烷化活性。Yang等[7]研究表明,在甲烷二氧化碳重整反应中,La2O3的加入有效抑制了Ni的烧结,提高了催化剂的抗积碳性能。我们前期曾对Ni/ZrO2-Al2O3催化剂的甲烷化性能进行了系统的研究[8],结果显示出其催化活性和稳定性比Ni/Al2O3有明显提升,但其抗积碳能力不足,需要进一步提高。
本研究中以Ni为活性组分,ZrO2-Al2O3为载体,考察助剂La2O3的含量对CO甲烷化性能的影响,同时利用BET、XRD、TPR、TG-DTA等各种表征方法对甲烷化催化剂进行表征,并对催化剂进行稳定性测试,制备出活性及稳定性良好的甲烷化催化剂,从而为进行工业推广提供基础数据。
1 实验部分 1.1 La-Ni/ZrO2-Al2O3催化剂的制备ZrO2-Al2O3复合氧化物采用浸渍法制备:将一定量Zr(NO3)4·5H2O溶于定量的三蒸水中,搅拌0.5 h后,加入定量的γ-Al2O3(预先在600 ℃下焙烧4 h),搅拌2.0 h,室温陈化6.0 h,之后在120 ℃干燥14.0 h,干燥后的样品在550 ℃焙烧4.0 h,然后进行研磨,即得复合氧化物ZrO2-Al2O3。所制得复合氧化物记为ZA,其中ZrO2的质量分数为40%。
La-Ni/ZrO2-Al2O3催化剂采用共浸渍法制备:将Ni(NO3)3·6H2O和La(NO3)3·6H2O溶于三蒸水中,待其溶解后,加入上述制备的复合氧化物,并持续搅拌2.0 h,然后在室温下陈化6.0 h,在干燥箱中于120 ℃下真空干燥12.0 h,将干燥好的样品置于马弗炉中升温至650 ℃下焙烧4.0 h,所制得样品根据助剂含量记为xLa-Ni/ZA,其中x代表助剂La2O3的质量分数,NiO的质量分数为20%。对所制备的催化剂进行压片、破碎、筛分处理,得60~80目的颗粒,用于后续的反应活性测试及表征分析。
1.2 活性评价在内径为10 mm的不锈钢管固定床反应器中进行催化剂的活性和稳定性的评价。加热炉的温度采用精密温度自动控制仪控制,催化剂床层温度采用精密测温热电偶测量。催化剂装填量为1 mL,同时混合等体积的石英砂,使其均匀。将催化剂在50 mL/min H2中600 ℃常压下还原2.0 h,升温速率为10 ℃/min;催化剂还原完成后,在H2气氛下降至室温,然后切换至原料气,其中原料气比例V(H2):V(CO):V(N2)=3.0:1.0:1.4,原料气流量由质量流量计调节,反应器内空速为10 000 h-1,温度为300~650 ℃,压力为1.5 MPa(表压)。反应尾气通过除水装置后,进入气相色谱中SP-6890进行在线分析,TCD检测。
1.3 表征采用NOVA2000型全自动比表面积及孔径分析仪进行比表面积、孔容及平均孔径的测定与分析。采用静态法进行测定,吸附质为高纯氮气。将催化剂样品在300 ℃真空脱气4.0 h,然后在液氮温度(77.4 K)下,得到样品的吸附脱附等温曲线。根据相对压力为0.05~0.25之间的等温曲线的吸附支,利用BET方程计算比表面积;利用等温吸附脱附曲线的脱附支,采用BJH方法计算孔容及孔径分布。
XRD测定在D/MAX-2500 X射线衍射仪上进行。在室温条件下,采用Cu_Kα辐射源,电压为40 kV,电流为40 mA,扫描范围为20°~80°,扫描速度为5(°)/min。NiO或Ni物种的平均晶粒尺寸通过谢乐方程(1)计算[9]。
| $ d = \frac{{0.89\lambda }}{{\beta {\rm{cos}}\theta }} \times \frac{{180}}{{\rm{ \mathsf{ π} }}} $ | (1) |
分散度与平均晶粒尺寸关系为:
| $ D = 1/d $ | (2) |
H2-TPR在AutoChem2910型程序升温仪上进行。室温下将100 mg样品用He气吹扫30 min;然后以10(°)/min升温到200 ℃,保持30 min,除去样品中的水分及其他杂质;再通入He吹扫下冷却至30 ℃,切换为30 mL/min体积分数为10%的H2/Ar混合气,待信号稳定后从30 ℃以10 ℃/min的速度将催化剂升温至850 ℃,氢气消耗量通过TCD检测器进行检测。
催化剂的热重分析在Pyris Diamond型TG分析仪进行。将6 mg左右催化剂装入反应器中,样品在空气气氛下以10 ℃/min的速率从35 ℃升温至850 ℃,在此过程中,记录催化剂质量的变化。
2 结果与讨论 2.1 La2O3含量对活性的影响催化剂Ni/ZA和不同La2O3含量的催化剂La-Ni/ZA在不同反应温度下的催化活性见表 1。
| Catalysts | Reaction temperature/ ℃ |
CO conversion/ % |
CH4selectivity/ % |
CH4 yield/ % |
| Ni/ZA | 300 | 98.3 | 89.2 | 87.7 |
| 350 | 99.7 | 99.5 | 99.2 | |
| 450 | 99.6 | 98.7 | 98.3 | |
| 550 | 98.5 | 95.8 | 92.9 | |
| 650 | 92.7 | 87.9 | 81.5 | |
| 2La-Ni/ZA | 300 | 99.8 | 99.6 | 99.4 |
| 350 | 99.7 | 99.7 | 99.4 | |
| 450 | 99.5 | 99.5 | 99.0 | |
| 550 | 98.3 | 95.9 | 94.3 | |
| 650 | 92.8 | 92.3 | 85.7 | |
| 4La-Ni/ZA | 300 | 99.8 | 99.5 | 99.3 |
| 350 | 99.8 | 99.7 | 99.5 | |
| 450 | 99.6 | 99.5 | 99.1 | |
| 550 | 98.2 | 96.3 | 94.6 | |
| 650 | 92.3 | 91.9 | 84.8 | |
| 6La-Ni/ZA | 300 | 99.7 | 99.6 | 99.3 |
| 350 | 99.6 | 99.6 | 99.2 | |
| 450 | 99.7 | 99.4 | 99.1 | |
| 550 | 98.1 | 96.0 | 94.2 | |
| 650 | 92.6 | 92.1 | 85.3 | |
| 8La-Ni/ZA | 300 | 96.8 | 86.1 | 83.3 |
| 350 | 99.5 | 99.7 | 99.2 | |
| 450 | 99.4 | 99.5 | 98.9 | |
| 550 | 98.3 | 93.7 | 92.1 | |
| 650 | 92.8 | 90.2 | 83.7 | |
| Reaction conditions: P=1.5 MPa, GHSV=10 000 h-1, H2/CO=3. | ||||
由表 1看出,所有催化剂的CO转化率和CH4收率在300到350 ℃范围内是增加,在350到450 ℃温度区间保持稳定,在450到650 ℃随温度升高而减小。2La-Ni/ZA、4La-Ni/ZA和6La-Ni/ZA催化剂相对于Ni/ZA和8La-Ni/ZA催化剂在300~350 ℃和500~650 ℃温度区间表现出更高的CO转化率和CH4收率,说明少量La2O3的加入可以提高Ni/ZA催化剂的催化性能,尤其在低温和高温区间。
表 1数据表明各催化剂的CH4选择性随温度的升高先增大后减小,在350到450 ℃之间达到最高。当温度为450 ℃时,在尾气中会检测到CO2存在,随着温度的继续增加,CO2的量逐渐变多。这可能是CO甲烷化反应产生的水蒸气和原料中的CO发生了水汽变换反应:CO+H2O→CO2+H2,而且高温有利于水汽变换反应的进行,因此,随着温度的升高,CO2的量会增大,从而导致CH4的选择性随着温度的进一步升高反而降低。因此选择一个合适的温度,对于提高甲烷化催化剂的催化活性也是至关重要的。
2.2 催化剂稳定性测试催化剂的稳定性是其性能的一个重要因素,关系到工业生产的应用。甲烷化过程的催化剂不仅要具有良好的催化活性,同时也要表现出优良的长期稳定性及抗积碳性能[10-11]。因此,我们对2种催化剂4La-Ni/ZA及Ni/ZA进行了稳定性考察,结果见图 1。
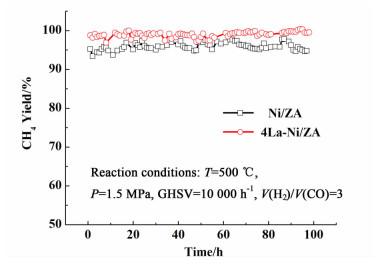
|
| 图 1 催化剂稳定性测试结果 Figure 1 Stability results of Ni/ZA and 4La-Ni/ZA catalysts for 100 h |
| |
由图 1可以看出,在100 h反应过程中,催化剂4La-Ni/ZA的收率一直维持在几乎100%,而催化剂Ni/ZA的收率也没有明显的减少,在96%左右。因此,两种催化剂都有比较好的稳定性,但4La-Ni/ZA收率更高,其原因为La2O3的引入改善了活性组分的分散度,提高了催化剂反应活性。
2.3 催化剂的结构表征 2.3.1 BET结果分析表 2为不同La2O3含量La-Ni/ZA催化剂的物理结构特性。
| Samples | Surface Area/ (m2·g-1) |
Pore Volume/ (cm3·g-1) |
BJH Pore Size/ nm |
d(NiO)a/ nm |
NiO dispersionb/ % |
| Ni/ZA | 86.1 | 0.22 | 9.7 | 19.2 | 5.2 |
| 2La-Ni/ZA | 97.8 | 0.21 | 9.7 | 16.6 | 6.0 |
| 4La-Ni/ZA | 98.1 | 0.20 | 9.7 | 15.5 | 6.5 |
| 6La-Ni/ZA | 86.8 | 0.18 | 11.4 | 13.8 | 7.2 |
| 8La-Ni/ZA | 83.0 | 0.18 | 11.4 | 11.9 | 8.4 |
| 注:a由公式(1)计算;b由公式(2)计算。 | |||||
由表 2看出,当加入少量La2O3时,催化剂的比表面积是增加的;当La2O3的添加量进一步增加时,催化剂的比表面积减小。孔容随着La2O3含量的增加而逐渐减小,说明在催化剂制备过程中,部分活性物种进入到复合载体ZrO2-Al2O3孔道中所致。催化剂La-Ni/ZA的平均孔径为9.7~11.4 nm,均具有介孔结构。结合活性数据,说明比表面积、孔容的变化并不是影响催化活性的主要因素[12]。
2.3.2 XRD结果分析图 2是Ni/ZA和不同La2O3含量xLa-Ni/ZA催化剂焙烧后的XRD谱图。
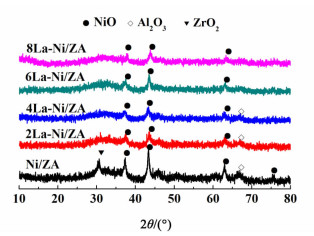
|
| 图 2 不同La2O3含量催化剂的XRD图 Figure 2 XRD profiles of the catalysts with different La2O3 contents |
| |
从图 2中可以看出,La-Ni/ZA催化剂中没有出现La2O3及其它含La的化合物的特征峰,可能的原因是La2O3含量低,或者是La2O3高度分散在催化剂表面[13]。在Ni/ZA催化剂中,除了Al2O3(2θ=67.1°)和NiO(2θ=37.1°, 43.2°, 62.8°, 75.4°)的衍射峰,还出现了四方相ZrO2的衍射峰,其由30.1°转变为30.7°,可能是Al3+离子进入到ZrO2导致ZrO2的晶格收缩,因为Zr4+的半径(0.084 nm)大于Al3+离子的半径(0.054 nm)。与Ni/ZA催化剂相比较,La-Ni/ZA催化剂中NiO衍射特征峰强度明显减弱;同时,四方相ZrO2的衍射峰消失。Sun等[14]曾报导过La2O3加入到ZrO2载体中能够阻止ZrO2的晶化和ZrO2晶粒生长。根据谢乐公式计算得到的NiO平均晶粒尺寸及分散度结果列于表 2中。Ni/ZA催化剂中NiO平均晶粒尺寸为19.2 nm。
2La-Ni/ZA、4La-Ni/ZA、6La-Ni/ZA、8La-Ni/ZA催化剂中NiO晶粒尺寸分别为16.6、15.5、13.8和11.9 nm。可以看出,随着La2O3的加入,NiO平均晶粒尺寸逐渐减小,NiO分散度逐渐提高。在Wu等[8]研究中发现,NiO分散度的提高有利于提高催化剂还原后Ni的分散度。而Ni基催化剂的催化活性依赖于金属Ni的晶粒尺寸,Ni晶粒尺寸越小,其分散度越高,其反应活性越好[15]。
图 3为还原后催化剂和经过100 h连续测试后催化剂的XRD图。

|
| 图 3 催化剂的XRD Figure 3 XRD patterns |
| |
由图 3可见,在44.5°和51.8°出现的衍射峰为金属Ni的特征峰。根据谢乐公式计算,将催化剂的Ni晶粒尺寸列在表 3。还原后的4La-Ni/ZA催化剂的Ni晶粒尺寸明显小于Ni/ZA催化剂的,说明其Ni分散度比较好;经过100 h稳定性测试后,Ni晶粒尺寸相对于还原后的催化剂都有所增大,4La-Ni/ZA增加6.5%,而Ni/ZA增加15.6%,说明适量La2O3的加入能抑制Ni晶粒烧结和聚集,能够维持反应稳定性。
| Catalysts | Total carbon deposition/ % |
Deactivating carbon/ % |
Fresh Ni crystallite size a/nm | Spent Ni crystallite size a/nm |
| Ni/ZA | 10.0 | 9.2 | 14.1 | 16.3 |
| 4La-Ni/ZA | 0.7 | 0.7 | 12.3 | 13.1 |
| 注:a由公式(1)计算。 | ||||
La2O3的加入提高了催化剂中NiO的分散度,同时,增强了NiO与载体之间的作用力,从而在高温反应中阻止Ni晶粒的烧结。
2.3.3 TPR结果分析图 4是Ni/ZA催化剂和La-Ni/ZA催化剂的TPR谱图。根据文献[16-18]报道,在Ni基催化剂中,NiO物种可以分为3种类型:α型NiO物种可以在低温下还原,属于游离态NiO;β型NiO物种与载体有较强的结合力,还原温度在450~740 ℃之间;γ型NiO物种属于NiAl2O4(镍铝尖晶石),高温才会发生还原。在所有结果中,TPR图形中都含有2个还原峰,它们分别对应于不同类型的活性物种。对于Ni/ZA催化剂,1个还原峰出现在400 ℃左右,应为α型NiO物种的还原;另1个还原峰出现在500~800 ℃之间,可归属于β型NiO物种和γ型NiO物种的还原,并以β型NiO物种的还原为主。对于La-Ni/ZA催化剂,2个还原峰均向高温方向偏移,说明加入助剂La2O3有助于提高活性组分和载体之间的相互作用。根据文献[18]报导,加强活性组分和载体间的相互作用有助于抑制活性组分的迁移和聚集,有利于改进催化剂的稳定性和抗烧结性能。
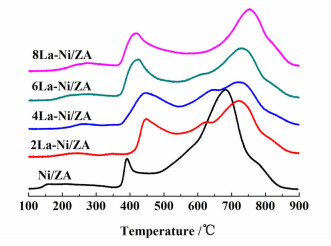
|
| 图 4 不同La含量催化剂的TPR图 Figure 4 TPR profiles of the catalysts with different La2O3 contents |
| |
采用TG技术对经过稳定性测试的4La-Ni/ZA及Ni/ZA催化剂的积碳行为进行研究,测试气氛为空气,结果见图 5所示。
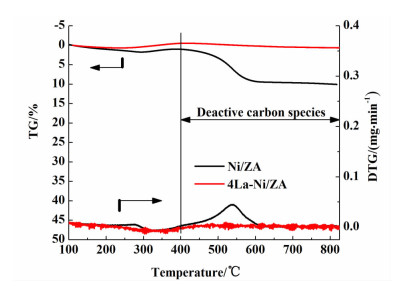
|
| 图 5 稳定性后催化剂的TG-DTG图 Figure 5 TG-DTG profiles of the spent catalysts |
| |
在110 ℃以下发生的失重损失被认为是催化剂中水分所致,因此积碳造成的损失从110 ℃以上开始计算。催化剂失重是由多种积碳造成的,依据失量的温度,将Ni基催化剂中的积碳分为2种[18-20]:在110~400 ℃的积碳相对活跃,容易消除掉,使催化剂维持其原有的催化活性;在400~800 ℃的积碳为惰性积碳,不易被清除,其覆盖在催化剂活性位点上积累到一定程度,致使催化剂失活。从图 5及表 3中可以看出,Ni/ZA催化剂的总积碳量为10%,而且主要积碳是在400 ℃以后,其长期运行易导致催化剂失活;而4La-Ni/ZA催化剂的总积碳量仅为0.7%,说明La2O3的加入能够有效抑制积碳的生成。Yang等[7]在CO2重整CH4的反应中发现,La2O3的加入,降低了载体的酸性,同时加快了消碳反应的进行,从而抑制了催化剂的积碳。
3 结论通过考察La2O3含量对La-Ni/ZrO2-Al2O3催化剂甲烷化性能影响,得到以下结论。
1) 在催化剂中引入少量的La2O3,可以提升催化剂的甲烷化催化活性,特别是在300~350 ℃和500~650 ℃温度区间,La-Ni/ZrO2-Al2O3表现出更高的CO转化率和CH4收率。
2) 对催化剂4La-Ni/ZrO2-Al2O3和Ni/ZrO2-Al2O3连续100 h的稳定性考察,结果表明适量La2O3的引入不仅提升催化剂的甲烷化活性,同时还大大抑制了催化剂积碳的形成,表现出了很好的长期稳定性。
3) 在Ni/ZrO2-Al2O3中引入适量La2O3,改善了活性组分的分散度,适当增强了活性组分和载体之间的相互作用力,明显提高催化剂的抗积碳和抗烧结性能。
| [1] |
刘延伟. 煤基新能源及其石化产品发展分析[J].
化学工业, 2008, 26(5): 9–13.
Liu Yanwei. Coal-Based new energy resource and its petrochemical products development[J]. Chemical Industry, 2008, 26(5): 9–13. |
| [2] | Mok Y S, Kang H C, Lee H J, et al. Effect of nonthermal plasma on the methanation of carbon monoxide over nickel catalyst[J]. Plasma Chemistry and Plasma Processing, 2010, 30(4): 437–447. DOI: 10.1007/s11090-010-9231-x |
| [3] | Sehested J, Dahl S, Jacobsen J, et al. Methanation of CO over nickel:Mechanism and kinetics at high H2/CO ratios[J]. The Journal of Physical Chemistry B, 2005, 109(6): 2432–2438. DOI: 10.1021/jp040239s |
| [4] | Shalabi M A, Zaidi S A, Ai-Salen M A. Effect of reduction conditions on the activity of Ni/γ-Al2O3 catalyst for methanation reaction[J]. Chemical Engineering Communications, 1997, 157(1): 23–33. DOI: 10.1080/00986449708936680 |
| [5] |
罗来涛, 王敏炜, 李凤仪, 等. La2O3对Ni-Mo/γ-Al2O3催化剂CO和CO2甲烷化的影响[J].
中国稀土学报, 1999, 17(2): 120–124.
Luo Laitao, Wang Minwei, Li Fengyi, et al. Effect of La2O3 on Methanation of CO and CO2 over Ni-Mo/γ-Al2O3 Catalyst[J]. Journal Of The Chinese Rare Earth Society, 1999, 17(2): 120–124. |
| [6] |
刘新华, 苗茵, 李晓丽, 等. La2O3对Ni/γ-Al2O3甲烷化催化剂的助催化作用[J].
物理化学学报, 1995, 11(8): 746–750.
Liu Xinhua, Miao Yin, Li Xiaoli. Promoting effect of La2O3 methanation catalyst[J]. ACTA Physico chimica sinica, 1995, 11(8): 746–750. |
| [7] | Yang R, Xing C, Lv C, et al. Promotional effect of La2O3 and CeO2 on Ni/γ-Al2O3 catalysts for CO2 reforming of CH4[J]. Applied Catalysis A:General, 2010, 385(1): 92–100. |
| [8] | Guo C, Wu Y, Qin H, et al. CO methanation over ZrO2/Al2O3 supported Ni catalysts:A comprehensive study[J]. Fuel Processing Technology, 2014, 124: 61–69. DOI: 10.1016/j.fuproc.2014.02.017 |
| [9] | Wei J, Iglesia E. Isotopic and kinetic assessment of the mechanism of reactions of CH4 with CO2 or H2O to form synthesis gas and carbon on nickel catalysts[J]. Journal of Catalysis, 2004, 224(2): 370–383. DOI: 10.1016/j.jcat.2004.02.032 |
| [10] | Hwang S, Lee J, Hong U G, et al. Hydrogenation of carbon monoxide to methane over mesoporous nickel-M-alumina (M=Fe, Ni, Co, Ce, and La) xerogel catalysts[J]. Journal of Industrial and Engineering Chemistry, 2012, 18(1): 243–248. DOI: 10.1016/j.jiec.2011.11.026 |
| [11] | Derekaya F B, Yaşar G. The CO methanation over NaY-zeolite supported Ni/Co3O4, Ni/ZrO2, Co3O4/ZrO2 and Ni/Co3O4/ZrO2 catalysts[J]. Catalysis Communications, 2011, 13(1): 73–77. DOI: 10.1016/j.catcom.2011.06.024 |
| [12] | Guo J, Lou H, Zhao H, et al. Dry reforming of methane over nickel catalysts supported on magnesium aluminate spinels[J]. Applied Catalysis A:General, 2004, 273(1): 75–82. |
| [13] | Martınez R, Romero E, Guimon C, et al. CO2 reforming of methane over coprecipitated Ni-Al catalysts modified with lanthanum[J]. Applied Catalysis A:General, 2004, 274(1): 139–149. |
| [14] | Sun H, Ding Y, Duan J, et al. Transesterification of sunflower oil to biodiesel on ZrO2 supported La2O3 catalyst[J]. Bioresource Technology, 2010, 101(3): 953–958. DOI: 10.1016/j.biortech.2009.08.089 |
| [15] | Zhang J, Xin Z, Meng X, et al. Effect of MoO3 on the heat resistant performances of nickel based MCM-41 methanation catalysts[J]. Fuel, 2014, 116: 25–33. DOI: 10.1016/j.fuel.2013.07.102 |
| [16] | Zhao A, Ying W, Zhang H, et al. Ni-Al2O3 catalysts prepared by solution combustion method for syngas methanation[J]. Catalysis Communications, 2012, 17: 34–38. DOI: 10.1016/j.catcom.2011.10.010 |
| [17] | Hu D, Gao J, Ping Y, et al. Enhanced investigation of CO methanation over Ni/Al2O3 catalysts for synthetic natural gas production[J]. Industrial & Engineering Chemistry Research, 2012, 51(13): 4875–4886. |
| [18] | Zou X, Wang X, Li L, et al. Development of highly effective supported nickel catalysts for pre-reforming of liquefied petroleum gas under low steam to carbon molar ratios[J]. International Journal of Hydrogen Energy, 2010, 35(22): 12191–12200. DOI: 10.1016/j.ijhydene.2010.08.080 |
| [19] | Bradford M C J, Vannice M A. Catalytic reforming of methane with carbon dioxide over nickel catalysts Ⅰ. Catalyst characterization and activity[J]. Applied Catalysis A:General, 1996, 142(1): 73–96. DOI: 10.1016/0926-860X(96)00065-8 |
| [20] | Wang S, Lu G. A comprehensive study on carbon dioxide reforming of methane over Ni/γ-Al2O3 catalysts[J]. Industrial & Engineering Chemistry Research, 1999, 38(7): 2615–2625. |
 2018, Vol. 35
2018, Vol. 35





