随着石油资源日益枯竭,乙醇作为一种新型可替代能源,有望显著缓解对石油资源依赖度日益加深的现状,正在受到广泛的关注。基于我国的能源结构,大力开发合成气制乙醇工业对提高我国能源安全、实现能源多元化目标具有重大战略意义。其中,由合成气经二甲醚(DME)羰基化制乙酸甲酯(MA)再加氢得到乙醇的工艺路线具有反应条件温和、原子利用率高、环境友好等优点,表现出良好的工业化应用前景[1-2]。乙酸甲酯加氢制乙醇是上述工艺路线的核心反应之一,高性能加氢催化剂是该反应研究的难点。
Cu/ZnO催化剂由于表现出优异的催化性能,在乙酸甲酯加氢反应体系中得到一定的研究。但ZnO对于乙酸甲酯加氢反应的作用机理尚无报道。Kim等[3]对丁酸丁酯加氢Cu/ZnO/Al2O3催化剂进行动力学研究探讨ZnO的作用,发现在Cu/Al2O3催化剂中加入ZnO不仅提高了铜物种的分散度,还降低了反应的本征活化能,说明Cu和ZnO都是Cu/ZnO催化剂的重要活性组分。Liao等[4]发现在CO2加氢合成甲醇反应体系中,ZnO的极化率强烈影响Cu-ZnO相互作用,较强的Cu-ZnO相互作用有利于提高甲醇的选择性。Lei等[5]发现Cu-ZnO相互作用与甲醇合成速率密切相关,显著提高Cu-ZnO相互作用有助于提高催化剂的催化活性。Narayanan等[6]发现催化活性不仅与催化剂的化学组成和活性组分的粒径相关,还与催化剂表面活性物种的种类密切相关。因此,研究Cu-ZnO表界面结构与酯类加氢活性的构效关系对于今后催化剂的理性设计具有重要意义。
本研究采用水热法制备不同极化率的ZnO载体,然后采用浸渍法制备Cu/ZnO模型催化剂,并对其进行了表征,深入研究了ZnO不同晶面结构对催化剂物理化学性质以及催化活性的影响规律。
1 实验部分 1.1 催化剂样品制备ZnO载体参照Li等[7]报道的水热法合成。称取18.0 g乙酸锌溶于144 mL去离子水中。接着在上述溶液中加入11.52 g六次甲基四胺,25 ℃水浴下磁子搅拌10 min至完全溶解,将得到的溶液转移至200 mL晶化釜中,97 ℃晶化一定时间。取出晶化釜待其缓慢降至室温,过滤得到白色样品,用去离子水和无水乙醇反复洗涤除去多余的前驱体。将得到的白色样品60 ℃干燥12 h,空气气氛400 ℃焙烧2 h,即得到水热法制备的ZnO载体,记作ZnO-T,其中T代表晶化时间,h。
称取0.6336 g Cu(NO3)2·3H2O于5 mL去离子水中搅拌至溶解,然后称取1.5 g ZnO载体加入至上述硝酸铜溶液中搅拌均匀。逐滴加入氨水至pH值为6,110 ℃下干燥12 h,空气气氛下400 ℃焙烧4 h,即可得到浸渍法制备的Cu/ZnO催化剂,记作10Cu/ZnO-T,其中10代表铜的负载量,质量百分数。
1.2 催化剂活性评价Cu/ZnO催化剂活性评价实验在微型固定床反应器中进行。称取0.55 g催化剂(40~60目),装入不锈钢反应管的恒温区内,将热电偶插入催化剂床层中心检测反应温度。在评价之前,催化剂在纯氢气氛下由室温升至300 ℃保持4 h活化,然后降至反应温度230 ℃。液相乙酸甲酯由高压泵(Lab Alliance Series Ⅱ)打入气化室中气化,再由氢气带入反应器中。反应在氢酯比为80、2.0 MPa下进行,反应产物经过冷阱液化,利用安捷伦6820气相色谱仪取样分析。气相色谱仪配备HP-INNOWAX毛细色谱柱用于分离反应产物,氢火焰检测器(FID)检测。
1.3 催化剂表征采用美国Micromeritics公司的Tristar 3000物理吸附仪表征催化剂的比表面积和孔道结构。比表面积采用Brunauer-Emmet-Teller (BET)方法进行计算,平均孔径采用Barrett-Joyner-Halenda (BJH)方法计算得到。催化剂中的铜含量由美国瓦里安公司的Vista-MPX型电感耦合等离子体发射光谱仪测定。采用日本理学公司的Rigaku C/Max-2500型X射线衍射仪测试催化剂的体相性质,仪器采用Cu_Kα(λ=0.154 nm)特征衍射辐射。ZnO载体的形貌和微观结构由日本日立公司的Hitachi S-4800型场发射扫描电子显微镜进行表征分析。采用美国Micromeritics公司的Autochem Ⅱ 2920全自动程序升温化学吸附仪,对催化剂样品进行程序升温还原分析,用N2O滴定法测定还原后催化剂的铜比表面积。还原后催化剂表面活性组分的存在形式由美国PE公司的PHI-1600型光电子能谱仪分析表征,激发光源为Al_Kα (hυ=1486.6 eV),功率为300 W。
2 结果与讨论图 1是ZnO载体的XRD图。

|
| 图 1 ZnO载体的XRD图 Figure 1 XRD patterns of parent ZnO |
| |
由图 1可以看出所有ZnO载体均高度结晶化,并且XRD谱图的衍射峰都对应于六方纤维锌矿结构的ZnO,除此之外并没有检测到其他衍射峰出现,说明采用本制备方法可以获得纯净的ZnO载体。然而,不同ZnO载体中(002)极性晶面与(100)非极性晶面的衍射峰强度的比值却具有明显的差异,目前文献报道中将I(002)/I(100)定义为极化率。标准纤维锌矿的极化率为0.73,当所制备的ZnO载体的极化率高于0.73时,表明具有较高的极化率,即暴露出更多的极性晶面。随着晶化时间延长,ZnO载体的极化率发生显著变化,极化率先增加后降低,在晶化时间为8 h时达到最大,极化率为1.65。其中,ZnO-4h和ZnO-12h的极化率大体相同,分别为1.08和1.02。
为了直观地探讨ZnO极化率与形貌之间的关系,对ZnO载体进行了SEM表征。图 2是不同晶化时间ZnO载体的扫描电镜图,可以看出ZnO载体最初呈六方板状结构,随着晶化时间的延长,板状结构逐渐被破坏。通过查阅文献发现,水热法制备ZnO载体的过程中,离子浓度可以显著影响ZnO的形貌,合成ZnO载体是一个成核与晶体生长相互竞争的过程[8]。XRD表征结果表明晶化时间小于8 h时,ZnO极化率随着晶化时间的延长而提高,当晶化时间高于8 h时,ZnO极化率随着晶化时间的延长而下降。这是由于在本合成条件下,较高浓度的醋酸根离子会替代ZnO(0001)面上的羟基,从而极大程度上限制ZnO在<0001>方向生长,随着晶化时间的延长而生长成具有较高极化率的六方平板状结构[9]。但是由于平板状ZnO在(0001)面上暴露的O2-可以与溶液中的NH+作用,所以过长的晶化时间会破坏原有的六方平板状结构,导致极化率降低[10]。

|
| 图 2 SEM电镜图 Figure 2 SEM images |
| |
从上面ZnO载体中挑选极化率具有显著差异的载体进行下一步研究,采用浸渍法制备10Cu/ZnO模型催化剂。图 3为还原后10Cu/ZnO催化剂的XRD图。

|
| 图 3 还原后10Cu/ZnO催化剂的XRD图 Figure 3 XRD patterns of the reduced 10Cu/ZnO catalysts |
| |
由图 3可以看出所有10Cu/ZnO催化剂均高度结晶化,并且ZnO的衍射峰均对应于六方纤维锌矿结构。与最初的ZnO载体相比,负载并还原之后的10Cu/ZnO催化剂的极化率发生了一定变化,但依旧可以保持较为明显的差异。其中,10Cu/ZnO-8h催化剂的极化率达到最大为0.95,10Cu/ZnO-24h催化剂的极化率最小为0.64。通过观察铜的衍射峰可以发现,10Cu/ZnO催化剂中铜的衍射峰均发生了明显的偏移,说明铜的晶格参数发生改变,即催化剂中的铜存在一定程度的合金化现象。
还原后10Cu/ZnO催化剂中铜的粒径尺寸采用Scherrer公式计算,如公式(1):
| $d = \frac{{k\lambda }}{{{\beta _{{\rm{hkl}}}}{\rm{cos}}\theta }}$ | (1) |
其中,k代表形状因子,取0.89;λ为X-射线波长(λ=0.154 nm);βhkl为校正后的衍射峰半峰宽,粒径尺寸d,单位为0.1 nm。
采用Bragg方程计算还原后10Cu/ZnO催化剂中铜的晶格间距,计算如公式(2):
| $n\lambda = 2d{\rm{sin}}\theta $ | (2) |
对于Cu(111)晶面来说,Cu的晶格参数与晶面间距存在如公式(3)关系:
| $a = \sqrt 3 d$ | (3) |
计算结果列于表 1中。
| Sample | Cu loading/ %a | SBET/
(m2·g-1) | Vp/
(cm3·g-1) | Dp/
nm | dCub/
nm | aCuc/
nm |
| 10Cu/ZnO-8h | 9.6 | 3.7 | 0.032 | 33.7 | 29.3 | 0.367 |
| 10Cu/ZnO-12h | 9.7 | 4.6 | 0.040 | 34.0 | 28.1 | 0.366 |
| 10Cu/ZnO-24h | 9.5 | 4.8 | 0.041 | 34.2 | 25.0 | 0.366 |
| aDetermined by ICP-OES. | ||||||
| b Calculated from the XRD data by the Scherrer equation. | ||||||
| c Calculated from the XRD data by the Bragg’s law. | ||||||
从表 1中可以看出,采用该制备方法所合成的10Cu/ZnO催化剂中,铜的晶粒尺寸相近,分散状态大体相同。Cu(111)的晶格常数为0.365 nm,从表 1中可以发现,各催化剂中铜的晶格常数相近且明显高于0.365 nm,说明各催化剂均存在合金化现象且合金化程度相近[11]。
为了探索不同ZnO晶面结构对10Cu/ZnO催化剂的物理结构的影响,对不同10Cu/ZnO催化剂进行了N2物理吸脱附表征,表征结果列于表 1中。从表 1可以看出,催化剂的比表面积、孔容、孔径等物理结构并没有随着极化率的不同而发生太大的变化,并且各催化剂中铜的分散状态以及合金化程度也大体相同,这为进一步探讨ZnO不同晶面结构与催化活性之间的构效关系提供了便利。
图 4给出了还原后10Cu/ZnO催化剂的XPS谱图。由Cu 2p谱图可以看出,还原后的催化剂均有2个特征峰,分别位于932.0 eV和951.8 eV处,归结为Cu 2p3/2和Cu 2p1/2的特征峰。同时可以看出,在942~944 eV间并没有出现Cu2+的特征峰,说明在当前还原条件下所有催化剂中的Cu2+均被完全还原成Cu0或者Cu+物种[12]。此外,由Zn 2p谱图可以看出,Zn 2p3/2的特征峰在1 022.0 eV处,与文献[13]报道的ZnO的结合能(1 021.6~1 022.0 eV)非常接近,且Zn 2p谱图中的2个特征峰均高度对称,证明还原后催化剂表面的锌物种主要以ZnO的形式存在。由O 1s谱图可以发现,O 1s能谱峰并不对称且在高结合能处存在肩峰。对其进行分峰拟合处理,处在低结合能处530.2 eV的峰(记为OLBE)归属为纤维锌矿中围绕在Zn2+周围呈满配位的O2-,处在高结合能处532.0 eV的峰(记为OHBE)归属为ZnO载体中氧缺陷结构里的O2-物种[14]。

|
| 图 4 10 Cu/ZnO催化剂还原后的XPS谱图 Figure 4 XPS spectra of the reduced 10Cu/ZnO catalysts |
| |
计算结果列于表 2中。
| Sample | Polarity ratio | SCua/
(m2·g-1) | OLBE/
% | OHBE/
% | LT-peak/
% | HT-peak/
% |
| 10Cu/ZnO-8h | 0.95 | 1.4 | 43 | 57 | 78 | 22 |
| 10Cu/ZnO-12h | 0.84 | 2.2 | 50 | 50 | 70 | 30 |
| 10Cu/ZnO-24h | 0.64 | 2.6 | 54 | 46 | 46 | 54 |
| a Determined by N2O titration. | ||||||
从表 2可以看出,10Cu/ZnO催化剂中OLBE和OHBE的比例各不相同。随着极化率降低,OHBE的比例随之降低,OLBE的比例逐渐升高。计算结果表明,ZnOx氧缺陷结构随着极化率升高而增多,相比于ZnO非极性晶面,ZnO极性晶面上暴露出更多的ZnOx氧缺陷结构。
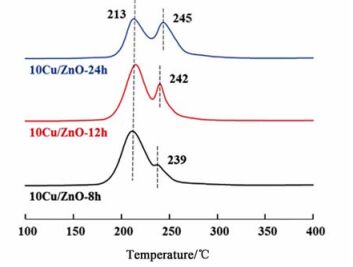
图 5给出了10Cu/ZnO催化剂的TPR曲线。
|
| 图 5 10Cu/ZnO催化剂的TPR曲线 Figure 5 H2-TPR profiles of 10Cu/ZnO samples |
| |
从图 5可以看出,所有样品的TPR曲线各不相同,说明ZnO载体的极化率影响到了铜物种的还原性质。每个催化剂都出现了2个明显的还原峰,它们分别在213(记为LT)和242 ℃左右(记为HT)处,表明每个催化剂表面上都存在2种铜物种。通常认为大颗粒CuO的还原温度为340 ℃[15],而各催化剂中CuO的还原温度都低于340 ℃,说明ZnO可以提高CuO的分散并促进CuO的转化,这可能是由于Cu与ZnO之间的强相互作用减弱了原来的Cu—O键,使得一部分铜在还原的过程中形成Cu-ZnOx结构。
根据文献[5]和[16]报道,213 ℃左右的低温还原峰归属为与ZnO紧密作用的CuO,这部分CuO在还原的过程中逐渐形成强相互作用的Cu-ZnOx结构。242 ℃左右的高温还原峰归属为与ZnO作用较弱的CuO,还原后主要转化为Cu0。通过对TPR曲线进行分峰拟合,拟合结果列于表 2。从表 2可以看出,随着极化率的降低,极性晶面比例下降,导致ZnOx氧缺陷结构逐渐减少。TPR表征结果表明低温还原峰所占比例也随着极化率的降低而降低,进一步说明ZnO载体中的极性晶面会暴露出更多的ZnOx氧缺陷结构。这些缺陷位可以与铜产生强相互作用形成Cu-ZnOx结构。采用N2O滴定法测定还原后催化剂的铜比表面积,滴定结果列于表 2中。从表 2中可以发现,随着极化率降低,铜比表面积逐渐增大,与前文的XRD数据相吻合。
为了探讨极化率对催化活性的影响,研究不同ZnO晶面结构与催化活性之间的构效关系,对10Cu/ZnO催化剂进行活性评价,评价结果列于表 3中。
| Sample | Polarity ratio | MA conversion/ % | Ethanol selectivity/ % | STYEthanol/
(g·kg-1·h-1) |
| 10Cu/ZnO-8h | 0.95 | 11 | 40 | 55 |
| 10Cu/ZnO-12h | 0.84 | 15 | 55 | 103 |
| 10Cu/ZnO-24h | 0.64 | 10 | 39 | 49 |
| Reaction conditions: temperature=503 K, pressure=2.0 MPa, n(H2)/n(MA)=80, WHSV=2 h-1. | ||||
从表 3可以看出,随着极化率逐渐下降,催化活性先升高后降低,在极化率为0.84时催化活性达到最佳,在230 ℃、2.0 MPa、氢酯比为80的反应条件下,转化率达到15%。而极化率为0.64和0.95时,10Cu/ZnO催化剂的转化率分别为10%和11%。相比于文献报道的Cu/ZnO体系催化剂,以上3个模型催化剂的转化率较低,这是由于它们的比表面积极低且铜的负载量较小,同时铜的分散状态也较差。而高性能的铜基催化剂需要大幅度提高催化剂的分散度,但是在要求活性组分高分散的前提下,难以实现具有不同极化率特征载体的定向合成。本研究能够为高性能铜基催化剂的设计与制备提供理论基础。
对于铜基催化剂,我们前期研究发现,还原后催化剂表面铜物种的价态分布与催化活性密切相关[17-19],Cu+物种有利于吸附活化甲氧基和酰基,而Cu0物种则有利于解离H2,二者共同作用促进乙酸甲酯加氢反应的进行[18, 20]。对于Cu/ZnO催化剂,目前已有文献报道Cu-ZnO相互作用有利于Cu+的形成[21-22]。随着ZnO载体极化率减小,即极性晶面比例下降,暴露出的ZnOx氧缺陷结构减少,从而形成较少的Cu-ZnOx强相互作用结构,改变催化剂表面铜物种的存在形式。
当Cu0较少时,催化活性随着Cu0增多而提高,但是当Cu0过多时,催化活性随着极化率下降而降低,这是由于过多的非极性晶面而形成的Cu0物种过多,而形成的Cu-ZnOx过少使羰基的活化成为反应的限制因素。而极化率为0.84时表现出最佳的催化活性,其原因在于此时催化剂拥有适宜比例的Cu0和Cu-ZnOx结构。
3 结论采用水热法制备不同极化率的ZnO载体,然后由浸渍法制备Cu/ZnO模型催化剂。发现极化率不会显著改变催化剂的物理结构和催化剂活性物种的晶粒尺寸,但会强烈影响催化剂的催化活性。极化率较高的ZnO载体暴露出更多的极性晶面和ZnOx氧缺陷结构,促进还原过程中形成更多Cu-ZnOx强相互作用结构,从而影响催化剂表面Cu0和Cu-ZnOx的分布。随着极化率降低,催化活性先升高后下降,在极化率为0.84时实现最佳催化性能。Cu-ZnO相互作用和氧缺陷结构的深入研究,对今后酯类加氢Cu/ZnO催化剂的理性设计提供新的研究思路。
| [1] | San X, Zhang Y, Shen W, et al. New synthesis method of ethanol from dimethyl ether with a synergic effect between the zeolite catalyst and metallic catalyst[J]. Energy & Fuels, 2009, 23(5): 2843–2844. |
| [2] | Li X, San X, Zhang Y, et al. Direct synthesis of ethanol from dimethyl ether and syngas over combined H-Mordenite and Cu/ZnO catalysts[J]. Chem Sus Chem, 2010, 3(10): 1192–1199. |
| [3] | Kim S, Lee M, Choi J, et al. Role of ZnO in Cu/ZnO/Al2O3 catalyst for hydrogenolysis of butyl butyrate[J]. Catalysis Communications, 2011, 12(14): 1328–1332. DOI: 10.1016/j.catcom.2011.05.006 |
| [4] | Liao F, Huang Y, Ge J, et al. Morphology-Dependent interactions of ZnO with Cu nanoparticles at the materials' interface in selective hydrogenation of CO2 to CH3OH[J]. Angewandte Chemie International Edition, 2011, 123: 2210–2213. |
| [5] | Lei H, Nie R, Wu G, et al. Hydrogenation of CO2 to CH3OH over Cu/ZnO catalysts with different ZnO morphology[J]. Fuel, 2015, 154: 161–166. DOI: 10.1016/j.fuel.2015.03.052 |
| [6] | Narayanan R, El-Sayed M. Catalysis with transition metal nanoparticles in colloidal solution:Nanoparticle shape dependence and stability[J]. Journal of Physical Chemistry B, 2005, 109(26): 12663–12676. DOI: 10.1021/jp051066p |
| [7] | Li G, Hu T, Pan G, et al. Morphology-Function relationship of ZnO:Polar planes, oxygen vacancies, and activity[J]. The Journal of Physical Chemistry C, 2008, 112(31): 11859–11864. DOI: 10.1021/jp8038626 |
| [8] | Yang M, Pang G, Li J, et al. Preparation of ZnO nanowires in a neutral aqueous system:Concentration effect on the orientation attachment process[J]. Berichte Der Deutschen Chemischen Gesellschaft, 2006(19): 3818–3822. |
| [9] | Peng Y, Xu A, Deng B, et al. Polymer-Controlled crystallization of zinc oxide hexagonal nanorings and disks[J]. Journal of Physical Chemistry B, 2006, 110(7): 2988–2993. DOI: 10.1021/jp056246d |
| [10] | Li F, Ding Y, Gao P, et al. Single-Crystal hexagonal disks and rings of ZnO:Low-Temperature, large-scale synthesis and growth mechanism[J]. Angewandte Chemie International Edition, 2004, 116: 5350–5354. |
| [11] | Fujitani T, Nakamura J. The effect of ZnO in methanol synthesis catalysts on Cu dispersion and the specific activity[J]. Catalysis Letters, 1998, 56(2): 119–124. |
| [12] | Gong J, Yue H, Zhao Y, et al. Synthesis of ethanol via syngas on Cu/SiO2 catalysts with balanced Cu0-Cu+ sites[J]. Journal of the American Chemical Society, 2012, 134(34): 13922–13925. DOI: 10.1021/ja3034153 |
| [13] | Grohmann I, Peplinski B, Unger W. New entries in the XPS fingerprint database for the characterization of precipitated Cu-Zn-Al oxide catalysts[J]. Surface & Interface Analysis, 1992, 19(1/2): 591–594. |
| [14] | Silva H, Mateos C, Magén C, et al. Simple hydrothermal synthesis method for tailoring the physicochemical properties of ZnO:Morphology, surface area and polarity[J]. RSC Advances, 2014, 4(4): 31166–31176. |
| [15] | Wang L, Liu Y, Chen M, et al. Production of hydrogen by steam reforming of methanol over Cu/ZnO catalysts prepared via a practical soft reactive grinding route based on dry oxalate-precursor synthesis[J]. Journal of Catalysis, 2007, 246(1): 193–204. DOI: 10.1016/j.jcat.2006.12.006 |
| [16] | Mateos C, Silva H, Tanaka D, et al. CuO/ZnO catalysts for methanol steam reforming:The role of the support polarity ratio and surface area[J]. Applied Catalysis B:Environmental, 2015, 174: 67–76. |
| [17] |
耿尧辰, 赵玉军, 王胜平, 等. 热稳定性增强的铈改性Cu/SiO2催化剂及在草酸酯加氢制乙二醇反应中的应用[J].
化学工业与工程, 2015, 32(6): 1–6.
Gen Yaochen, Zhao Yujun, Wang Shengping, et al. Ceria-Modified Cu/SiO2 catalyst with enhanced thermal stability and its application in hydrogenation of dimethyl oxalate to ethylene glycol[J]. Chemical Industry and Engineering, 2015, 32(6): 1–6. |
| [18] |
迟涵文, 赵玉军, 王胜平, 等. Cu-MCM-41催化剂的制备及在草酸酯加氢制乙二醇催化性能[J].
化学工业与工程, 2013, 30(3): 1–6.
Chi Hanwen, Zhao Yujun, Wang Shengping, et al. Preparation of Cu-MCM-41 catalyst and catalytic performance for hydrogenation of dimethyl oxalate to ethylene glycol[J]. Chemical Industry and Engineering, 2013, 30(3): 1–6. |
| [19] |
李振花, 李延春, 许根慧. 草酸二乙酯气相催化加氢合成乙二醇的研究[J].
化学工业与工程, 1993, 10(4): 27–33.
Li Zhenhua, Li Yanchun, Xu Genhui. Study on hydrogenation of diethyl oxalate to ethylene glycol in gas phase[J]. Chemical Industry and Engineering, 1993, 10(4): 27–33. |
| [20] | Wang Y, Shen Y, Zhao Y, et al. Insight into the balancing effect of active Cu species for hydrogenation of carbon-oxygen bonds[J]. ACS Catalysis, 2015, 5(10): 6200–6208. DOI: 10.1021/acscatal.5b01678 |
| [21] | Velu S, Suzuki K, Gopinath C, et al. XPS, XANES and EXAFS investigations of CuO/ZnO/Al2O3/ZrO2 mixed oxide catalysts[J]. Physical Chemistry Chemical Physics, 2002, 4(10): 1990–1999. DOI: 10.1039/b109766k |
| [22] | Rodrigues E, Marchi A, Apesteguia C, et al. Promoting effect of zinc on the vapor-phase hydrogenation of crotonaldehyde over copper-based catalysts[J]. Applied Catalysis A-General, 2005, 294(2): 197–207. DOI: 10.1016/j.apcata.2005.07.029 |
 2017, Vol. 34
2017, Vol. 34





