氧还原反应(Oxygen reduction reaction,ORR)和析氧反应(Oxygen evolution reaction,OER)在燃料电池、水电解池和金属-空气电池等电化学能量转化技术中至关重要[1-3],然而ORR和OER缓慢的动力学严重制约了这些电化学装置的能量转化效率[4-6]。铂和铱因其分别对ORR和OER具有较高的催化活性而成为目前最广泛使用的ORR催化剂和OER催化剂,但二者均因储量稀少和成本高昂而妨碍大规模商业化应用[7]。因此,迫切需要发展具有高ORR和OER催化活性的非贵金属双功能电催化剂来取代传统的贵金属催化剂。
杂原子掺杂的碳材料(Heteroatoms Doped Carbon,HDC)对ORR[8-14]和OER[13-14]均表现出较高的催化活性,且具有成本低、耐久性好以及环境友好等优点,被认为是具有广阔的研究和应用前景的新型催化剂[8]。最近的研究表明,生物质热解制备的HDC可对ORR表现出较高的催化活性[15-16]。但碳材料在高电位下催化析氧反应时容易被氧化腐蚀,造成其催化活性降低,严重制约了其在相关电化学能量转化装置中的应用。
我国是禽类养殖大国,禽蛋资源丰富且价廉。鸡蛋黄中富含蛋白质、卵磷脂,具有较高的营养价值。但鸡蛋黄中还含有大量胆固醇,容易引发心脑血管系统疾病,因而限制了其作为食品的消费。鸡蛋黄中富含蛋白质和卵磷脂,使其具有较高的N含量和P含量,而蛋白质中的蛋氨酸和胱氨酸等也使得其含有较多的S元素。在热解过程中,这些杂原子可原位掺杂到所形成的碳结构中,即生成杂原子掺杂的碳材料[15-16]。
本研究以鸡蛋黄和钴盐为前驱体,在熔融盐介质中热解制备了HDC负载Co2P纳米颗粒的双功能电催化剂(Co2P-HDC),对所制备的Co2P-HDC催化剂进行了相关的物性表征,并研究了其对氧还原反应和析氧反应的电催化活性,同时采用计时电流法研究了该催化剂在碱性介质中高电位下催化析氧反应的稳定性。
1 实验材料与方法 1.1 催化剂的制备将新鲜鸡蛋煮熟后取鸡蛋黄干燥作为热解前体,取该前体1.000 g,加入150 mg CoCl2·6H2O(99.99%,Aladdin)和5.000 g KCl(AR,天津科密欧试剂),充分研磨使之均匀混合,装入瓷舟中压实,然后将瓷舟置于管式炉中在N2保护下以10 ℃·min-1的速率升温至800 ℃并保持2 h。将热解后的产物分散在水中,过滤洗涤至滤液中无Cl-检出,然后将滤饼在80 ℃下真空干燥,研磨备用。
1.2 催化剂的物相表征采用日本日立公司的S-4800型扫描电子显微镜(SEM)和日本电子公司的JEM-2100F型透射电子显微镜(TEM)对催化剂的微观形貌进行表征。使用日本理学公司的D/MAX-2500型X射线衍射仪(XRD)对催化剂的晶体结构进行表征,辐射源为Cu_Kα靶(40 kV,200 mA),X射线波长为λ=0.15 406 nm,扫速为2θ=4 (°)·min-1。使用日本ULVAC-PHI公司的PHI5000 VersaProbe型X射线光电子能谱仪(XPS)对催化剂表面的元素组成和化学价态进行表征,辐射源为Al_Kα靶。
1.3 催化剂的性能测试电化学测试所用仪器为美国普林斯顿应用研究的P2273型电化学工作站。采用江苏江分电分析仪器公司的ATA-1B型旋转圆盘电极(直径为3 mm)对催化剂的电化学性能进行测试,电解液为O2或N2饱和的0.1 mol·L-1 KOH溶液,辅助电极为铂柱电极,参比电极为银氯化银电极(Ag/AgCl)。采用薄膜电极法制备工作电极,具体操作为:将5.00 mg催化剂分散到990 μL无水乙醇和10 μL质量分数为5%的Nafion乳液的混合液中,超声分散30 min使之成为均匀的分散液。用微量进样器将5 μL分散液滴到抛光过的玻碳电极表面,室温下自然晾干。
氧还原反应极化曲线的测试在O2饱和的0.1 mol·L-1 KOH溶液中进行,电位扫描区间为-1.1~0.2 V,扫速为10 mV·s-1,电极转速为1 600 r/min。极化曲线测试中的背景电流在N2饱和的0.1 mol·L-1 KOH溶液中测试,测试方法与上述相同。氧还原反应的电子转移数n可根据Koutecky-Levich方程[17]计算得出。析氧反应极化曲线的测试在O2饱和的0.1 mol·L-1 KOH溶液中进行,电位扫描区间为0~1.2 V,扫速为10 mV·s-1,电极转速为1 600 r/min。采用计时电流法对催化剂的OER耐久性进行测试,所施加电位为催化剂OER极化曲线中电流密度达到10 mA·cm-2时的电位,测试时间为3 h。
2 结果与讨论 2.1 催化剂的形貌表征图 1为Co2P-HDC催化剂的SEM图。

|
| 图 1 Co2P-HDC催化剂的SEM图 Figure 1 SEM images of Co2P-HDC |
| |
从图 1中可以清楚地看到所制备的Co2P-HDC的碳基体结构类似于海绵,在块状结构上密集地分布着直径约为100 nm左右的泡孔,这可以显著地增加碳材料的比表面积。这种独特的结构可能是由于热解过程中熔融状态的KCl对蛋黄在其中的分散和碳化过程产生了一定的影响。
图 2为Co2P-HDC催化剂的TEM图。
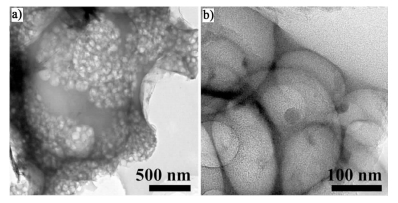
|
| 图 2 Co2P-HDC的TEM图 Figure 2 TEM images of Co2P-HDC |
| |
从图 2a)中可以更清晰地看出Co2P-HDC碳基体的海绵状结构。从图 2b)中可以看到碳基体的孔内附着有直径为几十纳米的深色颗粒,这可能就是碳基体上负载的含Co的纳米颗粒。这种独特的结构可能是在高温热解时形成的,鸡蛋黄热解生成的C作为具有较高还原性的物质与Co2+发生了氧化还原反应,C被氧化为CO2或CO气体,在熔融KCl介质中形成气泡,使碳材料内部产生气孔;同时使钴价态降低,以纳米颗粒的形式沉积到孔泡的壁上。
2.2 催化剂的XRD表征图 3为Co2P-HDC催化剂的XRD谱图。为了便于比较,图 3中还示出了Co2P的标准XRD谱图。
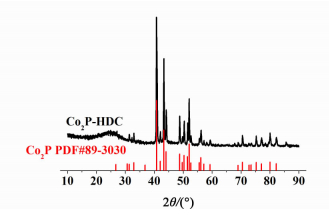
|
| 图 3 Co2P-HDC的XRD谱图 Figure 3 XRD pattern of Co2P-HDC |
| |
Co2P-HDC的XRD谱图中在2θ=25°附近出现了1个较宽的衍射峰,这是由于碳基体中碳的无定型结构所致。使用Search-Match软件对Co2P-HDC催化剂的XRD谱图数据进行分析,并与标准物质PDF卡片对比后可知,Co2P-HDC的XRD衍射峰位置和峰强度均与Co2P吻合良好,说明碳基体上附着的纳米颗粒的主要成分是Co2P[18]。鸡蛋黄中因含有大量的卵磷脂而具有较高的P含量,这些P在高温热解过程中与Co结合生成具有极高热稳定性的Co2P纳米颗粒。
2.3 催化剂的XPS表征图 4为Co2P-HDC催化剂的XPS谱图。
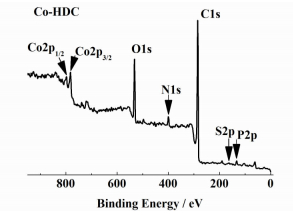
|
| 图 4 Co2P-HDC的XPS谱图 Figure 4 Wide scan survey XPS spectrum of Co2P-HDC |
| |
从图 4中可以看到的Co2P-HDC催化剂的XPS谱图中明显的C、O、N、S、P和Co元素谱线,肯定了催化剂中这些元素的存在,其中各元素的含量见表 1。该结果表明,Co2P-HDC催化剂中除含有大量的C元素以外,还有一定量的O、N、S、P、Co等元素。
| C | O | N | S | P | Co | |
| element content/% | 79.54 | 13.20 | 3.63 | 0.25 | 1.30 | 1.53 |
使用XPS Peak 4.1软件对催化剂XPS图谱中的N1s峰进行了分峰拟合,结果如图 5所示。
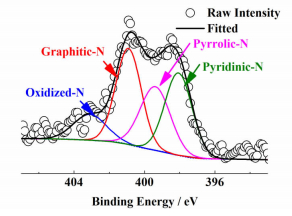
|
| 图 5 Co2P-HDC的XPS谱图中N1s分峰图 Figure 5 Deconvoluted N1s peak in XPS spectrum of Co2P-HDC |
| |
N元素的N1s峰可以分为4个峰,分别为398.2 eV处的Pyridinic-N峰,399.6 eV处的Pyrrolic-N峰,400.8 eV处的Graphitic-N峰和403.1 eV处的Oxidized-N峰。根据各峰的积分面积,可以定量地计算各种结合形式的N原子所占比例,分别为Pyridinic-N 23.5%、Pyrrolic-N 26.9%、Graphitic-N 35.9%、Oxidized-N 13.7%,其中边缘平面型掺杂的N原子(包括Pyridinic-N和Pyrrolic-N)总量高达50.4%。
2.4 Co2P-HDC催化剂的ORR催化性能图 6所示为Co2P-HDC和JM-Pt/C催化剂在O2饱和的0.1 mol·L-1 KOH溶液中的ORR极化曲线,电位扫描区间为-1.1~0.2 V,扫速为10 mV·s-1,旋转圆盘电极转速为1 600 r/min。
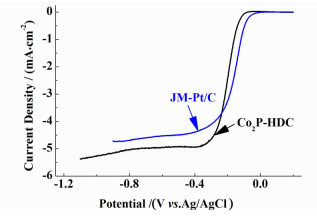
|
| 图 6 Co2P-HDC和JM-Pt/C催化剂的ORR极化曲线 Figure 6 Polarization curve of Co2P-HDC for ORR, compared with JM-Pt/C |
| |
从图 6中可以看出,Co2P-HDC催化剂表现出与JM-Pt/C催化剂相当的催化活性。Co2P-HDC催化剂的ORR起始电位为-21 mV,仅比JM-Pt/C催化的起始电位低49 mV。对比两者在极化电位为-0.4 V vs. Ag/AgCl处的极化电流密度,Co2P-HDC催化剂为-4.94 mA·cm-2,而JM-Pt/C催化剂为-4.39 mA·cm-2,即Co2P-HDC催化剂在此极化电位下的电流密度比JM-Pt/C催化剂高出了12.6%。Co2P-HDC催化剂表现出如此优异的ORR催化活性,这是由于鸡蛋黄在热解过程中实现了N、S和P原子在碳基体上的原位掺杂,使其表面形成了大量的催化活性位点,且其中约半数N原子为边缘平面型掺杂。而边缘平面型掺杂的N原子被许多研究者[19-21]认为是最有可能提供ORR催化活性的。此外,Co2P-HDC催化剂的碳基体内部直径约为100 nm左右的大孔可促进电解液中溶解的O2向其催化活性表面扩散,这种海绵状疏松多孔结构也使其表现出较大的催化活性表面,大大提高其ORR催化活性。
为了进一步分析Co2P-HDC催化剂对ORR的催化到底是以二电子路径还是以4电子路径进行,在本研究中测试了各催化剂在RDE不同转速下的极化曲线,如图 7a)所示。然后根据Koutecky-Levich (K-L)方程,求得催化剂在任一电位处催化氧还原反应的电子转移数n,见图 7b)。
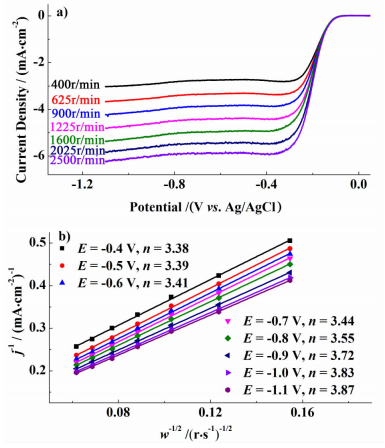
|
| 图 7 Co2P-HDC催化剂在RDE不同转速下的极化曲线a)和不同极化电位下的Koutecky-Levich曲线图b) Figure 7 Polarization curves of Co2P-HDC obtained at different rotating speeds of RDE a) and Koutecky-Levich plots at different potentials b) |
| |
图 7a)所示的RDE不同转速下Co2P-HDC催化ORR的极化曲线在-0.3~-1.1 V的电位区间内呈现出很好的扩散电流平台。从图 7b)所示的计算结果可以看出,低过电位下Co2P-HDC催化氧还原反应的电子转移数约为3.4,说明有70%左右的O2经4电子路径发生还原;高过电位下的电子转移数可达到3.8以上,即有90%以上的O2经4电子路径发生还原。
2.5 Co2P-HDC催化剂的OER催化性能图 8中所示为旋转圆盘电极转速1 600 r/min下在O2饱和的0.1 mol·L-1 KOH溶液中测得的Co2P-HDC催化剂OER极化曲线。以极化曲线中电流密度达到10 mA·cm-2时对应的极化电位为标准,对Co2P-HDC催化剂的OER催化活性进行了考察。
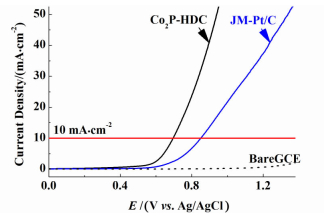
|
| 图 8 Co2P-HDC和JM-Pt/C催化剂的OER极化曲线 Figure 8 Polarization curve of Co2P-HDC for OER, compared with JM-Pt/C |
| |
Co2P-HDC催化剂在该电流密度下的极化电位为696 mV vs. Ag/AgCl,远低于Pt/C催化剂的851 mV vs. Ag/AgCl,说明Co2P-HDC催化剂的OER催化活性优于Pt/C催化剂。Zhang等[22]的理论计算结果表明,催化OER的活性位点可能是在靠近碳材料边缘掺杂的N原子附近。由此分析,可能是Co2P-HDC碳基体表面和边缘处以Pyridinic-N形式掺杂的N原子所形成的催化活性位点大大降低了OER过电位,对催化剂的OER活性的提高产生了促进作用。
采用计时电流法考察了Co2P-HDC催化剂与Pt/C催化剂在长时间催化OER时的稳定性,结果见图 9。将修饰有催化剂薄膜的电极以1 600 r/min的转速在O2饱和的0.1 mol·L-1 KOH溶液中进行了计时电流测试,所施加的电位分别为二者极化曲线中电流密度达到10 mA·cm-2时所对应的极化电位,即Co2P-HDC为696 mV vs. Ag/AgCl,而作为对照的Pt/C催化剂为851 mV vs. Ag/AgCl。

|
| 图 9 Co2P-HDC和JM-Pt/C催化剂的耐久性测试 Figure 9 Durability of Co2P-HDC for OER, compared with JM-Pt/C |
| |
根据图 9中的测试结果计算了经过3 h测试后两催化剂的电流密度与初始状态电流密度的比值,得到Co2P-HDC催化剂在测试结束时的电流密度为初始时的79%,而对于Pt/C催化剂该比值为52%,说明Co2P-HDC在催化OER的过程中表现出了比Pt/C催化剂更优异的稳定性。同时还发现在测试进行的前2 000 s内,Co2P-HDC催化剂的电流密度表现出与JM-Pt/C催化剂类似的下降趋势,应该是由于Co2P-HDC催化剂的碳基体在高电位下发生了比较严重的腐蚀,使其表面掺杂N原子的催化活性位点被破坏,导致其活性的降低;但在2 000 s以后则表现出与之相反的上升趋势,说明其OER催化活性在逐渐回升,可能是因为碳基体被腐蚀破坏比较严重,使得部分闭合海绵孔变为通孔从而提高了催化剂的活性催化面积,而孔内的Co2P颗粒也逐渐暴露出来,形成新的OER催化活性位点,二者协同作用使OER电流密度得以提高。
3 结论以鸡蛋黄和六水合氯化钴为前体,采用简单的一步热解法在熔融盐体系中制备了海绵状HDC负载Co2P纳米颗粒双功能电催化剂。所得Co2P-HDC催化剂表现出与商品Pt/C催化剂相当的ORR催化活性以及优于Pt/C催化剂的OER催化活性和耐久性,对于设计新型高效双功能电催化剂并有效提高其稳定性提供了很好的思路。
| [1] | Armand M, Tarascon J M. Building better batteries[J]. Nature, 2008, 451(7 179): 652–657. |
| [2] | Neburchilov V, Wang H, Martin J J, et al. A review on air cathodes for zinc-air fuel cells[J]. Journal of Power Sources, 2010, 195(5): 1 271–1 291. DOI: 10.1016/j.jpowsour.2009.08.100 |
| [3] | Carmo M, Fritz D L, Mergel J, et al. A comprehensive review on PEM water electrolysis[J]. International Journal of Hydrogen Energy, 2013, 38(12): 4 901–4 934. DOI: 10.1016/j.ijhydene.2013.01.151 |
| [4] | Gasteiger H A, Kocha S S, Sompalli B, et al. Activity benchmarks and requirements for Pt, Pt-alloy, and non-Pt oxygen reduction catalysts for PEMFCs[J]. Applied Catalysis B: Environmental, 2005, 56(1): 9–35. |
| [5] | Suntivich J, Gasteiger H A, Yabuuchi N, et al. Design principles for oxygen-reduction activity on perovskite oxide catalysts for fuel cells and metal-air batteries[J]. Nature Chemistry, 2011, 3(7): 546–550. DOI: 10.1038/nchem.1069 |
| [6] | Cheng F, Chen J. Metal-Air batteries: From oxygen reduction electrochemistry to cathode catalysts[J]. Chemical Society Reviews, 2012, 41(6): 2 172–2 192. DOI: 10.1039/c1cs15228a |
| [7] | Chen Z, Higgins D, Yu A, et al. A review on non-precious metal electrocatalysts for PEM fuel cells[J]. Energy & Environmental Science, 2011, 4(9): 3 167–3 192. |
| [8] | Gong K, Du F, Xia Z, et al. Nitrogen-Doped carbon nanotube arrays with high electrocatalytic activity for oxygen reduction[J]. Science, 2009, 323(5 915): 760–764. |
| [9] | Yang Z, Yao Z, Li G, et al. Sulfur-Doped graphene as an efficient metal-free cathode catalyst for oxygen reduction[J]. ACS Nano, 2011, 6(1): 205–211. |
| [10] | Sheng Z, Gao H, Bao W, et al. Synthesis of boron doped graphene for oxygen reduction reaction in fuel cells[J]. Journal of Materials Chemistry, 2012, 22(2): 390–395. DOI: 10.1039/C1JM14694G |
| [11] | Liu Z, Peng F, Wang H, et al. Phosphorus-Doped graphite layers with high electrocatalytic activity for the O2 reduction in an alkaline medium[J]. Angewandte Chemie International Edition, 2011, 50(14): 3 257–3 261. DOI: 10.1002/anie.201006768 |
| [12] | Choi C H, Park S H, Woo S I. Binary and ternary doping of nitrogen, boron, and phosphorus into carbon for enhancing electrochemical oxygen reduction activity[J]. ACS Nano, 2012, 6(8): 7 084–7 091. DOI: 10.1021/nn3021234 |
| [13] | Sakaushi K, Fellinger T P, Antonietti M. Bifunctional metal-free catalysis of mesoporous noble carbons for oxygen reduction and evolution reactions[J]. Chem Sus Chem, 2015, 8(7): 1 156–1 160. DOI: 10.1002/cssc.v8.7 |
| [14] | Zhang J, Zhao Z, Xia Z, et al. A metal-free bifunctional electrocatalyst for oxygen reduction and oxygen evolution reactions[J]. Nature Nanotechnology, 2015, 10: 444–452. DOI: 10.1038/nnano.2015.48 |
| [15] | Chaudhari K N, Song M Y, Yu J S. Transforming hair into heteroatom-doped carbon with high surface area[J]. Small, 2014, 10(13): 2 625–2 636. DOI: 10.1002/smll.v10.13 |
| [16] | Zhang Z, Li H, Yang Y, et al. Cow dung-derived nitrogen-doped carbon as a cost effective, high activity, oxygen reduction electrocatalyst[J]. RSC Advances, 2015, 5(34): 27 112–27 119. DOI: 10.1039/C5RA01987G |
| [17] | Bard A J, Faulkner L R. Electrochemical methods: fundamentals and applications[M]. Second edition, New York: Wiley, 2001. |
| [18] | Skála R, Drábek M. The crystal structure of Co2P from X-ray powder diffraction data and its mineralogical applications[J]. Bulletin of Geosciences, 2001, 76(4): 209–216. |
| [19] | Yu D, Zhang Q, Dai L. Highly efficient metal-free growth of nitrogen-doped single-walled carbon nanotubes on plasma-etched substrates for oxygen reduction[J]. Journal of the American Chemical Society, 2010, 132(43): 15 127–15 129. DOI: 10.1021/ja105617z |
| [20] | Rao C V, Cabrera C R, Ishikawa Y. In search of the active site in nitrogen-doped carbon nanotube electrodes for the oxygen reduction reaction[J]. The Journal of Physical Chemistry Letters, 2010, 1(18): 2 622–2 627. DOI: 10.1021/jz100971v |
| [21] | Ding W, Wei Z, Chen S, et al. Space-Confinement-induced synthesis of pyridinic-and pyrrolic-nitrogen-doped graphene for the catalysis of oxygen reduction[J]. Angewandte Chemie International Edition, 2013, 52(45): 11 755–11 759. DOI: 10.1002/anie.v52.45 |
| [22] | Li M, Zhang L, Xu Q, et al. N-Doped graphene as catalysts for oxygen reduction and oxygen evolution reactions: Theoretical considerations[J]. Journal of Catalysis, 2014, 314: 66–72. DOI: 10.1016/j.jcat.2014.03.011 |
 2017, Vol. 34
2017, Vol. 34





