随着工业革命以及科学技术的发展,环境污染问题日益严重。CO是空气中常见的有害气体,无色无味,其密度和空气相近,传播性较强[1]。CO与人体血红蛋白的结合能力约为O2的210倍[2]。当空气中φ(CO)达到200×10-6时,3 h后就会出现轻微头疼;当φ(CO)达到1.28%时,1~3 min内即可致人死亡。由于CO对人类生命健康威胁较大,低浓度的CO消除很早就引起了学者的关注。
催化消除是最有效的CO消除途径[3-4]。一直以来贵金属催化剂,以其高催化活性吸引着广大研究者的关注[5-8]。但是贵金属催化剂价格昂贵,高温易烧结失活等问题阻碍了其在工业上的推广应用。因此金属氧化物催化剂,如Co3O4[4]、Fe2O3[9]、CeO2[10]和CuO[11],以其低成本和良好的热稳定性成为近年来的研究热点[12]。
二氧化锡(SnO2)是n型半导体材料,常用于CO气敏材料[13],电极材料[14]以及太阳能电池材料[15]。在催化领域,由于其具有良好的热稳定性及抗水性,常被用作贵金属载体如Au/SnO2、Pd/SnO2[16],催化剂助剂[17],此外,通过形成复合金属氧化物,SnO2体系也表现出了极高的反应活性[18-19]。本课题组的刘程等[20]通过将Ce掺杂进入SnO2晶格得到了活性极高的甲烷氧化催化剂,掺杂Ce后可以提高SnO2氧流动性,产生表面和体相的氧空位,同时活化了催化剂表面的氧物种和Sn4+。
但是目前关于SnO2基体本身的研究工作报道较少,本工作主要是以SnO2材料为模型,采用简单的一步水热法对其尺寸进行调控,并利用X射线衍射(XRD)、透射电镜(TEM)、N2物理吸脱附(BET)和H2程序升温还原(H2-TPR)手段,考察纳米尺寸对其表面状态及催化性能的影响,为其作为催化剂载体材料以及掺杂型复合金属氧化物催化剂的设计提供重要的理论参考。
1 实验部分 1.1 催化剂的制备称取五水合四氯化锡试剂,在40 ℃的水浴温度下,配制成0.1 mol·L-1的溶液。溶解均匀后在磁力搅拌下逐滴加入氨水调节pH值至7,得到白色沉淀。用去离子水抽滤洗涤Cl-离子,至滤液滴入0.1 mol·L-1的AgNO3溶液无沉淀产生。将滤饼溶于氨水中,滴加配置好的0.05 mol·L-1的CTAB溶液,40 ℃水浴搅拌1 h。将前驱体溶液移入水热釜,190 ℃水热处理12 h。将水热产物干燥过夜,然后在马弗炉中2 ℃·min-1升温至300 ℃保持1 h,再升温至500 ℃焙烧3 h。将此催化剂标记为Nano-SnO2。
对照组样品采用氨水沉淀法制备,同样抽滤洗去Cl-离子,将滤饼干燥过夜,然后马弗炉中500 ℃,焙烧4 h。将此催化剂标记为SnO2。
所用CTAB为上海阿拉丁生化科技股份有限公司生产,其余试剂均为天津市光复精细化工研究所生产,纯度均为分析纯。
1.2 催化剂表征 1.2.1 热重-差热(TG/DTA)测试对催化剂的TG/DTA测试所用仪器为Perkin Elmer公司生产的Diamond TG/DTA热重分析仪。样品用量10 mg,空气气速100 mL·min-1,升温速率10 ℃·min-1。
1.2.2 X射线衍射分析(XRD)测试XRD测试是在德国布鲁克AXS有限公司生产的型号为D8-S4衍射仪上进行。操作电压和电流分别为40 kV和40 mA,采用Cu_Kα作为射线源,扫描范围2θ=10°~90°,采集步长0.02°。
1.2.3 比表面积(BET)测试催化剂的比表面积测试在Quantachrome NOVA-2000物理吸附仪上进行。测试前催化剂于300 ℃脱气预处理4 h,然后在液氮温度(-196 ℃)下利用氮气吸附/脱附测试,样品比表面积采用多点BET方法计算得出。
1.2.4 透射电子显微镜(TEM)测试催化剂的形貌测试是在JEM-2100F场发射透射显微镜上进行的,加速电压200 kV。样品测试前经过超声分散在乙醇溶液中,然后将其沉积到铜网上,干燥后进行测试。
1.2.5 H2程序升温还原(H2-TPR)测试催化剂的H2-TPR测试在天津先权公司的TP-5080全自动化学吸附仪上进行,尾气进入TCD检测仪前,经过CaO和NaOH净化处理。测试条件:样品用量30 mg,还原气为8% H2/N2混合气,气速30 mL·min-1,并以10 ℃·min-1的升温速率从室温加热到900 ℃。
1.3 催化剂的CO氧化性能测试催化剂的CO氧化性能测试在微型反应评价装置上进行。样品用量100 mg,测试气体组成为1% CO/24% O2/N2 (150 mL·min-1)。空速约为93 000 mL·g-1·h-1。反应前在350 ℃,25% O2/N2 (150 mL·min-1)气氛条件下预处理0.5 h。反应尾气用红外线气体分析仪进行检测。CO转化率通过公式(1) 计算。
| ${X_{{\rm{CO}}}} = {\left[ {{\rm{C}}{{\rm{O}}_2}} \right]_{{\rm{outlet}}}}/({\left[ {{\rm{CO}}} \right]_{{\rm{outlet}}}} + {\left[ {{\rm{C}}{{\rm{O}}_2}} \right]_{{\rm{outlet}}}})$ | (1) |
式(1) 中[CO]outlet和[CO2]outlet分别表示反应尾气中CO和CO2的浓度。
确定温度下的反应速率(r)采用公式(2) 计算。
| $r = \frac{{0.01Q{X_{{\rm{CO}}}}}}{{22.4m}}$ | (2) |
式(2) 中,Q表示反应气流量,XCO表示CO转化率,m表示催化剂质量。
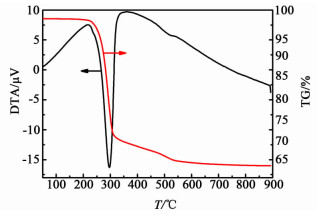
2 结果与讨论 2.1 热重分析由于Nano-SnO2样品在制备的过程中加入CTAB作为模板剂,因此在表征催化剂之前要确认模板剂已完全焙烧脱除。图 1是对于干燥后的水热产物进行的热重测试。
|
| 图 1 焙烧前Nano-SnO2样品的TG-DTA谱图 Figure 1 TG-DTA analysis curves of nano-SnO2 |
| |
从TG/DTA结果可以看出,样品有2个失量台阶,对应温度区间分别为200~300 ℃和300~500 ℃。第1个失量台阶失量比例高达30%,此过程应包含脱水和有机物的剧烈燃烧;第2个失量台阶失量比例不到10%,可能是模板剂的完全燃烧脱除。因此在焙烧温度设定上,采用缓慢升温,并在300 ℃停留1 h,再缓慢升温至500 ℃的方法。使催化剂表面的CTAB模板剂得以完全脱除,并且不会在剧烈燃烧的过程中局部过热导致纳米颗粒烧结团聚。
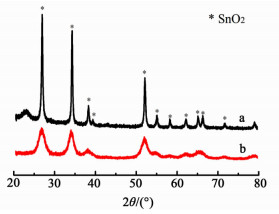
2.2 催化剂结构分析图 2为SnO2和Nano-SnO2催化剂的XRD衍射谱图。图 2中SnO2和Nano-SnO2催化剂的衍射峰均可以归属为金红石型SnO2相(JCPDS no.41-1445),未观察到其他杂相的衍射峰。这表明,通过水热法也合成出了与沉淀法一样的金红石型SnO2。本研究又观察到Nano-SnO2催化剂的衍射峰变宽,衍射峰变宽表明催化剂的结构对称性下降了,晶粒尺寸减小了。通过谢乐公式进一步计算得出,Nano-SnO2的晶粒大小约为5.5 nm,而SnO2的晶粒大小在23.1 nm左右。
|
| 图 2 SnO2 (a)及Nano-SnO2 (b)的XRD谱图 Figure 2 XRD patterns of SnO2 (a) and nano-SnO2 (b) |
| |
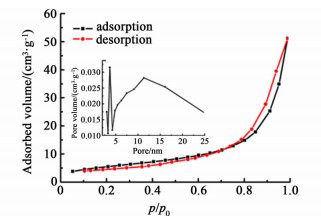
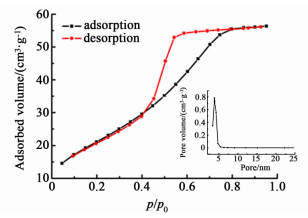
图 3和图 4分别展示了SnO2和Nano-SnO2催化剂的N2吸附-脱附曲线和BJH孔径分布曲线。SnO2和Nano-SnO2样品均表现出了典型的Ⅳ型吸附等温线。不同的是SnO2样品的滞后环为H3型,没有明显的饱和吸附平台,孔结构不规整;Nano-SnO2样品的滞后环为H2型,具有饱和吸附平台,孔径分布较均匀,可能为尺寸均一的球形颗粒聚集而成。孔径分布曲线证实了这点,SnO2样品的堆积孔径分布在3.65和11.52 nm处,且分布范围较宽,孔结构不一致,而Nano-SnO2样品的堆积孔径为3.88 nm,分布范围窄,孔结构相近。表 1列出了催化剂的晶粒尺寸和比表面积的具体数值,SnO2的BET比表面积为20 m2·g-1,与文献[19]报道相一致。Nano-SnO2催化剂的BET比表面积大幅提高,达到了79 m2·g-1,这意味着将有更多的活性位暴露出来,有利于SnO2活性的提高。
|
| 图 3 SnO2的N2吸附-脱附曲线和BJH孔径分布曲线 Figure 3 N2 adsorption-desorption isotherms and BJH pore size distribution of SnO2 |
| |
|
| 图 4 Nano-SnO2的N2吸附-脱附曲线和BJH孔径分布曲线 Figure 4 N2 adsorption-desorption isotherms and BJH pore size distribution of nano-SnO2 |
| |
| 样品 | 晶粒大小/nm | 比表面积/(m2·g-1) | 孔径/nm |
| SnO2 | 23.1 | 20 | 3.65, 11.52 |
| Nano-SnO2 | 5.5 | 79 | 3.88 |
图 5a)和图 5b)是SnO2催化剂的TEM图,图 5c)和图 5d)是Nano-SnO2催化剂的TEM图。从中可以看出通过水热法本研究合成出了粒径均一、分散度良好的SnO2纳米颗粒。且Nano-SnO2催化剂的晶粒尺寸明显小于纯SnO2催化剂的晶粒尺寸,这与表 1中所列的晶粒尺寸结果相一致。
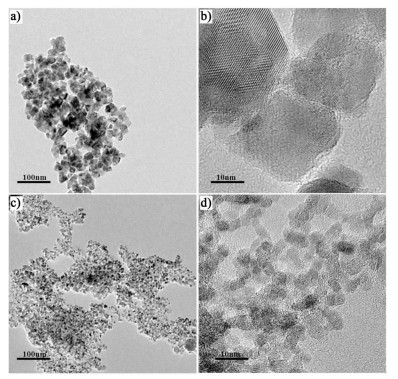
|
| 图 5 催化剂样品的TEM图片 Figure 5 TEM images of catalysts SnO2 (a, b) and nano-SnO2 (c, d) |
| |
图 6为催化剂的H2-TPR图,200~500 ℃的还原峰可被归属为表面4价Sn4+到Sn2+的还原,而高温的还原峰为体相4价Sn4+到Sn2+的还原以及表面的2价Sn2+到Sn0的还原[20]。
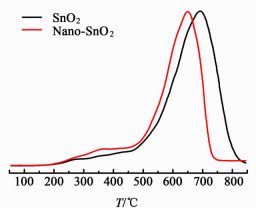
|
| 图 6 催化剂样品的H2-TPR谱图 Figure 6 H2-TPR profiles of the catalysts |
| |
从图 6中可以看出,水热制备的Nano-SnO2催化剂和沉淀法制备的SnO2催化剂的起始还原温度相同,但低温峰面积更大,即Nano-SnO2催化剂的表面Sn4+浓度高于SnO2催化剂,原因是前者具有更大的比表面积。Nano-SnO2催化剂高温的还原峰向低温方向偏移,可能是由于晶粒尺寸更小,有利于颗粒的还原。
2.5 催化剂CO氧化活性图 7为催化剂随反应温度变化的CO转化率曲线,由图 7可知两者T10相差5 ℃,T50相差15 ℃,T90相差35 ℃。由此可以看出相比于沉淀法制备的SnO2催化剂,Nano-SnO2催化剂具有高的表观催化活性。
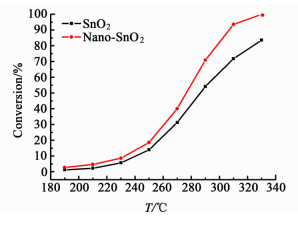
|
| 图 7 催化剂样品的CO转化率曲线 Figure 7 Conversion curves of the CO oxidation via the different catalysts |
| |
图 8给出了催化剂的阿伦尼乌斯曲线,并将其表观活化能(Ea)和指前因子(A)列于表 2。如表 2所示,相比于传统SnO2材料,纳米SnO2催化剂的活化能从61.3下降到54.2 kJ·mol-1,同时指前因子(A)也由23.2下降到19.4。活化能与催化反应的能垒相关,Ea降低表明在纳米SnO2催化剂上CO更加容易发生氧化反应。指前因子(A)和活性位的数量紧密相关[4],之前曾有报道显示SnO2催化剂的活性晶面是(001) 面[21],可能本文所制备的纳米颗粒暴露的(001) 面比例下降,导致指前因子(A)下降,从而使其单位比表面积的反应速率变小。本研究所报道的纳米尺寸SnO2在CO催化氧化过程中活化能降低这一结果,能为其作为催化剂载体材料以及掺杂型复合金属氧化物催化剂的设计提供重要的理论参考。
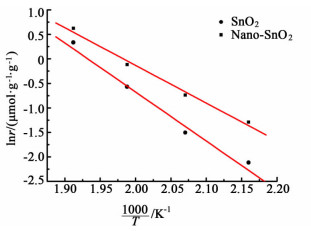
|
| 图 8 CO催化氧化的阿仑尼乌斯图 Figure 8 Arrhenius plots of the catalysts upon the CO oxidation |
| |
| 催化剂 | Ea/(kJ·mol-1) | A |
| SnO2 | 61.3±4 | 23 |
| Nano-SnO2 | 54.2±3 | 19 |
表 3比较了文献报道的SnO2基催化剂的CO催化氧化活性。可以看出,经过掺杂后的SnO2基催化剂的活性较高。而作为单一组分的SnO2催化剂,本研究的实验结果不低于文献报道,纳米样品的反应速率甚至接近于Sn-Ce复合金属氧化物催化剂。
以CTAB为模板,SnCl4为锡源,采用水热法成功合成了粒径为5 nm的SnO2纳米颗粒。所合成的Nano-SnO2催化剂具有高比表面积、均一粒径、分布均匀等特点。在氧化还原能力方面,低温峰面积更大,表面Sn4+浓度高于SnO2催化剂,这有利于CO的氧化消除。在随后的CO氧化性能测试中,Nano-SnO2催化剂的反应活化能比传统SnO2材料有所下降,表明在纳米SnO2催化剂上CO更加容易发生氧化反应。同时指前因子(A)也由23.2下降到19.4,表明纳米颗粒暴露的(001) 面比例下降。本研究所报道的纳米尺寸SnO2在CO催化氧化过程中活化能降低这一结果,能为其作为催化剂载体材料以及掺杂型复合金属氧化物催化剂的设计提供重要的理论参考。
| [1] | Raub J A, Benignus V A. Carbon monoxide and the nervous system[J]. Neuroscience & Biobehavioral Reviews, 2002, 26(8): 925–940. |
| [2] | Blumenthal I. Carbon monoxide poisoning[J]. Journal of the Royal Society of Medicine, 2001, 94(6): 270–272. |
| [3] | Green I X, Tang W, Neurock M, et al. Spectroscopic observation of dual catalytic sites during oxidation of CO on a Au/TiO2 catalyst[J]. Science, 2011, 333(6 043): 736–739. |
| [4] | Xie X, Li Y, Liu Z, et al. Low-Temperature oxidation of CO catalysed by Co3O4 nanorods[J]. Nature, 2009, 458(7 239): 746–749. |
| [5] | Lopez N, Janssens T V W, Clausen B S, et al. On the origin of the catalytic activity of gold nanoparticles for low-temperature CO oxidation[J]. Journal of Catalysis, 2004, 223(1): 232–235. DOI: 10.1016/j.jcat.2004.01.001 |
| [6] | Ackermann M D, Pedersen T M, Hendriksen B L M, et al. Structure and reactivity of surface oxides on Pt (110) during catalytic CO oxidation[J]. Physical Review Letters, 2005, 95(25): 255 505.1–255 505.4. |
| [7] | Zhang C, Hu P. CO oxidation on Pd (100) and Pd (111): A comparative study of reaction pathways and reactivity at low and medium coverages[J]. Journal of the American Chemical Society, 2001, 123(6): 1 166–1 172. DOI: 10.1021/ja002432f |
| [8] | Blume R, Hävecker M, Zafeiratos S, et al. Catalytically active states of Ru (0001) catalyst in CO oxidation reaction[J]. Journal of Catalysis, 2006, 239(2): 354–361. DOI: 10.1016/j.jcat.2006.02.019 |
| [9] | Liu X, Liu J, Chang Z, et al. Crystal plane effect of Fe2O3 with various morphologies on CO catalytic oxidation[J]. Catalysis Communications, 2011, 12(6): 530–534. DOI: 10.1016/j.catcom.2010.11.016 |
| [10] | Pan C, Zhang D, Shi L, et al. Template-Free synthesis, controlled conversion, and CO oxidation properties of CeO2 nanorods, nanotubes, nanowires, and nanocubes[J]. European Journal of Inorganic Chemistry, 2008, 2008(15): 2 429–2 436. DOI: 10.1002/(ISSN)1099-0682 |
| [11] | Zhou K, Wang R, Xu B, et al. Synthesis, characterization and catalytic properties of CuO nanocrystals with various shapes[J]. Nanotechnology, 2006, 17(15): 3 939–3 943. DOI: 10.1088/0957-4484/17/15/055 |
| [12] | Bao H, Zhang W, Hua Q, et al. Crystal-Plane-Controlled surface restructuring and catalytic performance of oxide nanocrystals[J]. Angewandte Chemie International Edition, 2011, 50(51): 12 294–12 298. DOI: 10.1002/anie.v50.51 |
| [13] | Kida T, Fujiyama S, Suematsu K, et al. Pore and particle size control of gas sensing films using SnO2 nanoparticles synthesized by seed-mediated growth: Design of highly sensitive gas sensors[J]. The Journal of Physical Chemistry C, 2013, 117(34): 17 574–17 582. DOI: 10.1021/jp4045226 |
| [14] | Chen J, Lou X. SnO2-Based nanomaterials: Synthesis and application in lithium-ion batteries[J]. Small, 2013, 9(11): 1 877–1 893. DOI: 10.1002/smll.v9.11 |
| [15] | Hossain M A, Jennings J R, Koh Z Y, et al. Carrier generation and collection in CdS/CdSe-sensitized SnO2 solar cells exhibiting unprecedented photocurrent densities[J]. ACS Nano, 2011, 5(4): 3 172–3 181. DOI: 10.1021/nn200315b |
| [16] | Wang S, Huang J, Zhao Y, et al. Preparation, characterization and catalytic behavior of SnO2 supported Au catalysts for low-temperature CO oxidation[J]. Journal of Molecular Catalysis A: Chemical, 2006, 259(1): 245–252. |
| [17] | Roller J M, Yu H, Zhang L, et al. Evaluation of phase segregation in ternary Pt-Rh-SnO2 catalysts prepared from the vapor phase[J]. Microscopy and Microanalysis, 2014, 20(S3): 462–463. DOI: 10.1017/S1431927614004036 |
| [18] | Baidya T, Gupta A, Deshpandey P A, et al. High oxygen storage capacity and high rates of CO oxidation and NO reduction catalytic properties of Ce1-xSnxO2 and Ce0.78Sn0.2Pd0.02O2-δ[J]. The Journal of Physical Chemistry C, 2009, 113(10): 4 059–4 068. DOI: 10.1021/jp8060569 |
| [19] | Li Y, Peng H, Xu X, et al. Facile preparation of mesoporous Cu-Sn solid solutions as active catalysts for CO oxidation[J]. RSC Advances, 2015, 5(33): 25 755–25 764. DOI: 10.1039/C5RA00635J |
| [20] | Liu C, Xian H, Jiang Z, et al. Insight into the improvement effect of the Ce doping into the SnO2 catalyst for the catalytic combustion of methane[J]. Applied Catalysis B: Environmental, 2015, 176: 542–552. |
| [21] | Sun Y, Lei F, Gao S, et al. Atomically thin tin dioxide sheets for efficient catalytic oxidation of carbon monoxide[J]. Angewandte Chemie International Edition, 2013, 125(40): 10 763–10 766. |
| [22] | Xu X, Liu F, Han X, et al. Elucidating the promotional effects of niobia on SnO2 for CO oxidation: developing an XRD extrapolation method to measure the lattice capacity of solid solutions[J]. Catalysis Science & Technology, 2016. DOI: 10.1039/C5CY01870F |
| [23] | Zhang R, Shang J, Zeng X, et al. SnO2 promoted by praseodymia: Novel catalysts for CO oxidation[J]. Zeitschrift für Physikalische Chemie International Journal of Research in Physical Chemistry and Chemical Physics, 2012, 226(4): 275–290. |
| [24] | Wang X, Tian J, Zheng Y, et al. Tuning Al2O3 surface with SnO2 to prepare improved supports for Pd for CO oxidation[J]. Chem Cat Chem, 2014, 6(6): 1 604–1 611. |
 2017, Vol. 34
2017, Vol. 34





