2. 系统生物工程教育部重点实验室, 天津 300072
2. Key Laboratory of System Bioengineering, Ministry of Education, Tianjin University, Tianjin 300072, China
随着肿瘤发病率和致死率的日益增高,恶性肿瘤已成为目前威胁人类健康最严重的疾病之一。自从1971年Folkman[1]提出肿瘤的生长和转移依赖于血管生成的观点后,通过抑制肿瘤血管的生成来抑制肿瘤生长的理论已被大量研究所证实[2]。目前广泛认为,新生血管的形成对于实体瘤的生长是一个关键的步骤。因此以肿瘤血管新生为靶点的治疗方法逐渐受到重视,并且发展成为目前肿瘤治疗的研究重点。而寻找具有低毒性、高活性、良好的稳定性和高度靶向性的血管生成抑制剂是当前研究的热点。研究表明,许多内源性或外源性抗血管生成因子如血管生成抑制素(angiostatin)、内皮抑制素(endostatin)、interleukin-12(IL-12)、血小板因子四(platelet factor-4,PF4) 等均具有一定的抗血管生成作用[3-4]。重组人血管内皮抑制素于2005年获得国内新药证书,作为全球首例,也是目前唯一的内源性血管抑制剂抗肿瘤药物,已经得到广泛应用。目前,包括PF4、血管生成抑制素、IL-12等在内的血管生成抑制因子已进入临床试验阶段。
血小板因子四作为肿瘤血管生成抑制因子中的一员,日益发挥出了重要的作用,成为最受关注的抑制血管新生因子之一。血小板因子四是一种具有多种生物学功能的趋化因子,它能够通过抑制内皮细胞的增殖与迁移抑制血管生成,研究表明,PF4抑制血管新生作用主要集中在其C末端与肝素结合的结构域,其47-70肽段抑制活性较强[5-6]。早在1999年,Jouan等[7]观察到PF4 47-70可以直接抑制血管内皮细胞的生长;Perollet等[8-9]发现PF4 47-70可以通过抑制促进内皮细胞生长的细胞因子发挥作用间接地抑制血管内皮细胞生长;在FGF-2或VEGF结合试验、三维血管小管形成增殖试验等一系列试验中,PF4 47-70都显示出了抗血管生成活性[10]。RGD肽是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)序列的短肽,能够与肿瘤细胞表面高表达的整合素αvβ3结合[11],因此可作为肿瘤靶向肽进行肿瘤的诊断与治疗,且含有2个二硫键的环形RGD肽对肿瘤新生血管内皮细胞的抑制效力最强[12-14]。
本研究将PF4 47-70与环形RGD肽通过柔性肽连接构成靶向性重组PF4,表达的PF4 47-70蛋白含有RGD结构。利用RGD肽能与肿瘤细胞表面高表达的整合素结合的特性,提高PF4 47-70蛋白与肿瘤细胞的结合能力与靶向性,使其在抑制血管生成的同时,增强靶向性,降低副作用,从而更有针对性的抗癌。考虑到PF4蛋白的分离纯化困难,加之其结构复杂,活性形式为四聚体,直接化学合成不但成本高,还难以保证其活性。且直接给予蛋白药物,在体内不稳定,易被代谢,很难维持较高治疗浓度。而基因治疗则具有可以在肿瘤局部维持血管新生抑制因子较高水平表达、避免肿瘤细胞的耐药性、降低药物毒副作用等优势[15]。本研究以能表达该重组肽的裸质粒pcDNA3.1(+)-PF447-70-RGD为研究对象,探讨了其在体外的抑制血管生成活性,为抗血管新生基因疗法治疗肿瘤奠定了基础。
1 材料与方法 1.1 材料 1.1.1 主要试剂RPMI-1640培养液、DMEM培养液购自Hyclone公司,标准胎牛血清购自浙江天杭生物科技有限公司,DMSO购自美国Sigma公司,胰蛋白酶-EDTA消化液、G-418 Sulfate、RIPA裂解液和MTT均购自北京索莱宝科技有限公司,脂质体LipofectamineTM2000购自Invitrogen公司,无内毒素质粒小提试剂盒购自Biomiga公司,RNApure超纯总RNA快速提取试剂盒购自北京博迈德科技发展有限公司,Hind Ⅲ和Xba Ⅰ限制性内切酶和RevertAid First Strand cDNA Synthesis Kit购自Thermo公司,抗β-actin鼠单克隆抗体、抗His标签鼠单克隆抗体和HRP标记的羊抗鼠lgG购自Abcam公司。所用引物自行设计,由金唯智生物科技(北京)有限公司合成。
1.1.2 仪器设备日本Sanyo细胞培养箱,Viber Lourmat凝胶成像系统,美国IR公司CO2恒温培养箱,日本Nikon公司倒置荧光显微镜;SIGMA公司3K-18低温高速离心机,Microplate酶标仪,Perkin Elmer Cetus PCR仪,北京六一仪器厂核酸、蛋白电泳仪。
1.1.3 质粒、细胞株和试验动物真核表达质粒pcDNA3.1(+)为本实验室保存;中华仓鼠卵巢(CHO)细胞系和人脐静脉内皮(HUVEC)细胞系均购于天津国际生物医药联合研究院。
1.2 实验方法 1.2.1 靶向性重组PF4的设计、拼接和优化根据NCBI数据库中编号为NM_002619.3的PF4基因序列,选取PF4信号肽基因及PF447-70基因;连入环状RGD肽(PDB: 1FUV_A)基因(33bp)序列,为了保持PF447-70和RGD肽各自的空间结构,在二者之间加入了柔性连接肽(GenBank:CAJ56254.1),根据其氨基酸序列初步设计其基因(42bp)序列。在PF447-70-RGD基因前后加入表达必需的元件拼接后,利用软件进行密码子优化,优化后的PF447-70-RGD基因序列为(含有Hind Ⅲ和Xba Ⅰ酶切位点及His标签):AAGCTT GCCACC ATG GGC AGC TCC GCA GCC GGG TTC TGC GCC TCA CGC CCC GGG CTG CTG TTC CTG GGG TTG CTG CTC CTG CCA CTT GTG GTC GCC TTC GCC AGC GCT AAT GGA AGG AAA ATT TGC TTG GAC CTG CAA GCC CCC CTG TAC AAG AAA ATA ATT AAG AAA CTT TTG GAG AGT GGA GGC GGA GGA AGC GGA GGA GGA GGA AGC GGC GGA GGA GGC AGC GCC TGC GAC TGC AGG GGA GAC TGC TTC TGC GGT CAT CAT CAC CAT CAC CAT TGA G TCTAGA;氨基酸序列为:MGSSAAGFCASRPGLLFLGLLLLPLVVAFASA






合成靶向性重组PF4基因序列(由金唯智公司合成)。用Hind Ⅲ和Xba Ⅰ分别对靶向性重组PF4基因片段和真核表达载体pcDNA3.1(+)进行双酶切。用1.5%的琼脂糖凝胶进行电泳分离,并对酶切后的目的基因片段(286 bp)及酶切后的pcDNA3.1(+) (5428 bp)载体进行切胶回收。各自回收纯化后,用T4连接酶对目的片段和酶切后的pcDNA3.1(+)载体进行连接,构建出真核表达载体pcDNA3.1(+)-PF447-70-RGD。以其转化感受态细DH5α,通氨苄青霉素LB培养基平板进行筛选,挑取阳性克隆。在含100 μg/mL氨苄青霉素的LB培养液中,37 ℃,220 r/min,培养过夜,按质粒提取试剂盒说明提取质粒。进行双酶切鉴定并测序。鉴定正确的重组载体即为重组pcDNA3.1(+)-PF447-70-RGD真核表达载体。
1.2.3 细胞培养与转染CHO细胞培养于含体积分数为10%的胎牛血清+青霉素100 IU/mL、链霉素100 μg/mL,DMEM (High Glucose)培养液中,置于5% CO2、37 ℃、95%饱和湿度的恒温培养箱中进行常规培养。转染前1 d,用胰蛋白酶进行消化以收获对数期生长的细胞,以(0.5~2.0)×105个细胞接种于24孔板中,培养过夜至细胞达到70%~80%汇合时,进行转染。分别取适量DNA,LipofectamineTM2000用无血清无双抗培养基稀释至25 μL,轻轻混匀,室温孵育5 min;将稀释的DNA和稀释的LipofectamineTM2000混合,轻轻混匀,并在室温下孵育20 min。将24孔板中的生长培养基更换成450 μL无血清无双抗培养基,然后将50 μL转染复合物加入到24细胞孔板内,轻轻摇匀。将细胞置于37 ℃恒温培养箱培养4~6 h后,更换成500 μL含双抗和10%血清的培养基继续培养24~48 h后检测。
1.2.4 稳定转染细胞株的筛选选择培养基中G418浓度在400~1 200 μg/mL范围内,以100 μg/mL为梯度;分别进行筛选,每3~5 d更换1次筛选培养基。在筛选10~14 d内能够杀死所有细胞的最小G418浓度1 000 μg/mL即为最适宜筛选浓度。转染24 h后,细胞传代,第2 d加入最适宜筛选浓度的G418筛选培养基进行筛选。每3~5 d更换1次筛选培养基。当有大量细胞死亡时,可以把G418浓度减半维持筛选。筛选10~14 d后,可见有抗性的克隆出现。停药培养,待其逐渐增大后挑取单克隆进行扩大培养,该细胞系为CHO稳定表达系。未转染pcDNA3.1(+)-PF447-70-RGD质粒的细胞,筛选4 d,细胞全部死亡。
1.2.5 MTT法检测对脐静脉内皮细胞(HUVEC)增殖的影响收集对数期HUVEC细胞以5×104个细胞/mL的密度接种于96孔板,180 μL/孔,分成3组,每组设9个复孔,培养24 h。弃去培养液,第1组加入未转染组CHO细胞培养液,第2组加入转染质粒pcDNA3.1(+)组CHO细胞培养液,第3组加入转染质粒pcDNA3.1(+)-PF447-70-RGD组CHO细胞培养液,每孔各加入200 μL。培养72 h后,吸去96板中上清,加入90 μL新鲜培养基,再加入10 μL MTT溶液,继续培养4 h。然后洗掉上清,每孔加入110 μL Formazan溶解液,振荡混匀10 min,使结晶物充分溶解。酶联免疫检测仪在540 nm波长测定各孔吸光度A540值。细胞增殖抑制率(inhibition ratio,IR),IR=(1-实验组平均A540/对照组平均A540)×100%;计算出含有重组质粒pcDNA3.1(+)-PF447-70-RGD的CHO细胞表达产物的培养上清对血管内皮细胞增殖能力的影响。
1.2.6 RT-PCR检测提取CHO细胞系的总RNA,用Nanodrop测定总RNA的浓度,总RNA经M-MLVⅡ逆转录酶合成cDNA第一链,以cDNA第一链为模板,进行PCR扩增。以P1(5’-GAGACCTTCAACACCCCAGC-3’)P2(5’-ATGTCACGCACGATTTCCC-3’)为引物进行PCR扩增内参肌动蛋白(β-actin)特异性片段,以P3(5’-GGCTGCTGTTCCTGGGGTTGCTG-3’)P4(5’-CAGAAGCAGTCTCCCCTGCAGTCGC-3’)为引物进行PCR获得目的基因特异性片段。PCR循环参数为: 94 ℃ 30 s,55 ℃/65 ℃ 30 s,72 ℃25 s,35个循环后,72 ℃继续延伸10 min。扩增产物进行凝胶电泳,切胶,琼脂糖凝胶DNA回收试剂盒回收PCR产物,测序鉴定。测序工作由上海生工生物工程有限公司完成。
1.2.7 Western Blot检测收集CHO细胞培养液进行分泌蛋白检测。用RIPA裂解液裂解CHO细胞提取胞内总蛋白检测。采用BCA法进行蛋白定量。15% SDS-PAGE凝胶电泳,半干转到PVDF膜。转完膜后用TBST清洗1次,5%的脱脂奶粉中封闭90 min,弃掉5%封闭缓冲液,分别于一抗His标签鼠单克隆抗体(1:500)、β-actin鼠单克隆抗体(1:1 000),4 ℃孵育过夜。从抗体中取出PVDF膜,用TBST清洗3次,每次摇床摇动10 min;将其放入二抗HRP标记的羊抗鼠IgG(1: 000) 中室温孵育1 h,再用TBST液清洗3次,每次10 min。滴加ECL发光液显影,用凝胶成像系统进行扫描曝光。
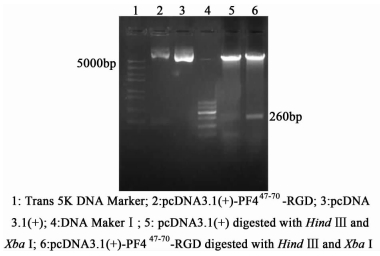
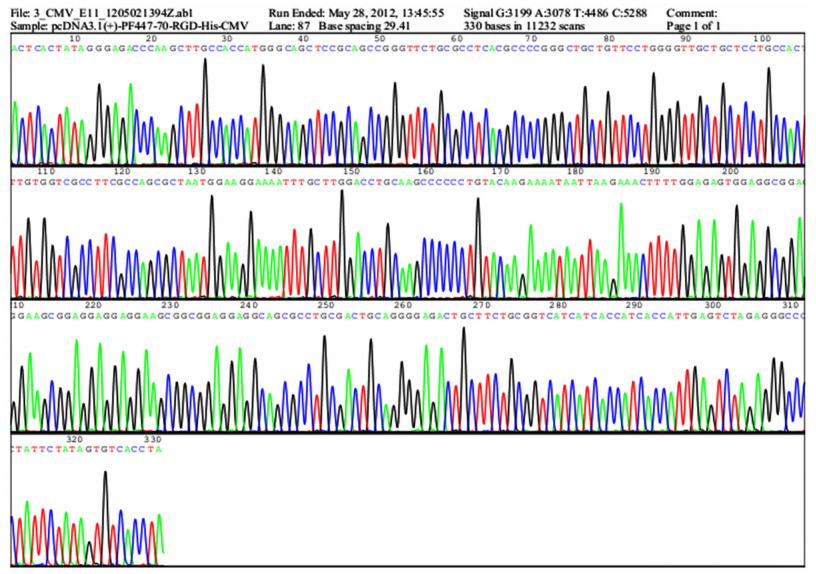
2 结果 2.1 重组表达质粒的构建、转化与鉴定利用Hind Ⅲ和Xba Ⅰ进行重组质粒pcDNA3.1(+)-PF447-70-RGD的双酶切鉴定,其产物经过1.5%凝胶电泳检测,可见到约5.4 kb的大片段和约260 bp的小片段(图 1)。大片段与pcDNA3.1(+)真核表达载体片段大小一致,小片段与PF447-70-RGD基因片段大小一致。而经Hind Ⅲ、Xba Ⅰ双酶切过的质粒pcDNA3.1(+),无小片段,与实验预期结果一致。测序鉴定证明序列正确(图 2),证明重组质粒已构建成功。
|
| 图 1 pcDNA3.1(+)-PF447-70-RGD质粒Hind Ⅲ、Xba Ⅰ双酶切鉴定 Figure 1 Recombinant plasmid pcDNA3.1(+)-PF447-70-RGD identified with Hind Ⅲ and Xba Ⅰ digestion |
| |
|
| 图 2 pcDNA3.1(+)-PF447-70-RGD质粒测序峰图 Figure 2 pcDNA3.1(+)-PF447-70-RGD plasmid sequencing diagram |
| |
利用根据pcDNA3.1(+)-PF447-70-RGD两端cDNA设计的引物P1、P2、P3、P4进行RT-PCR,扩增出内参β-actin特异性条带,经过2.0%凝胶电泳检测,可见到约260 bp的片段,与预期条带位置相符,说明反转录合成cDNA第一链成功;扩增目的基因特异性条带经凝胶电泳检测,未转染组与转染质粒pcDNA3.1(+)组未见条带,转染质粒pcDNA3.1(+)-PF447-70-RGD的CHO细胞组可见约200 bp的基因片段,与预期相符,说明转染质粒pcDNA3.1(+)-PF447-70-RGD组基因水平上可检测到目的蛋白表达(图 3)。

|
| 图 3 RT-PCR扩增电泳图 Figure 3 RT-PCR amplified electrophoresis |
| |
收取CHO细胞裂解液获得胞内总蛋白,经Western blot法检测未转染组、转染质粒pcDNA3.1(+)组、转染质粒pcDNA3.1(+)-PF447-70-RGD组胞内蛋白,均表达了43 KD的内参β-actin,且亮度基本相同,说明3组的胞内蛋白样品质量良好且浓度相仿;而只有转染质粒pcDNA3.1(+)-PF447-70-RGD组在8.8 KD附近处有带有His标签的目的条带,而未转染组、转染质粒pcDNA3.1(+)组则无条带(见图 4)。说明转染质粒pcDNA3.1(+)-PF447-70-RGD组在蛋白水平上可检测到目的蛋白表达。收集CHO细胞培养液进行分泌蛋白检测,转染质粒pcDNA3.1(+)-PF447-70-RGD组分泌蛋白可见带有His标签目的5.7 KD左右的条带,未转染组、转染质粒pcDNA3.1(+)组未见条带(见图 5),说明转染质粒pcDNA3.1(+)-PF447-70-RGD组在蛋白水平上可检测到目的蛋白分泌表达。

|
| 图 4 胞内蛋白Western blot结果图 Figure 4 Western blot analysis for intracellular proteins |
| |

|
| 图 5 分泌蛋白Western blot结果图 Figure 5 Western blot analysis for secreted proteins |
| |
MTT法检测含有重组质粒表达产物的培养上清对血管内皮细胞增殖能力的影响(见图 6)。结果表明,转染空质粒pcDNA3.1(+)组与未转染组相比无明显区别(P=0.260 < 0.05)。而经转染质粒pcDNA3.1(+)-PF447-70-RGD组CHO细胞的培养上清培养后,与转染空质粒pcDNA3.1(+)组对比,血管内皮细胞的增殖能力显著减小(P=0 < 0.05),与转染质粒pcDNA3.1(+)组相比降低了50.8%。表明分泌表达的PF447-70-RGD重组蛋白对血管内皮细胞的生长有抑制作用。
|
| 图 6 含有靶向性重组PF4细胞培养液对HUVEC细胞增殖能力的抑制作用 Figure 6 The inhibition of cell culture medium containing Targeting Recombinant PF4 on HUVEC proliferation |
| |
肿瘤的侵袭与转移,是影响临床肿瘤治疗的主要问题。研究表明,通过抑制血管新生能控制实体瘤及血液肿瘤的生长,所以抑制血管新生治疗的方法已成为当前治疗肿瘤的热点[16]。PF4属于CXC趋化因子亚家族,大量实验已经证实,PF4作为一种抑制血管新生因子,通过干扰血管生成因子、激活CXCR3B、与整合素相互作用、干扰细胞周期、与VEGF家族的其他成员VEGF121相互作用等多种分子作用机制诱发了其在内皮细胞中的活性,得到了广泛关注。
为了深入研究PF4,本研究颇具创新性的构建了能够在真核细胞和动物体内表达该重组肽的裸质粒pcDNA3.1(+)-PF447-70-RGD,利用脂质体将其转染至CHO细胞,采用RT-PCR和Western blot分别从基因和蛋白水平上检测目的基因的表达。筛选得到CHO稳转细胞系,经过Western blot验证,细胞表达了目的蛋白且部分分泌到了胞外。MTT法测定胞外分泌蛋白对人脐静脉内皮细胞(HUVEC)生长抑制作用较强。因此,本研究证明靶向性重组PF447-70-RGD肽段具有较强的体外抑制血管生成活性。位于PF4的C末端的PF4 47-70肽段具有较强的抗血管生成活性,其可能的机理在于:由于肽键剪切后影响了蛋白的四聚体结构而引起形成的新氨基末端富含碱性氨基酸;空间结构的变化可能使其暴露更多的活性中心或尚不为人所知的功能区域;可能去除了PF4的某些活性抑制区域。此外,结合了RGD肽段的PF4 47-70-RGD肽段,在肿瘤的治疗过程中,具有比PF4 47-70肽段更高的活性,更精准的靶向性。因为RGD肽靶向性的药物能更有效地选择性杀伤肿瘤部位的新生血管内皮细胞,抑制肿瘤的效果更好[17-18]。而此实验结果表明,PF4 47-70肽段和RGD肽分别形成了有活性的空间结构,而通过中间的柔性肽连接,没有互相干扰,各自发挥作用或者起到协同作用而使其抗血管生成活性更强大。此外,我们的研究已经涉及少量动物实验,初步研究结果显示靶向性重组PF4表达载体在体内也展现出一定的抑瘤效果,对我们的进一步的研究起到促进意义。
本研究利用裸质粒的治疗肿瘤的方案,为肿瘤抑制血管新生的基因治疗开辟光明前景;而加入环状RGD肽的靶向性的设计对靶向抗肿瘤治疗的研究具有重大意义。综上所述,本次研究的对象pcDNA3.1(+)-PF447-70-RGD具有很好的临床应用前景。然而,对于PF447-70-RGD的抑制肿瘤生长活性具体作用机理及同其他抗血管生成因子抑癌作用的比较,有待进一步的研究。
同时,基因治疗的应用面临的一些问题,其中重要问题之一是如何提高基因药物的传递效率。研究表明通过一些物理、化学,生物学等方法,可以提高传递效率。因此为靶向性PF4基因片段能够高效的转染进入细胞组织,寻求合理的物理化学等的方法或者有效安全的运载系统是十分必要的。此外,用于基因治疗的生物制品的生产与质量控制都有相当严格的要求。因此其产品的有效性和安全性需要有所保障,这些问题有待克服。
| [1] | Folkman J. Tumor angiogenesis: Therapeutic implications[J]. The New England Journal of Medicine, 1971, 285(21): 1182–1186. DOI: 10.1056/NEJM197111182852108 |
| [2] | Dimova I, Popivanov G, Djonov V. Angiogenesis in cancer-general pathways and their therapeutic implications[J]. J Buon, 2014, 19(1): 15–21. |
| [3] | Prokopiou E M, Ryder S A, Walsh J J. Tumour vasculature targeting agents in hybrid/conjugate drugs[J]. Angiogenesis, 2013, 16(3): 503–524. DOI: 10.1007/s10456-013-9347-8 |
| [4] | Chen Q, Zhang L, Gasper W, et al. Targeting tumor angiogenesis with gene therapy[J]. Mol Genet Metab, 2001, 74(1/2): 120–127. |
| [5] | Hagedorn M, Zilberberg L, Lozano R M, et al. A short peptide domain of platelet factor 4 blocks angiogenic key events induced by FGF-2[J]. Faseb J, 2001, 15(3): 550–552. |
| [6] | Bello L, Lucini V, Costa F, et al. Combinatorial administration of molecules that simultaneously inhibit angiogenesis and invasion leads to increased therapeutic efficacy in mouse models of malignant glioma[J]. Clin Cancer Res, 2004, 10(13): 4527–4537. DOI: 10.1158/1078-0432.CCR-04-0194 |
| [7] | Jouan V, Canron X, Alemany M, et al. Inhibition of in vitro angiogenesis by platelet factor-4-derived peptides and mechanism of action[J]. Blood, 1999, 94(3): 984–993. |
| [8] | Perollet C, Han Z, Savona C, et al. Platelet factor 4 modulates fibroblast growth factor 2 (FGF-2) activity and inhibits FGF-2 dimerization[J]. Blood, 1998, 91(9): 3289–3299. |
| [9] | Hagedorn M, Zilberberg L, Lozano R M, et al. A short peptide domain of platelet factor 4 blocks angiogenic key events induced by FGF-2[J]. Faseb J, 2001, 15(3): 550–552. |
| [10] | Vandercappellen J, Liekens S, Bronckaers A, et al. The COOH-terminal peptide of platelet factor-4 variant (CXCL4L1/PF-4var47-70) strongly inhibits angiogenesis and suppresses B16 melanoma growth in vivo[J]. Mol Cancer Res, 2010, 8(3): 322–334. DOI: 10.1158/1541-7786.MCR-09-0176 |
| [11] | Zitzmann S, Ehemann V, Schwab M. Arginine-Glycine-Aspartic acid (RGD)-peptide binds to both tumor and tumor-endothelial cells in vivo[J]. Cancer Res, 2002, 62(18): 5139–5143. |
| [12] | Garanger E, Boturyn D, Dumy P. Tumor targeting with RGD peptide ligands-design of new molecular conjugates for imaging and therapy of cancers[J]. Anticancer Agents Med Chem, 2007, 7(5): 552–558. DOI: 10.2174/187152007781668706 |
| [13] | Wang J, Han X, Yang H, et al. A novel RGD-toxin protein, Lj-RGD3, from the buccal gland secretion of Lampetra japonica impacts diverse biological activities[J]. Biochimie, 2010, 92(10): 1387–1396. DOI: 10.1016/j.biochi.2010.07.001 |
| [14] | Yu Y, Wang Q, Liu Y, et al. Molecular basis for the targeted binding of RGD-containing peptide to integrin alpha(Ⅴ)beta(3)[J]. Biomaterials, 2014, 35(5): 1667–1675. DOI: 10.1016/j.biomaterials.2013.10.072 |
| [15] | Gardlik R, Celec P, Bernadic M. Targeting angiogenesis for cancer (gene) therapy[J]. Bratisl Med J, 2011, 112(8): 428–434. |
| [16] | Eichholz A, Merchant S, Gaya A M. Anti-Angiogenesis therapies: Their potential in cancer management[J]. Oncotargets Ther, 2010, 3: 69–82. |
| [17] | Cao Q, Li Z, Chen K, et al. Evaluation of biodistribution and anti-tumor effect of a dimeric RGD peptide-paclitaxel conjugate in mice with breast cancer[J]. Eur J Nucl Med Mol Imaging, 2008, 35(8): 1489–1498. DOI: 10.1007/s00259-008-0744-y |
| [18] | Okada Y, Okada N, Mizuguchi H, et al. Transcriptional targeting of RGD fiber-mutant adenovirus vectors can improve the safety of suicide gene therapy for murine melanoma[J]. Cancer Gene Ther, 2005, 12(7): 608–616. DOI: 10.1038/sj.cgt.7700824 |
 2017, Vol. 34
2017, Vol. 34





