钴基金属氧化物材料是一类很有发展潜力的催化剂,近年来,致力于提高这类材料的催化性能方面的研究也越来越受到人们的重视[1]。在这些研究中,将氧化钴与其他金属氧化物联合使用,尤其是与稀土金属氧化物联合使用得到了众多的关注。多组分材料因具备一些单一组分材料所不具有的性质,使其性能和应用都大大增强[2]。氧化铈 (CeO2) 是一种重要的稀土金属氧化物,其氧化还原电位为+1.74 mV,易在3价 (Ce3+) 态和4价 (Ce4+) 态之间变化,这种结构特点使得CeO2有着优越的储放氧功能及高温快速氧空位扩散能力,因而可作为催化剂助剂被广泛应用于氧化还原反应中[3]。将Co3O4与CeO2联合使用被广泛应用于N2O分解[4]、柴油机尾气碳烟氧化[5]和低温CO氧化[3, 6-7]中,在这些反应过程中,由于氧化铈的加入,使得2种氧化物之间产生了协同作用,从而使得材料的催化反应活性大大增强。鉴于此,钴铈氧化物的复合催化剂成为了当前的研究热点[7]。
氯酚类化合物是一类应用广泛、具有环境毒性的持久性有机污染物,已被美国、欧盟和中国列为优先控制污染物[8]。氯酚类化合物常见于各种化学工业废水,主要来源为有机材料的氯化处理、杀虫剂、除草剂、垃圾焚烧、木材防腐剂及水处理消毒等[9]。大部分氯酚类化合物在环境中不易降解,一旦进入环境中,将会在大气、水体、土壤等环境介质中长久存在,从而对生态环境和人类健康造成严重危害。因此,有关废水中氯酚类物质的存在以及降解备受关注。
本研究采用溶胶-凝胶法制备出钴铈复合氧化物,并完成了对所制备材料的各项表征,同时以废水中的2, 4, 6-三氯酚 (TCP) 作为模型化合物,研究所合成的复合氧化物对废水中的2, 4, 6-三氯酚催化降解效果和影响因素,并优化工艺条件,为含有氯酚类物质的废水处理技术的发展提供理论依据。
1 实验材料与方法 1.1 仪器与试剂仪器:HCT-1差热-热重联用仪 (北京恒久科学仪器厂);S-3000N扫描电子显微镜 (日本HITACHI公司);Quadra Surb SI比表面孔分析仪 (美国Quantachrome公司);XD-2自动X射线粉末衍射仪 (北京普析通用仪器有限责任公司);SHA-B水浴恒温震荡器 (江苏省金坛荣华仪器制造有限公司);UV-2300紫外可见分光光度计 (天美科技有限公司);HH-6化学耗氧量测定仪 (江苏电分析仪器厂)。
试剂:硝酸钴 (国药集团化学试剂有限公司);硝酸铈 (天津市福晨化学试剂厂);柠檬酸 (北京化工厂);2, 4, 6-三氯酚 (美国ACROS ORGANICS)。所用试剂均为AR级。
1.2 实验方法 1.2.1 钴铈复合氧化物的制备分别准确称取一定量的Co (NO3)2·6H2O、Ce (NO3)3·6H2O、柠檬酸,先加适量水将硝酸盐混合物溶解,再加入柠檬酸,搅拌使其全部溶解。将所制备的混合溶液经磁力搅拌器恒温加热搅拌,蒸发溶剂至得到深红色的黏稠胶状物。将胶状物质在烘箱中120 ℃下烘干过夜,得到黑色疏松多孔的干凝胶,将干凝胶研磨成粉,在马弗炉中800 ℃下焙烧6 h,得到粉末样品即为钴铈复合氧化物。
氧化铈 (CeO2) 和四氧化三钴 (Co3O4) 的制备方法同上。
1.2.2 材料分析与表征样品的SEM表征是在日本HITACHI公司生产的S-3000N型扫描电子显微镜上进行的,加速电压为20 kV。采用XRD-7000型X射线衍射仪进行X射线衍射分析,以Ni滤波的Cu_Kα射线 (λ=0.15418 nm) 为激发源,管电压为40 kV,管电流为40 mA。采用BET (Brunauer-Emmett-Teller) 法测定样品比表面积,采用BJH (Barret-Joyner-Halendar) 方法测定平均孔径。
1.2.3 降解实验方法称取一定量的钴铈复合氧化物和一定量的100 mg/L的TCP溶液于棕色试剂瓶中,在一定温度下水浴恒温振荡反应一定时间。将反应后的溶液用带0.45 μm滤膜的针头过滤器过滤后,进行分析测试。
1.2.4 试样分析试样分析直接采用紫外分光光度法。通过实验测定可知,在不同的pH值下,TCP在水溶液中的吸光度值与浓度成直线关系,故可以采用式 (1) 计算降解率:
| $ D\% = \frac{{{A_0} - A}}{{{A_0}}} \times 100\% $ | (1) |
其中,A0为试样反应前的吸光度值;A为反应一定时间时试样的吸光度值。
化学耗氧量 (COD) 在HH-6化学耗氧量测定仪上进行,采用密封催化消解法测定COD值。
2 实验结果与讨论 2.1 钴铈复合氧化物的制备和表征采用柠檬酸络合法制得的钴铈复合氧化物 (Co-Ce) 利用日本HITACHI公司生产的S-3000N型扫描电子显微镜观察材料的表面结构和形貌,SEM照片如图 1所示。

|
| 图 1 钴铈复合氧化物的SEM照片 Figure 1 SEM images of cobalt-cerium complex oxides |
| |
从图 1可以清楚的看到所合成的钴铈复合氧化物是一种疏松多孔、呈“蜂窝”状的材料。
将前体在马弗炉中800 ℃下焙烧6 h后,对产物进行了XRD分析,如图 2。

|
| 图 2 钴铈复合氧化物、Co3O4和CeO2的XRD谱图 Figure 2 The XRD patterns of cobalt-cerium complex oxides, Co3O4and CeO2 |
| |
从图 2中可以看出,烧后的产物结晶度较好,XRD分析主要体现的是Co3O4和CeO2的相关衍射峰,表明所合成的钴铈复合氧化物中,主要物相为Co3O4和CeO2。采用BET法测定样品比表面积为24.5 m2/g;采用BJH方法测定样品的平均粒径为18.9 nm;总孔体积为0.128 cm3/g。
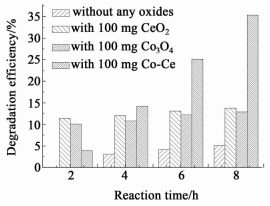
2.2 钴铈复合氧化物催化降解2, 4, 6-三氯酚 2.2.1 钴铈复合氧化物催化效果的确定为初步确定所合成的钴铈复合氧化物对废水中的2, 4, 6-三氯酚的降解是否具有催化作用及其催化降解效果,设计了如下实验。反应条件:10 mL 100 mg/L TCP (pH=6.51),在25 ℃下分别恒温振荡2、4、6和8 h,分别比较加入自制的CeO2、自制的Co3O4和自制的钴铈复合氧化物 (各100 mg) 与不加任何氧化物的条件下,2, 4, 6-三氯酚的降解率,结果如图 3所示。
|
| 图 3 钴铈复合氧化物催化效果的评价 Figure 3 The catalytic efficiency of cobalt-cerium complex oxides |
| |
由图 3可知,在不加任何氧化物的情况下,TCP的降解很难,25 ℃下恒温振荡8 h后降解率也仅达到5.2%。分别加入100 mg自制的CeO2、Co3O4和钴铈复合氧化物后,TCP的降解率均明显提高,且随反应时间的增加而增加,实验结果说明自制的CeO2、Co3O4和钴铈复合氧化物对废水中的2, 4, 6-三氯酚具有一定的催化降解活性。这种催化降解活性可能与材料本身所具有的氧化还原性能有关。众所周知,金属氧化物表面存在一些活性氧物种,这些活性氧物种可以由晶格氧、气态氧以及金属氧化物表面弱键合的氧相互转化产生。一些活性氧物种诸如超氧阴离子自由基和羟基自由基,是一类很强的氧化剂,这类活性物质能够将有机物氧化成一些小分子中间物,甚至CO2和H2O[10-11]。
另从图 3可明显看出,随着反应时间的增加,自制的钴铈复合氧化物对TCP的降解效率要明显优于单一的CeO2和Co3O4,说明在催化降解TCP中,自制的钴铈复合氧化物具有明显的优势,这种优势应该来源于自制的钴铈复合氧化物中CeO2和Co3O4的协同催化作用。CeO2和Co3O4具有协同催化作用已有很多研究[3-7]报道。CeO2具有很强的氧存储和氧移动能力,吸附在CeO2表面上的氧可以被快速的转移到活性中心上,因而使其具有很强的氧化还原性能。将CeO2与其他氧化物联合使用,可以影响氧化物表面的氧的可移动性。在某些情况下,CeO2能够通过从元素中夺取氧或为其他元素提供氧,来影响与它相连的元素的氧化态,进而影响该元素的氧化还原性以及催化活性[12]。CeO2容易从气相中吸收氧并把氧转移到催化剂的其他组分上,是CeO2加入到钴基氧化催化剂上的原因[2]。钴铈复合氧化物中两种物相本身所具有的氧化还原性能以及二者之间的协同催化作用使其对废水中的2, 4, 6-三氯酚具有一定的催化降解活性。
2.2.2 催化降解优化条件的确定通过多次的摸索实验,发现反应温度、反应时间、溶液的pH值以及催化剂用量等因素对2, 4, 6-三氯酚的降解具有一定的影响,为此,设计了以下单因素实验。
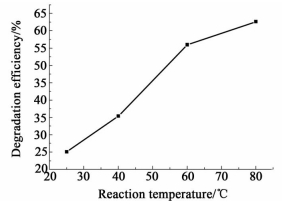
2.2.2.1 反应温度的影响取10 mL 100 mg/L TCP (pH=6.51) 溶液和100 mg钴铈复合氧化物,混匀后,分别在25、40、60和80 ℃下恒温振荡反应6 h,实验结果如图 4所示。
|
| 图 4 反应温度对TCP的降解率的影响 Figure 4 The influence of reaction temperature on the degradation efficiency of TCP |
| |
由图 4可见,TCP的降解率随反应温度的升高而提高,40~60 ℃时降解率的提高很明显,80 ℃时降解率达到了62.7%。温度升高,会使更多的反应物分子吸收能量而活化,并增加了TCP与钴铈复合氧化物碰撞的几率,对氧化降解TCP越有利,从而使TCP的降解率提高。
2.2.2.2 溶液pH值的影响分别采用NaOH和浓HCl调节反应液的初始pH值,研究不同pH值对2, 4, 6-三氯酚降解的影响。取10 mL不同pH值的100 mg/L TCP溶液和100 mg钴铈复合氧化物,分别混匀后,分别在25和80 ℃下恒温振荡反应2 h,反应结果如图 5所示。

|
| 图 5 溶液pH值对TCP的降解率的影响 Figure 5 The influence of solution pH on the degradation efficiency of TCP |
| |
由图 5可见,溶液pH值变化对降解反应有明显的影响,无论25 ℃下还是80 ℃下,TCP的降解率均随溶液pH值的增大而降低,说明在此反应条件下,酸性条件有利于2, 4, 6-三氯酚的降解,其中溶液pH值为2~3时,TCP的降解效果较好。这可能是因为在碱性条件下TCP降解产生的CO2在溶液中转化形成CO32-和HCO3-,而CO32-和HCO3-与氧化物表面的活性氧物种如羟基自由基等反应速率很快[13],消耗了氧化物表面的活性氧物种,从而使TCP的降解率降低。
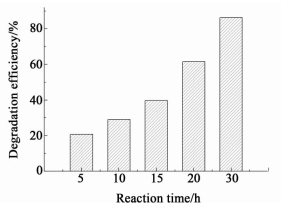
2.2.2.3 反应时间的影响分别取10 mL 100 mg/L TCP (pH=2.85) 溶液和100 mg钴铈复合氧化物,混匀后,在25 ℃下恒温振荡反应一定时间,结果如图 6所示。
|
| 图 6 反应时间对TCP的降解率的影响 Figure 6 The influence of reaction time on the degradation efficiency of TCP |
| |
由图 6可见TCP的降解率随反应时间的增加而提高,反应时间越长,TCP的降解越充分,当反应30 h时降解率达到了86.3%。
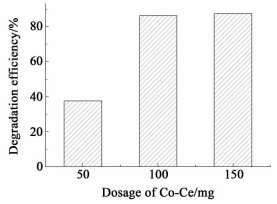
2.2.2.4 钴铈复合氧化物用量的影响取10 mL 100 mg/L TCP (pH=2.85) 溶液,分别和一定量的钴铈复合氧化物混匀后,在25 ℃下恒温振荡反应30 h,结果如图 7所示。
|
| 图 7 钴铈复合氧化物用量对TCP的降解率的影响 Figure 7 The influence of Co-Ce dosage on the degradation efficiency of TCP |
| |
由图 7可见TCP的降解率随钴铈复合氧化物用量的增加而提高,钴铈复合氧化物用量为100 mg时明显比50 mg的降解率提高很多,但100 mg与150 mg的降解率差距不大,故此条件下钴铈复合氧化物的用量为100 mg比较合适。
综上所述,采用自制的钴铈复合氧化物催化降解TCP的优化条件为:100 mg自制的钴铈复合氧化物与10 mL 100 mg/L的2, 4, 6-三氯酚在25 ℃下恒温振荡30 h, 2, 4, 6-三氯酚的降解率可达到86.3%。
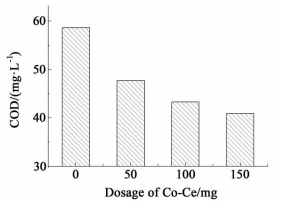
一般说来,TCP降解的产物复杂,分析时有一定的难度。因COD总体上可以作为有机物含量的指标,我们分析了降解前后溶液的COD值,结果如图 8所示。
|
| 图 8 钴铈复合氧化物的用量对COD的影响 Figure 8 The influence of Co-Ce dosage on COD |
| |
由图 8可见,初始TCP溶液中化学耗氧量为68.4 mg·L-1,在不加钴铈复合氧化物的条件下,在25 ℃下恒温振荡30 h后,溶液的化学耗氧量仅减少了14.3%,而加入自制的钴铈复合氧化物后,溶液的化学耗氧量随钴铈复合氧化物的用量的增加而降低,当钴铈复合氧化物的用量为100 mg时,化学耗氧量减少了36.7%,说明水中易被氧化的有机物含量降低,钴铈复合氧化物的加入对TCP的降解有较明显的作用。
3 结论1) 采用溶胶-凝胶法制备了一种疏松多孔的钴铈复合氧化物,该复合氧化物具有较大的比表面积和孔体积。钴铈复合氧化物中2种物相成分本身所具有的氧化还原性能以及协同催化作用使其对废水中的2, 4, 6-三氯酚具有一定的催化降解活性。
2) 初始溶液的pH值对降解影响较大,酸性条件更有利于2, 4, 6-三氯酚的降解。在酸性条件下,100 mg自制的钴铈复合氧化物与10 mL 100 mg/L的2, 4, 6-三氯酚在25 ℃下恒温振荡30 h, 2, 4, 6-三氯酚降解率可达到86.3%,溶液中的可被氧化的有机物含量下降了36.7%。
| [1] | Tsoncheva T, Ivanova L, Minchev C, et al. Cobalt-Modified mesoporous MgO, ZrO2, and CeO2 oxides as catalysts for methanol decomposition[J]. J Colloid Interface Sci, 2009, 333 : 277–284. DOI: 10.1016/j.jcis.2008.12.070 |
| [2] | Lin S, Su G, Zheng M, et al. Synthesis of flower-like Co3O4-CeO2 composite oxide and its application to catalytic degradation of 1, 2, 4-trichlorobenzene[J]. Appl Catal B:Environ, 2012(123/124) : 440–447. |
| [3] | Tang C, Kuo M, Lin C, et al. Evaluation of carbon monoxide oxidation over CeO2/Co3O4 catalysts:Effect of ceria loading[J]. Catal Today, 2008, 131 : 520–525. DOI: 10.1016/j.cattod.2007.10.026 |
| [4] | Xue L, Zhang C, He H, et al. Catalytic decomposition of N2O over CeO2 promoted Co3O4 spinel catalyst[J]. Appl Catal B:Environ, 2007, 75 : 167–174. DOI: 10.1016/j.apcatb.2007.04.013 |
| [5] | Dhakad M, Mitshuhashi T, Rayalu S, et al. Co3O4-CeO2 mixed oxide-based catalytic materials for diesel soot oxidation[J]. Catal Taday, 2008, 132 : 188–193. DOI: 10.1016/j.cattod.2007.12.035 |
| [6] | Tang C, Kuo C, Kuo M, et al. Influence of pretreatment conditions on low-temperature carbon monoxide oxidation over CeO2/Co3O4 catalysts[J]. Appl Catal A:Gen, 2006, 309 : 37–43. DOI: 10.1016/j.apcata.2006.04.020 |
| [7] | Luo J, Meng M, Li X, et al. Mesoporous Co3O4-CeO2and Pd/Co3O4-CeO2 catalysts:Synthesis, characterization and mechanistic study of their catalytic properties for low-temperature CO oxidation[J]. J Catal, 2008, 254 : 310–324. DOI: 10.1016/j.jcat.2008.01.007 |
| [8] | Goretti D D, Maria C G, Carmen M B L, et al. Heterogeneous catalytic 2, 4, 6-trichlorophenol degradation at hemin-acrylic copolymer[J]. Applied Catalysis B:Environmental, 2010, 96(1/2) : 51–56. |
| [9] | Gaya U I, Abdullah A H, Hussein M Z, et al. Photocatalytic removal of 2, 4, 6-trichlorophenol from water exploiting commercial ZnO powder[J]. Desalination, 2010, 263(1/3) : 176–182. |
| [10] | Lai T, Lai Y, Lee C C, et al. Microwave-Assisted rapid fabrication of Co3O4 nanorods and application to the degradation of phenol[J]. Catal Today, 2008, 131 : 105–110. DOI: 10.1016/j.cattod.2007.10.039 |
| [11] | Hoffmann M R, Martin S T, Choi W, et al. Environmental applications of semiconductor photocatalysis[J]. Chem Rev, 1995, 95 : 69–96. DOI: 10.1021/cr00033a004 |
| [12] | Xue L, Zhang C, He H, et al. Catalytic decomposition of N2O over CeO2 promoted Co3O4 spinel catalyst[J]. Appl Catal B:Environ, 2007, 75 : 167–174. DOI: 10.1016/j.apcatb.2007.04.013 |
| [13] |
孙云娜, 魏东洋, 刘芬, 等. UV/H2O2体系降解六氯苯动力学及其机理研究[J].
环境科学与技术, 2012, 35(s1) : 66–70.
Sun Yunna, Wei Dongyang, Liu Fen, et al. Degradation of hexachlorbenzene kinetics and mechanism analysis by UV/H2O2 system[J]. Environmental Science & Technology, 2012, 35(s1) : 66–70. |
 2017, Vol. 34
2017, Vol. 34





