2. 天津化学化工协同创新中心, 天津 300072
2. Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), Tianjin University, Tianjin 300072, China
近年来,磁性纳米材料因其具有的独特物理化学性质而受到越来越多研究者的关注,在生物医学、电化学、催化等领域都得到了广泛应用[1-3]。由于形貌对于纳米材料性质具有十分重要的影响,因此对磁性纳米材料的可控合成的研究是一大热点[4-7]。纳米Fe3O4作为一种重要的磁性纳米材料,主要的合成方法有共沉淀法[8]、热分解法[9]、溶剂热法[10]。其中溶剂热法由于其操作简便、实验结果重复性好,成为广泛采用的一种合成纳米Fe3O4的方法。
离子液体作为一种绿色溶剂,被广泛用于反应、分离、电化学等领域,它具有热稳定性高、几乎为0的饱和蒸汽压、电化学窗口宽等许多特点[11]。近些年,基于离子液体自组装形成的超分子结构,将其用于材料合成领域并成功合成了一系列具有新颖结构的纳米材料[12-13]。采用离子液体合成材料主要有2种方法:一是通过单独采用离子液体作为溶剂的离子热合成法(ionothermal synthesis),最早由Morris提出用于合成磷铝分子筛[14]。另一种方法将离子液体作为结构导向剂添加入反应体系,通过离子液体辅助溶剂热法或水热法合成,南开大学郑文君在这方面做了许多工作[15-17]。而关于使用离子液体合成Fe3O4的研究还比较少,迄今为止仅有一篇文献报道采用1-十六烷基-3-甲基咪唑氯合成了无规则的片状微米Fe3O4[18]。
本研究采用离子液体辅助溶剂热法成功合成了粒径均一的珊瑚状Fe3O4纳米簇,重点研究其微观形貌、晶相、表面性质及磁性能等特性,并与无离子液体辅助合成的球形Fe3O4纳米簇作比较。
1 实验部分 1.1 溶剂热法合成Fe3O4取2 mmol Fe (NO3)3·9H2O溶于27 mL乙二醇溶剂中,加入或不加入适量离子液体1-癸基-3甲基咪唑氯盐[Dmim]Cl,室温搅拌10 min后,加入12 mmol乙酸钠继续搅拌10 min,转移至50 mL水热釜中,200 ℃反应24 h,产物通过外加磁场分离,分别用无水乙醇和去离子水洗涤3次,60 ℃下真空干燥24 h。
1.2 Fe3O4的分析表征SEM表征:采用日本日立公司的S-4800F场发射扫描电子显微镜(FE-SEM)分析产品的形貌、尺寸及粒度分布。
TEM表征:采用日本电子公司JOEL-2100F场发射透射电子显微镜(TEM)分析样品的新貌和微观结构。
XRD表征:采用Bruker公司的D8 Advance X射线粉末衍射仪(Cu_Kα radiation λ=0.15418 nm)分析样品的晶相。
低温氮气吸-脱附实验:采用美国micromeritics公司Tristar 3000型自动物理吸附仪测定样品的比表面积。样品在200 ℃下脱气3 h,液氮温度-196 ℃,以BET方法计算比表面积。
VSM表征:采用LDJ 9600-1型震动样品强磁机(美国LDJ公司)测量样品的磁性能,测量温度为室温。
2 结果与讨论 2.1 SEM表征分别对在离子液体辅助溶剂热法和未加入离子液体条件下合成的Fe3O4进行SEM表征,结果如图 1所示。

|
| 图 1 Fe3O4纳米团簇的SEM图 Figure 1 SEM images |
| |
由图 1a)和图 1b)可以看到,在离子液体[Dmim]Cl存在的条件下成功合成了珊瑚状Fe3O4纳米簇,且这些纳米簇具有均一的粒径,平均粒径约为160 nm。其中,高分辨率的SEM照片[图 1a)]显示这些珊瑚状团簇是由一些微小的片状Fe3O4堆积形成,片状Fe3O4直径大约为40 nm,厚度约为6 nm,形成的团簇具有粗糙的表面和丰富的孔隙。相反,未加入离子液体时,合成的Fe3O4为球形的纳米簇[图 1c)和图 1d)],但粒径分布不均一,粒径介于160~200 nm之间,由图 1c)可进一步看出,此球状纳米簇同样是由初级构筑单元组装形成的二级结构,不同的是其初级单元是粒径在30 nm左右的纳米颗粒,与图 1a)和图 1b)相比,球形Fe3O4纳米簇具有较为光滑的表面和较少的堆积形成的孔隙。
由分析可知,造成2种纳米簇形貌不同的主要原因是构成这两种纳米簇的初级构筑单元的形貌(纳米片和纳米颗粒)不同。当加入离子液体作为结构导向剂时,它通过氢键和静电力与晶体表面相互作用而吸附在晶体表面,同时吸附的离子液体间还会通过π-π作用堆叠以进一步增强其在晶体表面的稳定性,从而阻碍了晶体生长的各向同性,促成了晶体的取向生长[17-18],形成初级片状结构并进而组装形成最终的珊瑚状纳米团簇。而没有加入离子液体的Fe3O4晶体的生长依然保持着各向同性,因此形成了初级纳米颗粒并组装形成最终的球状纳米团簇。
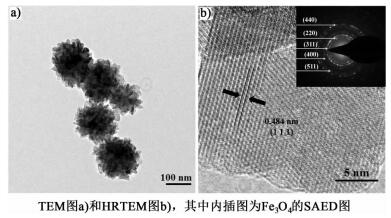
2.2 TEM表征为了进一步探究珊瑚状Fe3O4产品的微观形貌与晶体结构,我们还对其进行了TEM表征以及选取电子衍射(SAED),结果如图 2所示。
|
| 图 2 离子液体存在下合成的珊瑚状Fe3O4纳米簇TEM图a)和HRTEM图b) Figure 2 TEM a) and HRTEM b) images |
| |
从图 2a)可以更加清晰地看到,离子液体辅助溶剂热法合成的Fe3O4呈现珊瑚状形貌,并且是由纳米片堆积形成的多级结构。初级构筑单元纳米片和纳米团簇的粒径大小均与SEM表征结果相一致。图 2b)为珊瑚状纳米团簇的高分辨透射电镜(HRTEM)图,经测量,晶面间距为0.484 nm,符合Fe3O4的(111)晶面。通过SAED我们得到了多晶结构的衍射环,分别对应Fe3O4的多个晶面[如图 2b)内插图所示],证明了合成的产物确实为Fe3O4。
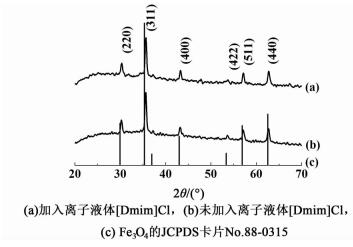
2.3 XRD表征为了确定产物Fe3O4的晶体结构和晶粒尺寸,我们进行XRD表征,结果如图 3所示。
|
| 图 3 合成的Fe3O4纳米团簇的XRD图 Figure 3 XRD patterns of the Fe3O4 nanoclusters synthesized |
| |
从图 3可以看出,无论是加入离子液体[图 3a)]还是未加入离子液体[图 3b)],产物的相对峰强度和峰位置都与立方晶系反尖晶石结构的纯Fe3O4 [JCPDS No. 88-0315, 图 3c)]相一致,同时没有观察到其它无关的衍射峰。通过Debye-Scherrer方程,我们选择了衍射峰最强的(311)晶面进行计算,分别得到了离子液体辅助溶剂热法合成的珊瑚状和未加离子液体溶剂热法所得球形Fe3O4纳米簇的晶粒尺寸,结果表明:珊瑚状Fe3O4纳米簇的晶粒尺寸为29.0 nm,球形团簇的晶粒尺寸为29.3 nm,与之前通过SEM分别观测到的纳米片和纳米颗粒的尺寸很接近,进一步印证了这2种纳米簇都是通过初级构筑单元(纳米片和纳米颗粒)组装构建形成的。
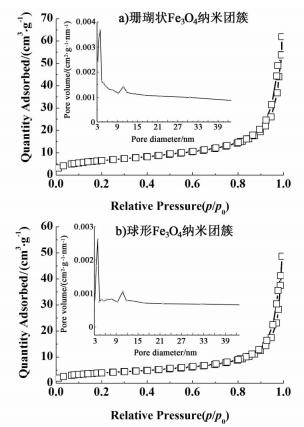
2.4 表面性质与磁性能表征为了研究合成的Fe3O4纳米簇的表面性质,分别对采用离子液体辅助溶剂热法合成的珊瑚状Fe3O4纳米簇和未采用离子液体辅助合成的球形Fe3O4团簇进行了氮气吸脱附实验,得到氮气吸脱附曲线及对应的孔径分布如图 4所示。
|
| 图 4 3种样品的氮气吸脱附曲线和相应的孔分布 Figure 4 The nitrogen adsorption-desorption isotherms and corresponding pore-size distribution (inset) |
| |
通过BET方法计算得到的比表面积分别为23.8 m2·g-1和10.6 m2·g-1,可见经离子液体辅助合成的Fe3O4比表面积提高至原来的2倍多,其原因在于两者微观形貌的差异。比较而言,由片层结构组装形成的珊瑚状Fe3O4纳米簇具有更丰富的孔隙结构,且表面粗糙程度大,因此具有更高的比表面积。珊瑚状Fe3O4的这种微观形貌与表面结构的特点使其有望成为优异的催化剂载体。
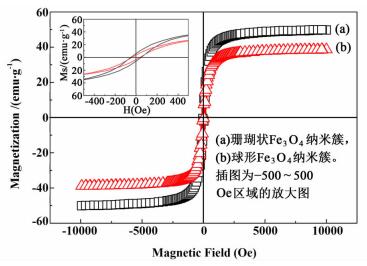
2种Fe3O4纳米簇的磁性能测量结果如图 5所示。
|
| 图 5 室温测量的磁滞回线 Figure 5 Magnetization hysteresis loops recorded at room temperature |
| |
图 5中曲线(a)和(b)分别为珊瑚状和球形Fe3O4纳米簇在室温下测量的磁滞回线。通过对原点附近处的放大,我们可以发现,2种样品的磁滞回线都未经过原点,在X轴和Y轴的截距都不为0,表明它们都有一定的矫顽力和剩余磁化强度,但是数值都不大,珊瑚状纳米簇的矫顽力和剩余磁化强度分别为47.9 Oe和8.0 emug-1,球状纳米簇的矫顽力和剩余磁化强度分别为35.0 Oe和2.5 emug-1。此外,珊瑚状Fe3O4纳米团簇的饱和磁化强度为50.1 emug-1,高于球形纳米簇的40.2 emug-1,但都小于文献[10]中报道的单级结构的Fe3O4纳米球的饱和磁化强度(81.9 emug-1)。究其根本原因还是由微观形貌所决定。由于2种纳米簇均由更小尺寸的初级构筑单元组装形成,因此它们的饱和磁化强度与单级结构的纳米球相比较低。而珊瑚状纳米簇的饱和磁化强度大于球形纳米簇也是由于其构筑单元纳米片的平均尺寸相对较大所致。
3 结论通过离子液体辅助溶剂热法得到了粒径在160 nm左右、形貌均一的珊瑚状Fe3O4纳米簇,该团簇由Fe3O4纳米片初级结构组装形成,表面粗糙度大,孔隙结构丰富,与未加入离子液体溶剂热法合成的球形Fe3O4纳米簇相比,比表面积更大,饱和磁化强度更高,其独特的珊瑚状孔隙结构特点使其有望成为优异的磁性可回收催化剂、催化剂载体或吸附剂。而离子液体[Dmim]Cl作为结构导向剂,起到了有效调控Fe3O4形貌及性能的作用。
| [1] | Daniele M A, Shaughnessy M L, Roeder R, et al. Magnetic nanoclusters exhibiting protein-activated near-infrared fluorescence[J]. ACS Nano, 2012, 7(1) : 203–213. |
| [2] | Kang E, Jung Y S, Cavanagh A S, et al. Fe3O4 nanoparticles confined in mesocellular carbon foam for high performance anode materials for lithium-ion batteries[J]. Advanced Functional Materials, 2011, 21(13) : 2430–2438. DOI: 10.1002/adfm.201002576 |
| [3] | Deng Y, Cai Y, Sun Z, et al. Multifunctional mesoporous composite microspheres with well-designed nanostructure:A highly integrated catalyst system[J]. Journal of the American Chemical Society, 2010, 132(24) : 8466–8473. DOI: 10.1021/ja1025744 |
| [4] | Geng B, Zhan F, Jiang H, et al. Egg albumin as a nanoreactor for growing single-crystalline Fe3O4nanotubes with high yields[J]. Chem Commun, 2008(44) : 5773–5775. DOI: 10.1039/b813071j |
| [5] | Jia C, Sun L, Luo F, et al. Large-Scale synthesis of single-crystalline iron oxide magnetic nanorings[J]. Journal of the American Chemical Society, 2008, 130(50) : 16968–16977. DOI: 10.1021/ja805152t |
| [6] | Kim D, Lee N, Park M, et al. Synthesis of uniform ferrimagnetic magnetite nanotubes[J]. Journal of the American Chemical Society, 2008, 131(2) : 454–455. |
| [7] | Peng S, Sun S. Synthesis and characterization of monodisperse hollow Fe3O4 nanoparticles[J]. Angewandte Chemie, 2007, 119(22) : 4233–4236. DOI: 10.1002/(ISSN)1521-3757 |
| [8] | Li Z, Tan B, Allix M, et al. Direct coprecipitation route to monodisperse dual-functionalized magnetic iron oxide nanocrystals without size selection[J]. Small, 2008, 4(2) : 231–239. DOI: 10.1002/(ISSN)1613-6829 |
| [9] | Sun S, Zeng H. Size-Controlled synthesis of magnetite nanoparticles[J]. Journal of the American Chemical Society, 2002, 124(28) : 8204–8205. DOI: 10.1021/ja026501x |
| [10] | Deng H, Li X, Peng Q, et al. Monodisperse magnetic single-crystal ferrite microspheres[J]. Angewandte Chemie, 2005, 117(18) : 2842–2845. DOI: 10.1002/(ISSN)1521-3757 |
| [11] | Dupont J. From molten salts to ionic liquids:A "nano" journey[J]. Accounts of Chemical Research, 2011, 44(11) : 1223–1231. DOI: 10.1021/ar2000937 |
| [12] | Zhang J, Wang J, Zhou S, et al. Ionic liquid-controlled synthesis of ZnO microspheres[J]. Journal of Materials Chemistry, 2010, 20(43) : 9798–9804. DOI: 10.1039/c0jm01970d |
| [13] | Torimoto T, Tsuda T, Okazaki K, et al. New frontiers in materials science opened by ionic liquids[J]. Advanced Materials, 2010, 22(11) : 1196–1221. DOI: 10.1002/adma.v22:11 |
| [14] | Cooper E R, Andrews C D, Wheatley P S, et al. Ionic liquids and eutectic mixtures as solvent and template in synthesis of zeolite analogues[J]. Nature, 2004, 430(7003) : 1012–1016. DOI: 10.1038/nature02860 |
| [15] | Lian J, Duan X, Ma J, et al. Hematite (α-Fe2O3) with various morphologies:Ionic liquid-assisted synthesis, formation mechanism, and properties[J]. ACS Nano, 2009, 3(11) : 3749–3761. DOI: 10.1021/nn900941e |
| [16] | Zheng W, Liu X, Yan Z, et al. Ionic liquid-assisted synthesis of large-scale TiO2 nanoparticles with controllable phase by hydrolysis of TiCl4[J]. ACS Nano, 2008, 3(1) : 115–122. |
| [17] | Duan X, Kim T, Li D, et al. Understanding the effect models of ionic liquids in the synthesis of NH4-Dw and γ-AlOOH nanostructures and their conversion into porous γ-Al2O3[J]. Chemistry-A European Journal, 2013, 19(19) : 5924–5937. DOI: 10.1002/chem.201203176 |
| [18] | Liu X, Duan X, Qin Q, et al. Ionic liquid-assisted solvothermal synthesis of oriented self-assembled Fe3O4 nanoparticles into monodisperse nanoflakes[J]. Cryst Eng Comm, 2013, 15(17) : 3284–3287. DOI: 10.1039/c3ce00035d |
 2017, Vol. 34
2017, Vol. 34





