当前温室效应已成为人类社会可持续发展面临的全球性问题,CO2是造成温室效应主要的气体之一,对温室效应的贡献占70%[1]。而我国的CO2排放量居世界第一[2],我们国家面临着CO2减排的艰巨任务。高温烟道气是CO2长期稳定集中的排放源,因此,合成高温下能有效脱除CO2的吸附剂成为人们的研究重点。
目前CO2高温吸附剂以钙基吸附剂[3]、水滑石类吸附剂[4]、锂基吸附剂[5-6]为主。其中,钙基吸附剂原料来源广泛、价格便宜,但再生温度较高,容易烧结;水滑石类吸附剂在高温时能转化为化学吸附,但吸附量仍较低[4];2001年日本东芝公司和东芝陶瓷公司成功开发出用于吸收CO2的新型陶瓷材料--硅酸锂[7],这种新材料高温吸收CO2的能力超过其他陶瓷材料[8-9],具有吸收容量大、循环性能好等,被认为是最具潜力的CO2高温吸附剂。
为了提高硅酸锂基吸附剂吸附效果,可改变制备方法和离子掺杂。改变制备方法可以在一定程度上改善吸附剂的吸附性能,离子掺杂能够加强Li+、O2-在双壳中的扩散,进一步增强吸附效果[10]。硅酸锂的制备方法主要有固相法、溶胶凝胶法、浸渍沉淀法。固相法产量高、成本低、制备工艺简单,但产品颗粒尺寸较大[11];溶胶-凝胶法,反应物料可以在分子水平上均匀混合、反应温度低、反应容易进行,但是难以合成出纯的硅酸锂[12];浸渍沉淀法可以获得纯度较高的硅酸锂,且样品颗粒较小,制备工艺简单,有利于大规模生产。在离子掺杂中,有钠、钾、铁、钛、铝掺杂,其中铝掺杂所得吸附剂被认为是最具发展前景的硅酸锂基吸附剂[13]。这种固溶体更能改善硅酸锂基吸附剂中Li+的扩散,这样有利于促进CO2的吸附;另外基于结构和热力学的考虑,铝离子的掺杂更易产生缺陷,且铝离子属于快离子导体[14-15]。
埃洛石纳米管(halloysite nanotubes,HNTs)是一种结晶度良好的天然纳米管,具有纳米级的中空管状结构,比表面积高等特点,其分子式为Al2Si2O5(OH)4·nH2O,n为0或2[16],分别代表脱水和水化状态,其晶胞结构为单斜晶系。埃洛石纳米管多为管状结构,管内壁是铝氧八面体层,外壁是硅氧四面体层,内表面是Al-OH基团,它的外表面则是O-Si-O基团。经煅烧后仍然保持管状结构[17],其中的铝仍然是以结构铝的形式存在,故本研究尝试掺杂结构铝,进一步改善硅酸锂基吸附剂的吸附性能。
在硅酸锂基吸附剂掺杂改性的研究中,未有利用HNTs改性的相关报道,因此,本研究在以酸处理后的煤系高岭土为硅源,研究不同方法制备硅酸锂基吸附剂的基础上,进一步探讨了以HNTs的形式掺杂铝对硅酸锂基吸附剂的吸附性能的影响,并从硅酸锂基吸附剂的结构、形貌等方面进行了分析。
1 实验 1.1 实验试剂实验所用原料为碳酸锂、硝酸锂、氨水、无水乙醇、盐酸(AR,天津光复精细化工研究所);煤系高岭土(华生煤系高岭土);埃洛石纳米管(HNTs,原料来源于广西)。
1.2 埃洛石纳米管预处理称取25 g的100目HNTs,加入体积比1:10的硫酸溶液,室温搅拌3 h,过滤,洗涤至中性,干燥,研磨,过100目筛。
取上述除杂后的HNTs,在马弗炉中750 ℃煅烧2 h,得到热处理的HNTs,分子式为Al2O3·2SiO2。
1.3 硅酸锂的制备以高岭土酸处理后得到的物料(溶铝率为87.58%)为硅源(以下简称为高岭土SiO2),采用高温固相法和浸渍沉淀法制备硅酸锂吸附剂。
高温固相法,即将高岭土-SiO2和Li2CO3按一定的比例混合,其中n(Si):n(Li)=1:4,并加入适量的无水乙醇,充分研磨,将多余的乙醇加热蒸干,干燥完全后,在马弗炉中750 ℃煅烧6 h,自然冷却,将所得样品研磨,过100目筛。
浸渍沉淀法,即称取一定量LiNO3溶于无水乙醇中,加热至40 ℃,加入高岭土SiO2[其中n(Si):n(Li)=1:4],浸渍搅拌一段时间后,以每6 s 1滴的速度滴加一定量的氨水,然后静置一段时间,于烘箱中80 ℃干燥,干燥完全后,研磨,然后将混合物置于马弗炉中于750 ℃煅烧4 h,自然冷却,将所得样品研磨,过100目筛。
按照配比n(LiNO3):n(高岭土SiO2):n(HNTs)=4(1-x):1-3x:x[其中n(Si):n(Li)=1:4)],其中x=1.04%、1.90%、2.80%和3.71%,准确称取高岭土SiO2、LiNO3、经预处理的HNTs,按照浸渍沉淀法制备硅酸锂基吸附剂,记为(1-x) Li4SiO4·xAl2O3。
1.4 测试分析采用荷兰Panalytical公司X′Pert Pro型X射线衍射分析仪测定样品的晶体结构,辐射源为Co_Kα,管电压为40 mV,管电流为40 mA,扫描范围为10°~90°,扫描速率为8(°)/min。采用日本日立公司S-4800型场发射扫描电子显微镜观察样品的微观形貌。采用ASAP-2010C型吸附仪进行测试样品的比表面积。采用美国Perkin-Elmer公司生产的型号为DIAMOND差热-热重联用分析仪(DTA-TG)进行热分析过程,取一定质量的样品,首先在100 mL/min N2气氛下以10 ℃/min的速率由室温升温至760 ℃并保温至恒量,目的是除去样品在存放过程中从大气中吸收的水分和CO2,然后在N2气氛下降温至250 ℃,之后切换为CO2气体,60 mL/min,以10 ℃/min的速率升温至760 ℃,并保温15 min。
2 结果及分析 2.1 XRD分析图 1为所制备样品的XRD图。

|
| 图 1 硅酸锂基吸附剂的XRD图 Figure 1 XRD patterns of lithium orthosilicate based sorbents |
| |
样品的特征衍射峰与PDF卡片37-1472相吻合,为Li4SiO4的特征峰,说明通过固相法和浸渍沉淀法可成功制备硅酸锂基吸附剂。制得的样品中除Li4SiO4外,还含有少量的Li2SiO3(PDF卡号30-0766)、Li2CO3(PDF卡号22-1141)和LiAlSi2O6(PDF卡号35-0797)。对比固相法和浸渍沉淀法,采用浸渍沉淀法制备的样品的XRD衍射峰的强度减弱,且峰形相对较宽,这表明浸渍沉淀法制备的硅酸锂基吸附剂结晶度较低,晶粒较小。对比采用浸渍沉淀法HNTs掺杂前后的XRD谱图,可以看出,掺杂后衍射峰的强度变高,峰形变宽,说明掺杂后的硅酸锂基吸附剂结晶度较大,晶粒较小。
2.2 SEM分析图 2是分别用2a)固相法、2b)浸渍沉淀法制备的硅酸锂基吸附剂的SEM图。

|
| 图 2 硅酸锂基吸附剂的SEM图 Figure 2 SEM images of lithium orthosilicate based sorbents |
| |
由图 2可以看出2种方法制备的硅酸锂基吸附剂均呈现不规则的颗粒状,固相法制备的样品颗粒较大,约为3~30 μm,且颗粒大小分布不均匀,表面积为2.21 m2/g;浸渍沉淀法制备的样品颗粒较小,约为3~5 μm,且颗粒大小分布较均匀,表面积为5.59 m2/g,是固相法的2.53倍,较大的比表面积有利于增加吸附剂与CO2的接触面积,改善吸附效果。
图 3是掺杂HNTs前后硅酸锂基吸附剂的SEM图,图 3a)是未掺杂的样品, 图 3b)是掺杂量为x=1.04%的样品。

|
| 图 3 掺杂前后硅酸锂基吸附剂的SEM图 Figure 3 SEM of lithium orthosilicate based sorbents |
| |
由扫描电镜图可以看出,2个样品均有不同程度的烧结,然而掺杂了HNTs的样品烧结程度较轻,表面相对较疏松,而疏松的表面结构,有利于增加样品与CO2的接触面积。由此可以推测,较大的比表面积和疏松的表面结构,将有利于提高吸附剂对CO2的吸附性能。
2.3 热重分析图 4是不同制备方法制备的硅酸锂基吸附剂的热重曲线图。

|
| 图 4 不同制备方法合成的硅酸锂基吸附剂的热重曲线图 Figure 4 TG curve of lithium orthosilicate based sorbents prepared by different methods |
| |
由图 4可以看出,固相法制备的硅酸锂基吸附剂在250~450 ℃范围内缓慢吸附CO2,当温度升高到450 ℃时,开始明显吸附CO2,550 ℃时,吸附速率有所减缓,当温度达到600 ℃以上时,又开始快速吸附CO2,718 ℃左右时吸附量达到最大,即29.84%,随着温度继续升高,样品开始快速脱附。
浸渍沉淀法制备的硅酸锂基吸附剂,在250~450 ℃范围内,对CO2的吸附量及吸附速率仍然很低,但相比固相法吸附剂而言,吸附量及吸附速率均有所增加。当温度升高到500 ℃时,开始明显吸附CO2,704 ℃左右时吸附量达到最大,即35.74%,随后样品开始快速脱附。
对比2种制备方法,在250~450 ℃温度范围内,浸渍沉淀法制备的吸附剂的吸附量和吸附速率略高于固相法; 当温度高于560 ℃时,浸渍沉淀法制备的吸附剂吸附量和吸附速率则明显高于固相法; 浸渍法制备的吸附剂的最大吸附量为35.74%,也明显大于固相法吸附剂(29.84%),与文献报道的以硅藻土为硅源采用浸渍法制备的吸附剂相比,远大于文献值29.89%[18]。另外,从图 4中还可以看出,无论是吸附温度还是脱附温度,浸渍沉淀法制备的吸附剂均低于固相法制备的吸附剂,大约15 ℃左右。分析原因应该是浸渍沉淀法制备的吸附剂有较大的比表面积和疏松的表面结构,二者有利于增加CO2与吸附剂的接触面积,有利于CO2在吸附剂表面及孔道中扩散,从而提高了吸附剂对CO2的吸附性能。
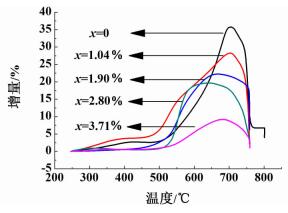
图 5是一系列的硅酸锂基吸附剂的热重曲线图。
|
| 图 5 掺杂量对硅酸锂基吸附剂吸附性能的影响 Figure 5 The influence of HNTs on absorption performance of lithium orthosilicate based sorbents |
| |
由图 5可以看出,以埃洛石纳米管的形式掺杂铝后,随掺杂量的增加,最大吸附量逐渐降低。但掺杂后能明显提高吸附剂在500~650 ℃范围内的吸附量,且吸附效果优于文献值[13],说明以结构铝的形式掺杂优于元素掺杂,这可能是因为结构铝较稳定,可形成稳定的空穴,更有利于Li+和O2-的迁移以及CO2的扩散。最适宜掺杂量为1.04%,具体数据详见表 1。
| x/% | 最大吸附量/% | 540 ℃时/% | 600 ℃时/% |
| 文献值[13] | 16.50(760.0 ℃) | 3.20 | 5.20 |
| 0 | 35.78(704.4 ℃) | 5.35 | 12.94 |
| 1.04 | 28.15(704.5 ℃) | 12.78 | 19.14 |
| 1.90 | 22.24(663.4 ℃) | 6.43 | 17.42 |
| 2.80 | 19.81(639.5 ℃) | 4.56 | 18.85 |
| 3.71 | 9.16(682.4 ℃) | 1.84 | 5.50 |
颗粒大小影响吸附剂的吸附性能,以高岭土酸处理后得到的物料为硅源,采用固相法和浸渍沉淀法制备的硅酸锂基吸附剂的颗粒大小分别为3~30 μm和3~5 μm,比表面积分别为2.21和5.59 m2/g,最大吸附量分别为35.74%和29.84%,浸渍沉淀法制备的样品的颗粒较小、分布均匀,比表面较大,吸附性能明显优于固相法。
通过以埃洛石纳米管的形式适量掺杂铝后,能够在一定程度上改善吸附剂在550~650 ℃范围内的吸附性能。当掺杂量x=1.04%时,所得吸附剂吸附效果最佳,540 ℃时吸附量为12.78%,是未掺杂时的2.39倍。
| [1] |
曲建升, 曾静静, 张志强. 国际主要温室气体排放数据集比较分析研究[J].
地球科学进展, 2008, 23(1) : 47–54.
Qu Jiansheng, Ceng Jingjing, Zhang Zhiqiang. The research on comparative analysis of international main greenhouse gas emissions data[J]. Advances in Earth Science, 2008, 23(1) : 47–54. |
| [2] | Internation Energy Agency. CO2 emissions from fuel combustion highlights[R]. Paris:IEA, 2012:7-16 |
| [3] | Radfarnia H R, Iliuta M C. Development of zirconium-stabilized calcium oxide absorbent for cyclic high-temperature CO2 capture[J]. Industrial & Engineering Chemistry Research, 2012, 51 : 10390–10398. |
| [4] | Oliveira E L G, Grande C A, Rodrigues A E. CO2 sorption on hydrotalcite and alkali-modifıed (K and Cs) hydrotalcites at high temperatures[J]. Separation and Purifıcation Technology, 2008, 62 : 137–147. DOI: 10.1016/j.seppur.2008.01.011 |
| [5] | Puccini M, Seggiani M, Vitolo S. Lithium silicate pellets for CO2 capture at high temperature[J]. Chemical Engineering Transactions, 2013, 35 : 373–378. |
| [6] |
刘玉兰, 丁彤, 马智, 等. 煤系高岭土为硅源制备硅酸锂及其对CO2的吸附性能[J].
化学工业与工程, 2013, 30(5) : 11–15.
Liu Yulan, Ding Tong, Ma Zhi, et al. CO2 absorption performance of Li4SiO4 prepared from coal-Kaolin[J]. Chemical Industry and Engineering, 2013, 30(5) : 11–15. |
| [7] |
佚名. 日本开发出硅酸锂新材料[J].
化工矿物与加工, 2001, 30(11) : 34–34.
Anonymous. A new lithium silicate materials developed by Japan[J]. IM & P, 2001, 30(11) : 34–34. |
| [8] | Kato M, Nakagawa K. New series of lithium containing complex oxides, lithium silicates, for application as a high temperature CO2 absorbent[J]. Journal of the ceramic society of Japan, 2001, 109(11) : 911–914. |
| [9] | Kato M, Yoshikawa S, Nakagawa K. Carbon dioxide absorption by lithium orthosilicate in a wide range of temperature and carbon dioxide concentrations[J]. Journal of Materials Science Letters, 2002, 21 : 485–487. DOI: 10.1023/A:1015338808533 |
| [10] | 刘杨.吸附强化甲烷水蒸汽重整制氢系统-Li4SiO4吸附剂制备、改性及CO2吸附动力学研究[D].上海:华东理工大学, 2013 Liu Yang. Sorption enhanced steam methane reforming for hydrogen production-preparation and CO2 absorption kinetic investigation of Li4SiO4[D]. Shanghai:East China University of Science and Technology, 2013(in Chinese) |
| [11] | Venegas M J, Fregoso-Israel E, Escamilla R, et al. Kinetic and reaction mechanism of CO2 sorption on Li4SiO4:Study of the particle size effect[J]. Ind Eng Chem Res, 2007, 46 : 2407–2412. DOI: 10.1021/ie061259e |
| [12] | Chowdhury M B I, Quddus M R, deLasa H I. CO2 capture with a novel solid fluidizable sorbent:Thermodynamics and temperature programmed carbonation-decarbonation[J]. Chemical Engineering Journal, 2013, 232 : 139–148. DOI: 10.1016/j.cej.2013.07.044 |
| [13] | Ortiz-Landeros J, Gòmez-Yãñez C, Palacios-Romero L M, et al. Structural and thermochemical chemisorption of CO2 on Li4+x(Si1-xAlx) O4 and Li4-x(Si1-xVx) O4 solid solutions[J]. J Phys Chem A, 2012, 116 : 3163–3171. DOI: 10.1021/jp3006298 |
| [14] | Huggins R A. Recent results on lithium ion conductors[J]. Electrochimica Acta, 1977, 22(7) : 773–781. DOI: 10.1016/0013-4686(77)80034-0 |
| [15] | Yang A, Wang H, Li W, et al. Synthesis of lithium metasilicate powders at low temperature via mechanical milling[J]. Am Ceram Soc, 2012, 95(6) : 1818–1821. DOI: 10.1111/jace.2012.95.issue-6 |
| [16] | Bailey S W. Crystal structures of clay minerals and their X-ray identification:Structures of layer silicates[M]. Brindley G W, Brown G Ed. London:Mineralogical Society, 1980 |
| [17] | 景瑞芳.埃洛石纳米管及高岭土纳米管脱硫性能的研究[D].天津:天津大学, 2013 Jing Ruifang. Study on desulfurization performance of halloysite nanotubes and Kaolin nanotubes[D]. Tianjin:Tianjin University, 2013(in Chinese) |
| [18] | Shan S, Li S, Jia Q, et al. Impregnation precipitation preparation and kinetic analysis of Li4SiO4-based sorbents with fast CO2 adsorption rate[J]. Industrial & Engineering Chemistry Research, 2013, 52(21) : 6941–6945. |
 2017, Vol. 34
2017, Vol. 34