石油资源的日益枯竭与环境危机的日益严重,更加突出了将生物质资源转化为生物石油的重要性。纤维素,作为最丰富的生物质资源,受到了越来越多的关注[1-5]。非均相催化剂,由于具有酸性、无腐蚀性、安全性、不易溶于水、易分离及可重复使用等特性,在纤维素降解转化方面具有重大的应用前景。
金属磷酸盐(metal phosphate),作为一种新型的固体酸催化剂被许多课题组研究[6-9]。Kamiya等[10]研究了磷酸氧锆,并证明这种高比表面积的介孔材料作为一种不溶于水的固体酸催化剂,具有良好的应用前景。Hattori等[11]研究了结晶磷酸氧锆,指出这类催化剂具有强酸位和弱酸位,所有的酸位均来源于磷羟基P (OH)。Sinhamahapatra等[12]研究了介孔磷酸氧铌材料,并证明这种固体酸催化剂中B酸位来源于偕磷羟基,而L酸位来源于Zr4+。除了Zr、Nb、Ti的磷酸氧盐外,磷酸氧钒也应用于催化反应,这种催化剂同时具备B酸和L酸,适用于脱水[13]、氧化[14-15]及异构化[16]等一系列反应。磷酸氧钛是一种无机离子交换剂,具有耐高温、耐辐射、耐强酸等优点,作为催化剂在石油化工和有机合成的应用方面有非常广阔的前景[17-18]。
在纤维素转化方面,Onda等[19]首次应用固体酸催化剂在环境友好的前提下将纤维素选择性转化为葡萄糖。Hirokazu等[20]和Dhepe等[21]研究了纤维素在双功能催化剂作用下直接生成山梨醇的反应。张等[22]制备了介孔磷酸氧铌材料,用于果糖在水相中脱水制备5-羟甲基糠醛,在温和的反应条件下,5-羟甲基糠醛的最大收率为45%,经过5次循环后,收率仅略微降到了32%。他们课题组也制备了双功能催化剂Ru/NbOPO4用于纤维素高选择性转化为山梨醇,得到山梨醇的产率高达59%~69%[23]。Regina等[24]研究了多种双功能催化剂催化纤维素转化体系,他们指出,无机酸与贵金属结合,用于纤维素一步转化成小分子醇的过程中,可以大大提高底物转化率,并且可以通过无机酸与贵金属的配比改变产物分布。
本研究制备了固体酸催化剂磷酸氧钛及双功能催化剂磷酸氧钛负载钌,首先研究磷酸氧钛催化纤维素水解反应生成葡萄糖的最适宜反应条件,在此基础上,以磷酸氧钛负载钌为催化剂,对其催化纤维素水解加氢反应制山梨醇的催化性能进行研究。旨在研究水解反应与加氢反应随温度、压强、时间等反应条件的变化规律,进一步探讨水解反应进行到何种程度时加氢最利于山梨醇的生成,以及加氢活性位Ru的存在对纤维素水解反应的促进作用。
1 实验部分 1.1 试剂与仪器微晶纤维素,Sigma-Aldrich公司;结晶四氯化钛,科密欧化学试剂有限公司;磷酸,分析纯(质量分数为85%),光复化学试剂有限公司;水合氯化钌,科密欧化学试剂有限公司。
分析样品的晶相结构采用的是日本理学公司D/MAX-2500型X射线粉末衍射仪,仪器配置:Cu_Kα辐射,管电流40 mA,电压40 kV。扫描条件:广角2θ扫面角度范围10°~90°,扫描速度8(°)/min。
催化剂表面酸性位的强度和数量采用美国Micromeritics公司的Autochem2910型全自动化学吸附仪进行测定。测量条件是:100 mg样品在氮气气氛下473 K预处理2 h,降温至313 K,注入NH3,每次1 mL,待吸附饱和基线平稳后,升到100 ℃氮气吹扫30 min,以去除催化剂表面以物理吸附形式存在的NH3,待基线平稳后程序升温到1 073 K,升温速率为10 K/min。热导检测器检测NH3脱附信号。
样品的物理吸附在Micromeritics公司的Tristar 3000自动物理吸附仪上进行,在77 K下测定样品的比表面积。样品比表面积采用Brunauer Emmett Teller (BET)方程计算。样品预处理条件:氮气气氛下,363 K下干燥1 h,573 K下干燥4 h。
1.2 材料制备 1.2.1 磷酸预处理纤维素实验中使用的反应底物是磷酸纤维素,按文献[25]制备方法如下:0.6 mL去离子水加入到装有0.2 g纤维素的离心管中,形成纤维素浆,缓慢加入9 mL冰磷酸,缓慢震荡,至纤维素浆完全溶解,再加入2 mL冰磷酸。将得到的混合物在冰箱中放置1 h,并伴随间歇性的搅拌。1 h后,将纤维素混合物取出,在剧烈搅拌下加入50 mL冰水,得到白色云状沉淀物,3 500 r/min下离心10 min,初步分离再生纤维素和磷酸溶液,用去离子水离心清洗几遍再生纤维素至pH>5,333 K条件下干燥,得到固体即为磷酸纤维素。
1.2.2 催化剂的制备磷酸氧钛(以下简称TPO)的制备是参考文献[26]中的方法:在四氯化钛水溶液中搅拌加入85%磷酸,n(磷)/n(钛)为2,将所得凝胶过滤,并放入带聚四氟乙烯内衬的水热釜中,在453 K下进行水热反应,6 h后过滤,用蒸馏水洗涤所得固体至pH>5,在333 K烘箱中干燥过夜。
双功能催化剂钌负载磷酸氧钛(以下简称Ru/TPO)按照以下方法制备:采用湿浸渍的方法在磷酸氧钛上负载金属Ru。称取1 g TPO,在烧杯中按照质量分数5%配置RuCl3溶液,将TPO加入到配置的RuCl3溶液中,搅拌,待溶剂挥发完全,随后在室温下干燥过夜。干燥后在573 K,氢气/氮气混合气氛内还原2 h,升温速率为1 K/min。
1.3 催化性能评价纤维素的水解反应是在有聚四氟乙烯内衬的不锈钢自动高压反应釜中进行。每一次反应中,加入0.1 g TPO,0.3 g磷酸纤维素和20 g水,密闭后用高纯H2置换反应釜中空气3次,充入高纯H2至设定压力值。反应釜搅拌加热,至设定温度后开始计时,达到设定的反应时间后,冰水浴冷却停止反应,缓慢减压放出气体,离心分离液体产物和剩余固体(包括未反应的纤维素和催化剂)。
纤维素的水解加氢反应是在带聚四氟乙烯内衬的不锈钢自动反应高压釜中进行。每一次反应中,加入0.1 g Ru/TPO,0.3 g磷酸纤维素和20 g水,密闭后用高纯H2置换反应釜中空气3次,充入高纯H2至设定压力值。反应釜搅拌加热,至设定温度后开始计时,达到设定的反应时间后,冰水浴冷却停止反应。
1.4 产物分析及计算液体产物用高效液相色谱(HPLC)进行定性和定量分析,固体干燥后称量,作好记录。
催化效果计算是参考刘等[27]的方法,纤维素的转化率由式(1)计算。
| $ {X_{cellulose}} = \frac{{{m_{cellulose0}} - {m_{cellulose}}}}{{{m_{cellulose0}}}} \times 100\% $ | (1) |
公式(1)中的mcellulose0和mcellulose表示反应前后的纤维素质量。
每个产物的选择性用公式(2)表示。
| $ {S_{product}} = \frac{{{Y_{product}}}}{{{X_{cellulose}}}} \times 100\% $ | (2) |
产品的收率由高效液相色谱中峰面积值根据各产品内标曲线计算得出。
水解反应和加氢反应中的产物共包括:可溶性低聚糖(oligosaccharides)、葡萄糖(glucose)、乙酰丙酸(LA)、5-羟甲基糠醛(HMF)、山梨醇(sorbitol)和脱水山梨醇(sorbitan)。
2 结果与讨论 2.1 表征结果 2.1.1 X-射线粉末衍射图 1为固体酸催化剂TPO及双功能催化剂Ru/TPO的XRD图谱。
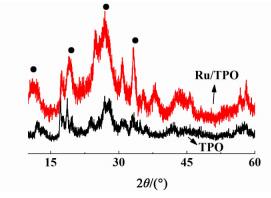
|
| 图 1 TPO, Ru/TPO的XRD图谱 Figure 1 XRD pattern of TPO and Ru/TPO |
| |
从图 1中可以看出,图 1中所示4个衍射峰,在2θ为15.812°、20.590°、28.217°及37.280°为Ti (HPO4)2·0.5H2O的衍射峰(JCPDS:33-1380)。磷酸氧钛的结晶度比较低。Ru/TPO的XRD谱图中没有观察到Ru的特征峰,证明Ru粒子均匀分散在TPO中。
2.1.2 NH3-TPD及BET表征图 2为TPO及Ru/TPO的NH3-TPD曲线。
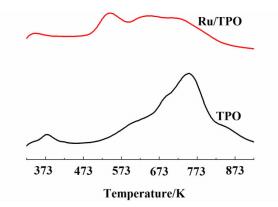
|
| 图 2 TPO, Ru/TPO的NH3-TPD Figure 2 NH3-TPD profiles of TPO and Ru/TPO |
| |
由图 2可见,在373 K处,TPO及Ru/TPO均有脱附峰,对应弱酸位。TPO在598、683和753 K处出现NH3脱附峰,Ru/TPO在543、643和753 K存在3个NH3脱附峰;这表明,负载Ru之后,相比于固体酸催化剂TPO,双功能催化剂Ru/TPO的中强酸位增多,强酸的酸位减少。酸量计算结果及BET比表面积列于表 1。
| Entry | Catalyst | Total acid sites/(mmol·g-1) | SBET/(m2·g-1) |
| 1 | TPO | 1.60 | 85.2 |
| 2 | Ru/TPO | 1.58 | 12.1 |
由表 1可以看出,虽然负载前后,中强酸位和强酸位的相对数量有所变化,但是2种催化剂的总酸量基本保持不变。酸量的具体的计算方法是,首先进行NH3校准:用Loop环(100 μL)进NH3,在10 ℃/min升温速率的程序升温条件下记录TCD信号,待出峰稳定之后,取稳定后的峰面积,计算峰面积和NH3体积之间的量化关系。峰面积与NH3体积之间的量化关系为:NH3体积=峰面积×0.1÷0.050075=峰面积×1.997004493。将NH3体积换算为NH3的物质的量:n=101.325×NH3体积÷(8.314×298.15)。NH3的物质的量即为对应的酸量。在NH3-TPD部分,从脱附曲线来看,未负载Ru的样品,其脱附面积显著高于负载Ru的样品,但负载Ru后的样品的吸附峰面积比较宽,按照面积的量来计算酸量,故2种样品酸量相近。
Ru/TPO的比表面比TPO有所减小,由85.2 m2/g下降到12.1 m2/g。
2.2 催化剂性能评价 2.2.1 TPO催化纤维素水解反应条件的优化纤维素生成山梨醇的反应,包括纤维素的水解和葡萄糖的加氢两步反应。其中,纤维素水解生成葡萄糖是速率控制步骤,因此,首先对TPO催化纤维素的水解反应进行考察。
图 3为纤维素的转化率及各产物收率随反应时间的变化曲线。
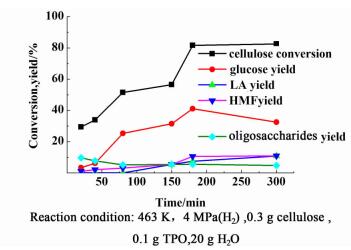
|
| 图 3 TPO催化纤维素水解反应随时间变化规律 Figure 3 Change of cellulose conversion and product yield with time |
| |
反应时间增加,纤维素的转化率一直增加,但增加速率减慢,水解反应主产物葡萄糖的收率,在180 min时达41.1%,时间再延长,收率降低。原因是,在反应开始阶段,纤维素在酸性位作用下水解为葡萄糖,随着反应的不断进行,主产物葡萄糖收率一直增加,充分反应后,继续延长反应时间,主产物葡萄糖在酸性位的作用下进一步水解生成乙酰丙酸等其他降解产物,故反应时间再增加,主产物葡萄糖的收率降低。其他副产物(HMF、LA)的收率均随反应时间增加而增加。因此水解反应的最适宜时间为180 min。
图 4为纤维素转化率及各产物收率随氢压变化的曲线图。可以看出,氢压对水解反应没有显著影响。水解反应的最适宜压强确定为4 MPa。
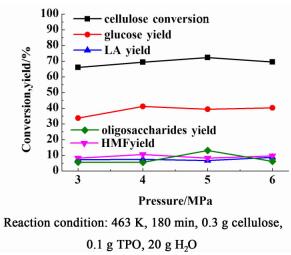
|
| 图 4 TPO催化纤维素水解反应随氢压变化规律 Figure 4 Change of cellulose conversion and product yield with hydrogen pressure |
| |
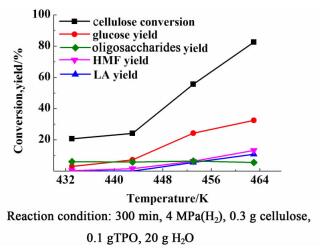
图 5为纤维素水解反应转化率及各产物收率效果随温度的变化规律。
|
| 图 5 TPO催化纤维素水解反应随温度变化规律 Figure 5 Change of cellulose conversion and product yield with temperature |
| |
随着反应温度的提高,纤维素转化率升高,水解主产物葡萄糖收率一直增加。由于超过463 K,液体水解离出的H+会增多,H+提供较强的B酸位,会导致水解产物葡萄糖继续脱水生成乙酰丙酸、HMF等副产物,当水解反应温度超过463 K,结焦现象非常明显,反应后反应液呈深黄色。故水解反应的最适宜温度确定为463 K。
2.2.2 Ru/TPO催化纤维素制山梨醇在研究了反应温度、反应压力、反应时间对TPO催化纤维素水解反应影响的基础上,初步确定了Ru/TPO催化纤维素水解加氢反应制备山梨醇的反应条件。考察水解加氢反应的转化率、产物分布随反应时间、氢压、反应温度的变化,同时,探究水解反应程度与山梨醇收率的关系。
图 6、图 7和图 8为催化纤维素水解和加氢反应中,纤维素转化率及各产物收率随反应时间、压氢、温度变化曲线。与相同反应条件下的水解反应对比,可以看出,在同一反应条件下,纤维素转化率及主产物收率均高于水解反应。

|
| 图 6 Ru/TPO催化纤维素水解加氢反应随时间变化规律 Figure 6 Change of cellulose conversion and product yield with time |
| |

|
| 图 7 Ru/TPO催化纤维素水解加氢反应随氢压变化规律 Figure 7 Change of cellulose conversion and product yield with pressure |
| |
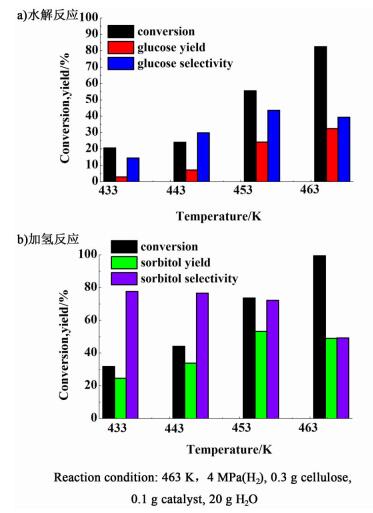
|
| 图 8 Ru/TPO催化纤维素水解加氢反应随反应温度变化规律 Figure 8 Change of cellulose conversion and product yield with temperature |
| |
对比图 6a)和图 6b)发现,2个反应主产物到达最高收率的反应时间不同。水解反应中,反应时间180 min时葡萄糖的收率为41.1%,而加氢反应中,反应时间仅为150 min时,主产物收率已达到最大值,为60.5%。上述对比证明了加氢催化剂的存在可以同时促进水解反应的进行。在水解反应和加氢反应中,第一步反应均为纤维素在高温水解离的H+的作用下水解生成可溶性低聚糖,可溶性低聚糖在固体酸催化剂作用下生成葡萄糖。加氢反应中,在贵金属Ru和氢气的存在下,葡萄糖进一步加氢生成山梨醇。由于加氢反应的最适宜反应时间小于水解反应的最适宜反应时间,而在相同反应条件下,高温水解离的H+是相同的,由此推测,加氢反应中第一步可溶性低聚糖的断键速度高于水解反应中可溶性低聚糖的断键速度。Ru/TPO对于水解反应的促进,不仅表现在产物收率上,同时也表现在反应速率上。
从图 7中可以看出,氢压对水解反应和加氢反应几乎都没有什么影响,在相同反应条件下,当使用双功能催化剂进行加氢反应时,加氢反应的反应效果仍是优于水解反应,进一步证明了双功能催化剂的存在促进了水解反应的进行这一结论。
席等[23]的研究表明在纤维素一步水解加氢反应中,金属Ru不仅仅提供加氢位,而且可以同时促进水解反应的进行。
对比图 8a)和图 8b)可以看出,水解反应和加氢反应的目标产物随温度变化趋势不相同。随着反应温度的增加,2个反应的磷酸纤维素转化率都升高,水解主产物葡萄糖收率一直增加,而加氢主产物山梨醇的收率先增加后降低,出现1个拐点。
对比相同反应条件下的水解和加氢反应可知,在水解反应效果最好的条件下进行加氢反应,并不能得到最高的山梨醇收率。因为纤维素转化反应体系中众多副反应的存在,水解反应与加氢反应随各反应因素的变化并不相同,选择接近水解最适宜条件(反应温度稍低于水解最适宜温度,反应时间略短于水解最适宜时间)的反应条件进行双功能催化剂的水解加氢反应可得到更好的反应效果。
2.2.3 Ru/TPO对葡萄糖的高效转化在纤维素水解加氢转化为山梨醇的过程中,纤维素先水解,生成葡萄糖,如果有加氢位的存在,葡萄糖会进一步发生加氢反应,生成山梨醇(见图 9)。

|
| 图 9 Ru/TPO催化纤维素转化过程 Figure 9 Cellulose conversion process by Ru/TPO |
| |
由于葡萄糖的生成是速率控制步骤,葡萄糖的加氢非常迅速,所以,水解反应和加氢反应同时发生[28]。为了探究固体酸催化剂TPO和双功能催化剂Ru/TPO在水解加氢反应中的催化效果,设计了不同物料比条件下的水解反应及加氢反应进行研究,见表 2。
| entry | catalyst | ratio (cat.:p-mcc)a |
conversion/ % |
yield/% | |||||
| glucose | LA | HMF | oligosaccharides | sorbitol | sorbitan | ||||
| 1b | TPO | 0.25 | 55.1 | 25.7 | 3.8 | 9.9 | 3.0 | ||
| 2 | TPO | 0.33 | 69.3 | 41.1 | 7.5 | 10.5 | 5.5 | ||
| 3 | TPO | 0.50 | 73.8 | 31.7 | 4.7 | 11.0 | 4.6 | ||
| 4 | TPO | 1.00 | 73.7 | 23.5 | 6.1 | 12.7 | 3.6 | ||
| 5 | TPO | 2.00 | 99.2 | 18.9 | 9.0 | 15.3 | 4.3 | ||
| 6c | Ru/TPO | 0.25 | 47.8 | 0.5 | 0 | 0 | 1.9 | 29.7 | 6.3 |
| 7 | Ru/TPO | 0.33 | 85.6 | 0.9 | 0 | 0 | 6.0 | 56.6 | 12.4 |
| 8 | Ru/TPO | 0.50 | 76.7 | 0 | 0 | 0 | 5.9 | 49.3 | 9.8 |
| 9 | Ru/TPO | 1.00 | 71.2 | 0 | 0 | 0 | 6.4 | 46.2 | 16.1 |
| 10 | Ru/TPO | 2.00 | 90.5 | 0 | 0 | 0 | 7.1 | 71.0 | 1.5 |
| 11 | blank | 36.2 | 10.0 | 0 | 3.7 | 9.0 | |||
| a: the p-mcc is the mix, changing the quality of catalyst; b: reaction condition: 463 K, 4 MPa (N2), 180 min (Entry 1-5); c: reaction condition: 463 K, 4 MPa (H2), 180 min (Entry 6-10). | |||||||||
表 2为水解反应(entry 1~5)和加氢反应(entry 6~10)随催化剂/反应物比(催化剂TPO、Ru/TPO与底物纤维素的物质的量之比)的产物收率表。在水解反应中,固体酸催化剂TPO加入的量越大,纤维素转化率越高,说明这种固体酸催化剂具有良好的酸性。但是,随着固体酸量的增加,主产物葡萄糖的收率并没有增加,相反,当催化剂与底物比高于0.33时,葡萄糖收率降低,这是因为葡萄糖在固体酸和高温水解离的H+的作用下会进一步异构、脱水生成HMF,HMF可水解生成LA。
在双功能催化剂的作用下,纤维素水解生成的葡萄糖,可以在酸性位的作用下水解生成HMF、LA和其他降解产物,也可以在加氢位的作用下加氢生成山梨醇,这2个反应存在竞争关系。
从表 2中可以看出,TPO负载Ru后,山梨醇的收率高于水解反应中葡萄糖的收率,证明Ru的存在可以抑制葡萄糖进一步降解的竞争反应,使葡萄糖快速加氢转化为目标产物山梨醇。entry 2中水解反应,葡萄糖与HMF、LA的总收率为59.1%,而同一反应条件下entry 7中葡萄糖、山梨醇与脱水山梨醇的总收率为69.0%,证明加氢反应的纤维素分解程度略大于水解反应,在主产物的收率方面,水解反应葡萄糖的收率41.1%,加氢反应的主产物收率山梨醇为56.6%。同样表明了,加氢位Ru的存在,会促进葡萄糖进行快速加氢反应,抑制葡萄糖的进一步降解的竞争反应,从而最大效率的将葡萄糖转化为山梨醇。
对比entry 5和entry 10,可以看出,催化剂用量较大时,加氢反应中葡萄糖的有效利用率更高,entry 5水解反应中,葡萄糖与HMF、LA的总收率为43.2%,葡萄糖仅有18.9%,而加氢之后,entry 10中山梨醇与脱水山梨醇的总收率高达72.5%,极大的提高了目标产物的选择性,从而提高了原料的利用率。
3 结论对固体酸催化剂TPO及双功能催化剂Ru/TPO催化纤维素水解反应、水解加氢反应分别进行了研究。以TPO催化纤维素水解反应为基础,选择水解反应效果较好的条件,进行水解加氢反应,实验证明,在水解反应效果最好的条件下进行加氢反应,并不能得到最高的山梨醇收率。选择接近水解最适宜条件(反应温度稍低于水解最适宜温度,反应时间略短于水解最适宜时间)的反应条件,进行双功能催化剂的水解加氢反应可得到更好的反应效果。此外,通过相同反应条件下水解反应和加氢反应的转化率及产物分布的对比,结果表明,双功能催化剂Ru/TPO的存在可以使葡萄糖进行加氢反应,同时减少葡萄糖进一步降解的发生,最大效率的将纤维素转化为山梨醇。
| [1] | Deng W, Tan X, Fang W, et al. Conversion of cellulose into sorbitol over carbon nanotube-supported ruthenium catalyst[J]. Catalysis Letters, 2009, 133(1/2) : 167–174. |
| [2] | Ding L, Wang A, Zheng M, et al. Selective transformation of cellulose into sorbitol by using a bifunctional nickel phosphide catalyst[J]. Chem Sus Chem, 2010, 3(7) : 818–821. DOI: 10.1002/cssc.v3:7 |
| [3] | Stijn V, Jan G, Jacobs P A, et al. Recent Advances in the catalytic conversion of cellulose[J]. Chem Cat Chem, 2010, 3(1) : 82–94. |
| [4] | Li N, Tompsett G A, Zhang T, et al. Renewable gasoline from aqueous phase hydrodeoxygenation of aqueous sugar solutions prepared by hydrolysis of maple wood[J]. Green Chemistry, 2011, 13(1) : 91–101. DOI: 10.1039/C0GC00501K |
| [5] |
王华, 宋志强, 韩金玉, 等. 水热体系下ZrO2-SiO2混合氧化物催化纤维素转化[J].
化学工业与工程, 2015, 32(1) : 1–5.
Wang Hua, Song Zhiqiang, Han Jinyu, et al. Catalytic conversion of cellulose in the presence of mixed-oxide ZrO2-SiO2 under hot compressed water (HCW) condition[J]. Chemcial Industry and Engineering, 2015, 32(1) : 1–5. |
| [6] | Lin R, Ding Y. A review on the synthesis and applications of mesostructured transition metal phosphates[J]. Materials, 2013, 6(1) : 217–243. DOI: 10.3390/ma6010217 |
| [7] | Sarkar A, Pramanik P. Synthesis of mesoporous niobium oxophosphate using niobium tartrate precursor by soft templating method[J]. Microporous and Mesoporous Materials, 2009, 117(3) : 580–585. DOI: 10.1016/j.micromeso.2008.08.001 |
| [8] | Tarafdar A, Panda A B, Pradhan N C, et al. Synthesis of spherical mesostructured zirconium phosphate with acidic properties[J]. Microporous & Mesoporous Materials, 2006, 95(1) : 360–365. |
| [9] | Gliozzi G, Innorta A, Mancini A, et al. Zr/P/O catalyst for the direct acid chemo-hydrolysis of non-pretreated microcrystalline cellulose and softwood sawdust[J]. Applied Catalysis B-Environmental, 2014, 145(1) : 24–33. |
| [10] | Kamiya Y, Sakata S, Yoshinaga Y, et al. Zirconium phosphate with a high surface area as a water-tolerant solid acid[J]. Catalysis Letters, 2004, 94(1/2) : 45–47. DOI: 10.1023/B:CATL.0000019329.82828.e4 |
| [11] | Hattori T, Ishiguro A, Murakami Y. Acidity of crystalline zirconium phosphate[J]. Journal of Inorganic and Nuclear Chemistry, 1978, 40(6) : 1107–1111. DOI: 10.1016/0022-1902(78)80519-3 |
| [12] | Spielbauer D, Mekhemer G A H, Riemer T, et al. Chem inform abstract:Structure and acidic properties of phosphate-modified zirconia[J]. Journal of Physical Chemistry B, 1997, 101(23) : 4681–4688. DOI: 10.1021/jp963785x |
| [13] | Carlini C, Patrono P, Galletti A M R, et al. Heterogeneous catalysts based on vanadyl phosphate for fructose dehydration to 5-hydroxymethyl-2-furaldehyde[J]. Applied Catalysis A-General, 2004, 275(1) : 111–118. |
| [14] | Centi G. Vanadyl pyrophosphate-A critical overview[J]. Catalysis Today, 1993, 16(1) : 5–26. DOI: 10.1016/0920-5861(93)85002-H |
| [15] | Marengo S, Patrono P, Comotti P, et al. Propane partial oxidation over M3+-substituted vanadyl phosphates dispersed on titania and silica[J]. Applied Catalysis A-General, 2002, 230(1) : 219–231. |
| [16] | Beneš L, Galli P, Massucci M A, et al. Thermal, structural and acidic characterization of some vanadyl phosphate materials modified with trivalent metal cations[J]. Journal of Thermal Analysis, 1997, 50(3) : 355–364. DOI: 10.1007/BF01980496 |
| [17] | Guo S, Song H, Bo C, et al. Synthesis of shape-controlled mesoporous titanium phosphate nanocrystals:The hexagonal titanium phosphate with enhanced hydrogen generation from water splitting[J]. International Journal of Hydrogen Energy, 2014, 39(6) : 2446–2453. DOI: 10.1016/j.ijhydene.2013.12.007 |
| [18] | Guo S, Han S. Constructing a novel hierarchical 3D flower-like nano/micro titanium phosphate with efficient hydrogen evolution from water splitting[J]. Journal of Power Sources, 2014, 267 : 9–13. DOI: 10.1016/j.jpowsour.2014.05.011 |
| [19] | Onda A, Ochi T, Yanagisawa K. Selective hydrolysis of cellulose into glucose over solid acid catalysts[J]. Green Chemistry, 2008, 10(10) : 1033–1037. DOI: 10.1039/b808471h |
| [20] | Kobayashi H, Matsuhashi H, Komanoya T, et al. Transfer hydrogenation of cellulose to sugar alcohols over supported ruthenium catalysts[J]. Chemical Communications, 2011, 47(8) : 2366–2373. DOI: 10.1039/C0CC04311G |
| [21] | Dhepe P L, Fukuoka A. Cracking of cellulose over supported metal catalysts[J]. Catalysis Surveys from Asia, 2007, 11(4) : 186–191. DOI: 10.1007/s10563-007-9033-1 |
| [22] | Shu Y, Oyama S T. Synthesis, characterization, and hydrotreating activity of carbon-supported transition metal phosphides[J]. Carbon, 2005, 43(7) : 1517–1532. DOI: 10.1016/j.carbon.2005.01.036 |
| [23] | Xi J, Yu Z, Xia Q, et al. Direct conversion of cellulose into sorbitol with high yield by a novel mesoporous niobium phosphate supported Ruthenium bifunctional catalyst[J]. Applied Catalysis A-General, 2013, 459(7) : 52–58. |
| [24] | Palkovits R, Tajvidi K, Procelewska J, et al. Hydrogenolysis of cellulose combining mineral acids and hydrogenation catalysts[J]. Green Chemistry, 2010, 12(6) : 972–978. DOI: 10.1039/c000075b |
| [25] | Zhang Y, Cui J, Lynd L R, et al. A transition from cellulose swelling to cellulose dissolution by o-phosphoric acid:Evidence from enzymatic hydrolysis and supramolecular structure[J]. Biomacromolecules, 2006, 7(2) : 644–648. DOI: 10.1021/bm050799c |
| [26] | Gu M, Yu D, Zhang H, et al. Metal (IV) Phosphates as solid catalysts for selective dehydration of sorbitol to isosorbide[J]. Catalysis Letters, 2009, 133(1/2) : 214–220. |
| [27] | Liu M, Wang H, Han J, et al. Enhanced hydrogenolysis conversion of cellulose to C2-C3 polyols via alkaline pretreatment[J]. Carbohydrate Polymers, 2012, 89(2) : 607–618. DOI: 10.1016/j.carbpol.2012.03.058 |
| [28] | Deng W, Wang Y, Zhang Q, et al. Development of bifunctional catalysts for the conversions of cellulose or cellobiose into polyols and organic acids in water[J]. Catalysis Surveys from Asia, 2012, 16(16) : 91–105. |
 2017, Vol. 34
2017, Vol. 34





