2. 天津化学化工协同创新中心, 天津 300072 ;
3. 天津力生制药股份有限公司, 天津 300111 ;
4. 天津工业大学环境与化学工程学院, 天津 300387
2. Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), Tianjin 300072, China ;
3. Tianjin Lisheng Pharmaceutical Co. Ltd, Tianjin 300111, China ;
4. School of Environmental and Chemical Engineering, Tianjin Polytechnic University, Tianjin 300387, China
吡啶不仅是含吡啶环类的农药和医药中间体的基础原料,也是日用化工、饲料、食品添加剂、子午轮胎工业的重要原料,而且在医药和工业领域中还可以作为特殊溶剂。作为中间体原料,吡啶在农药用途最为广泛,涉及杀虫剂、杀菌剂、除草剂、植物生长调节剂、杀鼠剂等农药品种,可用于生产百草枯、敌草快、毒死蜱等农药产品。1924年Chichibabin提出了以醛和氨为原料,大批量生产吡啶及其衍生物的工业方法,经过对催化剂的不断改进,吡啶碱的总产率已由50年代初的40%~50%提高到70%~80%,其中吡啶产率一般60%左右,经贵金属改性的催化剂,吡啶产率最高可达70%[1-2]。醛氨合成吡啶路线多采用流化床多相催化法生产吡啶碱,不仅原料廉价易得,而且仅需通过改变反应原料或原料比,就能在同一装置中生产出各种吡啶衍生物,但这条工艺路线也存在着一些不足,原料来源于石化产品,吡啶选择性不高,副产一定比例的3-甲基吡啶,并且催化剂单程寿命短[3]。
四氢糠醇是由我国丰富廉价的原料糠醛转变而来,作为可再生的农副产品,与目前吡啶工业生产中的来源于化石产品的甲醛、乙醛在成本和环保方面更具有竞争力。20世纪70年代,Butler and Laundon研究了γ-Al2O3上分别负载金属Pd[4]、酸性氧化物MoO3、碱性氧化物K2O[5]四氢糠醇合成吡啶,以及Pd/γ-Al2O3催化剂上合成吡啶的动力学[6],并推测了四氢糠醇合成吡啶的反应机理,其中以四氢糠醇为原料,Pd/γ-Al2O3为催化剂,反应温度为400 ℃,在氮气氛围中合成吡啶的最高收率为60%,四氢糠醇的转化率为100%。20世纪90年代,Choi and Lee研究了四氢糠醇合成吡啶过程中Pd/γ-Al2O3催化剂表面吸附氨气的存在状态[7],载体和钯负载量[8]的影响以及Pd/γ-Al2O3催化剂上合成吡啶的动力学,提出反应速率的快慢由催化剂表面反应物分子吸附强弱决定的[9],在反应温度320 ℃的条件下,吡啶的选择性大于90%。由于Pd成本高,本课题组一直对复合金属氧化物催化剂改性,并且吡啶收率均在80%以上[10-16]。虽然四氢糠醇合成吡啶的工艺路线中四氢糠醇来源广泛、可再生,原子利用率高,并且吡啶选择性单一,生成甲基吡啶的量很少,但是在以四氢糠醇合成吡啶的工艺路线中存在两大难题,一是继续提高吡啶选择性,二是提高催化剂寿命。
本研究以四氢糠醇为原料,MoO3-NiO/γ-Al2O3为催化剂合成吡啶,针对催化剂失活问题进行系列研究,通过一系列表征分析,确定了催化剂失活的原因,并进行了简单再生,希望能为开发高效催化剂及寻找更好的催化剂再生方法提供参考。
1 实验部分 1.1 催化剂的制备γ-Al2O3的制备:以2%的稀硝酸为黏结剂、PEG600为润滑剂与拟薄水铝石固体粉末混合,充分研磨,挤条成型后,于120 ℃烘箱中干燥12 h,然后放于马弗炉450 ℃煅烧6 h得γ-Al2O3,最后将制备好的γ-Al2O3载体剪成3~5 mm的柱状。
浸渍法制备10%MoO3-10%NiO/γ-Al2O3催化剂:称取一定质量的钼酸铵和硝酸镍,依次溶于一定量的蒸馏水中,待完全溶解后,将一定量的γ-Al2O3浸渍到上述溶液中,室温浸渍12 h后,在120 ℃干燥12 h至溶液完全挥发,然后放于马弗炉中575 ℃煅烧5 h。
1.2 催化剂的表征采用日本Bel公司的Belprep vacⅡ型比表面积测量仪,对催化剂的比表面积以及孔隙度进行测量;运用Vario Micro cube EL III元素分析仪对催化剂上的C、N和H元素含量进行测量;利用日立公司S-4800场发射扫描电子显微镜和日本电子公司的JEM-2100F观察失活催化剂的形貌;催化剂的物相组成分析采用德国布鲁克AXS有限公司D8-Focus射线衍射仪,Cu_Kα特征衍射辐射,石墨单色滤光片,衍射角转速10(°)/min,工作电压40 kV,电流100 mA,扫描范围10°~90°范围之间;采用美国热电公司的DXR Microscope激光显微拉曼光谱仪对失活催化剂表面碳物种进行检测,检测波长为532 nm;催化剂的表面元素分析用美国PE公司PHI l600型进行X光电子能谱分析(XPS),Ag靶,Kα;功率,250 W;电压,15 kV;采用美国TA仪器公司出产的TGA-500热重分析仪,采用WCT-1型差热天平(氮气气氛),升温速率为10 ℃/min;采用美国Nicolet公司的Nexus智能型傅里叶变换红外光谱仪NEXUS TM吡啶为探针分子,测量催化剂表面的酸性质。
1.3 催化剂的评价取20 g制备好的10%MoO3-10%NiO/γ-Al2O3催化剂,放入内径13 mm,高1 000 mm的固定床反应管中,检查固定床密封良好后插好控温热电偶,接通预热保温装置和反应床加热装置电源。0.1 MPa氮气氛围下升温到反应温度550 ℃,关闭氮气,接通氨气,氨气流量为500 mL/min。开启微量进料泵电源,四氢糠醇经200 ℃充分预热后进入反应管,四氢糠醇的流量为0.15 mL/min。开启冷凝水,产品经冷凝液化后进入收集器,尾气经吸收后放空。每隔3 h进行取样,产品用安捷伦6890N气相色谱进行分析,氢离子火焰检测器,气相色谱柱为DB-1701。吡啶的产率为四氢糠醇的选择性×吡啶选择性。催化剂失活后,催化剂仍然装在固定床反应器中,用空气泵鼓入空气,10(°)/min升温到600 ℃保温5 h。
2 结果与讨论 2.1 催化剂的活性变化曲线MoO3-NiO/γ-Al2O3催化剂的催化活性随时间变化关系如图 1所示。

|
| 图 1 新鲜MoO3-NiO/γ-Al2O3催化剂合成吡啶活性曲线 Figure 1 Catalytic performance of fresh MoO3-NiO/γ-Al2O3 used for pyridine synthesis |
| |
由图 1可知催化剂的催化性能在前40 h内保持比较好的活性,四氢糠醇的转化率99.9%,吡啶的选择性维持在84.6%,但是在40 h后转化率和选择性下降明显,100 h后四氢糠醇的转化率明显降至为80%,吡啶的选择性也明显降至45%。为了考察催化剂失活原因,本研究对100 h以后的失活催化剂进行了系列表征,最终找到了催化剂失活的原因是积碳失活,并且采用在线燃烧的方法去除了积碳,催化剂活性得到恢复。
2.2 催化剂的表征 2.2.1 元素分析测试用元素分析仪对失活催化剂进行C、N和H元素的分析,得相应的元素物质的量之比依次为33.82%,0.98%、2.54%,H/C原子比为0.9[17],说明存在积碳。Xu等报道在初始反应阶段,固体酸催化剂上快速形成积碳,有利于提高产物的选择性[18]。从图 1可以看到吡啶的选择性在前6 h内有所提高,并一直保持到40 h。随着时间延长到100 h,吡啶选择性逐渐下降,积碳严重,覆盖了活性位点,反应活性降低。
2.2.2 SEM和TEM表征采用扫描电镜对失活催化剂形貌进行了测试,如图 2所示。

|
| 图 2 新鲜和失活催化剂的SEM图 Figure 2 SEM images of fresh and deactivated MoO3-NiO/γ-Al2O3 |
| |
图 2a)和图 2b)为棒状催化剂的扫描电镜图,图 2a)为新鲜催化剂,图 2b)为失活催化剂,图 2a)表面均匀,比较完整,图 2b)中表面覆盖了层状物,并且形成了部分凹陷。图 2c)和图 2d)为粉末状催化剂的扫描电镜图,图 2c)为新鲜催化剂,图 2d)为失活催化剂,图 2c)表面疏密一致,图 2d)颗粒团聚,形成比较大的空隙。
采用透射电镜对失活催化剂形貌进行了测试,如图 3所示。
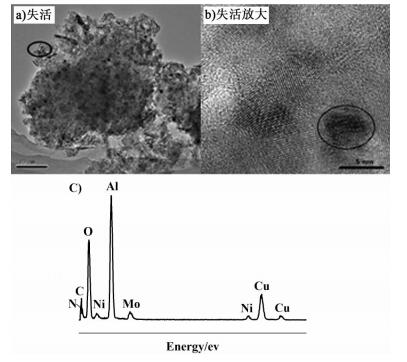
|
| 图 3 失活催化剂MoO3-NiO/γ-Al2O3的TEM图和能谱 Figure 3 TEM images of the deactivated MoO3-NiO/γ-Al2O3 and EDX analysis |
| |
图 3a)中小黑点是活性组分或者积碳[19-20]。图 3a)中局部放大后见图 3b),从图 3b)中可以看到活性组分的晶格条纹,并且还有黑色的部分。图 3c)为能谱,碳元素和氮元素的存在证明了积碳的存在。
2.2.3 激光拉曼测试用激光拉曼光谱对沉积在失活催化剂MoO3-NiO/γ-Al2O3表面的积碳进行了分析表征,如图 4所示。

|
| 图 4 失活催化剂MoO3-NiO/γ-Al2O3的拉曼光谱 Figure 4 Laser Raman spectroscopy of deactivated catalysts MoO3-NiO/γ-Al2O3 |
| |
拉曼光谱信号显示积碳谱峰位置为1 580 cm-1是石墨化碳,称之为G线,为CC键的伸缩振动,G线强度可用来表征石墨结构中sp2杂化键结构的完整程度。除了G线外,还在1 350 cm-1出现1条D线,表示C—H键变形振动,是因为其取向度低、石墨微晶不完整、结构缺陷多、边缘不饱和碳原子数目多而引起的。只具有单晶石墨的天然石墨,只有G线,而无D线;对于结构无序,微晶小而排列紊乱的碳材料存在较强的D线。因此,常用两者的相对强度比值(R=ID/IG)大小来判断石墨化程度和石墨结构完整的程度。二者的峰宽随着R值的减小而变小,并且G线的波数往小的方向移动[21]。失活催化剂是因为积炭失活,并且形成了无定形碳和石墨化碳。
2.2.4 吡啶红外测试新鲜和失活催化剂的吡啶红外吸收光谱如图 5所示,B酸在1 540 cm-1出峰,L酸在1 450 cm-1出峰。

|
| 图 5 新鲜和失活催化剂MoO3-NiO/γ-Al2O3的吡啶红外谱图 Figure 5 FTIR spectra of chemisorbed pyridine of the deactivated and fresh catalysts |
| |
由图 5可以看出失活催化剂的L酸和B酸的强度明显降低,这主要是积碳覆盖在催化剂上导致的。其中B酸相对减弱更明显,说明积碳对B酸的影响更大,自由基碳正离子在固体酸催化剂的酸性位点上脱氢,低聚,环化,芳构化而形成多核芳香烃,最终脱氢聚合形成了类似石墨结构的积碳[22]。
2.2.5 TG测试MoO3-NiO/γ-Al2O3催化剂失活是因为积炭,积炭分为无定形碳和石墨化碳。用TG分析积炭的含量和热稳定性,如图 6所示。

|
| 图 6 失活催化剂MoO3-NiO/γ-Al2O3的热重谱图 Figure 6 TG profiles of the fresh and deactivated MoO3-NiO/γ-Al2O3 |
| |
由图 6可以看出存在2个失量平台,第1个平台的失量温度范围为室温到450 ℃,这部分的失量主要为水分的挥发,第2个失量平台是450~620 ℃,为积炭的燃烧的过程,反应100 h后MoO3-NiO/γ-Al2O3催化剂的积炭含量为10.58%,并且积炭可以通过在空气气氛中600 ℃在线燃烧的方法除去[23]。
2.2.6 BET测试采用氮气物理吸附的方法对新鲜催化剂、失活催化剂和再生催化剂的物理结构进行了表征,如表 1所示。
| catalysts | SBET/ (m2·g-1) |
VP/ (cm3·g-1) |
DP/ nm |
| fresh MoO3-NiO/γ-Al2O3 | 231.8 | 0.53 | 9.28 |
| deactivated MoO3-NiO/γ-Al2O3 | 75.2 | 0.16 | 8.50 |
| regeneration MoO3-NiO/γ-Al2O3 | 217.1 | 0.61 | 11.24 |
| SBET-surface area, DP-average pore width, VP-total pore volume. | |||
由表 1可以发现失活催化剂的比表面积和孔容大幅度变小,说明积碳覆盖在催化剂表面,导致了活性位点的减少,反应活性降低;平均孔径的减少说明积碳也存在于催化剂的内表面,再生后的催化剂的比表面积和孔容均恢复,说明积碳占据了催化剂的内外表面。对比再生后的催化剂与新鲜催化剂,发现再生后的催化剂比表面积变小,孔径变大,是因为再生过程中高温煅烧除碳所致[24]。积碳不仅覆盖了活性位点,而且进入催化剂孔道后会堵塞孔道,进一步影响反应物扩散和产物的分布。
2.2.7 XRD测试用多晶粉末X射线衍射技术对载体γ-Al2O3、新鲜催化剂、失活催化剂和再生后的催化剂的体相结构进行了分析,如图 7所示。
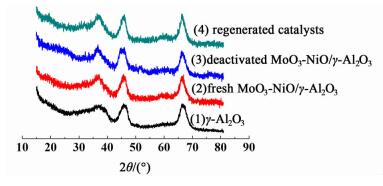
|
| 图 7 γ-Al2O3、新鲜、失活、再生催化剂的XRD图 Figure 7 XRD patterns |
| |
负载的金属氧化物氧化钼、氧化镍均没有显示相应的峰,说明金属氧化物在γ-Al2O3载体上单层分散,没有形成结晶性良好的金属氧化物[25]。由图 7看出新鲜催化剂、失活催化剂和再生催化剂的晶型均为典型的γ-Al2O3晶型,由此证明催化剂失活不是因为催化剂晶型改变所致,积碳的产生也没有改变催化剂固有的晶型,也没有使活性组分颗粒烧结出峰,也说明反应过程中MoO3-NiO/γ-Al2O3催化剂具有良好的水热稳定性。
2.2.8 XPS测试用XPS对新鲜催化剂、失活催化剂和再生后的催化剂进行了催化剂表面元素及其价态的表征,从C1s谱可看出碳的结合能在284.5 eV,新鲜催化剂与再生催化剂表面的碳的出峰位置和强度一致,之所以新鲜催化剂和再生催化剂有碳存在是因为测试过程中碳材料作为基底,而催化剂制备过程中并未引入碳源。而失活催化剂中碳的含量明显高于新鲜和再生催化剂,出峰位置在284.7 eV。非石墨化碳C1s谱对称,石墨化的碳变窄,不对称,且向高结合能方向移动[26-27]。如图 9所示,Ni2p和Mo3d谱表明新鲜催化剂与再生催化剂表面的Ni、Mo元素存在状态基本一致。所以催化剂的失活不是因为活性组分的变化导致的。

|
| 图 8 新鲜、失活和再生催化剂MoO3-NiO/γ-Al2O3的C1s谱图 Figure 8 C1s XPS spectra of catalysts MoO3-NiO/γ-Al2O3 |
| |
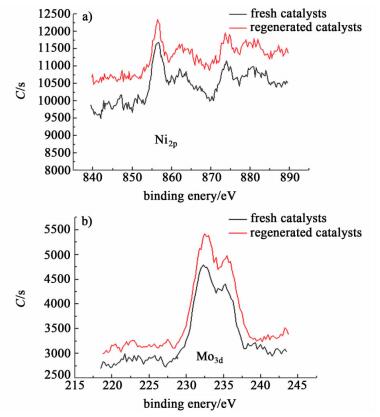
|
| 图 9 新鲜和再生催化剂MoO3-NiO/γ-Al2O3的Ni2p和Mo3d谱图 Figure 9 The Ni2p and Mo3d XPS spectra of fresh and regenerated MoO3-NiO/γ-Al2O catalysts |
| |
综上所述,MoO3-NiO/γ-Al2O3催化剂失活是积碳失活,TG分析表明积碳可以在空气中分解,故采用在线燃烧法清除积碳,使催化剂再生,并测试了再生后的催化剂的反应活性。将失活催化剂装在固定床反应器中,用空气泵鼓入空气,升温到600 ℃保温5 h,用氮气吹扫1 h,待温度降至550 ℃,对再生后的催化剂进行反应活性的测试,每隔3 h取样。再生后催化剂的反应活性与新鲜催化剂的活性对比如图 10所示。
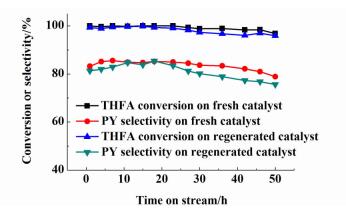
|
| 图 10 再生和新鲜催化剂MoO3-NiO/γ-Al2O3活性对比曲线 Figure 10 Catalytic performance of regenerated MoO3-NiO/γ-Al2O3 used for pyridine synthesis |
| |
由图 10发现再生催化剂的催化活性在50 h之内与新鲜催化剂的活性相当。
4 结论四氢糠醇合成吡啶的催化剂MoO3-NiO/γ-Al2O3具有良好的活性和稳定性。失活催化剂MoO3-NiO/γ-Al2O3的体相结构并未发生根本变化,并且催化剂的活性组分没有变化和流失,催化剂失活的原因是催化剂严重积碳。积碳使催化剂的比表面积和孔容孔径减小,一方面导致了活性位点的利用率减少,四氢糠醇的转化率减少和吡啶的选择性减小;另一方面影响了物料扩散,导致活性下降。积碳物种有两种存在形式,无定形碳和石墨化碳,积碳的含量为10.52%,积碳覆盖在催化剂的内外表面和孔道内。采用了简便可行的在线燃烧法除去积碳,再生后的催化剂性能保持和新鲜催化剂相当的催化活性和使用寿命。
| [1] | 周焕文, 于世钧, 徐杰, 等. 吡啶及其衍生物催化合成进展及应用前景[J]. 周焕文, 于世钧, 徐杰, 等. 2001. 吡啶及其衍生物催化合成进展及应用前景[J]. 工业催化 , 2001 , 9 (3) : 26–32. Zhou Huanwen, Yu Shijun, Xu Jie, et al. Development and application prospect for the methods for catalytic synthesis of pyridine and its derivatives[J]. Industrial Catalysis , 2001, 9(3) : 26–32. |
| [2] | 蒋劼, 卢冠忠, 毛东森, 等. 吡啶碱类化合物合成进展[J]. 蒋劼, 卢冠忠, 毛东森, 等. 2002. 吡啶碱类化合物合成进展[J]. 精细石油化工进展 , 2002 , 3 (12) : 25–29. Jiang Jie, Lu Guanzhong, Mao Dongsen, et al. Development in synthesis of pyridine bases[J]. Advances in Fine Petrochemicals , 2002, 3(12) : 25–29. |
| [3] | 卫双绍. 吡啶碱催化剂进展[J]. 卫双绍. 1996. 吡啶碱催化剂进展[J]. 四川化工 , 1996 , 3 : 40–43. Wei Shuangshao. Development of pyridine bases catalysts[J]. Sichuan Chemical Industry , 1996, 3 : 40–43. |
| [4] | Butler J D, Laundon R D. Catalytic vapour-phase reactions of 2-hydroxymethylpyrrolidine and 2-aminomethyl tetrahydrofuran over palladium-alumina[J]. J Chem Soc B , 1970, 32(2) : 1525–1527. |
| [5] | Butler J D, Laundon R D. Catalytic conversion of 2-hydroxyrmethyltetrahydrofuran into pyridine[J]. J Chem Soc C , 1969, 20(2) : 173–176. |
| [6] | Butler J D, Laundon R D. Intermediates and products in the catalytic vapour-phase dehydration and ammonolysis of 2-hydroxymethyltetrahydrofuran over alumina[J]. J Chem Soc B , 1970, 21(4) : 716–720. |
| [7] | Choi J H, Lee W Y. Pyridine synthesis from tetrahydrofurfuryl alcohol over a palladium/γ-alumina catalyst I. Behavior of adsorbed ammonia on a palladium/γ-alumina catalyst[J]. Appl Catal A: Gen , 1992, 87(2) : 157–169. DOI: 10.1016/0926-860X(92)80053-F |
| [8] | Choi J H, Lee W Y. Pyridine synthesis from tetrahydrofurfuryl alcohol over a Pd/γ-Al2O3 catalyst II. Effect of supports and palladium loading[J]. Appl Catal A: Gen , 1993, 98 : 21–31. DOI: 10.1016/0926-860X(93)85022-H |
| [9] | Choi J H, Kim H D, Lee W Y. The kinetics of pyridine formation from tetrahydrofurfuryl alcohol over Pd/γ-Al2O3[J]. Korean J of Chem Eng , 1993, 10(3) : 135–139. DOI: 10.1007/BF02705135 |
| [10] | 周丹, 冯亚青, 傅雪晶, 等. MoO3/γ-Al2O3在四氢糠醇合成吡啶中的应用[J]. 周丹, 冯亚青, 傅雪晶, 等. 2005. MoO3/γ-Al2O3在四氢糠醇合成吡啶中的应用[J]. 精细化工 , 2005 , 22 (10) : 795–797. Zhou Dan, Feng Yaqing, Fu Xuejing, et al. Preparation of pyridine from tetrahydrofurfuryl alcohol with MoO3/γ-Al2O3 catalyst[J]. Fine Chemicals , 2005, 22(10) : 795–797. |
| [11] | 周丹, 冯亚青, 孟舒献, 等. 钯/氧化铝催化剂对四氢糠醇合成吡啶的研究[J]. 周丹, 冯亚青, 孟舒献, 等. 2006. 钯/氧化铝催化剂对四氢糠醇合成吡啶的研究[J]. 高校化学工程学报 , 2006 , 20 (2) : 250–253. Zhou Dan, Feng Yaqing, Meng Shuxian, et al. Study on preparation of pyridine from tetrahydrofurfuryl alcohol catalyzed by Pd/Al2O3[J]. Journal of Chemical Engineering of Chinese Universities , 2006, 20(2) : 250–253. |
| [12] | 周丹, 冯亚青, 孟舒献, 等. V2O5/A12O3催化四氢糠醇合成吡啶[J]. 周丹, 冯亚青, 孟舒献, 等. 2006. V2O5/A12O3催化四氢糠醇合成吡啶[J]. 天津大学学报 , 2006 , 39 (5) : 601–604. Zhou Dan, Feng Yaqing, Meng Shuxian, et al. Preparation of pyridine from tetrahydrofurforyl alcohol with V2O5/A12O3 as catalyst[J]. Journal of Tianjin University , 2006, 39(5) : 601–604. |
| [13] | 刘大蔚, 冯亚青, 孟舒献, 等. MoO3-Ce2O3-MgO/γ-Al2O3在四氢糠醇合成吡啶中的应用[J]. 刘大蔚, 冯亚青, 孟舒献, 等. 2006. MoO3-Ce2O3-MgO/γ-Al2O3在四氢糠醇合成吡啶中的应用[J]. 精细化工 , 2006 , 23 (11) : 1068–1081. Liu Dawei, Feng Yaqing, Meng Shuxian, et al. Preparation of pyridine from tetrahydrofurfuryl alcohol with MoO3-Ce2O3-MgO/γ-Al2O3 catalyst[J]. Fine Chemicals , 2006, 23(11) : 1068–1081. |
| [14] | 徐哲, 张卫红, 冯亚青, 等. 四氢糠醇合成吡啶催化剂的制备及工艺研究[J]. 徐哲, 张卫红, 冯亚青, 等. 2011. 四氢糠醇合成吡啶催化剂的制备及工艺研究[J]. 化学工业与工程 , 2011 , 28 (6) : 22–26. Xu Zhe, Zhang Weihong, Feng Yaqing, et al. Preparation of catalyst for synthesizing pyridine using THFA as the starting material[J]. Chemical Industry and Engineering , 2011, 28(6) : 22–26. |
| [15] | 徐哲, 张卫红, 孟舒献, 等. Ni-NiO/γ-Al2O3催化四氢糠醇制备吡啶[J]. 徐哲, 张卫红, 孟舒献, 等. 2012. Ni-NiO/γ-Al2O3催化四氢糠醇制备吡啶[J]. 精细化工 , 2012 , 29 (5) : 458–462. Xu Zhe, Zhang Weihong, Meng Shuxian, et al. Performance of catalyst Ni-NiO/γ-Al2O3 in the catalytic reaction from tetrahydrofurfuryl to pyridine[J]. Fine Chemicals , 2012, 29(5) : 458–462. |
| [16] | Zhang L, Meng S, Feng Y, et al. A continuous process for the preparation of pyridine from tetrahydrofurfuryl alcohol with (MoO3-NiO)/Al2O3 as catalyst [C]. Advanced Materials Research, 2012, 581/582: 27-32 |
| [17] | Koh J H, Lee J J, Kim H, et al. Correlation of the deactivation of CoMo/Al2O3 in hydrodesulfurization with surface carbon species[J]. Appl Catal B , 2009, 86 : 176–181. DOI: 10.1016/j.apcatb.2008.08.002 |
| [18] | Xu W, Yin Y, Sui S L, et al. Coke formation and its effects on shape selective adsorptive and catalytic properties of ferrierite[J]. J Phys Chem , 1995, 99 : 758–765. DOI: 10.1021/j100002a045 |
| [19] | Liu C, Ye J, Jiang J, et al. Progresses in the preparation of coke resistant Ni-based catalyst for steam and CO2 reforming of methane[J]. Chem Cat Chem , 2011, 3 : 529–541. |
| [20] | Hou Z, Gao J, Guo J, et al. Deactivation of Ni catalysts during methane autothermal reforming with CO2 and O2 in a fluidized-bed reactor[J]. J Catal , 2007, 250 : 331–341. DOI: 10.1016/j.jcat.2007.06.023 |
| [21] | 贺福. 用拉曼光谱研究碳纤维的结构[J]. 贺福. 2005. 用拉曼光谱研究碳纤维的结构[J]. 高科技纤维与应用 , 2005 , 30 (6) : 20–25. He Fu. Raman spectroscopy studies on structure of carbon fibres[J]. Hi-Tech Fiber & Application , 2005, 30(6) : 20–25. |
| [22] | Lin X, Fan Y, Shi G, et al. Coking and deactivation behavior of HZSM-5 zeolite-based FCC gasoline hydro-upgrading catalyst[J]. Energy & Fuel , 2007, 21 : 2517–2524. |
| [23] | He S, Sun C, Yang X, et al. Characterization of coke deposited on spent catalysts for long-chain-paraffin dehydrogenation[J]. Chem Eng J , 2010, 163 : 389–394. DOI: 10.1016/j.cej.2010.07.024 |
| [24] | Bartholomew C H. Mechanisms of catalyst deactivation[J]. Appl Catal A: Gen , 2001, 212 : 17–60. DOI: 10.1016/S0926-860X(00)00843-7 |
| [25] | Wang X, Zhao B, Jiang D, et al. Monolayer dispersion of MoO3, NiO and their precursors on γ-Al2O3[J]. Appl Catal A: Gen , 1999, 188 : 201–209. DOI: 10.1016/S0926-860X(99)00248-3 |
| [26] | Shamsi A, Baltrus J P, Spivey J J. Characterization of coke deposited on Pt/alumina catalyst during reforming of liquid hydrocarbons[J]. Appl Catal A: Gen , 2005, 293 : 145–152. DOI: 10.1016/j.apcata.2005.07.002 |
| [27] | Albers P, Seibold K, Prescher G, et al. XPS and SIMS studies of carbon deposits on Pt/Al2O3 and Pd/SiO2 catalysts applied in the synthesis of hydrogen cyanide and selective hydrogenation of acetylene[J]. Appl Catal A: Gen , 1999, 176 : 135–146. DOI: 10.1016/S0926-860X(98)00325-1 |
 2016, Vol. 33
2016, Vol. 33





