盐酸、氯化亚锡、柠檬酸钠和碳酸氢钾等均为分析纯试剂。S4800场发射扫描电子显微镜(日本日立公司);D8-Focus型XRD衍射仪(德国布鲁克AXS有限公司);Agilent-1100高效液相色谱(安捷伦科技有限公司);M8811型直流电源(南京美尔诺电子有限公司);CHI660D电化学工作站(上海辰华仪器有限公司)。
1.2 多孔锡电极的制备以面积为4 cm2锡片(99.9%)为阳极,面积1 cm2的铜片(99.9%)为阴极(基底),两者之间的间距为2 cm。金属电极先在丙酮中超声去除表面的有机物,用蒸馏水洗净后再用20%硝酸去除表面的氧化物,用砂纸(Deer,1 200目/1 500目/2 000目)逐级打磨至光亮备用。沉积液的组成为0.01 mol/L SnCl2、0.01 mol/L柠檬酸钠、1.2 mol/L盐酸。采用恒电流法,在冰水浴中,电流密度为4 A/cm2时,电沉积1 min取出,用去离子水清洗,常温吹干备用。
1.3 电极的表征 1.3.1 物理表征场发射扫描电子显微镜(SEM)和EDS对电极的形貌和组成进行了观察;采用XRD对结构和组成进行表征,扫描角度为10°~90°。
1.3.2 电化学表面积测试本研究采用循环伏安法表征电极的电化学表面积。0.1 mol/L KF溶液中,分别测试扫描速率从20~100 mV/s的循环伏安曲线。根据公式(1)计算出电极的电容。
| $ C = \frac{{{\rm{d}}Q}}{{{\rm{d}}E}} = \frac{{i{\rm{d}}t}}{{{\rm{d}}E}} = \frac{i}{{{\rm{d}}E/{\rm{d}}t}} $ | (1) |
式(1)中,C为电容器的电容,F·cm-2;Q为电容器的电量,C;E为电容器的电压,V;i为电流密度,可取正向扫描和逆向扫描电流密度模量的平均值,mA·cm-2;t为时间, s。
1.4 CO2电化学还原性能 1.4.1 循环伏安测试电化学测试在H型电解池中进行。用Nafion 117将电解池分为阴极室和阳极室。工作电极为多孔锡电极或普通锡片电极,对电极为4 cm2的铂片电极,饱和甘汞电极(SCE)作为参比电极。反应温度为5 ℃,电解液为0.5 mol/L KHCO3溶液。循环伏安法(CV)电位的扫描范围为0~-2.0 V,扫描速率为50 mV·s-1,每次扫3圈。实验前先向阴极室通N2 30 min,做空白CV扫描。然后通CO2 30 min达到饱和,做CO2电化学还原的CV扫描。
1.4.2 恒电位电解和产物分析恒电位电解实验采用电化学工作站CHI660D配置的控制电位电解库仑法。恒电位下电解一段时间,记录电流密度的变化。取液相产物,用磷酸酸化到pH值为2.0左右后进行色谱分析,计算出甲酸的含量和电流效率。甲酸的电流效率为生成甲酸消耗的电荷量与反应过程消耗的总电荷量之比。
2 结果和讨论 2.1 多孔锡沉积层的表征 2.1.1 SEM结果电沉积过程中,生成的氢气泡会占据一定的空间,从而在沉积层中形成空隙。锡离子则在气泡的间隙生长。随着沉积过程的进行,生成的气泡不断向外扩散,形成通路,会逐渐形成三维多孔结构。采用恒电流法,电流密度为-4 A·cm-2时电沉积1 min制备了多孔锡电极,如图 1所示。

|
| 图 1 多孔锡电极的SEM图 Figure 1 SEM images of porous Sn electrode |
| |
从图 1a)、图 1b)、图 1c)和图 1d)中可以看出多孔锡电极的表面呈现蜂窝状,其内部的晶枝向各个方向生长。多孔锡电极的孔径均匀的分布在40 μm左右,晶枝粒度大约为800~900 nm。从电极的截面图 1e)和图 1f)中可以观察到沉积层类似矮灌木丛状,沉积层的厚度大约为80 μm。
2.1.2 EDS结果为了分析多孔锡电极表面元素的组成,实验对电极进行了EDS测试,如图 2。图 2中Sn密集的分布于电极表面,还有Cu和O的零星分布。Cu可能因为基底层没有被完全覆盖造成的,而O是因为沉积层被部分氧化产生的。可见沉积层未混入其它杂质。同时可以观察到Cu和Sn都有不同的电子能态。
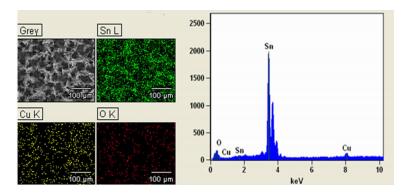
|
| 图 2 多孔锡电极的EDS图 Figure 2 EDS of the porous Sn electrode |
| |
为了表征沉积层的结构和组成特征,对新制备的多孔锡电极进行了XRD分析,结果见图 3。

|
| 图 3 多孔锡电极的XRD图 Figure 3 XRD pattern of freshly deposited porous Sn electrode |
| |
从图 3中可以观察到主要衍射峰有Sn(200)、Sn(101)和Sn(211)。因此,我们推测锡沉积层为多晶结构。对照标准卡知,78.99°处衍射峰对应Cu6Sn5,从而推断多孔锡电极制备中有Cu6Sn5形成。Gu等[15]和Du等[16]的研究表明在没有加热情况下,铜基底与锡沉积层之间会发生相互扩散,从而增加两者之间的结合力。因此,合金的形成有利于沉积层与基底的结合,从而防止沉积层的脱落。
2.2 电化学活性表面积循环伏安曲线在不发生法拉第反应时会呈现出电容特性[17],即电流密度与扫描速率成线性关系,其斜率正好是双电层的电容。由于双电层的电容又正比于双电层的表面积,由此可以推断电化学活性表面积的变化。图 4a)和图 4b)分别为0.1 mol/L KF溶液中锡片电极和多孔锡电极在不同扫描速率下的循环伏安曲线。由图 4a)和图 4b)可以看出电流密度随扫描速率的增加而增加,但是循环伏安曲线并不是完美的方型,这可能是由于在多孔电极上电荷分散存储造成的[18-19]。公式(1)中, i取-0.55 V时正向扫描和逆向扫描电流模量的平均值,得到了电流密度和扫描速率的关系图,如图 4c)所示。从图 4c)中可以看出多孔锡电极和普通锡片电极的电流密度和扫描速率都成正比,也证明了此过程的电容特性。根据公式(1),电流密度与扫描速率线性关系的斜率即为双电层的电容,从而可以求出多孔锡电极的电容为599 μF·cm-2,而普通锡片电极只有101 μF·cm-2。从而可以得出多孔锡电极的电化学表面积远高于普通锡片电极。

|
| 图 4 a)和b)分别为0.1 mol/L KF溶液中不同扫描速率下锡片电极和多孔锡电极上的循环伏安曲线;c)在-0.55 V时电流密度与扫描速率的关系 Figure 4 a) and b)Typical CV curves for Sn plate and the porous Sn electrode in 0.1 mol·L-1 KF solution at different scan rates c) the plot of current density against scan rates at -0.55 V |
| |
图 5a)所示为普通锡片电极的循环伏安曲线,图 5b)所示为多孔锡电极的循环伏安曲线。反应温度为5 ℃,电解液为0.5 mol·L-1 KHCO3,电势的扫描范围为0~-2.0 V,扫描速率为50 mV·s-1。在-0.85 V左右,2个电极上都出现了1个锡的氧化还原峰。在饱和N2溶液中,电流密度的增加是由析氢反应引起的,在饱和CO2溶液中,电流密度的增加是由析氢反应和CO2还原共同作用的结果,所以2曲线之差即为CO2电还原反应的分电流密度。对比图 5a)和图 5b),可以看出多孔锡电极上的电流密度大约是普通锡片电极上的3倍,而且在多孔锡电极的起峰电位在-1.2 V左右,普通锡片电极的起峰电位在-1.4 V左右此外,从5b)内插图中可以看出在多孔锡电极上CO2还原反应比析氢反应更早发生,而在锡片上两者同时发生。这些优先性和电流密度的提高主要是多孔电极上电活性表面积的提高引起的。
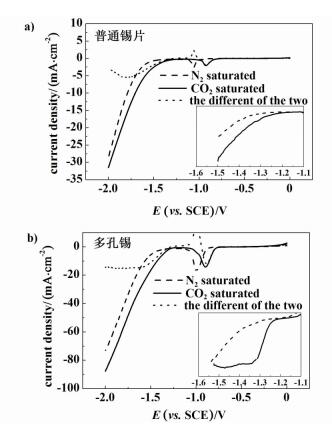
|
| 图 5 电极的CV曲线(内插图都是对CVs曲线的一阶微分) Figure 5 CV curves(The insets show the differential of CV curves in two figures) |
| |
在常压下,反应温度为5 ℃,施加电位为-1.7 V,反应时间10 min,KHCO3浓度为0.1~0.7 mol·L-1之间,生成甲酸的电流密度和电流效率的关系如图 6所示。
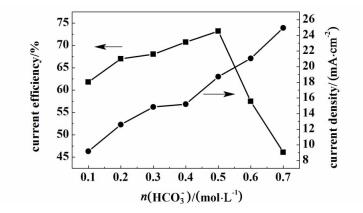
|
| 图 6 不同KHCO3浓度下CO2电还原的电流密度和电流效率 Figure 6 Dependency of current efficiency and current density on the concentration of KHCO3 at -1.7 V |
| |
图 6表明电流密度随着KHCO3浓度的增加而增加。这是由于溶液中离子浓度增加,电解液的电导率会随之增加,有利于反应中的电子传递,从而使得反应的电流密度增加。但是甲酸的电流效率随KHCO3浓度的增加先增大后减少,在0.5 mol·L-1时达到最大,电流效率为73.9%。这是由HCO3-的缓冲作用,CO2的浓度和溶液的黏度等共同作用的结果[20-21]。Hori等证明KHCO3浓度从0.1 mol·L-1增加到0.5 mol·L-1左右,它的缓冲作用逐渐增加,浓度高于0.5 mol·L-1后缓冲作用不再变化[20]。从式(2)中可以看出HCO3-能消耗掉电极表面的OH-,使得反应界面pH值降低,有利于反应过程中提供足够的氢质子,所以反应的电流效率会增加。但是当KHCO3的浓度大于0.5 mol·L-1时,它的缓冲作用不再起主要作用,这时随着KHCO3浓度增加,CO2的溶解度会减小,同时电解质的pH值会下降,使析氢反应更容易发生,所以CO2电还原制甲酸的电流效率会下降。
| $ {\rm{HCO}}_3^ - + {\rm{O}}{{\rm{H}}^ - } \to {\rm{CO}}_3^{2 - } + {{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (2) |
CO2电化学还原的竞争反应是析氢反应,而且随着电势降低而增强。我们考察了不同电位下,恒电位电解10 min过程中的电流密度和电流效率如图 7。CO2电化学还原的电流密度随着电位的降低而增加,电流密度增加的趋势与饱和CO2中的循环伏安曲线基本符合。从图 7可以看出随着电势的降低,CO2的电流效率逐渐增加,在-1.7 V时,电流效率达到最大,然后随着电位降低,电流效率也降低。这是因为随着电位降低,析氢反应的竞争力增强。
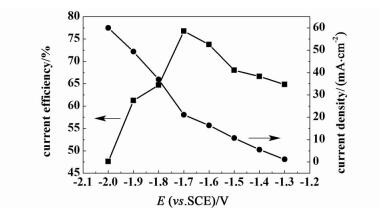
|
| 图 7 电解液为0.5 mol·L-1 KHCO3时不同电位下CO2电还原反应的电流密度和电流效率 Figure 7 Dependency of current efficiency and current density on the potential in the 0.5 mol·L-1 KHCO3 |
| |
反应温度为5 ℃,电解液为0.5 mol·L-1 KHCO3溶液,电解电位为-1.7 V时,CO2恒电位电解1 h过程中的电流密度和电流效率,甲酸的浓度的变化如图 8。

|
| 图 8 多孔锡电极上1 h内甲酸的电流效率和生成量的变化;内插图分别为锡片电极和多孔锡电极上1 h内电流密度随时间的变化 Figure 8 Curves of current efficiencies and HCOOH concentration during one hour for porous Sn electrode. The inset shows dependency of current density on the time for the Sn plate and porous Sn electrode during 1 h |
| |
从内插图 8中可以看出,在电解过程中,随着时间的推移电流密度基本保持不变,普通锡片电极CO2电还原的电流密度大约恒定在-5~-6 mA·cm-2左右,而多孔锡电极上的电流密度恒定在-15~-16 mA·cm-2左右,可见反应过程中多孔锡电极上的电流密度大约为普通锡片电极上的3倍。但是电流效率随时间的推移逐渐降低,1 h后电流效率降低到33%左右。可能是由于随着反应的进行,CO2传质困难,使得析氢反应相对加强,CO2电还原效率下降。甲酸生成量随时间增加,1 h后总量为120 μmol·L-1。
3 结论采用氢气泡动态模板法在铜基底上制备出了蜂窝状三维多孔结构的锡电极。通过XRD表征发现沉积层与基底之间有合金Cu6Sn5生成,增强了两者之间的结合力,有效地防止沉积层的脱落。不同扫描速率下的CV曲线表明多孔锡电极的电化学表面积大约是普通锡片电极的6倍。
CO2还原的CV曲线表明多孔锡电极的电流密度大约是普通锡片电极的3倍并且起峰电位比普通锡片电极正0.2 V。研究确定了KHCO3溶液为0.5 mol·L-1,还原电位为-1.7 V vs.SCE时,CO2电化学还原的效果最好,甲酸的电流效率可达73.9%。这些结果表明多孔结构的电极有效地提高了CO2还原反应的催化效果。
| [1] | Enthaler S, Langermann J V, Schimdt T. Carbon dioxide and formic acid: The couple for environmental-friendly hydrogen storage?[J]. Energy & Environmental Science , 2010, 3(9) : 1207–1217. |
| [2] | Whipple D T, Kenis P J A. Prospects of CO2 utilization via direct heterogeneous electrochemical reduction[J]. The Journal of Physical Chemistry Letters , 2010, 1(24) : 3451–3458. DOI: 10.1021/jz1012627 |
| [3] | Todoroki M, Hara K, Kudo A, et al. Electrochemical reduction of high pressure CO2 at Pb, Hg and In electrodes in an aqueous KHCO3 solution[J]. Journal of Electroanalytical Chemistry , 1995, 394(1/2) : 199–203. |
| [4] | Köleli F, Atilan T, Palamut N, et al. Electrochemical reduction of CO2 at Pb-and Sn-electrodes in a fixed-bed reactor in aqueous K2CO3 and KHCO3 media[J]. Journal of Applied Electrochemistry , 2003, 33(5) : 447–450. DOI: 10.1023/A:1024471513136 |
| [5] | Machunda R L, Ju H, Lee J. Electrocatalytic reduction of CO2 gas at Sn based gas diffusion electrode[J]. Current Applied Physics , 2011, 11(4) : 986–988. DOI: 10.1016/j.cap.2011.01.003 |
| [6] | Hara K, Kudo A, Sakata T. Electrochemical reduction of carbon dioxide under high pressure on various electrodes in an aqueous electrolyte[J]. Journal of Electroanalytical Chemistry , 1995, 391(1/2) : 141–147. |
| [7] | Azuma M, Hashimoto K, Hiramoto M, et al. Carbon dioxide reduction at low temperature on various metal electrodes[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry , 1989, 260(2) : 441–445. DOI: 10.1016/0022-0728(89)87158-X |
| [8] | Wu J, Risalvato F, Ke F, et al. Electrochemical reduction of carbon dioxide: I. Effects of the electrolyte on the selectivity and activity with Sn electrode[J]. Journal of the Electrochemical Society , 2012, 159(7) : F353–F359. DOI: 10.1149/2.049207jes |
| [9] | Hara K, Kudo A, Sakata T. Electrochemcial reduction of carbon dioxide under high pressure on various electrodes in an aqueous electrolyte[J]. Journal of Electroanalytical Chemistry , 1995, 391(1/2) : 141–147. |
| [10] | Tang W, Peterson A A, Varela A S, et al. The importance of surface morphology in controlling the selectivity of polycrystalline copper for CO2 electroreduction[J]. Physical Chemistry Chemical Physics , 2012, 14(1) : 76–81. DOI: 10.1039/C1CP22700A |
| [11] | Lee J, Kwon Y. Formic acid from carbon dioxide on nanolayered electrocatalyst[J]. Electrocatalysis , 2010, 1(2/3) : 108–115. |
| [12] | Shin H C, Liu M. Three-Dimensional porous copper-tin alloy electrodes for rechargeable lithium batteries[J]. Advanced Functional Materials , 2005, 15(4) : 582–586. DOI: 10.1002/(ISSN)1616-3028 |
| [13] | Xing X, Cherevko S, Chung C H. Porous Pd films as effective ethanol oxidation electrocatalysts in alkaline medium[J]. Materials Chemistry Physics , 2011, 126(1/2) : 36–40. |
| [14] | Cherevko S, Chung C H. The porous CuO electrode fabricated by hydrogen bubble evolution and its application to highly sensitive non-enzymatic glucose detection[J]. Talanta , 2010, 80(3) : 1371–1377. DOI: 10.1016/j.talanta.2009.09.038 |
| [15] | Gu C, Mai Y, Zhou J, et al. Non-Aqueous electrodeposition of porous tin-based film as an anode for lithium-ion battery[J]. Journal of Power Sources , 2012, 124(15) : 200–207. |
| [16] | Du Z, Zhang S, Jiang T, et al. Preparation and characterization of three-dimensional tin thin-film anode with good cycle performance[J]. Electrochimica Acta , 2010, 55(10) : 3537–3541. DOI: 10.1016/j.electacta.2010.01.065 |
| [17] | Trasatti S, Petrii O A. Real surface area measurements in electrochemistry[J]. Pure and Applied Chemistry , 1991, 63(5) : 711–734. |
| [18] | Bo Z, Wen Z, Kim H, et al. One-Step fabrication and capacitive behavior of electrochemical double layer capacitor electrodes using vertically-oriented grapheme directly grown on metal[J]. Sci Verse Science Direct , 2012, 50(12) : 4379–4387. |
| [19] | Weng T, Teng H. Characterization of high porosity carbon electrodes derived from mesophase pitch for electric double-layer capacitors[J]. Journal of the Electrochemical Society , 2011, 148(4) : A368–A373. |
| [20] | Hori Y. [J]. Electrochemical CO2 reduction on metal electrodes , 2008 . |
| [21] | Li H, Oloman C. Development of a continuous reactor for the electro-reduction of carbon dioxide to formate. Part 1: Process variables[J]. Journal of Applied Electrochemistry , 2006, 36(10) : 1105–1115. DOI: 10.1007/s10800-006-9194-z |
 2016, Vol. 33
2016, Vol. 33





