氢气作为一种洁净的燃料,在燃料电池工业化应用中备受亲睐。近年来,由于NH3储氢密度高、生产和运输等技术完备,且价格低廉、分解后无COx生成,可作为燃料电池的原位供氢法,因而受到人们的广泛关注[1-2]。此外,焦炉煤气尾气中的氨气杂质容易腐蚀设备,燃烧后会形成NOx,对其进行催化脱除将有利于降低运行成本、减少环境污染[3]。有文献报道,钌具有很好的催化氨分解活性[4-6],但价格昂贵,使其工业化应用受到阻碍。与钌相比,镍的储量较丰富、价格低廉,同时对氨分解反应具有较好的催化效果,被认为是替代贵金属钌的最适宜选择。有关金属镍及其氧化物作为催化剂催化氨分解制氢反应的研究较多[7-10],但是长期以来镍基催化剂的研究缺乏较大突破,主要表现在催化剂的低温活性差、处理能力低。因此,本课题组对镍基钙钛矿型催化剂氨分解催化性能进行了研究[11],研究结果表明,镍基钙钛矿型催化剂具有较好的氨分解催化活性。在前期研究的基础上,进一步研究了负载型镍基钙钛矿型催化剂的氨分解催化性能,深入分析了载体对催化剂氨分解性能的影响。
本研究分别以γ-Al2O3、MgO、SiO2和MCM-41为载体,采用溶胶凝胶法制备了负载型镍基钙钛矿型催化剂,并在常压连续微反装置上对其氨分解催化活性进行了评价。通过BET、TPR、XRD和TEM等方法对催化剂进行表征,分析了载体对催化剂催化性能的影响。
1 实验部分 1.1 催化剂的制备本研究所用的载体:γ-Al2O3、SiO2,天津化工研究设计院;MgO,天津光复精细化工研究所;MCM-41,介孔分子筛,购置于山东立元化工。
首先,称取一定质量的载体。然后,量取一定体积的Ni(NO3)2、La(NO3)3和柠檬酸(天津光复精细化工研究所)溶液,在超声波发生器(KQ-100DB型,昆山市超声仪器有限公司)中均匀混合。将载体加入到混合溶液中,在红外灯照射下直至干燥。将此固体粉末放入烘箱中于110 ℃干燥,进一步脱去其中的水分,然后在400 ℃下预煅烧2 h以分解柠檬酸及硝酸盐。取出压片成形,在800 ℃的温度下煅烧4 h。最后将制得的催化剂样品破碎过筛,取20~40目颗粒样品进行活性评价。
1.2 催化氨分解的活性评价催化剂活性评价在常压固定床石英管反应器中进行。在300~800 ℃范围内对氨分解反应进行测试。反应器内径10 mm,催化剂装填量为1.0 mL,空速10 000 h-1,原料气为高纯氨。反应产物采用北京分析仪器厂生产的3420型气相色谱仪进行在线检测(GDX-401色谱柱60~80目,热导检测器控温80 ℃,热导110 ℃,H2载气,稳压0.01 MPa),尾气用稀硫酸溶液吸收。氨气的转化率按公式(1)计算。
| ${{X}_{N{{H}_{3}}}}=\frac{{{n}_{反应前}}-{{n}_{反应后}}}{{{n}_{反应前}}}\times 100%\text{ }$ | (1) |
催化剂的比表面积与孔径测试是在美国Quantach生产的Quadrasorb SI型自动物理吸附仪上进行。将样品在300 ℃下高真空处理4 h,以除去表面杂质,以N2为吸附质于77 K下进行吸附。比表面积由N2吸附等温线结合BET方程求得。孔分布的测定采用BJH方法处理等温线脱附分支的32个数据点后进行计算。
1.3.2 TPR表征TPR测试是在Thermo Finnigan公司生产的TP-DRO 1100 SERIES仪器上进行。以含H2 5%(体积分数)的氢氮混合气为还原气,样品用量50 mg,气体流速20 mL/min,测试温度从室温升到700 ℃,升温速率为10 ℃/min。
1.3.3 X-射线衍射(XRD)实验采用荷兰Panalytical公司的X′Pert Pro型X射线衍射仪,辐射源为Co_Kα,工作电流40 mA,工作电压40 kV,滤波Ni,衍射仪的角度转动速率4(°)/min,时间常数Tc=2,扫描范围10°~80°。
1.3.4 TEM表征催化剂研磨后,超声振荡分散制成乙醇悬浮液,将悬浮液滴到铜网上。采用荷兰菲利普FEI公司Tecnai G2 F20场发射透射电子显微镜观察样品中的晶粒形貌和尺寸。
2 结果与讨论 2.1 载体对催化剂性能的影响本研究制备了一系列负载型催化剂:LaNiO3/SiO2、LaNiO3/γ-Al2O3、LaNiO3/MgO(以NiO含量为10%计),并考察了它们的氨分解催化活性。从图 1可以看出,以SiO2为载体的催化剂,氨从400 ℃开始发生分解,随着温度的升高,氨分解速率加快,705 ℃时氨分解率达到100%。与以γ-Al2O3、MgO为载体的催化剂比较,LaNiO3/SiO2有较好的催化活性。

|
| 图 1 不同载体负载的催化剂不同温度下的氨分解转化率 Figure 1 Ammonia decomposition on different supports at different temperature |
| |
以SiO2为载体,制备了不同负载量的催化剂,取温度550 ℃氨转化率及氨100%转化时的温度为考核指标,考察了负载量对催化剂性能的影响(见表 1)。由表 1可知,随着负载量的增加,催化剂的活性呈现先升高后降低的趋势,当NiO含量达到20%时催化能力达到最佳,与非负载的LaNiO3相当,甚至在较低温时催化活性还优于单一的LaNiO3催化剂。由此可见,NiO含量为20%的负载型催化剂具有与非负载型的催化剂相当的催化活性,在保持原有催化活性的基础上,减少了活性组分用量,降低了生产成本。
| 负载量/%(以NiO计) | 空速WHSV(NH3)/h-1 | 550 ℃氨转化率X/% | 氨100%转化时温度/℃ |
| 5 | 10 000 | 28.56 | 745 |
| 10 | 10 000 | 42.21 | 705 |
| 15 | 10 000 | 46.55 | 676 |
| 20 | 10 000 | 63.61 | 646 |
| 25 | 10 000 | 51.49 | 746 |
| 30 | 10 000 | 39.11 | 742 |
| 非负载的LaNiO3 | 10 000 | 61.70 | 640 |
介孔分子筛MCM-41的化学组成是SiO2,具有一维规则孔道结构、呈六方有序排列、孔径分布窄且可调变、比表面积大等特点,在催化、吸附、分离等领域中有潜在的应用价值。本研究以MCM-41为载体,首次制备了LaNiO3/MCM-41催化剂,并将其应用于氨分解反应研究,比较了两种不同结构的“SiO2”对氨分解反应催化性能的影响。图 2是SiO2和MCM-41为载体的催化剂氨分解活性结果。

|
| 图 2 载体不同结构时氨分解的活性分析 Figure 2 Ammonia conversion on different structure of supports at various temperature |
| |
由图 2可知,以MCM-41为载体的催化剂,无论在低温区(300~500 ℃),还是高温区(500~800 ℃),催化活性都高于LaNiO3/SiO2。从图 2中还可以看出,LaNiO3/MCM-41低于600 ℃,即594 ℃时氨已完全分解,而LaNiO3/SiO2在640 ℃后氨才达到100%分解。因此,可以认为,在氨分解反应中,MCM-41比SiO2更有利于提高LaNiO3的催化活性,是一种很好的催化剂载体。
2.4 催化剂的表征 2.4.1 BET表征采用氮气等温吸附脱附方法分析了催化剂的比表面积、孔径分布和孔体积等结构特征,结果见图 3、图 4和表 2。

|
| 图 3 催化剂的氮气吸附脱附等温线 Figure 3 N2 absorption-desorption isotherm of the catalysts |
| |

|
| 图 4 催化剂的孔径分布 Figure 4 Pore diameter distribution of the catalysts |
| |
| 不同样品 | 比表面积/(m2·g-1) | 平均孔径/nm | 孔体积/(cm3·g-1) |
| SiO2 | 170.000 | 12.000 | 0.570 |
| MCM-41 | 1 000.000 | 3.600 | 0.700 |
| 20%LaNiO3/SiO2 | 13.015 | 3.703 | 0.139 |
| 20%LaNiO3/MCM-41 | 299.396 | 1.931 | 0.199 |
从表 2可知,MCM-41分子筛的比表面积高达1 000 m2·g-1,负载一定量的LaNiO3后,催化剂的比表面仍高达299.396 m2·g-1。
由图 3可知,LaNiO3/MCM-41的等温吸附曲线为IV型等温吸附曲线,在低压段,氮气吸附量随着相对压力p/p0的增大而平缓增加,说明在这一阶段氮气主要是以单层吸附在介孔的孔壁上。在p/p0=0.3~0.45之间氮气吸附量有1个明显的突跃,并且出现了1个明显的低压滞后环,这是因为N2在均匀的介孔孔道内发生了毛细管凝聚作用,使得吸附量迅速增加,吸附等温线急剧上升。这个阶段N2吸附曲线的斜率是衡量介孔均一性的依据。由图 3可知,LaNiO3/MCM-41仍保留了介孔结构[12]。
由图 4可知,LaNiO3/MCM-41的孔径分布很窄,仍保留了规整的孔结构。结合上述的活性评价分析,可以得出,载体的结构对活性组分的氨分解性能有较大影响,大的比表面及规整的孔结构有利于活性组分在载体表面上分散,增加有效活性位。另外,规整的孔道结构也有利于反应物及产物在其中扩散,有利于反应的进行。
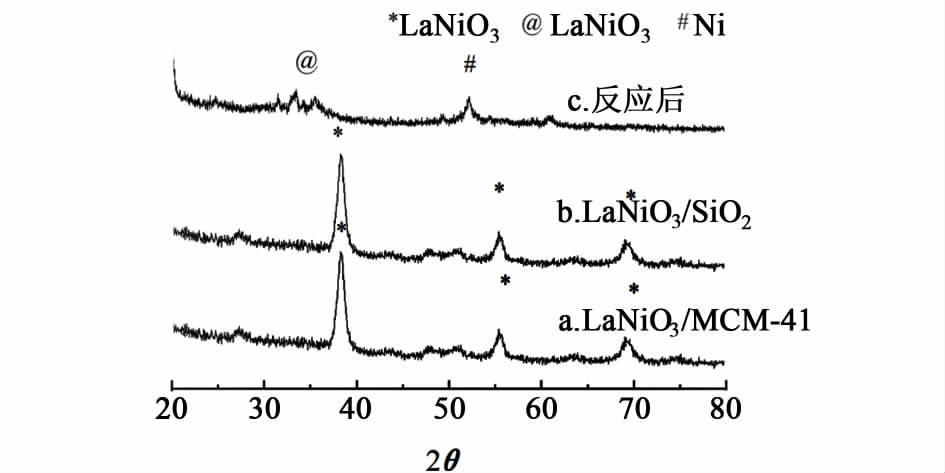
2.4.2 XRD分析图 5是以SiO2和MCM-41为载体制备的催化剂的反应前后的XRD谱图。
|
| 图 5 样品的XRD图 Figure 5 XRD patterns of the samples |
| |
由图 5a)、5b)可知,所制备的样品组分呈钙钛矿结构,说明成功地合成出了负载型钙钛矿型催化剂。由图 5c)可知,两个样品反应后,钙钛矿结构均解体,解体后的物相均为La2O3和Ni。
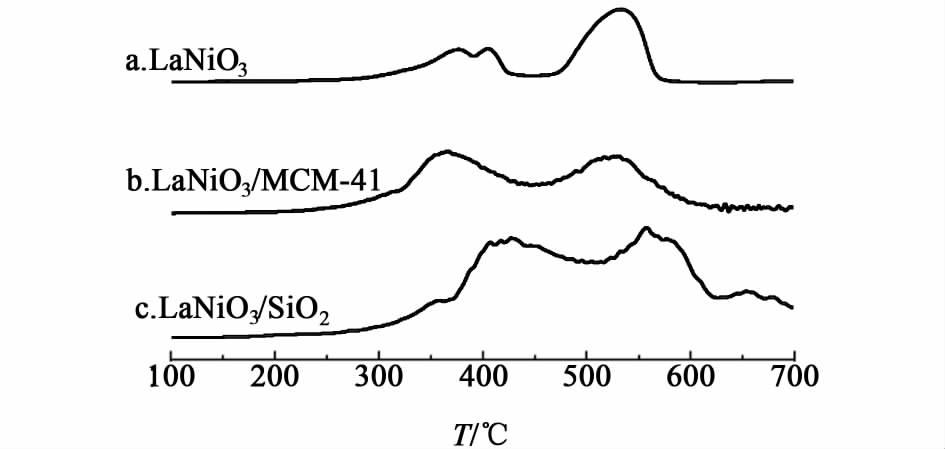
2.4.3 TPR结果分析催化剂程序升温还原的分析结果如图 6所示。
|
| 图 6 样品的TPR表征数据 Figure 6 TPR profiles of the samples |
| |
LaNiO3有3个还原峰,这表明该催化剂中有3种不同反应能力的氧物种[11]。第1个还原峰对应于样品表面吸附氧的还原,第2个峰对应于Ni3+→Ni2+的还原[11],其还原反应如下:
| $\begin{align} & LaNi{{O}_{3}}+\lambda +\lambda {{H}_{2}}\to LaNi{{O}_{3}}+\lambda {{H}_{2}}O\text{ } \\ & LaNi{{O}_{3}}+\delta {{H}_{2}}\to LaNi{{O}_{3-\delta }}+\delta {{H}_{2}}O \\ \end{align}$ | (2) |
在第3还原峰温度下还原后钙钛矿结构受到了破坏,这一步可视为LaNiO3已完全还原,结合其反应前后XRD图(图 5),可知此时解体为La2O3和Ni,其还原过程对应于如下反应:
| $LaNi{{O}_{3-\delta }}+\left( \frac{3}{2}-\delta \right){{H}_{2}}\to \frac{1}{2}L{{a}_{2}}{{O}_{3}}+Ni+\left( \frac{3}{2}-\delta \right){{H}_{2}}O$ | (3) |
LaNiO3/MCM-41有2个还原峰,与LaNiO3的程序升温还原情况相对比,可以看出,LaNiO3/MCM-41的起始还原温度低,且第1个还原峰的峰温比LaNiO3的低,第2个还原峰温与LaNiO3的第3个还原峰较接近,另外,LaNiO3/MCM-41的2个还原峰的面积相当,因此,可以认为,LaNiO3/MCM-41的第1个还原峰对应于样品表面吸附氧的还原及Ni3+→Ni2+和部分Ni2+离子的还原[13],第2还原峰对应于载体上的LaNiO3完全还原,结合图 5可知,其被完全还原为La2O3和Ni。分析原因可能是MCM-41大的比表面积,使活性组分在其上得到了很好地分散,有利于活性组分被还原,从而提高了反应活性。
LaNiO3/SiO2也表现为2个还原峰,温度比LaNiO3/MCM-41和LaNiO3的高,这可能是LaNiO3与SiO2载体之间形成了较强的相互作用,使LaNiO3的还原变得困难,但比较2个还原峰的面积,我们发现,低温还原峰的面积比高温还原峰的面积大,也就是说,SiO2载体起到了分散活性组分的作用,在一定程度上促进了活性组分的还原,使非负载的样品需要在高温下才能被还原的部分在低温时即得到还原。因此,表现为当NiO含量20%时氨分解催化活性与非负载的LaNiO3相当。
2.4.4 TEM结果分析2种催化剂的透射电镜图见图 7。

|
| 图 7 2种催化剂的透射电镜图 Figure 7 TEM images of two samples |
| |
由图 7中样品的透射电镜形貌可以看到,LaNiO3/MCM-41仍保留了规整的介孔结构,且钙钛矿颗粒均匀地分散在载体MCM-41上,与BET分析的结果一致,这样增加了催化剂与反应物的接触面积,有利于催化反应的进行,因此具有较好的催化活性。以SiO2为载体的样品,钙钛矿颗粒粒径相对较大,分散地也不均匀,由此可以理解,催化效果不如前者好。
3 结论1) 利用用溶胶凝胶法成功地制备了负载型镍基钙钛矿型催化剂。且以MCM-41为载体,首次制备了LaNiO3/MCM-41催化剂,并将其应用于氨分解反应研究中。以NiO计,负载量为20%的负载型LaNiO3/MCM-41催化剂具有比非负载的LaNiO3更好的催化活性,这样不仅提高了催化活性,还大大地减少了活性组分用量,降低了生产成本。
2) MCM-41分子筛大的比表面和规整的介孔结构,有利于活性组分的分散,增加了有效活性位,提高了活性组分的反应能力,表现为很好的氨分解催化活性。
| [1] | Wang L, Chen J, Ge L, et al. Halloysite-Nanotube supported Ru nanoparticles for ammonia catalytic decomposition to produce COx-free hydrogen[J]. Energy & Fuels,2011,25 (8) : 3408–3416 |
| [2] | Li G, Kanezashi M, Lee H R, et al. Preparation of a novel bimodal catalytic membrane reactor and its application to ammonia decomposition for COx hydrogen production[J]. International Journal of Hydrogen Energy,2012,37 (17) : 12105–12113 |
| [3] | Peitz D, Bernhard A M, Elsener M, et al. Liquid-Phase catalytic decomposition of novel ammonia precursor solutions for the selective catalytic reduction of NOx[J]. Topics in Catalysis,2013,56 (1/8) : 19–22 |
| [4] | Yin S, Zhang Q, Xu B, et al. Investigation on the catalysis of COx-free hydrogen generation from ammonia[J]. J Catal,2004,224 (2) : 384–396 |
| [5] | Li L, Wang Y, Xu Z, et al. Catalytic ammonia decomposition for CO-free hydrogen generation over Ru/Cr2O3 catalysts[J]. Applied Catalysis A: General,2013 : 246–252 |
| [6] | DiCarlo A, Vecchione L, DelPrete Z. Ammonia decomposition over commercial Ru/Al2O3 catalyst: An experimental evaluation at different operative pressures and temperatures[J]. International Journal of Hydrogen Energy,2014,39 (2) : 808–814 |
| [7] | Cao J, Yan Z, Deng Q, et al. Mesoporous modified-red-mud supported Ni catalysts for ammonia decomposition to hydrogen[J]. International Journal of Hydrogen Energy,2014,39 (11) : 5747–5755 |
| [8] | Zhang J, Xu H, et al. Characterizations and activities of the nano-sized Ni/Al2O3 and Ni/La2Al2O3 catalysts for NH3 decomposition[J]. Appl Catal A,2005,290 (1/2) : 87–96 |
| [9] | Deng Q, Zhang H, Hou X, et al. High-Surface-Area Ce0.2O2 solid solutions supported Ni catalysts for ammonia decomposition to hydrogen[J]. International Journal of Hydrogen Energy,2012,37 (21) : 15901–15907 |
| [10] | Duan X, Qian G, Liu Y, et al. Structure sensitivity of ammonia decomposition over Ni catalysts: A computational and experimental study[J]. Fuel Processing Technology,2013 : 112–117 |
| [11] | 董森. 催化剂的组成结构和类型对氨分解催化性能的影响[D]. 天津: 天津大学, 2009 |
| [12] | 高雄厚, 毛学文, 曹镭, 等. MCM-41超大孔分子筛的催化裂化性能考察[J]. 石油炼制与化工,1997,28 (5) : 16–20 |
 2016, Vol. 33
2016, Vol. 33





