诺氟沙星又名氟哌酸,是第三代氟喹诺酮类广谱抗菌药物,不但被广泛应用于临床治疗,近年来还被应用于食用性动物疾病的预防和治疗,对多种炎症有着较好的疗效。但它也存在着致胎儿畸形、损害肾功能等毒副作用,欧盟已经限定了此类物质在食品中的最大残留限量[1],因此控制并检测其在环境或食品中的含量,对达到最佳治疗效果及降低毒副作用具有非常重要的意义。目前文献报道的诺氟沙星测定方法主要有电位法[2]、荧光光度法[3, 4]和高效液相色谱法[5]等,这些方法都存在耗时长、需使用特殊或复杂仪器[2, 3, 4, 5]等缺点。
近年来,分子印迹凝胶光子晶体(MIPP) [6, 7, 8, 9]越来越受到人们的关注。它是将凝胶光子晶体与分子印迹技术相结合,既可以利用凝胶光子晶体的结构可控性,也可以实现印迹目标分子的高度选择性。反蛋白石结构的分子印迹凝胶光子晶体是三维有序大孔材料,不仅具有大孔径,还具有孔分布均一、有序、比表面积大、孔隙率高、孔径柔性可调等特点[6]。将凝胶光子晶体与分子印迹技术相结合,不仅赋予其对目标分子的特异性识别性能,还能保证智能水凝胶的环境敏感性。更重要的是,凝胶发生溶胀或收缩的同时,光子晶体的晶格参数和禁带结构得到同步的调制,结合或释放目标分子的过程会伴随着光子带隙的移动,能观察到衍射光谱或颜色的明显变化。如果保持外界刺激,随着溶液中目标分子浓度的不断加大,凝胶光子晶体能逐步溶胀,光子带隙也随之逐步移动,因此可以通过建立衍射峰与目标分子浓度之间的定量关系,实现对特定目标分子的非标记传感[7]。分子印迹凝胶光子晶体是一种性能优异、普适性强、具有自表达特性的新型传感器,目前已经应用于牛血清白蛋白[6]、香草醛[7]、有机磷[8]和四环素[9]等物质的有效检测。
虽然分子印迹凝胶光子晶体的分析应用已经取得了较大的进展,但由分子印迹凝胶光子晶体的制备原理可知,要想获得高选择性的光子晶体印迹薄膜,在分子印迹过程中功能单体与模板分子间的相互作用方式很重要。例如,以丙烯酰胺为功能单体的分子印迹过程主要是利用氢键的相互作用,但氢键在水相中很容易被水分子破坏,致使功能单体与模板分子间的相互作用大大减弱[10, 11]。因此以丙烯酰胺为功能单体的分子印迹聚合物的制备及应用绝大多数是在非水溶液中进行。然而,自然界中许多天然的识别系统以及MIPP所面临的实际应用环境多是水相体系,因此,寻找合适的功能单体实现水相分子印迹是一个亟需解决的问题。
β-环糊精(β-CD)是由7个D-吡喃葡萄糖单元通过α-1,4-糖苷键连接而成的腔内疏水、腔外亲水的环状低聚糖。由于环糊精的疏水空腔能识别许多带有疏水基团的化合物并与之形成主客体包合物[10],并且β-环糊精经改性后可以疏水作用、范德华力或氢键等多种作用力形式与模板分子进行相互作用[12],因此将环糊精应用于分子印迹中将拓宽分子印迹的应用范围,进而实现水相中的分子印迹。日本的Komiyama课题组已利用环糊精为功能单体在水溶液中成功印迹了抗生素和寡肽[10]。
本实验将顺丁烯二酸酐改性的β-环糊精和丙烯酸作为功能单体,过硫酸铵为引发剂,N,N’-亚甲基双丙烯酰胺为交联剂,在水溶液中制备了诺氟沙星印迹凝胶光子晶体。通过对分子印迹条件的优化,实现了对水溶液中诺氟沙星的快速、灵敏检测。
1 实验部分 1.1 仪器与试剂扫描电镜(Nova Nanosem 430,FEI);红外光谱仪(Perkin-Elmer 1600,PE);光纤光谱仪(JKHQ-D1,天津市浩强电子有限公司);数显恒温水浴锅(山东鄄城华鲁仪器有限公司);电子天平(BT-125D,德国赛多利斯科学仪器有限公司);数控超声波清洗器(KQ2200B,昆山市超仪器有限公司);多功能电动搅拌器(WH-8401-60,天津市威华实验室仪器厂);电热真空干燥箱(DZG-4018,天津市天宇实验仪器有限公司)。
诺氟沙星(NOR)(分析纯,美国百灵威公司),环丙沙星(CIP)(分析纯,天津市光复有限公司),二者均用3%的醋酸溶液作溶剂配制一系列浓度的溶液。β-环糊精(β-CD)、顺丁烯二酸酐(MAH)、三氯甲烷、N,N’-二甲基甲酰胺(DMF)、丙烯酰胺(AMD)、丙烯酸(AA)、N,N’-亚甲基双丙烯酰胺(BIS)、过硫酸铵(APS)、冰醋酸等均为分析纯,购自天津大学科威公司。实验用水均为二次蒸馏水。β-CD,NOR,CIP的结构式见图 1。

|
| 图 1 环丙沙星、诺氟沙星、β-环糊精的分子结构示意图 Fig. 1 Molecular structures of ciprofloxacin,norfloxacin and β-cyclodextrin |
| |
参照文献采用乳液聚合法制备单分散的聚苯乙烯(PS)微球[13]。将一定量制备好的单分散PS微球悬浊液置于洁净的平底容器中,将经过预处理的洁净的载玻片垂直插入其中,将其固定,置于43 ℃水浴中,保证环境安静不被打扰,随着烧杯中水的挥发,单分散微球会在毛细力作用下在竖直的载玻片上自组装,待溶剂彻底挥发完之后便可得到平整且光色鲜亮的光子晶体模板。将覆盖光子晶体模板的载玻片轻轻从容器中取出,置于80 ℃的烘箱中,干燥,自然降温后,便可得到牢固的光子晶体模板。
1.2.2 MAH修饰β-CD的合成乙烯羧基修饰的β-CD的合成方法参照文献[14, 15]。将5.68 g β-CD(0.005 mol)和4.9 g MAH(0.05 mol)溶于30 mL干燥的DMF中,二者在80 ℃下恒温反应10 h。待反应物冷却至室温后,向体系中加入三氯甲烷,析出白色沉淀,真空抽滤,粗产品(滤饼)用V(丙酮):V(蒸馏水)=1:19溶液进行充分洗涤,真空在80 ℃干燥后得顺丁烯二酸酐改性β-CD(MAH-β-CD)。
1.2.3 诺氟沙星分子印迹凝胶光子晶体的制备称取0.319 g诺氟沙星溶于2 mL 3%醋酸溶液中,然后分别加入0.5 g MAH-β-CD、3 mL丙烯酸、0.1 g BIS及0.15 g APS,均匀混合后滴加到PS光子晶体模板的上边缘。待溶液通过毛细力和重力作用缓慢渗透至整个模板中,在55 ℃的烘箱中聚合5 h,便得到蛋白石结构的凝胶光子晶体。然后,将得到的蛋白石印迹凝胶光子晶体先置于二甲苯中超声除去聚苯乙烯光子晶体模板,再用十二烷基硫酸钠的V(醋酸):V(甲醇)=1:9溶液除去分子印迹模板诺氟沙星,蒸馏水清洗后得到反蛋白石结构的诺氟沙星印迹凝胶光子晶体。非印迹凝胶光子晶体(NIPP)的制备方法除不加诺氟沙星外,其它条件相同。
1.3 表征方法本实验用Nanosem 430型场发射扫描电镜来表征蛋白石结构分子印迹凝胶光子晶体和反蛋白石结构凝胶光子晶体的形貌特征。顺丁烯二酸酐改性β-CD结构用Perkin-Elmer 1600型红外光谱仪测定。
1.4 诺氟沙星分子印迹凝胶光子晶体的响应性测定按照浓度从低到高的顺序,将制得的MIPP膜依次浸入诺氟沙星的醋酸溶液中,并用光纤光谱仪记录其在不同浓度溶液中衍射峰的位置。测定响应时间时,把MIPP薄膜浸入浓度为10-6 mol/L的诺氟沙星醋酸溶液中,利用光纤光谱仪每隔10 s测试和记录1次光子晶体衍射峰位置。待衍射峰的位置不再发生变化时,说明印迹凝胶光子晶体对模板分子诺氟沙星的吸附已经达到了平衡状态。
2 结果与讨论 2.1 MAH-β-CD 的红外光谱分析为了得到水溶性好且能与丙烯酸交联聚合的改性环糊精,实验中使用顺丁烯二酸酐对β-CD进行修饰,合成了带有双键和羧基的环糊精衍生物,图 2为其红外光谱图。由图 2可以看出,3 387 cm-1为—OH伸缩振动吸收峰,2 930 cm-1为—CH2的反对称伸缩振动吸收峰,1 729 cm-1为C=O伸缩振动吸收峰,1 647 cm-1为C=C的伸缩振动吸收峰,说明我们成功地将C=O和C=C引入到了β-CD上,实现了环糊精的改性。

|
| 图 2 MAH-β-CD的红外光谱图 Fig. 2 FT-IR spectrum of MAH-β-CD |
| |
分子印迹凝胶光子晶体的制备主要包括以下几个过程:1)垂直沉积法制备光子晶体模板;2)毛细力渗透法将含有模板分子的前驱液填充到光子晶体模板中,引发聚合;3)去除光子晶体模板,制备反蛋白石结构;4)洗脱模板分子,得到分子印迹凝胶光子晶体。为了得到特异性高的印迹凝胶光子晶体,功能单体的选择十分重要。功能单体、交联剂和引发剂用量的不同也会使得印迹薄膜的性能不同。实验中我们选择了MAH改性的β-CD和丙烯酸作为功能单体,优化了功能单体、交联剂、引发剂的用量,最终采用0.5 g MAH-β-CD、0.0319 g诺氟沙星、3 mL丙烯酸、0.1 g BIS及0.15 g APS制备分子印迹聚合物。在55 ℃时热引发聚合后的凝胶光子晶体表面平整,呈现出鲜艳的结构颜色。
实验中使用二甲苯超声除去光子晶体模板,再分别用2%十二烷基硫酸钠的V(醋酸):V(甲醇)=1:9溶液和蒸馏水多次清洗除去印迹模板分子诺氟沙星。由电镜照片可以看出,蛋白石结构的凝胶光子晶体具有三维有序的面心立方结构[图 3a)];去除光子晶体模板和印迹模板分子后,反蛋白石结构印迹凝胶光子晶体中的聚苯乙烯微球已经完全去除,呈现了三维有序相互连通的大孔结构[图 3b)]。

|
| 图 3 蛋白石结构的凝胶光子晶体和反蛋白石结构印迹凝胶光子晶体的SEM照片 Fig. 3 SEM images of opal MIPP and inverse opal MIPP |
| |
实验结果表明MIPP膜对诺氟沙星的响应速度很快,在1 min内就达到了平衡状态(图 4)。这是由于反蛋白石光子晶体规则的三维有序相互连通的柔性孔结构能充分保证识别位点的可接近性和分子扩散的无阻碍性。此外,由于比表面积的增大,更多的识别位点暴露在表面,有利于与外来的目标分子相结合,实现快速响应。
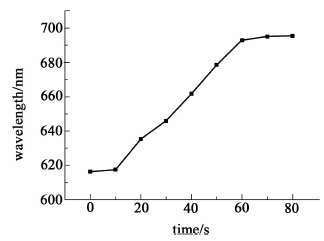
|
| 图 4 印迹凝胶光子晶体在10-6 mol/L诺氟沙星溶液中衍射波长随时间的关系曲线 Fig. 4 Time dependence of MIPP in 10-6 mol/L norfloxacin solution |
| |
实验中测试了诺氟沙星印迹凝胶光子晶体薄膜的传感特性。将薄膜放置在一系列浓度的诺氟沙星溶液中,我们发现随着诺氟沙星溶液浓度的增加,MIPP薄膜的衍射峰逐渐地红移。当浓度从10-9 mol/L增加到10-4 mol/L时,衍射峰从633 nm红移到了722 nm(图 5),说明MIPP薄膜对模板分子诺氟沙星有很好的响应性。

|
| 图 5 印迹凝胶光子晶体(MIPP)在浓度为10-9~10-4 mol/L的诺氟沙星溶液中衍射波长的变化 Fig. 5 Dependence of the diffraction wavelength of MIPP in response to norfloxacin in the range of 10-9 to 10-4 mol/L |
| |
将非印迹光子晶体膜(NIPP)也浸入不同浓度的诺氟沙星溶液中,结果见图 6。

|
| 图 6 非印迹凝胶光子晶体(NIPP)在浓度为10-9~10-4 mol/L的诺氟沙星溶液中衍射波长的变化 Fig. 6 Dependence of the diffraction wavelength of NIPP in response to norfloxacin in the range of 10-9 to 10-4 mol/L |
| |
由图 6可以看出,随着诺氟沙星浓度的增加,非印迹薄膜的衍射峰没有呈现出明显的移动。这说明上述实验中其衍射峰的红移是由于分子印迹过程而引起的。
为了进一步验证诺氟沙星印迹凝胶光子晶体膜的特异选择性,实验中选择了与诺氟沙星结构类似的喹诺酮类物质环丙沙星进行比较,结果见图 7。
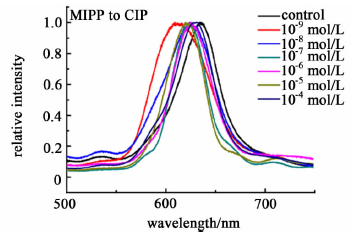
|
| 图 7 印迹凝胶光子晶体在浓度为10-9~10-4 mol/L的环丙沙星溶液中衍射波长的变化 Fig. 7 Dependence of the diffraction wavelength of MIPP in response to ciprofloxacin in the range of 10-9 to 10-4 mol/L |
| |
可以看出,随着环丙沙星浓度的增加,MIPP薄膜的衍射峰并没有出现明显的移动,这是由于MIPP薄膜形成的结合位点在大小和形状上只与目标分子诺氟沙星相吻合,因此对环丙沙星不能形成特异性响应,也就不能引起其衍射峰明显的移动。
2.4 传感机理初探由于β-CD具有疏水空腔,可以与一些疏水性的基团形成主客体包合物,因此诺氟沙星的疏水部分可以进入β-CD的空腔内,二者在水溶液中通过疏水相互作用实现结合,实现有效识别。此外,MAH-β-CD和丙烯酸的羧基也可以与诺氟沙星通过氢键作用力形成复合物[16]。所以,分子印迹过程疏水作用和氢键作用形成的多重反应位点和高密度的有效识别位点使得MIPP膜对诺氟沙星形成特异性传感。
3 结论将光子晶体与分子印迹技术相结合,将具有疏水空腔的MAH改性的环糊精作为一种新型的功能单体,在水相中制备了诺氟沙星印迹凝胶光子晶体。该方法低毒、环保、简便、灵敏,为水相中诺氟沙星的检测提供了一种新思路。
| [1] | Caro E, Marcé R M, Cormack P A G, et al. Novel enrofloxacin imprinted polymer applied to the solid-phase extraction of fluorinated quinolones from urine and tissue samples[J]. Anal Chim Acta,2006,562 (2) : 145–151 |
| [2] | Moreira F C, Freitas V P, Sales M F. Biomimetic norfloxacin sensors made of molecularly-imprinted materials for potentiometric transduction[J]. Microchim Acta,2011,172 (1/2) : 15–23 |
| [3] | Córdoba-Borrego M, Córdoba-Díaz M, Bernabé I, et al. Determination of norfloxacin by fluorescence in the presence of different antacids:Quantification of analytical interferences[J]. J Pharm Biomed Anal,1996,14 (8/10) : 977–982 |
| [4] | Vílchez J L, Ballesteros O, Taoufiki J, et al. Determination of the antibacterial norfloxacin in human urine and serum samples by solid-phase spectrofluorimetry[J]. Anal Chim Acta,2001,444 (2) : 279–286 |
| [5] | Kassab N M, Singh A K, Kedor-Hackmam E R M, et al. Quantitative determination of ciprofloxacin and norfloxacin in pharmaceutical preparations by high performance liquid chromatography[J]. Braz J Pharm Sci,2005,41 (4) : 507–513 |
| [6] | Hu X, Li G, Huang J, et al. Construction of self-reporting specific chemical sensors with high sensitivity[J]. Adv Mater,2007,19 (24) : 4 327-4 332 |
| [7] | Peng H, Wang S, Zhang Z, et al. Molecularly imprinted photonic hydrogels as colorimetric sensors for rapid and label-free detection of vanillin[J]. J Agric Food Chem,2012,60 (8) : 1 921-4 332 |
| [8] | Liu F, Huang S, Xue F, et al. Detection of organophosphorus compounds using a molecularly imprinted photonic crystal[J]. Biosens Bioelectron,2012,32 (1) : 273–277 |
| [9] | Wang L, Lin F, Yu L. A molecularly imprinted photonic polymer sensor with high selectivity for tetracyclines analysis in food[J]. Analyst,2012,137 (15) : 3 502-3 509 |
| [10] | Asanuma H, Akiyama T, Kajiya K, et al. Molecular imprinting of cyclodextrin in water for the recognition of nanometer-scaled guests[J]. Anal Chim Acta,2001,435 (1) : 25–33 |
| [11] | Xu Z, Xu L, Kuang D, et al. Exploiting β-cyclodextrin as functional monomer in molecular imprinting for achieving recognition in aqueous media[J]. Mater Sci Eng C,2008,28 (8) : 1 516-1 521 |
| [12] | Hishiya T, Akiyama T, Asanuma H, et al. Molecular imprinting of cyclodextrins leading to synthetic antibodies[J]. J Incl Phenom Macro,2002,44 (1/4) : 365–367 |
| [13] | Lin F, Yu L. Thiourea functionalized hydrogel photonic crystal sensor for Cd2+ detection[J]. Anal Methods,2012,4 (9) : 2 838-2 845 |
| [14] | Liu Y, Fan X. Synthesis and characterization of pH-and temperature-sensitive hydrogel of N-isopropylacrylamide/cyclodextrin based copolymer[J]. Polymer,2002,43 (18) : 4 997-5 003 |
| [15] | Liu X, Fang H, Yu L. Molecularly imprinted photonic polymer based on β-cyclodextrin for amino acid sensing[J]. Talanta,2013 : 283–289 |
| [16] | Liu W, Wang B. Preparation and application of norfloxacin-MIP/polysulfone blending molecular imprinted polymer membrane[J]. J Appl Polym Sci,2009,113 (2) : 1 125-1 132 |
 2016, Vol. 33
2016, Vol. 33





