2. 滨州展弘工程管理咨询有限责任公司, 山东滨州 256600
2. Binzhou Zhanhong Engineering Management Consulting Co., Ltd, Binzhou 256600, China
聚氯乙烯树脂(PVC)[1]是当今世界上最流行的合成材料之一,在日常生活中应用广泛。氯乙烯是生产聚氯乙烯树脂(PVC)的单体,是PVC行业的关键,其生产方法有乙烷法[2]、乙烯法[3]和乙炔法[4]。乙烷法发展较晚,各种工艺条件和经验都不成熟。乙烯法生产氯乙烯的工艺条件相对比较成熟,但该法法对石油具有较强的依赖性,适用于石油资源较为丰富的国家,但是我国石油储量相对较少,这使得乙烯法在我国的应用受到很大限制,然而丰富的煤炭资源使得乙炔法成为我国生产氯乙烯单体的主要方法。乙炔法生产氯乙烯单体主要是以乙炔与氯化氢为原料,通过加成反应制得氯乙烯单体,该生产工艺是以汞触媒作为催化剂,具体是以活性炭为载体,以氯化汞为活性组分制得的。但是氯化汞在反应过程中易于升华流失、且毒性较大,这不仅使催化剂在反应过程中易于失活,而且流失的氯化汞会对生物和环境造成巨大的危害。另外,我国汞资源相对稀缺,汞催化剂的价格也上涨到了原来的两倍,因此乙炔法生产氯乙烯单体正处在工业化发展的一个瓶颈期[5]。研发无汞催化剂替代工业氯化汞催化剂,降低氯乙烯生产过程中所带来的汞污染,已成为整个电石法生产PVC行业所亟待解决的问题。
长久以来,很多科学工作者对非汞催化剂做了大量的研究。主要是固相催化体系,其中以贵金属研究居多。Au、Pt、Pd等贵金属氯化物以其较高的催化活性博得广大研究者的青睐,并取得了很大的进展。1988~1991年,Nkosi等[6, 7, 8]通过实验研究了金的失活原因和再生方法。2010年,王声洁[9, 10]等也对金基催化剂进行了研究,且研制出AuCl3-CuCl2/C催化剂,其反应的转化率和选择性均保持在99%以上。贵金属催化剂成本太高,稳定性也不能满足工业化要求,因而对非贵金属的研究也逐渐被重视起来。邓国才等[11]对多种非贵金属活性组分进行筛选,制成了SnCl2-BiCl3-CuCl/C复合催化剂。在乙炔空速30 h-1时,催化剂寿命为120 h,其主活性组分SnCl2易流失是其失活的主要原因。魏小波等[12]以铋的磷酸盐为活性组分,以二氧化硅为载体,制备了双组分催化剂Cu3(PO4)-BiPO4/SiO2。200 ℃时,其初始活性为工业汞触媒的1/3。这些非贵金属催化剂廉价易得,但普遍存在活性不够高的问题。
本研究系统考察了溶剂种类、酸洗液种类、焙烧温度、铜的负载量等不同制备参数对催化剂活性和选择性的影响,然后又在此基础上考察了反应温度对催化剂性能的影响,并分析了高空速下催化剂失活的原因。相比之前的锡基和铜基催化剂,该催化剂具有较好的稳定性,催化活性也得到了一定的提升,为进一步的相关研究提供了一定的实验和理论参考。
1 实验部分 1.1 原料与试剂乙炔,体积分数为99.999%,天津涂达气体有限公司产品;HCl,体积分数为99.999%,天津涂达气体有限公司产品;球形活性炭(SAC0609),18~28目,堆积密度0.80 g/cm3,上海汇合达投资管理有限公司产品;氯化铜(CuCl2·2H2O),分析纯,天津市光复科技发展有限公司产品;实验所用其他药品均为分析纯。
1.2 催化剂的制备洗涤活性炭:将活性炭放入1 mol/L的酸溶液中,保持70 ℃密封浸渍5 h,然后冷却过滤,用去离子水清洗,最后在140 ℃环境下干燥18 h。
将称量好的CuCl2·2H2O固体溶于1 mol/L的盐酸,用等体积浸渍法浸渍到活性炭上,70 ℃密封保持4 h,然后140 ℃环境下干燥18 h,最后置于管式炉中,在N2氛围下保持特定温度焙烧1 h,制得活性炭负载的铜基催化剂。重复多次可制得高负载量的催化剂。
催化剂的负载量均以金属质量分数计。
1.3 催化剂的表征TEM检测采用的是Tecnai G2 F20型场发射透射电子显微镜,由荷兰Phlilps公司生产,加速电压为200 kV。电子衍射测试采用透射电镜中的选区电子衍射。
1.4 催化剂的活性评价采用内径为10 mm的不锈钢常压流动固定床反应器,以乙炔氢氯化反应评价催化剂的催化性能。反应器采用电热套加热,催化剂装填量为5.0 mL(约4.0 g)。实验装置与文献[13]中相同,采用质量流量计控制气体流量。产品组成采用北京北分瑞利分析仪器(集团)有限责任公司制造的SP3420型气相色谱仪进行检测分析,色谱柱是GDX-102填充色谱柱,载气为高纯氮气,操作条件为:柱温100 ℃,气化室温度为120 ℃,采用氢火焰检测器,检测温度为150 ℃。
2 结果与讨论 2.1 Cu/C催化剂制备条件对其催化性能的影响 2.1.1 不同浸渍溶剂对Cu/C催化活性的影响以相同的活性炭(1 mol/L盐酸洗涤过)为载体,在其他制备条件相同的情况下,通过更换溶剂制备了一系列Cu/C催化剂(300 ℃焙烧1 h),考察了它们对乙炔氢氯化反应的催化活性,结果示于图 1。

|
| 图 1 不同溶剂对Cu/C催化活性的影响(6% Cu) Fig. 1 Effects of solvent on the catalytic activity of Cu/C catalysts (6% Cu) |
| |
不同溶剂溶解氯化铜,在溶液中能形成四水合铜离子、含氯配离子、铜乙二胺络离子和铜氨络离子等不同的铜络合离子[14]。不同的络离子具有不同的空间构型,当浸渍在活性炭上之后,铜元素在载体上的吸附状态和铜离子之间的距离就会各不相同,干燥后最终得到的铜基催化剂其固载状态和分散状态也各不相同,从而使得不同溶剂处理得到的催化剂表现出了不同的催化活性和稳定性。由图 1可知,以1 mol/L盐酸为溶剂所制得催化剂具有最好的活性和稳定性,溶剂为去离子水时活性和稳定性略有下降,乙二胺和氨水为溶剂时,活性下降较大。由此可以推断,相比其他3种溶剂,用1 mol/L盐酸作为溶剂所制得的Cu/C催化剂具有较好的表面分散性和附着牢固性。其分散性和附着状态也可以由图 2得到证明,其中图 2a)和图 2b)分别是用1 mol/L盐酸和去离子水作溶剂制得的催化剂的TEM图,其分布均匀性明显优于图 2c)和图 2d)。并且图 2c)和图 2d)已经显示出了明显的活性位点聚集,这是其活性较低的重要原因。
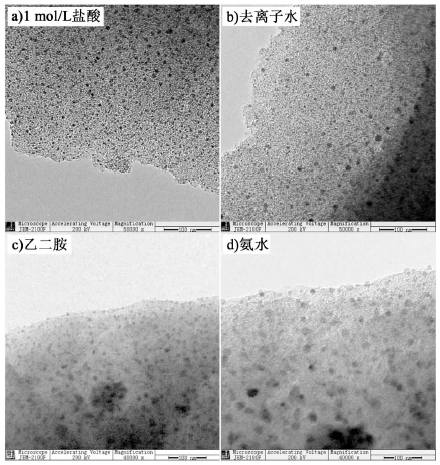
|
| 图 2 用不同溶剂浸渍所得催化剂的TEM图 Fig. 2 TEM images of catalysts prepared with different solvent |
| |
图 3是不同酸洗液处理后的活性炭载体负载6%铜而制备的Cu/C催化剂的乙炔转化率曲线图。
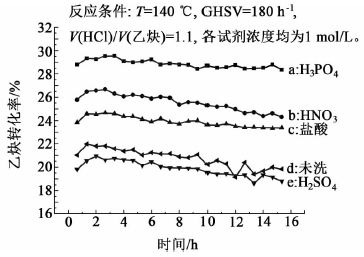
|
| 图 3 载体酸洗液对Cu/C催化活性的影响(6% Cu) Fig. 3 Effects of pickling solution on the catalytic activity of Cu/C (6% Cu) |
| |
从图 3中可以看出,若不用酸洗,直接用活性炭负载金属盐后催化剂的反应活性相对较低,乙炔氢氯化反应中乙炔转化率最高也只有21.7%,并且稳定性也比较差。而经过盐酸和硝酸处理后,其催化活性明显提高,Cu/C催化剂的初始乙炔转化率可以提高到24.8%和26.6%,这是由于载体经过酸处理后,去除了表面的灰分和Na、Fe等金属杂质[15, 16],进而降低了催化剂中毒的可能性并增强了金属活性位和载体的结合力。另外,硝酸洗涤活性炭后载体表面的含氧官能团会增多,提高了亲水性,使得活性炭更加容易浸湿,从而有利于活性组分在催化剂表面的固载和分散[17]。从图 3中还可以看出以硫酸洗过的活性炭,制备的6%Cu负载量的Cu/C催化剂催化活性反而比未加清洗的更低,这是因为硫酸盐容易形成沉淀,这不仅不能有效地去除催化剂的毒性物质,反而会使生成的沉淀沉积在载体表面上,从而影响了活性组分在催化剂表面的固载。
2.1.3 Cu负载量的影响以活性炭为载体制备了一系列不同负载量的Cu/C催化剂,在相同反应条件下考察其催化乙炔氢氯化反应的活性和选择性,结果示于图 4。

|
| 图 4 不同Cu负载量的Cu/C催化乙炔氢氯化反应的转化率和氯乙烯选择性 Fig. 4 Acetylene conversion and selectivity to vinyl chloride of Cu/C catalysts with different Cu loadings |
| |
从图 4中可以看出,活性炭负载的氯化铜催化剂其催化反应的选择性均大于99.5%。这对催化剂来说是十分优越的性能。但是这种未经任何特殊处理的氯化铜负载型催化剂的催化活性并不高。当负载量较小时,乙炔的转化率随着铜负载量的增加而增加,这是由于催化剂活性组分的增加使得催化剂孔道内的活性中心增多,从而使反应的转化率逐渐增大。其中经3次浸渍可制得15% Cu负载量的催化剂,其催化反应时活性最高,可达40.5%,同时反应10 h后催化剂的催化活性仍在40%左右。而后再增加铜的负载量,催化剂的反应活性开始降低,这种活性下降是由活性位点的团聚造成的。
2.1.4 焙烧温度的影响以相同的活性炭(1 mol/L H3PO4洗过)为载体,在其他制备条件完全相同的情况下,由于焙烧温度的不同可能会影响活性组分的粒径分布和结合牢固性[18, 19],因此,我们改变焙烧温度,制备出一系列的Cu/C催化剂,并考察了它们对乙炔氢氯化反应的催化活性,结果示于图 5。

|
| 图 5 焙烧温度对Cu/C催化活性的影响(15% Cu) Fig. 5 Effects of calcination temperature on catalytic activity of Cu/C catalyst |
| |
由图 5可见,在500 ℃焙烧温度下制得的催化剂比其他催化剂具有更好的催化活性和稳定性。当焙烧温度较低时,催化剂的初始活性变化不大,但稳定性较之于高温焙烧下的催化剂有明显不足,活性随反应时间下降明显,这说明低温焙烧后,活性组分和载体的结合牢固性不强,在反应过程中易于流失造成催化活性下降。当焙烧温度过高时(600 ℃),催化剂稳定性较好,但活性较之500 ℃焙烧有明显下降,这是由CuCl2在高温下的挥发流失造成的。综合考虑,500 ℃是Cu/C催化剂的最适宜焙烧温度。
2.2 Cu/C 催化剂的催化性能与失活原因分析 2.2.1 Cu/C催化剂的催化性能与温度的关系综合各种影响因素,我们选定最适宜制备条件为:用1 mol/L的H3PO4对活性炭进行预处理,然后将CuCl2盐酸(1 mol/L)溶液浸渍在活性炭上,烘干,500 ℃焙烧60 min,Cu负载量为15%。在这种条件下,制备出Cu/C催化剂,并考察在不同温度下对乙炔氢氯化反应的活性和选择性,结果示于图 6。
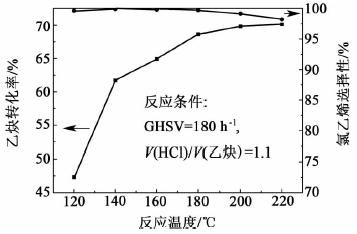
|
| 图 6 反应温度对Cu/C催化特性的影响 Fig. 6 Effects of reaction temperature on catalytic properties of Cu/C catalysts |
| |
从图 6可以看出,该催化剂催化乙炔氢氯化反应的乙炔转化率随温度的升高而增大,在160 ℃时,乙炔的转化率为61.0%,当温度升高到180 ℃时,转化率可达68.2%,而在高于180 ℃之后,活性增加就比较缓慢了;另一方面,随着温度的升高,氯乙烯选择性有一定程度的下降,尤其在温度高于180 ℃时,选择性下降明显,180 ℃时,其选择性为99.7%,220 ℃时就降为98.2%。
综合考虑这两种影响,确定180 ℃为该反应的最适宜反应温度。对比邓国才等[11]研发的锡铋铜复合催化剂95%的选择性,该催化剂的选择性更好,并且前者是在非常低的空速下(30 h-1)得到的数据,而本研究所述催化剂在较高空速下仍然具有很好的稳定性(图 7)。并且该催化体系比魏小波等[12]研发的铋基催化剂具有更高的活性。
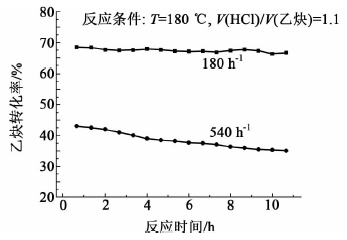
|
| 图 7 不同空速下Cu/C催化剂的活性曲线 Fig. 7 Activity curves of Cu/C catalysts under different GHSV |
| |
以磷酸洗过的活性炭为载体,1 mol/L盐酸为溶剂,500 ℃焙烧60 min后制得Cu/C催化剂。分别在180和540 h-1空速下考察了该催化剂对乙炔氢氯化反应的催化活性,结果示于图 7。
图 7表明,在180 h-1空速下,催化剂催化活性较为稳定,10 h内乙炔转化率稳定在68%左右;而在空速为540 h-1时,初始乙炔转化率为43%,并且催化剂活性下降较快。
图 8为540 h-1空速下,反应前后Cu/C催化剂的TEM图和电子衍射图。

|
| 图 8 Cu/C催化剂的TEM图和电子衍射图 Fig. 8 TEM and electron diffraction images of Cu/C catalysts |
| |
对比反应前后的TEM图可以看出,反应后活性组分出现了一定程度的团聚,平均粒径比反应前略有增加;由反应前后的电子衍射图可以看出,反应前活性组分是以非晶态形式负载于活性炭上的,而反应后出现了聚集态的多晶结构,而晶态的CuCl2由于络合位点被占据而不具有催化活性,因此,催化剂活性下降是催化剂失活的主要原因。
3 结论以活性炭为载体,CuCl2为活性组分制备了负载型Cu/C催化剂。用1 mol/L的H3PO4对活性炭进行洗涤,并以1 mol/L的盐酸作为溶剂,以CuCl2作为溶质所得负载型Cu/C催化剂具有较好的表面分散性。Cu/C催化剂在500 ℃氮气氛围下焙烧之后具有较好的活性和稳定性,焙烧温度过高会导致部分活性组分挥发流失,造成活性下降。该催化剂在T=180 ℃,GHSV=180 h-1,V(HCl)/V(乙炔)=1.1的条件下时同时具有较高的反应活性和氯乙烯选择性,乙炔转化率可达到68%,选择性大于99.5%,反应10 h内活性几乎不变;若空速增大到540 h-1,初始乙炔转化率只有43%,并且在反应10 h内活性下降明显,这是由活性组分的团聚结晶造成的。
| [1] | 李玉芳, 伍小明. PVC树脂生产技术进展及市场分析[J]. 中国氯碱,2008, (9) : 1–4 Li Yufang, Wu Xiaoming. Development of production technology of PVC and its market analysis[J]. China Chlor-Alkali,2008, (9) : 1–4 |
| [2] | 郑进. 乙烷氧氯化制备氯乙烯工艺[J]. 中国氯碱,2004, (3) : 14–16 Zheng Jin. Ethane oxychlorination process for vinyl chloride preparation[J]. China Chlor-Alkali,2004, (3) : 14–16 |
| [3] | 倪锐利, 陈江. 30万t/a乙烯法氯乙烯/聚氯乙烯生产工艺技术国产化开发[J]. 聚氯乙烯,2011,39 (5) : 19–21 Ni Ruili, Chen Jiang. Domestic development of production process of 300 kt/a vinyl chloride/PVC from ethylene[J]. Polyvinyl Chloride,2011,39 (5) : 19–21 |
| [4] | 刘岭梅. 电石法VCM工艺技术优化探讨[J]. 江苏化工,2002 : Liu Lingmei. Process technology development of VCM plant with carbide method[J]. Jiangsu Chemical Industry,2002 : |
| [5] | 杨惠娣. 我国聚氯乙烯行业现状与发展趋势[J]. 塑料助剂,2008, (2) : 1–7 Yang Huidi. The situation and development trends of the PVC industry in China[J]. Plastic Additives,2008, (2) : 1–7 |
| [6] | Nkosi B, Coville N J, Hutehings G J. Vapor phase hydrochloride of acetylene with group VIII and IB metal chloride catalysts[J]. Appl Catal,1988,43 (1) : 33–39 |
| [7] | Nkosi B, Coville N J, Hutehings G J, et al. Hydrochlorination of acetylene using gold catalysts:A study of catalyst deactivation[J]. J Catal,1991,128 (2) : 366–377 |
| [8] | Nkosi B, Adams M D, Coville N J, et al. Hydrochlorination of acetylene using carbon-supported gold catalyst:A study of catalyst reactivation[J]. J Catal,1991,128 (2) : 378–386 |
| [9] | Wang S, Shen B, Song Q. Kinetics of acetylene hydrochlorination over bimetallic Au-Cu/C catalyst[J]. Catal Lett,2010,134 (1/2) : 102–109 |
| [10] | 王声洁. 乙炔氢氯化非汞催化反应制取氯乙烯单体研究[D]. 上海:华东理工大学, 2010Wang Shengjie. Study on non-mercury catalytic acetylene hydrochlorination to produce vinyl cloride monomer (VCM)[D]. Shanghai:East China University of Science and Technology, 2010(in Chinese) |
| [11] | 邓国才, 吴本湘, 李同树, 等. 乙炔法合成氯乙烯固相非汞催化剂的研制[J]. 聚氯乙烯,1994, (6) : 5–9 Deng Guocai, Wu Benxiang, Li Tongshu, et al. Development of solid non-mercury catalysts for vinyl chloride production by acetylene method[J]. Polyvinyl Chloride,1994, (6) : 5–9 |
| [12] | 魏小波, 魏飞, 赛伟中, 等. 铋复合盐在乙炔氢氯化反应中的催化作用[J]. 过程工程学报,2008,8 (6) : 1 218-1 222 Wei Xiaobo, Wei Fei, Sai Weizhong, et al. Catalysis of bismuth complex salt in vapor phase hydrochlorination of acetylene[J]. The Chinese Journal of Process Engineering,2008,8 (6) : 1 218-1 222 |
| [13] | Zhang H, Dai B, Wang X, et al. Hydrochlorination of acetylene to vinyl chloride monomer over bimetallic Au-La/SAC catalysts[J]. Journal of Industrial and Engineering Chemistry,2012,18 (1) : 49–54 |
| [14] | Corma A, Esteve P, Martínez A. Solvent effects during the oxidation of olefins and alcohols with hydrogen peroxide on Ti-beta catalyst:The influence of the hydrophilicity-hydrophobicity of the zeolite[J]. Journal of Catalysis,1996,161 (1) : 11–19 |
| [15] | Conte M, Carley A F, Heirene C, et al. Hydrochlorination of acetylene using a supported gold catalyst:A study of the reaction mechanism[J]. Journal of Catalysis,2007,250 (2) : 231–239 |
| [16] | Conte M, Carley A F, Attard G, et al. Hydrochlorination of acetylene using supported bimetallic Au-based catalysts[J]. Journal of Catalysis,2008,257 (1) : 190–198 |
| [17] | 陈晨, 林性贻, 于政锡, 等. 硝酸处理活性炭对醋酸乙烯催化活性的影响[J]. 石油化工,2004,33 (11) : 1 024-1 027 Chen Chen, Lin Xingyi, Yu Zhengxi, et al. Effect of H3NO3 treated activated carbon on its catalytic activity for vinyl acetate synthesis[J]. Petrochemical Technology,2004,33 (11) : 1 024-1 027 |
| [18] | Boccuzzi F, Chiorino A, Manzoli M, et al. Au/TiO2 nanosized samples:A catalytic, TEM, and FTIR study of the effect of calcination temperature on the CO oxidation[J]. Journal of Catalysis,2001,202 (2) : 256–267 |
| [19] | Tsubota S, Nakamura T, Tanaka K, et al. Effect of calcination temperature on the catalytic activity of Au colloids mechanically mixed with TiO2 powder for CO oxidation[J]. Catalysis Letters,1998,56 (2/3) : 131–135 |
 2016, Vol. 33
2016, Vol. 33





