近年来,为了减少对化石能源的依赖,高效利用生物质资源受到了人们的广泛关注[1, 2, 3]。纤维素为生物质资源中最丰富的一类,通过水解加氢过程转化纤维素为山梨醇是利用纤维素这一可再生资源的重要途径。
在纤维素水解加氢过程中,纤维素首先酸催化水解生成葡萄糖,葡萄糖经快速加氢生成山梨醇。目前国内外研究者已对兼具酸性位和加氢活性位的双功能催化剂进行了大量研究[4, 5]。2006年,Fukuoka等[4]首次报导利用固体酸负载贵金属Ru或Pt为催化剂,在190 ℃水相中实现了纤维素到多元醇的一步催化转化。其中以Pt/γ-Al2O3为催化剂,山梨醇收率为25%。双功能催化剂将纤维素水解和加氢合为一步,加速了纤维素转化反应的进行。众多研究表明,双功能催化剂的酸性位、加氢活性位的数量及分布直接影响产物山梨醇的选择性[6]。由于这类催化剂主要由酸性载体和金属两部分组成,调控任一组分对载体比表面积、孔结构、表面酸量以及金属分散度会有较大的影响[7, 8, 9]。同时优化双功能催化剂的酸性位和加氢活性位在实验中并不简单易行,而采用酸性催化剂和加氢催化剂的组合体系更易于实现对催化剂酸性位、加氢活性位的调控。Sels课题组[10, 11]分别对杂多酸H4SiW12O40与Ru/C组合催化剂、稀盐酸与Ru/H-USY组合催化剂进行了研究,以较高浓度的球磨纤维素为原料,190 ℃下使纤维素完全转化,并通过合理调控酸性位和加氢活性位的比例,六元醇选择性均高于已报道的双功能催化剂,可达到85%左右。但这类组合催化剂都有一些显著的缺点如液体酸的难回收和对设备的腐蚀性,以及液体酸与醇类产物的难分离等。相比而言,非均相固体催化剂有利于解决这类问题。
本研究以固体酸提供酸性位,考虑到纳米粒子粒径小,更容易暴露表面活性位[12],采用了纳米酸性金属氧化物,同时选择已有文献报导的具有优异加氢性能的Ru/CMK-3提供加氢活性位。首先筛选出高选择性催化纤维素转化为山梨醇的组合催化剂,探讨催化剂的酸性位和加氢活性位的匹配对山梨醇选择性的影响。
1 实验部分 1.1 原料微晶纤维素购自Sigma-Aldrich(上海)贸易有限公司;γ-Al2O3纳米金属氧化物购自Alfa Aesar。TiO2(5 nm),WO3 (40 nm),SiO2(30 nm),ZrO2(20 nm)购自北京德科岛金科技有限公司;纳米HZSM-5[n(Si)/n(Al)=25](1~100 nm)购自上海卓越科技有限公司;RuCl3·nH2O[w(Ru)≥38%]购自陕西瑞科新材料股份有限公司;CMK-3,AC购自南京吉仓纳米科技有限公司。
1.2 Ru/CMK-3催化剂制备采用浸渍法制备,金属组分负载量为3%(质量分数)。步骤如下:配置一定浓度的RuCl3·nH2O溶液,将CMK-3载体浸渍在溶液中,剧烈搅拌30 min后,放置于80 ℃烘箱干燥12 h,在管式电阻炉中以氢气、氮气混合气还原2 h,还原温度400 ℃,V(N2):V(H2)=1:1。降至室温在氮气气氛下钝化1 h,用作3%Ru/CMK-3催化剂(记为Ru/MC)。3% Ru/AC催化剂采取相同步骤制备。
1.3 催化剂的性能评价催化反应在体积为50 mL的不锈钢高压反应釜中进行。将一定量的催化剂、0.5 g纤维素以及20 mL去离子水置于反应釜中,以高纯H2吹扫排空反应釜中空气后,充入H2至5 MPa。将高压反应釜加热升温至指定温度后,开始反应计时。冰水浴冷却停止反应,离心分离液体产物和剩余固体(包括催化剂和未反应的纤维素),液体产物以高效液相色谱(HPLC)定性和定量分析,固体干燥后称质量。
反应后纤维素转化率和各产物收率、选择性按公式(1)~(3)进行计算:
| $${\rm{转化率 = }}\frac{{初始纤维素的量 - 剩余纤维素的量}}{{初始纤维素的量}} \times 100\% $$ | (1) |
| $$\begin{array}{c} 收率 = \frac{{产物i在液相产品中的物质的量}}{{纤维素中葡萄糖单元的物质的量}} \times \\ \frac{{产物i的碳的物质的量}}{6} \times 100\% \end{array}$$ | (2) |
| $$选择性 = \frac{{收率}}{{转化率}} \times 100\% $$ | (3) |
采用日本理学公司D/MAX-2500型号X射线粉末衍射仪对样品的结晶结构进行分析,Cu_Kα辐射,管电流40 mA,电压40 kV,2θ扫面角度范围10°~90°;采用日本日立公司S-4800型场发射扫描电子显微镜表征催化剂的表面形貌及晶粒大小;采用日本电子公司JEM-2100F型场发射透射电子显微镜观察样品微观结构,测试前研磨样品,放入乙醇溶剂中,超声波处理分散1 h,后覆在带有超薄碳膜的铜网上观察。
2 结果与讨论 2.1 不同纳米酸性金属氧化物与Ru/CMK-3组合催化剂催化纤维素转化的性能比较不同纳米酸性金属氧化物与Ru/CMK-3组合催化剂催化纤维素水解加氢反应的结果如表 1所示。
| 序号 | 催化剂 | 转化率/% | 收率/% | |||||
| 葡萄糖 | 山梨醇 | 木糖醇 | 丙二醇 | 乙二醇 | 5-HMF | |||
| 1 | Ru/MC | 27.0 | 12.6 | 0.6 | 0.2 | |||
| 2 | γ-Al2O3-Ru/MC | 49.6 | 0.1 | 43.0 | 0.1 | 0.1 | 0.1 | |
| 3 | TiO2-Ru/MC | 30.5 | 9.2 | 1.8 | 1.7 | 0.8 | 0.2 | |
| 4 | WO3-Ru/MC | 43.4 | 0.2 | 7.0 | 0.3 | 1.7 | 13.0 | 0.9 |
| 5 | ZrO2-Ru/MC | 27.8 | 8.8 | 1.7 | 1.8 | 0.7 | 0.2 | |
| 6 | HZSM-5-Ru/MC | 58.1 | 0.3 | 36.3 | 2.4 | 0.1 | 1.1 | |
| 7 | γ-Al2O3-Ru/AC | 46.6 | 0.4 | 35.2 | 2.2 | 0.1 | 0.1 | 2.5 |
| Reaction conditions: cellulose(0.5 g), nanosized solid acid catalysts(0.35 g), 3% Ru/MC (0.01 g), 3% Ru/AC (0.01 g) H2O(20 g), 5 MPa H2, 200 ℃, 10 h. | ||||||||
从表 1中可以看到,只有Ru/MC、无酸性催化剂时,纤维素转化率为27.0%,山梨醇收率为12.6%。此时纤维素水解反应主要靠水在高温高压下解离产生的氢离子催化(据报道,水在190 ℃以上可解离产生H+[13])。水解生成的葡萄糖继而在Ru/MC催化剂作用下,生成山梨醇。在使用组合催化剂(No.2~No.6)后,纤维素转化率有不同程度的升高。其中,ZrO2-Ru/MC、TiO2-Ru/MC(No.3、No.5)催化时,纤维素转化率增加较少,分别为30.5%和27.8%,相应山梨醇收率为9.2%和8.8%。与仅有Ru/MC催化的结果(No.1)相比,山梨醇收率降低,而其他小分子产物如木糖醇,C2~C3醇等收率增多,可能的原因是ZrO2、TiO2会促使葡萄糖异构或断键,抑制葡萄糖的直接加氢反应。γ-Al2O3-Ru/MC、WO3-Ru/MC、HZSM-5-Ru/MC(No.2、No.4、No.6)催化时,纤维素的转化率显著升高,分别为49.6%、43.4%、58.1%,而产物分布却有很大不同。γ-Al2O3-Ru/MC催化时得到的山梨醇收率为43.0%,选择性达到86.8%,其他的醇类很少;WO3-Ru/MC所得到主要产物为乙二醇,乙二醇收率达到13.0%,山梨醇收率仅为7.0%;HZSM-5-Ru/MC所得到的山梨醇收率为36.3%,选择性达到62.4%。对于γ-Al2O3-Ru/MC催化剂,γ-Al2O3具有Lewis酸位,文献报道Lewis酸中心能与高温水产生的Brønsted酸协同催化纤维素转化为可溶性低聚糖,从而提高葡萄糖收率[14],再经Ru/MC催化剂高效加氢得到山梨醇。对于WO3-Ru/MC催化剂,WO3也是一类固体酸,但酸类目前还未有文献证实。张涛等[15]用Ru-W/AC作为催化纤维素转化的催化剂,在245 ℃、6 MPa H2下反应30 min,乙二醇的选择性达到61.7%,提出W物种有利于提高乙二醇选择性。表 1中WO3-Ru/MC组合催化剂的催化结果也说明了WO3不仅作为固体酸催化剂可促进水解反应,提高纤维素转化率,同时其还可催化低聚糖、葡萄糖等分子中的C—C键断裂,进一步生成低碳醇分子。与γ-Al2O3相比,HZSM-5具有B酸和L酸中心,酸类和酸量都较强,因此纤维素转化率最高,但山梨醇选择性显著偏低。同时葡萄糖、5-HMF的收率增加。Sels[6]的研究表明,当催化剂的酸性位占主导时,不仅催化纤维素水解反应,而且对水解产物葡萄糖的进一步降解,即生成5-HMF等副产物的转化路径也有较强的催化作用。此外,由于HZSM-5的孔径较小,一部分水解产物不能及时扩散出孔道,会进一步发生降解,因此加氢产物山梨醇收率低,而副产物明显增多。
在No.7中,选用γ-Al2O3-Ru/AC为催化剂。与γ-Al2O3-Ru/MC的催化结果相比,纤维素转化率略低,但山梨醇的收率仅为35.2%,同时伴随少量5-HMF(收率2.5%)生成。已有文献报道[16],在同样的金属负载量下,CMK-3的有序介孔结构和较大的比表面积使得金属有较高的分散度,活性中心能与反应物有更好的接触。Ru/MC比Ru/AC加氢活性位多,水解生成的葡萄糖能快速加氢,避免葡萄糖进一步降解。
结合表 1中各组合催化剂的特点,以及反应产物的分布特征,表明催化剂的酸性位和加氢活性位的不同会影响纤维素的反应路径,从而得到不同的产物分布,如图 1所示。
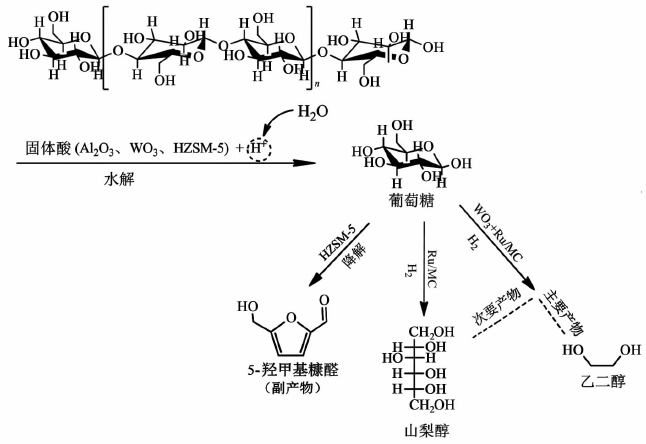
|
| 图 1 纤维素水解加氢的反应路线图 Fig. 1 Reaction path of the hydrolytic hydrogenation of cellulose |
| |
图 2给出了γ-Al2O3-Ru/CMK-3组合催化剂中γ-Al2O3样品的广角XRD粉末衍射图谱。图 3为Ru/CMK-3的小角XRD图谱。
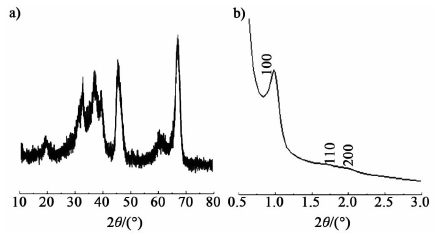
|
| 图 2 γ-Al2O3的广角XRD谱图a)和Ru/CMK-3的小角XRD谱图b) Fig. 2 Wide angle XRD of γ-Al2O3 a) and small angle XRD of Ru/CMK-3 b) |
| |

|
| 图 3 γ-Al2O3样品的SEM图 Fig. 3 SEM image of γ-Al2O3 |
| |
由图 2可见,样品在2θ=19.6°,31.9°,37.6°,39.5°,45.8°,60.5°和66.8°等处出现较强的衍射峰,分别为γ-Al2O3的(111),(220),(311),(222),(400),(511) 和 (440) 晶面衍射[17]。由图 3可见,样品在2θ=1.0°,1.7°,2.0°出现归属于有序二维六方结构、P6mm对称性的(100),(110),(200)晶面衍射峰。与文献报道的CMK-3小角XRD衍射谱图一致[18],说明3% Ru/CMK-3并未破坏和堵塞孔道,仍能保持很好的有序结构。
2.2.2 SEM结果图 3是γ-Al2O3样品的扫描电子显微镜分析图。
由图 3可以看到,纳米γ-Al2O3为规则类球形颗粒,有很好的分散度,少量团聚,粒径在20 nm左右。
2.2.3 TEM结果图 4为3% Ru/CMK-3的TEM图。图 4中清晰显示出样品有序的孔道结构,且Ru纳米粒子均匀分散在载体上,粒径大小均一,平均粒径为4 nm左右。

|
| 图 4 Ru/CMK-3的TEM图 Fig. 4 TEM image of Ru/CMK-3 |
| |
图 5是γ-Al2O3样品的NH3-TPD曲线。
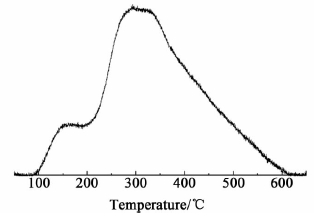
|
| 图 5 γ-Al2O3样品的NH3-TPD图 Fig. 5 NH3-TPD image of γ-Al2O3 |
| |
如图 5所示,样品在160 ℃,320 ℃具有两个脱附峰,分别属于氧化铝表面弱酸和中等强度酸对应的NH3脱附峰。总酸量为0.33 mmol/g。
2.3 反应条件的影响为进一步提高催化性能,对固体酸催化剂γ-Al2O3和加氢催化剂Ru/CMK-3的用量配比和反应时间进行了研究。
2.3.1 催化剂配比的影响图 6为γ-Al2O3用量对纤维素转化的影响。

|
| 图 6 γ-Al2O3用量对纤维素转化的影响 Fig. 6 Influence of the amount of γ-Al2O3 on cellulose conversion |
| |
从图 6中可以看到,随着纳米γ-Al2O3用量的增加,纤维素的转化率以及山梨醇收率迅速升高。当γ-Al2O3用量为0.1 g时,纤维素转化率由26.7%显著升高到37.3%,且山梨醇的收率从12.6%升高到32.3%。如文献[19]所述,Lewis酸的加入可以有效地促进纤维素降解产生的可溶性低聚糖进一步解聚,从而使纤维素的转化进一步提高。配合Ru/MC催化剂,解聚形成的葡萄糖可被高效加氢成为山梨醇,其它产物如脱水山梨醇、木糖醇、C2~C3醇的含量非常少。当γ-Al2O3催化剂用量大于0.4 g时,转化率趋于稳定,而山梨醇收率降低。γ-Al2O3和Ru/CMK-3的最适宜用量配比为40:1。
2.3.2 反应时间的影响图 7为反应时间对纤维素转化的影响。

|
| 图 7 反应时间对纤维素转化的影响 Fig. 7 Influence of reaction time on cellulose conversion |
| |
在反应时间为0.25 ~10.00 h之间时,纤维素的转化率随时间的延长不断升高,主要的产物仍然是山梨醇并且具有同样的规律。葡萄糖的收率则逐渐减少,当反应时间为0.25 h时,葡萄糖的收率有3.8%。继续反应0.25 h,葡萄糖收率则只有0.6%,之后逐步趋近为0。表明葡萄糖是转化为山梨醇的一种中间产物,而且葡萄糖加氢反应速率很快,产物中葡萄糖始终较少。当反应时间为10.00 h时,纤维素转化率为49.8%,山梨醇收率达到最高,为45.4%,选择性为91.3%。山梨醇选择性远高于目前使用10% Ru/AC-SO3H双功能催化剂所达到的最好的山梨醇选择性79%[5]。反应时间到12.00 h时,转化率依旧升高,但山梨醇收率略有下降,同时脱水山梨醇有所增加,表明随着时间的延长山梨醇会进一步发生脱水反应,生成脱水山梨醇。为了得到较高的山梨醇收率,最适宜的反应时间为10.00 h。
3 结论研究了多种纳米酸性金属氧化物与Ru/CMK-3组合催化剂催化纤维素转化制山梨醇的催化性能,结果表明纳米γ-Al2O3-Ru/CMK-3组合催化剂对纤维素水解加氢制山梨醇有高选择性。在200 ℃,反应时间 10 h,纳米γ-Al2O3与Ru/CMK-3的质量比为40:1时,纤维素转化率为49.8%,山梨醇收率为45.4%,山梨醇选择性达到91.3%,对山梨醇的高选择性优于目前的文献报道。研究还表明催化剂的酸性位和加氢活性位的合理匹配是提高山梨醇选择性的重要因素,当酸性位占主导时,不利于提高山梨醇选择性。
| [1] | Ruppert A M, Weinberg K, Palkovits R. Hydrogenolysis goes bio:From carbohydrates and sugar alcohols to platform chemicals[J]. Angewandte Chemie International Edition,2012,51 (11) : 2564-2601 |
| [2] | Klemm D, Heublein B, Fink H P, et al. Cellulose:Fascinating biopolymer and sustainable raw material[J]. Angewandte Chemie International Edition,2005,44 (22) : 3358-3393 |
| [3] | Fleming K, Gray D G, Matthews S. Cellulose crystallites[J]. Chemistry-A European Journal,2001,7 (9) : 1831-1836 |
| [4] | Fukuoka A, Dhepe P L. Catalytic conversion of cellulose into sugar alcohols[J]. Angewandte Chemie International Edition,2006,45 (31) : 5 161-5 163 |
| [5] | Lee H, Han J W. Direct conversion of cellulose into sorbitols using dual-functionalized catalysts in neutral aqueous solution[J]. Catalysis Communications,2012 : 115–118 |
| [6] | Geboers J, Van de Vyver S, Ooms R, et al. Chemocatalytic conversion of cellulose:Opportunities, advances and pitfalls[J]. Catalysis Science & Technology,2011,1 (5) : 714–726 |
| [7] | Ding L, Wang A, Zheng M, et al. Selective transformation of cellulose into sorbitol by using a bifunctional nickel phosphide catalyst[J]. Chem Sus Chem,2010,3 (7) : 818–821 |
| [8] | Baek I G, You S J, Park E D. Direct conversion of cellulose into polyols over Ni/W/SiO2-Al2O3[J]. Bioresource Technology,2012 : 684–690 |
| [9] | You S J, Baek I G, Kim Y T, et al. Direct conversion of cellulose into polyols or H2 over Pt/Na(H)-ZSM-5[J]. Korean Journal of Chemical Engineering,2011,28 (3) : 744–750 |
| [10] | Geboers J, Van de Vyver S, Carpentier K, et al. Efficient catalytic conversion of concentrated cellulose feeds to hexitols with heteropoly acids and Ru on carbon[J]. Chemical Communications,2010,46 (20) : 3 577-3 579 |
| [11] | Geboers J, Van de Vyver S, Carpentier K, et al. Efficient hydrolytic hydrogenation of cellulose in the presence of Ru-loaded zeolites and trace amounts of mineral acid[J]. Chemical Communications,2011,47 (19) : 5 590-5 592 |
| [12] | 刘佳欣, 黄玉东. 纳米材料在纤维素催化转化中的应用[J]. 纤维素科学与技术,2011,19 (4) : 74–79 Liu Jiaxin, Huang Yudong. Nanosized materials in the application of the catalytic conversion of cellulose[J]. Journal of Cellulose Science and Technology,2011,19 (4) : 74–79 |
| [13] | Luo C, Wang S, Liu H. Cellulose conversion into polyols catalyzed by reversibly formed acids and supported ruthenium clusters in hot water[J]. Angewandte Chemie International Edition,2007,46 (40) : 7 636-7 639 |
| [14] | Chambon F, Rataboul F, Pinel C, et al. Cellulose conversion with tungstated-alumina-based catalysts:Influence of the presence of platinum and mechanistic studies[J]. Chem Sus Chem,2013,6 (3) : 500–507 |
| [15] | Zheng M, Wang A, Ji N, et al. Transition metal-tungsten bimetallic catalysts for the conversion of cellulose into ethylene glycol[J]. Chem Sus Chem,2010,3 (1) : 63–66 |
| [16] | Kobayashi H, Komanoya T, Hara K, et al. Water-Tolerant mesoporous-carbon-supported ruthenium catalysts for the hydrolysis of cellulose to glucose[J]. Chem Sus Chem,2010,3 (4) : 440–443 |
| [17] | 聂仁峰, 王军华, 费金华, 等. 介孔氧化铝的制备及其在甲醇脱水制二甲醚反应中的应用[J]. 催化学报,2011,32 (2) : 379–384 Nie Renfeng, Wang Junhua, Fei Jinhua, et al. Preparation of mesoporous alumina and its application in dehydration of methanol to dimethyl ether[J]. Chinese Journal of Catalysis,2011,32 (2) : 379–384 |
| [18] | Jun S, Joo S H, Ryoo R, et al. Synthesis of new, nanoporous carbon with hexagonally ordered mesostructure[J]. Journal of American Chemistry Society,2000,122 (43) : 10 712-10 713 |
| [19] | Chambon F, Rataboul F, Pinel C, et al. Cellulose hydrothermal conversion promoted by heterogeneous Brønsted and Lewis acids:Remarkable efficiency of solid Lewis acids to produce lactic acid[J]. Applied Catalysis B:Environmental,2011,105 (1/2) : 171–181 |
 2016, Vol. 33
2016, Vol. 33





