草酸二甲酯(dimethyl oxalate),又名乙二酸二甲酯,作为重要的化工和医药原料,常被用于制备各种萃取剂、黏合剂、增塑剂及多种医药中间体,如用来合成维生素B13,代替草酸二乙酯合成5-甲基-3-甲酰基异恶唑,加氢制备乙醇酸甲酯、乙二醇[1, 2],与氨作用合成草酰胺以用作缓释化肥或冷凝剂[3]等。
由于草酸二甲酯是煤制乙二醇过程中重要的中间产物,各行业及科研院所开始研究利用CO这种清洁能源制备草酸二甲酯的新方法[4, 5, 6, 7],但利用草酸与甲醇进行催化酯化反应生产草酸二甲酯这种传统工艺仍是工业化生产的主要方式。为详细研究草酸与甲醇的酯化反应过程,需要对反应过程中各时刻的样品组成进行检测,但是由于对全部组分的实时检测较复杂,难以进行,所以根据酯化反应方程式发现,只需准确测定草酸与草酸二甲酯的含量,就可根据各物质之间的定量关系计算出各时刻反应液中的物质组成,进而研究草酸与甲醇的酯化反应机理。
对于草酸含量的检测,已知文献中主要有酸碱滴定法[8]、电化学发光法[9]、气相色谱法[10]以及液相色谱法[11, 12, 13]等。其中酸碱滴定法中碱性物质的存在会使得样品中一部分草酸二甲酯水解,即便采用非水滴定,也不能准确判断滴定终点;采用电化学发光法操作繁琐,不能快速测出草酸含量;由于草酸遇热易分解,故利用气相色谱准确测定草酸含量时需对草酸进行衍生化,而衍生化处理时间较长,且无法判断衍生是否完全,所以气相色谱法也无法准确测定草酸含量。
本研究针对生成草酸二甲酯的酯化反应体系,建立简单、快速的反相高效液相色谱法,该方法能够准确测定草酸及草酸二甲酯的含量。
1 实验部分 1.1 仪器与试剂仪器:Shimadzu Prominence LC-20A型高效液相色谱仪,配有紫外可变波长检测器(SPD-20A),Shimadzu液相色谱工作站和Inertsil ODS-SP柱(4.6 mm×150 mm,5 μm);microBench pH600型pH计;UV765型紫外可见分光光度计;TTL-6A型超纯水器。
草酸二甲酯,阿拉丁试剂(中国)有限公司,分析纯;无水草酸,阿拉丁试剂(中国)有限公司,分析纯;乙腈,天津市光复科技发展有限公司,色谱纯;磷酸,天津市光复科技发展有限公司,色谱纯;水,自制超纯水。
1.2 色谱条件流动相:A相为磷酸水溶液(pH=2.7),B相为乙腈。A与B混合体积比为60:40,流速0.7 mL/min,柱温:25 ℃,检测波长:254 nm,进样量:2.5 μL。
1.3 实验方法储备液的配制:精确称取草酸二甲酯1.210 g,用乙腈作为溶剂,采用50 mL容量瓶定容,配成草酸二甲酯储备液,浓度为24.19 g/L;取无水草酸1.007 g,用乙腈定容至50 mL,配成草酸储备液,浓度为20.13 g/L;用草酸二甲酯和草酸的储备液配制成标准混合溶液。
标准溶液的配制:按照表 1中所示的配比分别移取不同体积的草酸二甲酯及草酸储备液,配制成一系列不同浓度的标准溶液,各标准溶液的质量浓度如表 2所示。在1.2节色谱条件下,对5份标准混合溶液进行色谱分析。
| 标准溶液编号 | #1 | #2 | #3 | #4 | #5 |
| 草酸/mL | 9.5 | 8.0 | 5.0 | 2.0 | 0.5 |
| 草酸二甲酯/mL | 0.5 | 2.0 | 5.0 | 8.0 | 9.5 |
| 标准溶液编号 | 草酸/(g·L -1) | 草酸二甲酯/(g·L -1) |
| #1 | 19.1254 | 1.2096 |
| #2 | 16.1056 | 4.8384 |
| #3 | 10.0660 | 12.0960 |
| #4 | 4.0264 | 19.3536 |
| #5 | 1.0066 | 22.9824 |
所配制的标准溶液及待测样品均须经过0.45 μm的有机滤膜过滤处理备用。在1.2节色谱条件下对待测样品进行色谱分析,采用标准曲线法对数据进行处理,即可得到样品中草酸及草酸二甲酯的含量。
2 结果与讨论 2.1 色谱条件的确定 2.1.1 检测波长的确定利用UV765型紫外可见分光光度计对草酸标样、草酸二甲酯标样及流动相分别在200~400 nm的波长范围内进行全波长扫描。结果表明,在扫描波长范围内草酸的最大吸收峰位于200 nm,且其在300 nm之前均有吸收,具体的草酸紫外光谱图如图 1所示。草酸二甲酯的最大吸收波长为254 nm;流动相的最大吸收波长为204 nm,且根据检测结果,发现流动相在225 nm之前均存在吸收。为消除流动相吸收对检测结果的影响,检测波长需大于225 nm。同时,为了保证检测结果更为准确,需要将某种待测组分的最大吸收波长作为检测波长,因而在大于225 nm的波长范围内,可将草酸二甲酯的最大吸收波长254 nm作为实验的检测波长,在此检测波长下草酸的吸收强度也能满足检测的要求。
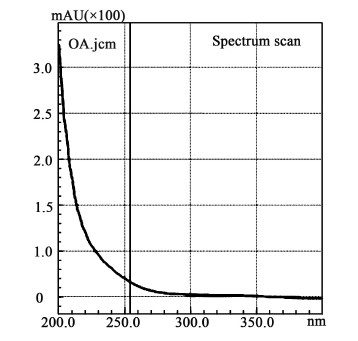
|
| 图 1 草酸的紫外光谱图 Fig.1 Ultraviolet spectrogram of oxalic acid |
考虑到草酸与甲醇在常温条件下可快速反应生成草酸二甲酯,故流动相中不可含有甲醇。分别以乙腈-水、乙腈-磷酸水溶液及纯水为流动相考察分离结果。
实验结果显示,以乙腈-水或纯水为流动相时,由于草酸在含有大量水的流动相中易解离出2个氢离子,导致草酸的色谱图出现双峰或拖尾等现象。以乙腈-磷酸水溶液为流动相时,由于在流动相中加入酸可抑制酸的电离,改善各物质色谱峰形以及分离度,故使用此流动相时,各物质的峰形及选择性较乙腈-水或纯水流动相有明显改善,各峰保留时间合适,峰形窄尖,分离度较为理想,符合分离要求。
2.1.3 流动相的优化流速对草酸二甲酯及草酸的分离有一定影响,当流速增加时,色谱峰变窄,保留时间变短,分离度变小;当流速减小是,色谱峰变宽,保留时间变长,分离度增大。综合考虑保留时间及分离度两个因素,选定流动相流速为0.7 mL/min。
分别以乙腈-磷酸水溶液(60:40、70:30和80:20,体积比)为流动相进行等度洗脱,随着流动相中乙腈的比例不断增加,草酸二甲酯及草酸的分离度逐渐减小。综合考虑泵压、分离度、保留时间及色谱柱寿命等因素,选择乙腈-磷酸水溶液(60:40,体积比)为流动相,柱温为25 ℃。
从色谱分析条件考虑,若酸的电离常数为pKa,则流动相的最适宜pH值满足2≤pH≤pKa2[14]。草酸的一级电离常数pKa1为1.27,二级电离常数pKa2为4.27。据此,流动相的pH值应满足2.00≤pH≤2.27。磷酸含量的增加虽能很好的抑制酸的电离,但长时间使用酸性流动相对色谱柱的使用寿命有不良影响。酸性过强会加速草酸二甲酯样品在流动性中的水解程度,加大测量误差。综合考虑两种物质的分离效果、测量误差及酸性条件对色谱柱性能的影响,确定流动相的pH值为2.70。
最适宜色谱条件下测得的草酸及草酸二甲酯色谱图如图 2所示。
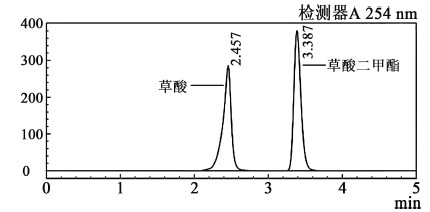
|
| 图 2 草酸及草酸二甲酯的高效液相色谱图 Fig.2 HPLC chromatography of oxalic acid and dimethyl oxalate |
分别对不同浓度的标准溶液进行定量分析,以峰面积y对质量浓度x作线性回归,回归曲线如图 3所示,回归方程如下:
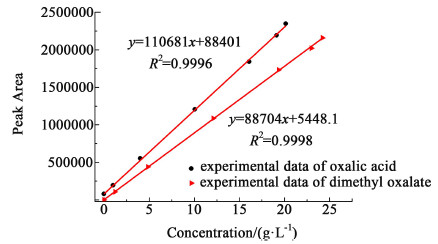
|
| 图 3 草酸及草酸二甲酯的标准曲线图 Fig.3 Standard curves of oxalic acid and dimethyl oxalate |
草酸的线性回归方程为:y=110681x+88401,R2=0.9996。
草酸二甲酯的回归方程为:y=88704x+5448.1,R2=0.9998。
在已确定的色谱条件下分析,以3倍信噪比计算草酸二甲酯的检出限为1.21 mg/L,草酸的检出限为1.01 mg/L。
2.3 加标回收率和精密度分别将不同浓度的草酸二甲酯及草酸标准品加入到已知浓度的混合样品中,并用乙腈定容至10 mL,以1.2节的色谱条件对加标样品重复进样测定5次,计算草酸和草酸二甲酯的加标回收率及相对标准偏差(RSD),结果见表 3。
| 物质 | 基准量/(g·L -1) | 加入量/(g·L -1) | 测定量/(g·L -1) | 加标回收率/% | RSD/% |
| 草酸 | 2.085 | 1.611 | 3.628 | 98.16 | 1.02 |
| 草酸二甲酯 | 2.435 | 0.487 | 2.919 | 99.89 | 1.03 |
在生成草酸二甲酯的反应液中取适量样品,在优化后的色谱条件下进行定量分析,每个样品重复进样4次,通过两种物质的标准曲线计算出各物质的浓度,分析结果如表 4所示。
| 所测物质 | 所测浓度/(g·L -1) | 平均浓度/(g·L -1) | 相对标准偏差/% | |||
| 1 | 2 | 3 | 4 | |||
| 草酸 | 10.014 | 10.146 | 10.207 | 10.041 | 10.102 | 0.83 |
| 草酸二甲酯 | 12.035 | 12.242 | 12.291 | 12.105 | 12.168 | 0.97 |
建立了在草酸二甲酯生产过程中,利用反相高效液相色谱定量分析草酸二甲酯和草酸的方法。实验结果表明,在优化的色谱条件下,反应液中的草酸二甲酯与草酸得到很好的分离。该方法具有回收率高,重复性好,操作方便等优点。
| [1] | 程能林. 溶剂手册[M]. 第4版. 北京: 化学工业出版社,2008 |
| [2] | 彭敏. 用草酸二甲酯替代草酸二乙酯合成磺胺甲恶唑[J]. 中国医药指南, 2012, 10(14): 73-75 Peng Min. Synthesis of sulfamethoxazole using dimethyl oxalate instead of diethyl oxalate[J]. Guide of China Medicine, 2012, 10(14): 73-75(in Chinese) |
| [3] | 胡玉容, 王科, 李扬, 等. 新型缓释氮肥草酰胺[J]. 化工技术与开发, 2012, 41(10): 31-33 Hu Yurong, Wang Ke, Li Yang, et al. New type of slow-release nitrogen fertilizer oxamide[J]. Technology & Development of Chemical Industry, 2012, 41(10): 31-33(in Chinese) |
| [4] | Tahara S, Fujii K, Nishihira K, et al. Process for continuous preparation of diester of oxalic acid: US, 4467109[P]. 1984-08-21 |
| [5] | 谭俊青, 计扬, 肖文德. CO 气相催化偶联合成草酸二甲酯的原位红外及动力学研究[J]. 广东化工, 2008, 35(6): 7-9 Tan Junqing, Ji Yang, Xiao Wende. IR study and kinetic research on CO catalytic coupling to dimethyl oxalate[J]. Guangdong Chemical Industry, 2008, 35(6): 7-9 (in Chinese) |
| [6] | 林茜, 计扬, 谭俊青, 等. Pd/α-Al2O3催化CO偶联制草酸二甲酯的反应机理[J]. 催化学报, 2008, 29(4): 325-329 Lin Qian, Ji Yang, Tan Junqing, et al. Mechanism of CO coupling to dimethyl oxalate over Pd/α-Al2O3[J]. Chinese Journal of Catalysis, 2008, 29(4): 325-329(in Chinese) |
| [7] | 张飞跃, 沙昆源. 一氧化碳催化合成草酸二甲酯的研究[J]. 广西大学学报(自然科学版), 1999, 24(3): 234-237 Zhang Feiyue, Sha Kunyuan. Mechanism studies of synthesis of dimethyl oxalate from CO and CH3ONO on Pd/Al2O3[J]. Journal of Guangxi University (Natural Science), 1999, 24(3): 234-237(in Chinese) |
| [8] | 张天一. 合成草酸二乙酯的工艺优化[D]. 北京: 北京化工大学, 2000 Zhang Tianyi. The process optimum of the synthesis of diethyl oxalate[D]. Beijing: Beijing University of Chemical Technology, 2000 |
| [9] | 马容明, 何治柯, 罗庆尧, 等. 草酸二乙酯中游离草酸的化学发光分析研究[J]. 华中师范大学学报(自然科学版), 1994, 28(4): 495-497 Ma Rongming, He Zhike, Luo Qingrao, et al. Chemiluminescence determination of free oxalic acid in diethyl oxalate[J]. Journal of Central China Normal University (Natural Science), 1994, 28(4): 495-497(in Chinese) |
| [10] | 林乐文, 郑嘉烈, 刘萍, 等. 气相色谱法测定蔬菜中草酸的含量[J]. 卫生研究, 1990, 19(2): 39-41 Lin Lewen, Zheng Jialie, Liu Ping, et al. Determination of oxaliate content in vegetables using gas chromatography[J]. Journal of Hygiene Research, 1990, 19(2): 39-41(in Chinese) |
| [11] | 刘景, 李崎, 顾国贤. 反相高效液相色谱法 (Rp-HPLC) 测定麦汁中的草酸[J]. 中国酿造, 2005, 151(10): 43-46 Liu Jing, Li Qi, Gu Guoxian. Determination of oxalic acid content in wort by reversed-phase HPLC (Rp-HPLC)[J]. China Brewing, 2005, 151(10): 43-46(in Chinese) |
| [12] | 郝蔚霞. 高效液相色谱法测定果蔬中的草酸含量[J]. 现代仪器, 2011, 17(4): 79-83 Hao Weixia. Determination of the content of oxalic acid in fruits and vegetables by HPLC[J]. Modern Instruments & Medical Treatment, 2011, 17(4): 79-83(in Chinese) |
| [13] | 谭新勇, 孙军勇, 谢广发, 等. 反相高效液相色谱法测定黄酒中的草酸[J]. 中国酿造, 2012, 31(11): 159-162 Tan Xinyong, Sun Junyong, Xie Guangfa, et al. Determination of oxalic acid in Chinese rice wine by reverse phase high performance liquid chromatography[J]. China Brewing, 2012, 31(11): 159-162(in Chinese) |
| [14] | 赵景婵, 郭治安, 常建华, 等. 有机酸类化合物的反相高效液相色谱法的分离条件研究[J]. 色谱, 2001, 19(3): 260-263 Zhao Jingchan, Guo Zhian, Chang Jianhua, et al. Study on reversed-phase high performance liquid chromatography separation condition and determination method of organic acids[J]. Chinese Journal of Chromatography, 2001, 19(3): 260-263(in Chinese) |
 2016, Vol. 33
2016, Vol. 33





