2. 天津大学化工学院 天津化学化工协同创新中心, 天津 300072
2. Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
随着社会发展和科技进步,人类对能源的需求逐年增多,现有的矿物能源已经愈发不能满足人类需求,可再生能源越来越受到人类的重视[1]。木质纤维素作为世界上最为丰富的生物质资源之一,具有来源广泛、可循环利用、价格低廉、环境友好等特点,因此,利用木质纤维素生产乙醇具有巨大的发展潜力[2]。木质纤维素乙醇的生产至少需要以下4个单元操作:预处理,酶解,发酵和分离单元[3]。在酶解和发酵的过程中,目前同步糖化发酵技术被广泛应用[4]。同步糖化发酵技术将酶解和发酵整合在同一个反应器中进行,可以降低成本,简化操作,而且通过发酵及时消耗葡萄糖,提高糖化的效率和乙醇的产率[5]。纤维素酶是一种多组分的复合酶,在现有的纤维素酶制剂中,β-葡萄糖苷酶活性相对较弱,导致同步糖化发酵过程中出现纤维二糖积累[6]。纤维二糖对纤维素酶具有明显的抑制作用,极大地抑制了酶解的速率[7]。因此,Galazka等[8]将纤维二糖转运蛋白CDT1和β-葡萄糖苷酶BGL导入酿酒酵母中,构建了一株可利用纤维二糖的酿酒酵母,可将纤维二糖转运到胞内后水解,能够有效地解除纤维二糖对酶解的抑制,提高乙醇的产率。同时,通过将纤维二糖转运蛋白、β-葡萄糖苷酶和木糖代谢路径引入酿酒酵母后,获得的重组菌株可用于解除葡萄糖对木糖的抑制效应,实现五六碳糖共利用[9]。因此,将纤维二糖利用菌株应用于木质纤维素乙醇的工业生产中,可以有效地降低乙醇生产成本,提高乙醇的生产效率。
但是由于木质纤维素原料预处理的过程中条件多采用高温高压,导致一系列对微生物细胞有毒性作用的副产物产生[10]。这些副产物主要是来源于纤维素、半纤维素和木质素的降解,对酵母的生长具有抑制作用,会降低酵母的乙醇产率和最终得率[11]。根据这些副产物的性质与来源,通常将这些抑制剂分为3大类,包括呋喃类、酚类和弱酸类物质[12]。在纤维素水解液中,这3大类抑制物大多都是同时存在,会对细胞产生明显的协同抑制作用[13]。本研究选取糠醛、苯酚和乙酸分别作为呋喃类、酚类和弱酸类抑制剂的代表进行研究。
目前酿酒酵母菌株在以葡萄糖为碳源条件下对抑制剂的耐受性研究较多,但是纤维二糖利用途径作为一个外源的代谢途径,在纤维二糖为碳源条件下酿酒酵母菌株对抑制剂的耐受性还鲜有研究。纤维二糖利用菌株能否在抑制剂存在的条件下正常利用纤维二糖,对其在纤维素乙醇工业生产中的应用非常重要。本研究选取本实验室现有的一株经过基因改造的、可以高效利用纤维二糖的工业背景菌株,在外加抑制剂的条件下分别以纤维二糖或葡萄糖作为碳源进行限氧发酵,研究了糠醛、苯酚、乙酸3种单一抑制剂以及复合抑制剂对纤维二糖发酵的影响,旨在为纤维二糖利用菌株在工业乙醇生产中的应用奠定基础,降低乙醇的生产成本,提高生产效率。
1 实验部分 1.1 菌种重组酿酒酵母菌株SyBE001603,由本实验室保藏。它以安琪酵母股份有限公司生产的安琪酵母(产品编号为80000012)为出发菌株,通过引入外源的纤维二糖转运蛋白CDT1基因和β-葡萄糖苷酶BGL基因,以获得快速纤维二糖利用能力。
1.2 培养基液体YPD培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L。
液体YPC培养基:酵母浸粉10 g/L,蛋白胨20 g/L,纤维二糖20 g/L。
固体YPD培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂粉20 g/L。
固体YPC培养基:酵母浸粉10 g/L,蛋白胨20 g/L,纤维二糖20 g/L,琼脂粉20 g/L。
培养基均采用121 ℃高温灭菌20 min。
1.3 乙醇发酵抑制剂的添加:在发酵接种前将糠醛、苯酚、乙酸分别按照实验设计的浓度加入发酵培养基中,对照组不添加抑制剂。加入乙酸后,为了保证不同乙酸浓度发酵液pH值的一致性,培养基初始pH值用无菌的10 mol/L NaOH调成pH值 5.5。
纤维二糖发酵:用接种环从平板上挑取酿酒酵母单菌落,接种到含3 mL YPC培养基的试管中,30 ℃,220 r/min培养24 h后,将一级种子以初始OD600=0.2转接到含有50 mL YPC培养基的250 mL摇瓶中,30 ℃,200 r/min培养12 h。按照初始OD600=1.0,取相应体积的二级种子培养液,4 000 r/min 离心5 min收集细胞,将细胞接种到装有50 mL YPC培养基的100 mL 细口三角瓶中,瓶口用插有针头的3号橡胶塞密封,34 ℃,150 r/min限氧培养。
葡萄糖发酵:发酵培养基采用液体YPD培养基,其余方法同纤维二糖发酵。
1.4 细胞密度与发酵产物测定菌株生长情况通过紫外可见分光光度计测定吸光值,吸收波长为600 nm。发酵产物经10 000 r/min离心5 min后取上清液,通过高效液相色谱测定纤维二糖、葡萄糖和乙醇的浓度。液相色谱条件为:Bio-Rad Aminex HPX-87H 色谱柱,Waters 1515高压泵,Waters 2414示差检测器,色谱柱柱温控制在65 ℃,检测器温度控制在50 ℃,流动相采用5 mmol/L的硫酸,流速控制在0.6 mL/min。
2 结果与讨论 2.1 菌株对糠醛的耐受性研究Palmqvist等[14]的研究表明,糠醛会降低细胞的生物量、比生长速率和乙醇的产率。预处理液中的糠醛含量根据纤维素原料的来源与预处理的方式的不同而变化,但大多在0.5~1.9 g/L的范围内[15]。本研究选取4个浓度梯度进行研究,分别为0.5、1.0、2.0 和3.0 g/L。
由图 1可以看出,当糠醛浓度为0.5 g/L时,糠醛对菌株的纤维二糖消耗和乙醇生产影响不显著。当糠醛浓度高于0.5 g/L时,随着糠醛浓度的提高,菌株SyBE001603的发酵时间延长,当浓度为3.0 g/L时,菌株生长24 h才进入稳定期,生长速率明显降低。随着糠醛浓度的提高,菌株的纤维二糖消耗速率与不含有抑制剂的对照组相比分别降低了24.9%、40.0%、51.4%(表 1),乙醇产率分别降低了26.1%、47.2%、65.7%,纤维二糖的利用和乙醇的生产得到明显的抑制,但菌株在3.0 g/L的糠醛存在的条件下依然可以生长发酵,具有一定的糠醛耐受能力。

|
| 图 1 不同糠醛浓度对菌体生长a),纤维二糖消耗b)和乙醇生产c)的影响 Fig.1 Influence of furfural concentration on cell growth a), cellobiose consumption b) and ethanol productivity c) |
| 抑制剂种类 | 浓度/(g·L -1) | 纤维二糖消耗速率/(g·L -1·h -1) | 乙醇产率/(g·L -1·h -1) | 乙醇得率 | 最大生物量/%(对照) |
| 对照 | 0 | 2.405±0.002 | 1.149±0.009 | 0.478±0.018 | 100.0 |
| 糠醛 | 0.5 | 2.284±0.039 | 1.054±0.087 | 0.472±0.011 | 95.5 |
| 1.0 | 1.806±0.001 * | 0.848±0.016 * | 0.470±0.009 | 94.2 | |
| 2.0 | 1.443±0.00 *** | 0.542±0.005 * | 0.452±0.008 | 92.3 | |
| 3.0 | 1.168±0.047 * | 0.394±0.021 * | 0.438±0.023 | 93.1 | |
| 苯酚 | 0.2 | 2.407±0.001 | 1.053±0.034 | 0.455±0.021 | 102.9 |
| 0.5 | 2.403±0.005 | 1.043±0.024 | 0.436±0.003 * | 104.0 | |
| 0.8 | 2.326±0.022 | 1.020±0.062 | 0.435±0.003 * | 96.2 | |
| 1.5 | 1.440±0.001 ** | 0.626±0.000 ** | 0.435±0.000 * | 75.9 | |
| 乙酸 | 0.5 | 2.162±0.015 * | 0.859±0.018 * | 0.479±0.011 | 87.8 |
| 1.0 | 1.795±0.003 *** | 0.826±0.012 * | 0.486±0.017 | 71.5 | |
| 1.5 | 1.436±0.004 *** | 0.577±0.011 * | 0.482±0.011 | 58.8 | |
| 2.5 | 1.131±0.017 * | 0.433±0.002 * | 0.479±0.001 | 46.8 | |
| 4.0 | 0.589±0.014 ** | 0.285±0.007 * | 0.484±0.024 | 42.3 | |
| 糠醛+苯酚+乙酸 | |||||
| M1 | 0.5+0.2+0.5 | 2.155±0.002 ** | 0.811±0.012 ** | 0.451±0.007 * | 89.0 |
| M2 | 1.0+0.5+1.0 | 1.719±0.036 * | 0.762±0.000 * | 0.434±0.000 * | 74.5 |
| M3 | 2.0+0.8+1.5 | 0.768±0.048 *** | 0.412±0.004 ** | 0.412±0.004 * | 62.9 |
| 注:纤维二糖消耗速率为菌株生长进入稳定期时的平均糖耗速率,乙醇产率为生长进入稳定期时的平均乙醇产率。乙醇得率 Y E/C=[EtOH] max/[Cellobiose] consumed,[EtOH] max为发酵过程中的最大乙醇浓度,[Cellobiose] consumed为对应时间所消耗的纤维二糖。最大生物量为乙醇浓度最大点所得的生物量。纤维二糖消耗速率、乙醇产率以及乙醇得率的数据都采用t-test进行显著性分析。显著性水平:* p<0.05, ** p<0.01, *** p<0.001。 | |||||
如图 2所示,以葡萄糖为碳源进行发酵时,糠醛对菌株的生长、糖耗和乙醇生产都有明显的抑制。随着糠醛浓度的升高,菌株的生长速率和最大生物量都有明显的降低。当糠醛浓度超过0.5 g/L时,发酵3 h后,葡萄糖的消耗量与不含糠醛的对照组相比分别降低了16.3%、36.9%和51.5%,菌株的耗糖能力受到糠醛的影响。糠醛对酵母细胞的中心碳代谢相关的酶有抑制作用,而且可以抑制蛋白质和RNA的合成,降解DNA[16]。而且糠醛会导致酵母细胞内的活性氧积累,对细胞的线粒体膜、液泡膜、核染色质和肌动蛋白细胞骨架等产生损伤[17]。因此在纤维二糖和葡萄糖分别作为单一碳源时,糠醛对菌株的生长、糖利用以及乙醇的生产均会产生抑制,抑制程度均随浓度的提高而增大。
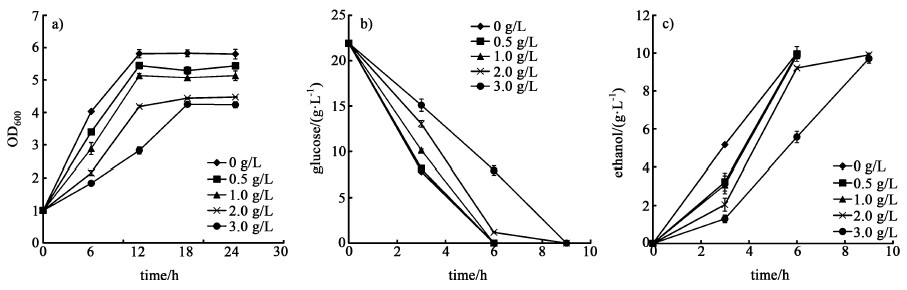
|
| 图 2 以葡萄糖作为碳源时,糠醛对菌株的生长a),糖耗b)和乙醇生产c)的影响 Fig.2 Effect of furfural on cell growth a), glucose consumption b) and ethanol productivity c) when using glucose as the sole carbon source |
酚类物质的毒性与相对分子质量和取代基位置有关,相对分子质量越小毒性越大[18]。本研究选择相对分子质量最小的苯酚作为酚类物质的代表,选取4个浓度梯度进行研究,分别为0.2、0.5、0.8和1.5 g/L。
由图 3可以看出,当苯酚浓度低于1.5 g/L时,苯酚对菌株的生长和纤维二糖消耗基本没有产生抑制,而且当苯酚浓度低于0.8 g/L时,细胞的生长和纤维二糖利用略快于对照组,细胞的生物量也有所增加。而当苯酚浓度为1.5 g/L时,菌株SyBE001603的生长受到明显抑制,与不含苯酚的对照组相比,纤维二糖消耗速率降低40.1%,乙醇产率降低45.5%(表 1)。苯酚的加入对乙醇的得率有一定的影响,当苯酚的浓度高于0.5 g/L时,乙醇的得率均降至对照的91%左右。
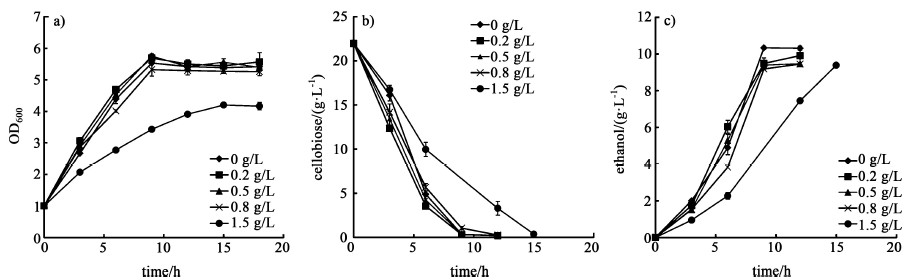
|
| 图 3 苯酚浓度梯度对菌体生长a),纤维二糖消耗b)和乙醇生产c)的影响 Fig.3 Effect of phenol concentration on cell growth a), cellobiose utilization b) and ethanol productivity c) |
当以葡萄糖作为碳源进行发酵时,苯酚浓度的提高对菌株产生了明显的抑制。0.2 g/L的苯酚对菌株的生长和生产没有产生显著影响,当苯酚浓度超过0.2 g/L时,随着浓度的提升,菌株的糖耗速率、乙醇产率和生物量均有明显的下降,见图 4。
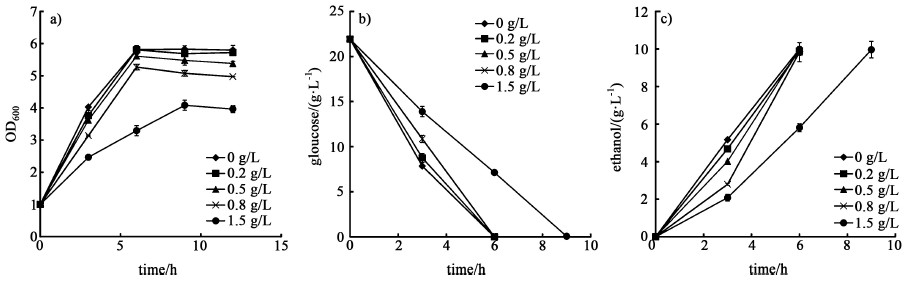
|
| 图 4 以葡萄糖为碳源时,不同苯酚浓度对菌体生长a),葡萄糖利用b)和乙醇生产c)的影响 Fig.4 Influence of different phenol concentration on cell growth a), glucose consumption b) and ethanol productivity c) when using glucose as the sole carbon source |
菌株的最大生物量分别降低了3.5%、9.3%、29.7%。发酵3 h葡萄糖的消耗量分别降低了6.4%、21.4%、43.0%,乙醇的产量分别降低了22.3%、46.0%、59.8%。由此可见,相比于以葡萄糖作为碳源,以纤维二糖作为碳源时菌株对苯酚的耐受能力有所增强,而且在发酵过程中低浓度苯酚的存在反而促进了细胞的生长和纤维二糖利用。苯酚主要作用于细胞膜,通过破坏细胞膜的完整性,从而影响细胞膜的选择性透过能力和胞内的酶反应环境[15]。苯酚的存在会降低细胞膜上脂质和蛋白质含量的比例,改变细胞膜的功能[19]。纤维二糖的转运主要通过细胞膜上的纤维二糖转运蛋白CDT1实现,由此可推测低浓度苯酚存在时,苯酚通过作用于细胞膜,可能会对细胞膜上的纤维二糖转运蛋白产生影响,对纤维二糖由胞外向胞内的转运产生一定的促进作用,有利于纤维二糖的利用。
2.3 菌株对乙酸的耐受性研究乙酸的存在会导致细胞生物量的降低,影响菌株的生长和发酵性能[20]。未解离的乙酸分子是脂溶性的,可以透过细胞膜进入细胞,进入细胞后乙酸分子在胞内解离,降低胞内的pH值。为了保持胞内的pH值平衡,ATPase水解ATP产生能量,将质子泵出细胞以维持细胞内pH值为中性[21]。同时胞内的乙酸根离子不能被泵出胞外,在胞内逐渐累积,对细胞的生长产生抑制。乙酸在木质纤维素水解液中广泛存在,浓度多在1.6~4.4 g/L 的范围内[15],因此本研究选用0.5、1.0、1.5、2.5 和4.0 g/L共5个浓度梯度进行研究。
由图 5可知,以纤维二糖作为碳源时,随着乙酸浓度的提高,菌株的生长速率明显降低,当乙酸浓度为4 g/L时,需要36 h才能将纤维二糖消耗完,菌株进入稳定期生长,发酵时间延长了3倍。菌株的最大生物量分别降低了12.1%、28.5%、41.2%、53.2%、57.7%,纤维二糖利用速率分别降低了10.1%、25.4%、40.3%、53.0%、75.5%(表 1)。由此可知,在纤维二糖作为碳源的条件下菌株对乙酸非常敏感,乙酸对菌株的纤维二糖利用能力有显著的影响,乙酸浓度越高对菌株的抑制作用越强。
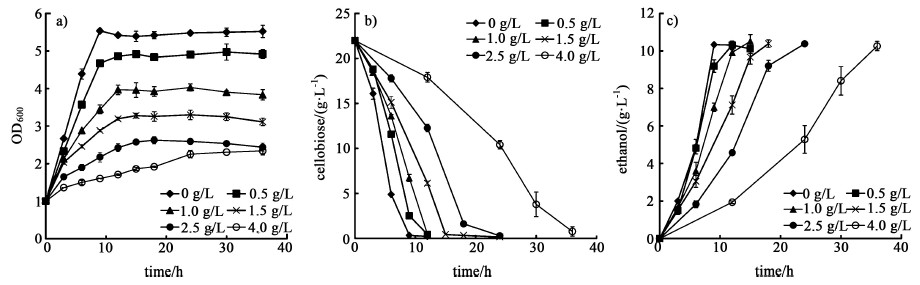
|
| 图 5 乙酸对菌体生长a),纤维二糖利用b)和乙醇生产c)的影响 Fig.5 Effect of acetic acid on cell growth a), cellobiose utilization b) and ethanol productivity c) |
当把发酵碳源选为葡萄糖时,乙酸浓度对生物量有明显影响,见图 6。

|
| 图 6 乙酸对菌体生长a),葡萄糖利用b)和乙醇生产c)的影响 Fig.6 Influence of acetic acid on cell growth a), glucose utilization b) and ethanol productivity c) |
随着乙酸浓度的提高,菌株的最大生物量分别降低了9.3%、11.5%、19.4%、25.7%、37.0%。但是在发酵过程中菌株的葡萄糖消耗速率却有一定提高,加入乙酸后乙醇的最终浓度也都有1%~2%的提高。Palmqvist等[10]的研究证明,当细胞外乙酸浓度较低时,乙酸可以刺激细胞产生ATP,促进乙醇的产生。当细胞外乙酸浓度较高的时候,细胞必须产生足量的ATP来维持胞内的pH值,从而抑制细胞的生长,导致生物量的降低。由此可知,在以葡萄糖作为碳源的时候,菌株对乙酸有较强的耐受能力,尽管菌株的生物量得到了抑制,但是一定浓度乙酸(0.5~4.0 g/L)的存在促进了葡萄糖的消耗和乙醇的产生。而在以纤维二糖作为碳源的时候,乙酸对菌株产生较强的抑制作用。
因此对乙酸的耐受能力成为菌株利用纤维二糖生产乙醇的一个限制因素。菌株的外源纤维二糖水解路径主要包括纤维二糖转运蛋白和β-葡萄糖苷酶,本研究所选用的纤维二糖转运蛋白CDT1和β-葡萄糖苷酶GH1-1均来自粗糙脉孢菌[8]。纤维二糖转运蛋白CDT1是一种依赖于质子梯度的同向转运蛋白,在纤维二糖发酵过程中需要消耗较多的能量[22]。在细胞外乙酸存在的条件下,细胞需要消耗ATP将质子泵出。同时在限氧条件下TCA循环没有被激活,ATP的产生受限[23]。因此在限氧条件下乙酸对纤维二糖的代谢产生抑制,降低了菌株的纤维二糖代谢速率。提高纤维二糖利用菌株对乙酸的耐受能力,是纤维二糖利用菌株应用于工业生产的一个关键问题。在接下来的研究中,可以考虑通过选用依靠协同扩散转运纤维二糖的转运蛋白CDT2[22, 24],减少转运过程中的ATP消耗,或者选用纤维二糖磷酸化酶代替β-葡萄糖苷酶,减少纤维二糖代谢过程中的ATP消耗[25],来提高菌株对乙酸的耐受能力。
2.4 菌株对复合抑制剂的耐受性研究在纤维素水解液中,呋喃类、酚类和弱酸类物质大多是共同存在的,共同发挥抑制作用[10]。根据水解液中各类抑制剂的浓度[26]以及菌株对单一抑制剂的耐受能力,本研究选取3个浓度梯度:M1,糠醛0.5 g/L,苯酚0.2 g/L,乙酸0.5 g/L;M2,糠醛1.0 g/L,苯酚0.5 g/L,乙酸1.0 g/L;M3,糠醛2.0 g/L,苯酚0.8 g/L,乙酸1.5 g/L。在复合抑制剂存在的条件下,随着抑制剂浓度的增加,菌株的各项生长和生产指标均有所下降,见图 7。

|
| 图 7 复合抑制剂对菌体生长a),纤维二糖利用b)和乙醇生产c)的影响 Fig.7 Influence of multiple inhibitors on cell growth a), cellobiose utilization b) and ethanol productivity c) |
最大生物量分别降低了11.0%、25.5%、37.1%,纤维二糖消耗速率分别降低了10.4%、28.5%、58.9%,乙醇产率分别降低了29.4%、33.7%、64.1%,乙醇得率分别降低了5.5%、9.2%、11.9%(表 1)。在复合抑制剂条件下,菌株的纤维二糖消耗速率、乙醇产率、乙醇得率均低于相同浓度的单一抑制剂条件。由此可见,当糠醛、苯酚和乙酸共同存在的时候,复合抑制剂表现出的是对菌株纤维二糖利用的协同抑制作用,协同抑制作用均强于单一抑制作用。在2.0 g/L糠醛、0.8 g/L苯酚、1.5 g/L乙酸3种复合抑制剂存在的条件下,菌株SyBE001603仍然可以将培养基中的纤维二糖消耗完全,展示了对复合抑制剂的耐受能力,可以作为底盘菌株进一步改造,提高对抑制剂的耐受能力,有望应用于工业生产中以提高纤维素乙醇的产率。
3 结论综上所述,本实验室保藏的基因工程重组酵母菌株SyBE001603,在纤维二糖作为单一碳源的条件下,可以分别耐受3.0 g/L糠醛、1.5 g/L苯酚、4.0 g/L乙酸以及含有2.0 g/L糠醛、0.8 g/L苯酚、1.5 g/L乙酸的复合抑制剂。糠醛对菌株纤维二糖利用能力和葡萄糖利用能力均会产生抑制,抑制程度均随浓度的提高而增大。苯酚对菌株的葡萄糖利用能力有明显的抑制作用,但是低浓度的苯酚对菌株的纤维二糖利用有一定的促进作用,高浓度的苯酚对菌株有毒害作用,抑制细胞的生长和发酵。乙酸对菌株纤维二糖利用的抑制作用最为明显,对乙酸的耐受能力是菌株能否应用于工业生产的关键问题之一。
| [1] | Zhong C, Cao Y, Li B, et al. Biofuels in China: Past, present and future[J]. Biofuels, Bioproducts and Biorefining, 2010, 4(3): 326-342 |
| [2] | Brethauer S, Wyman C E. Review: Continuous hydrolysis and fermentation for cellulosic ethanol production[J]. Bioresource Technology, 2010, 101(13): 4 862-4 874 |
| [3] | Talebnia F, Karakashev D, Angelidaki I. Production of bioethanol from wheat straw: An overview on pretreatment, hydrolysis and fermentation[J]. Bioresource Technology, 2010, 101(13): 4 744-4 753 |
| [4] | Hahn-Hägerdal B, Galbe M, Gorwa-Grauslund M F, et al. Bio-Ethanol:The fuel of tomorrow from the residues of today[J]. Trends in Biotechnology, 2006, 24(12): 549-556 |
| [5] | Hasunuma T, Kondo A. Consolidated bioprocessing and simultaneous saccharification and fermentation of lignocellulose to ethanol with thermotolerant yeast strains[J]. Process Biochemistry, 2012, 47(9): 1 287-1 294 |
| [6] | Chauve M, Mathis H, Huc D, et al. Comparative kinetic analysis of two fungal β-glucosidases[J]. Biotechnology for Biofuels, 2010, 3(6):1-8 |
| [7] | Voutilainen S P, Puranen T, Siikaaho M, et al. Cloning, expression, and characterization of novel thermostable family 7 cellobiohydrolases[J]. Biotechnology and Bioengineering, 2008, 101(3): 515-528 |
| [8] | Galazka J M, Tian C, Beeson W T, et al. Cellodextrin transport in yeast for improved biofuel production[J]. Science, 2010, 330(6 000): 84-86 |
| [9] | Ha S J, Galazka J M, Kim S R, et al. Engineered Saccharomyces cerevisiae capable of simultaneous cellobiose and xylose fermentation[J]. Proceedings of the National Academy of Sciences, 2011, 108(2): 504-509 |
| [10] | Palmqvist E, Hahn-Hägerdal B. Fermentation of lignocellulosic hydrolysates. II: Inhibitors and mechanisms of inhibition[J]. Bioresource Technology, 2000,74(1): 25-33 |
| [11] | Ding M, Wang X, Yang Y, et al. Comparative metabolic profiling of parental and inhibitors-tolerant yeasts during lignocellulosic ethanol fermentation[J]. Metabolomics, 2012, 8(2): 232-243 |
| [12] | Parawira W, Tekere M. Biotechnological strategies to overcome inhibitors in lignocellulose hydrolysates for ethanol production: Review[J]. Critical reviews in Biotechnology, 2011, 31(1): 20-31 |
| [13] | Palmqvist E, Grage H, Meinander N Q, et al. Main and interaction effects of acetic acid, furfural, and p-hydroxybenzoic acid on growth and ethanol productivity of yeasts[J]. Biotechnology and Bioengineering, 1999, 63(1): 46-55 |
| [14] | Palmqvist E, Almeida J S, Hahn-Hägerdal B. Influence of furfural on anaerobic glycolytic kinetics of Saccharomyces cerevisiae in batch culture[J]. Biotechnology and Bioengineering, 1999, 62(4): 447-454 |
| [15] | Almeida J R, Modig T, Petersson A, et al. Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae[J]. Journal of Chemical Technology and Biotechnology, 2007, 82(4): 340-349 |
| [16] | Liu Z. Genomic adaptation of ethanologenic yeast to biomass conversion inhibitors[J]. Applied Microbiology and Biotechnology, 2006, 73(1): 27-36 |
| [17] | Allen S A, Clark W, McCaffery J M, et al. Furfural induces reactive oxygen species accumulation and cellular damage in Saccharomyces cerevisiae[J]. Biotechnology for Biofuels, 2010, 3(2): 1-10 |
| [18] | Klinke H B, Thomsen A, Ahring B K. Inhibition of ethanol-producing yeast and bacteria by degradation products produced during pre-treatment of biomass[J]. Applied Microbiology and Biotechnology, 2004, 66(1): 10-26 |
| [19] | Keweloh H, Weyrauch G, Rehm H J. Phenol-Induced membrane changes in free and immobilized Escherichia coli[J]. Applied Microbiology and Biotechnology, 1990, 33(1): 66-71 |
| [20] | Larsson S, Palmqvist E, Hahn-Hägerdal B, et al. The generation of fermentation inhibitors during dilute acid hydrolysis of softwood[J]. Enzyme and Microbial Technology, 1999, 24(3): 151-159 |
| [21] | Russell J B, Diez-Gonzalez F. The effects of fermentation acids on bacterial growth[J]. Advances in Microbial Physiology, 1997, 39: 205-234 |
| [22] | Kim H, Lee W H, Galazka J M, et al. Analysis of cellodextrin transporters from Neurospora crassa in Saccharomyces cerevisiae for cellobiose fermentation[J]. Applied Microbiology and Biotechnology, 2014, 98(3): 1 087-1 094 |
| [23] | Spiro S, Guest J R. Adaptive responses to oxygen limitation in Escherichia coli[J]. Trends in Biochemical Sciences, 1991, 16(8): 310-314 |
| [24] | Lian J, Li Y, Hamedirad M, et al. Directed evolution of a cellodextrin transporter for improved biofuel production under anaerobic conditions in Saccharomyces cerevisiae[J]. Biotechnology & Bioengineering, 2014, 111(8):1 521-1 531 |
| [25] | Ha S J, Galazka J M, Joong O E, et al. Energetic benefits and rapid cellobiose fermentation by Saccharomyces cerevisiae expressing cellobiose phosphorylase and mutant cellodextrin transporters[J]. Metabolic Engineering, 2013, 15:134-143 |
| [26] | Martinez A, Rodriguez M E, Wells M L, et al. Detoxification of dilute acid hydrolysates of lignocellulose with lime[J]. Biotechnology Progress, 2001, 17(2): 287-293 |
 2016, Vol. 33
2016, Vol. 33





