质子交换膜燃料电池(PEMFCs)以其能效高、操作温度低(80~100 ℃)、环境友好等优点,在固定和移动燃料电池系统应用方面,受到了广泛的关注[1, 2]。质子交换膜燃料电池使用的燃料为富氢气体,主要由各种烃类燃料通过水蒸气重整和高温水煤气变换所得[3]。然而,由于水煤气变换的热力学限制,生成的富氢气体中仍旧含有0.5%~1.0%(体积分数)的CO,这些CO很容易使质子交换膜燃料电池的Pt电极中毒[4]。因此,CO的浓度应该净化到10×10-6以下[5, 6, 7]。目前,富氢气体中脱除CO的常见方法有膜分离法、变压吸附法、CO优先氧化(CO-PROX)和CO甲烷化。在这些方法中,CO-PROX被认为是最有效的方法[3, 8, 9]。
到目前为止,用于CO-PROX反应所报道的催化剂可以分为非贵金属氧化物催化剂,如CuO/CeO2[10, 11, 12]和Co3O4[13, 14],贵金属催化剂,如Pt、Ru、Rh[3]以及纳米金催化剂[15, 16, 17]。其中碱金属氧化物催化剂在含CO2和H2O条件下容易失活致使催化性能降低[18]。纳米金催化剂由于纳米金颗粒容易烧结,导致其在反应过程中很容易失活[19]。对于贵金属催化剂,尽管Pt基催化剂应用于CO-PROX反应表现出高的活性、选择性和稳定性,但低温催化性能仍需进一步的提高。不同的助剂,如Ni[20, 21]、Co[22, 23, 24]、 Fe[25, 26, 27]、 Cu[28]、Au[1]、碱金属[29]以及稀土氧化物已被用于提高Pt基催化剂的低温催化性能[30, 31]。Ko等[21]报道γ-Al2O3负载的Pt-Ni双金属表现出高的催化活性。Mu等[20]报道炭黑负载的Pt-Ni双金属催化剂可以在47 ℃下实现CO的100%转化。
对于Pt基催化剂,常用的载体有氧化铝[7, 21, 26, 27, 28, 31, 32]、二氧化硅[28, 30, 31, 33, 34]、丝光沸石[35]、CeO2[36, 37, 38]、TiO2[31]、分子筛[39]和炭黑[20, 22, 25]。尽管这些载体负载的Pt基催化剂用于富氢气体中CO的脱除表现出很好的催化性能,然而将CO的含量降低到10×10-6以下仍是一个难题。原因是CO氧化是一个放热反应,它容易导致催化剂表面产生热点,并且逆水煤气变换(RWGS)是吸热反应同时生成CO,催化剂表面热点的产生诱导了逆水煤气变换发生,影响CO总的脱除量[40]。
碳纳米管(CNTs)具有高机械强度,显著的热导、电导性能以及高的比表面积,因此被广泛的用作催化剂载体。如,Lu等[40]发现CNTs负载的Pt-Ni催化剂在95~120 ℃范围内展现出高的催化性能。Wang等[23]以CNTs为载体,Pt-Co为活性组分制备的催化剂在低温CO氧化反应中表现出高的催化活性和稳定性。然而CNTs在应用过程中面临成型的问题,在固定床反应器中团聚的CNTs将产生很大的压降。为了解决这个问题,Zhang等[41]在树脂球上原位生长CNTs,制备了毫米级球型CNTs整体式,且以该整体式CNTs球为载体的催化剂在乙苯脱氢氧化反应中,较CNTs粉末表现出更好的催化性能。
本研究将CNTs掺杂到氧化铝中制备CNTs-γ-Al2O3复合材料,利用CNTs显著的导热性能抑制或减缓热点的形成。采用等体积共浸渍法制备Pt-Ni/CNTs-γ-Al2O3催化剂,在低的反应温度下,Pt-Ni/CNTs-γ-Al2O3催化剂表现出高活性、选择性以及显著的抗H2O和CO2性能。
1 实验部分 1.1 CNTs-γ-Al2O3复合材料的制备羧基功能化碳纳米管(COOH-CNTs)的质量分数高于97%,其直径和长度分别为20~40 nm和1~5 μm,CNTs表面总的羧基官能团含量为2.31%(质量分数,下同)。
首先,将拟薄水铝石在室温搅拌条件下分批加入到一定量的去离子水中,剧烈搅拌1.5 h后,滴加一定量的2 mol·L-1 HNO3溶液,得到半透明的氧化铝水溶胶,继续搅拌10 min后,得到溶胶I,待用;称取一定量的羧基化CNTs,加入到去离子水中,超声分散2 h,得到溶胶II;将溶胶II逐滴加入到溶胶I中,继续搅拌6 h,得到CNTs-Al2O3水溶胶。随后将CNTs-Al2O3水溶胶冷冻干燥48 h,最后在N2气氛下600 ℃焙烧4 h获得CNTs-γ-Al2O3复合材料,其中CNTs相对于γ-Al2O3的含量为5%。用同样的方法制备了γ-Al2O3。
1.2 Pt-Ni/CNTs-γ-Al2O3催化剂的制备以H2PtCl6·6H2O和Ni(NO3)2·6H2O水溶液为前驱体,采用等体积共浸渍法浸渍CNTs-γ-Al2O3载体。浸渍完后,继续在真空条件下冷冻干燥12 h,得到Pt-Ni/CNTs-γ-Al2O3催化剂。用同样的方法制备了Pt-Ni/γ-Al2O3、Pt-Ni/CNTs、Pt/CNTs-γ-Al2O3和Ni/CNTs-γ-Al2O3催化剂,其中Pt和Ni的量分别控制在1.0%和1.5% [n(Pt):n(Ni)为1:5]。
1.3 催化剂的表征样品的N2物理吸附-脱附等温线测定采用美国Quantachrome公司的Quadrasorb SI型自动物理吸附仪,在-196 ℃下测定N2吸附和脱附等温线,测试之前先在200 ℃下真空脱气4 h。在相对压力为0.05~0.30范围内由BET方程计算比表面积,样品的孔容和孔径由脱附支的数据得到。
样品的X射线衍射测试在Bruker D8 Focus X射线衍射仪上进行。样品研磨到200目左右,平铺入样品池测试。采用Cu靶,Kα射线(λ=0.1541 nm),管电压40 kV,管电流40 mA,扫描步长5(°)·min-1,扫描范围为10°~90°。进行测试前,催化剂样品在15% H2/N2混合气中300 ℃下还原2 h,经研磨至200目左右。
样品的程序升温还原测试采用天津先权公司制造的全自动多用吸附仪。样品上下装填石英棉,样品量为50 mg,置于石英反应管中。以50 mL·min-1的速度通入5% H2-Ar混合气还原处理,以10 ℃·min-1的升温速率进行程序升温还原。进行分析前,催化剂样品在350 ℃空气气氛下焙烧2 h。
场发射透射电子显微镜(TEM)和扫描透射电子显微镜(STEM)采用TechnaiG2F20测试。样品在15% H2/N2混合气中300 ℃下还原2 h,随后经研磨和超声分散后置于铜网之上风干后,在200 kV电压下观测。
样品的微观形貌采用扫描电子显微镜(SEM)Hitachi S4800进行测试,样品用导电胶固定在基底上,表面喷金后在电压15 kV下观察样品的表面形貌。
1.4 催化剂富氢气体中CO-PROX的催化性能测试催化剂的性能测试在微型固定床反应器(内径8 mm,长450 mm,中部有石英砂)中进行。准确称取100 mg催化剂装填至反应器中,反应前用15% H2/N2混合气在300 ℃下预还原2 h。原料气组成为1.0% CO、1.0% O2、0~12.5% CO2、0~15.0% H2O、50% H2、48% N2作为平衡气,气体总流速为40 mL·min-1,对应的空速为24 000 mL·g-1·h-1。在管式电炉内壁装有K型热电偶,通过PID温度控制器控制电炉温度。每20 ℃作为1个检测点,每个温度检测点稳定30 min。采用SP-3420型气相色谱在线分析原料气和尾气的气体组成,尾气在测试前经硅胶和烧碱石棉分别除去水和CO2,采用5A分子筛色谱柱,氢气为载气,载气流速为30 mL·min-1,采用热导池(TCD)检测O2、N2和CO;甲烷转化炉用来放大CO的信号,氢焰(FID)检测,用来分析放大的CO的信号和CH4,对CO的检测精度可达到110×10-6。
采用CO转化率、CO选择性以及CH4产率指标对催化剂进行活性评价,其计算公式为:
CO转化率(%)
| $ {X_{CO}} = \frac{{{{[CO]}_{in}} - {{[CO]}_{out}}}}{{{{[CO]}_{in}}}} \times 100\% $ | (1) |
CO的选择性(%)
| $ {S_{{O_2}}} = \frac{{{{[CO]}_{in}} - {{[CO]}_{out}} - {{[C{H_4}]}_{out}}}}{{2 \times {{[{O_2}]}_{in}} - {{[{O_2}]}_{out}}}} \times 100\% $ | (2) |
CH4收率(%)
| $ {Y_{C{H_4}}} = \frac{{{{[C{H_4}]}_{out}}}}{{{{[CO]}_{in}}}} \times 100\% $ | (3) |
图 1是CNTs-γ-Al2O3、γ-Al2O3和CNTs的N2物理吸附-脱附等温线和孔径分布曲线图,相应的吸附数据在表 1中列出。

|
| 图 1 样品的a) N2物理吸附-脱附等温线和b) 孔径分布曲线 Fig.1 a) N2 adsorption-desorption isotherms and b) BJH pore diameter distribution curves |
| 样品 | SBET/(m2·g-1) | 孔径/nm | 孔容/(cm3·g-1) |
| CNTs | 108.3 | 14.5 | 0.40 |
| γ-Al 2O3 | 226.5 | 4.1 | 0.25 |
| CNTs-γ-Al 2O3 | 246.2 | 3.9 | 0.24 |
根据IUPAC规定,图 1a)中的等温线均归属于IV型吸附曲线,表明样品中均存在介孔[42]。CNTs呈现出H1型滞后环,CNTs-γ-Al2O3和γ-Al2O3均呈现出H2型滞后环,可以看出这些介孔主要是由于Al2O3堆积而成。
从图 1b)孔径分布图中可以看出CNTs在2.5 nm到90 nm范围内出现了2个峰,其中4 nm左右的介孔归属于CNTs的内孔,后面较宽较大的峰归属于团簇的CNTs间的缝隙产生的[43]。由于CNTs的平均孔径大,所以尽管其比表面积较小,但是它的孔容较大。
γ-Al2O3在4.1 nm左右出现相对较宽的孔径分布,添加CNTs后,孔径略微减小,约3.9 nm,其分布明显变窄,主要是由于CNTs的存在抑制Al2O3颗粒长大[44]。在15 nm左右几乎没有孔径分布,表面CNTs没有团聚,即CNTs单独的均匀分散并嵌入到Al2O3基质中。添加CNTs后,γ-Al2O3的比表面积由226.5 m2·g-1提高到247.0 m2·g-1,其比表面积变化不大,可能是由于大部分的CNTs被γ-Al2O3包裹起来,这与孔径分布以及下面的TEM表征相一致。
2.2 XRD表征图 2是CNTs-γ-Al2O3、Ni/CNTs-γ-Al2O3、Pt/CNTs-γ-Al2O3、Pt-Ni/CNTs-γ-Al2O3、Pt-Ni/γ-Al2O3和Pt-Ni/CNTs的XRD图。

|
| 图 2 不同催化剂以及载体CNTs-γ-Al2O3的XRD图 Fig.2 XRD patterns |
Pt-Ni/CNTs催化剂在26.0°出现了明显的CNTs (002)晶面特征衍射峰[45];从内插图中可以看到,在39.8°和46.4°分别出现了Pt的(111)和(200)晶面特征衍射峰,其特征衍射峰相对于纯Pt向高角度偏移;对于Ni,在39.8°和42.9°分别出现了Ni(002)和(011)晶面特征衍射峰,其特征衍射峰相对于纯Ni向低角度偏移。表明Pt-Ni双金属合金的生成[22, 45]。
从图 2中可以发现CNTs-γ-Al2O3、Ni/CNTs-γ-Al2O3、Pt/CNTs-γ-Al2O3、Pt-Ni/CNTs-γ-Al2O3、Pt-Ni/γ-Al2O3和Pt-Ni/CNTs的XRD曲线变化不大,衍射峰主要归属于γ-Al2O3和CNTs (002)晶面的特征衍射峰。没有出现Pt或Ni明显的特征衍射峰,这是由于Pt或Ni在载体上高度分散,这与随后的TEM和STEM结果相一致。
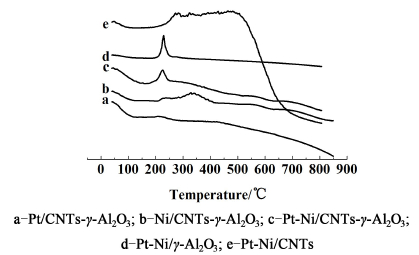
2.3 H2-TPR表征图 3为不同催化剂的H2-TPR图。
|
| 图 3 催化剂的H2-TPR图 Fig.3 H2-TPR profiles |
Pt/CNTs-γ-Al2O3 (图 3a)在214 ℃左右出现了很弱的还原峰归属于PtO2的还原;对于Ni/CNTs-γ-Al2O3(图 3b),在213~410 ℃范围内的还原峰,应归属于氧化镍物种的还原,620~800 ℃范围内的还原峰,归属于与载体作用力较强的镍物种的还原峰;对于Pt-Ni/CNTs-γ-Al2O3[3c)],在226 ℃左右的还原峰面积明显大于Pt/CNTs-γ-Al2O3(图 3a)的。
比较Ni/CNTs-γ-Al2O3 (b)和Pt-Ni/CNTs-γ-Al2O3 (c)的TPR的曲线,Pt-Ni/CNTs-γ-Al2O3(图 3c)上的金属氧化物还原温度明显变低,可能是由于Pt和Ni物种相互作用的结果。Lu等[40]报道在较低温度下还原出来的金属Pt通过氢溢流可以促进周围氧化镍的还原,因此氧化镍物种的还原峰向较低温度移动。相似的TPR结果也在Pt-Ni/γ-Al2O3催化剂上出现,镍物种的低温还原导致了Pt-Ni合金的生成[21]。Pt-Ni双金属合金的形成,Pt-Ni/CNTs-γ-Al2O3 (图 3c)催化剂的还原峰温度降低。
比较Pt-Ni/CNTs-γ-Al2O3 (图 3c)和Pt-Ni/γ-Al2O3(图 3d)的TPR的曲线,发现形成Pt-Ni合金的还原曲线几乎相似,表明Pt-Ni双金属颗粒负载在γ-Al2O3表面。另外Pt-Ni/CNTs-γ-Al2O3(图 3c)的TPR曲线与Pt-Ni/CNTs(图 3e)的明显不同,这也表明Pt-Ni双金属可以没有负载在CNTs的表面。
随着温度的升高,Pt-Ni/CNTs(图 3e)的TPR曲线急剧下降,表明有H2的生成,这一现象归因于CNTs上的CHx物种的分解[40]。对于CNTs掺杂的催化剂,TPR曲线没有出现明显的下降,这是由于CNTs被γ-Al2O3包裹,进而阻止CHx的分解,所以没有H2生成。Pt-Ni/CNTs-γ-Al2O3(图 3c)和Pt-Ni/γ-Al2O3(图 3d)的还原峰几乎完全相同,这一现象表明CNTs被γ-Al2O3包裹,CNTs的添加没有影响γ-Al2O3特有的性质。这与先前的孔径分布和随后的SEM表征结果相一致。
2.4 TEM、STEM和SEM表征图 4为Pt-Ni/CNTs-γ-Al2O3的TEM [a),b),e)]和STEM[c),d)]及其所对应的粒径尺寸分布图[4a’),c’)],TEM图 [a),b)]中的黑点和STEM[c),d)]中的白点表示Pt-Ni颗粒,从中可以看出金属颗粒高度均匀分散在CNTs-γ-Al2O3载体上。由图 4a’)的尺寸分布得出,其平均粒径大小为3.80±1.01 nm。由图 4c’)的尺寸分布得出,其平均粒径大小为4.04±0.74 nm。故活性组分的粒径大小主要集中在3.80~4.04 nm范围内。图 4e’)是Pt-Ni/CNTs-γ-Al2O3的线扫图,从图 4中可以看出Pt和Ni的检测信号强度曲线变化趋势大致相似,表明可能有Pt-Ni合金的生成。另外,图 4e)中活性组分的代表晶格条纹为0.198 nm,它介于金属Pt (0.1962 nm)和金属Ni (0.2033 nm)之间,这一现象也推断出可能有Pt-Ni合金的生成。

|
| 图 4 催化剂Pt-Ni/CNTs-γ-Al2O3的TEM图、STEM图、粒径分布图和线扫图以及CNTs-γ-Al2O3的SEM图 Fig.4 TEM [a), b), e)] images, STEM [c), d)] images, particle size distributions [a’), c’)] and line scanning image e’) (Pt, the red line; Ni, the black line) of Pt-Ni/CNTs-γ-Al2O3 and SEM image of CNTs-γ-Al2O3 f). Arrows in images indicate carbon nanotubes. Scale bars: 50 nm for [a), c), e’)], 20 nm for [b), d)], 2 nm for e) and 500 nm for f) |
从图 4f)中可以看出大部分的CNTs(箭头所指的位置)被γ-Al2O3包裹。这与TPR、N2的吸附-脱附结果以及TEM表征相一致。
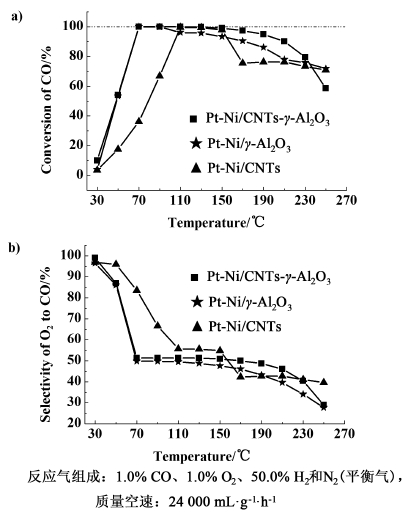
2.5 催化性能 2.5.1 载体对Pt-Ni催化剂性能的影响图 5是催化剂Pt-Ni/CNTs-γ-Al2O3,Pt-Ni/γ-Al2O3和Pt-Ni/CNTs的CO优先氧化活性评价。对于Pt-Ni/γ-Al2O3,在70~90 ℃范围内可以实现CO完全转化,当反应温度达到110 ℃时,CO转化率开始随着温度的升高而降低。由于反应温度过高,氧气将与氢气反应,降低了反应的选择性,导致CO氧化的转化率下降。对于Pt-Ni/CNTs,在整个反应温度区间也没有实现CO的完全转化,CO的最大转化率仅能达到99.5%,这与文献报道的类似[40]。对于Pt-Ni/CNTs-γ-Al2O3,在70~110 ℃可以将CO完全转化。反应温度升高到130 ℃时,CO的转化率略微减少,CO的出口浓度可净化到10×10-6。反应温度升高到150 ℃时,CO转化率有所降低,但是仍可以将CO的出口浓度净化到90×10-6。在70~150 ℃范围内,CO对O2的选择性维持在51.3%左右。
|
| 图 5 不同载体的Pt-Ni催化剂催化性能 a) CO的转化率和 b) O2对CO选择性曲线 Fig.5 Variation of the CO conversion a) and the selectivity of O2 to CO oxidation b) with the reaction temperature for CO-PROX |
Pt-Ni/CNTs-γ-Al2O3用于CO-PROX相对于Pt-Ni/CNTs具有更高的催化活性。Lu等[40]制备的1%Pt-Ni/CNTs-OX、2%Pt-Ni/CNTs-OX以及4%Pt-Ni/CNTs-OX催化剂,分别在125、95~120和75 ℃可以将CO完全转化。Wang等[23]制备的4.0%Pt-0.7%Co/CNTs在120 ℃将CO完全转化。总而言之,对于Pt-Ni/CNTs-γ-Al2O3催化剂,Pt-Ni活性组分颗粒主要是负载在Al2O3上,也就是说Al2O3是一种很好的Pt-Ni双金属用于CO-PROX的催化剂载体。
对比Pt-Ni/γ-Al2O3和Pt-Ni/CNTs-γ-Al2O3,可以发现低温下两者催化性能相似,然而当反应温度高于90 ℃,Pt-Ni/CNTs-γ-Al2O3表现较好的催化性能。对于Pt-Ni/CNTs-γ-Al2O3,CO完全转化的温度窗口变宽,CO对O2的选择性提高。这可能是由于CNTs的添加避免或减缓了热点的形成,从而避免或减缓了逆水煤气变换反应,进而提高了CO净化效果。
热点对通过CO-PROX技术净化CO的危害主要有以下两点:1) H2氧化的活化能比CO氧化所需的高,故反应温度升高导致更多的O2同H2反应,从而降低了CO氧化的选择性;从另一个方面看,升高反应温度,吸附在活性位上的CO脱附,进而促进了H2在活性位上的吸附[46]。2) 逆水煤气变换是CO2同H2作用生成CO和H2O的过程,它是一个吸热反应。因此,热点的存在导致逆水煤气变换发生,降低了CO的净化效果。富氢气体是通过烷烃的水蒸气重整和水煤气变换所得,由于水煤气变换的热力学限制的CO含量维持在1%左右,因此,热点的相对高温使得逆水煤气变换再次发生[47]。
热点的检测是必不可少,但,这又是十分困难的。同样,Pt-Ni/CNTs-γ-Al2O3复合材料的热导率的测定也是值得关注的,然而,可惜的是颗粒材料热导率的测定在当前的技术条件下还不能测试。尽管如此,依据CNTs具有良好的的热导性能,我们可以推出上述结论。
|
| 图 6 不同活性组分的催化剂催化性能 a) CO的 转化率、b) O2对CO选择性和CH4产率曲线 Fig.6 Variation of the CO conversion a), the selectivity of O2 to CO oxidation (filled symbol) and the CH4 yield (open symbol) b) with the reaction temperature for CO-PROX |
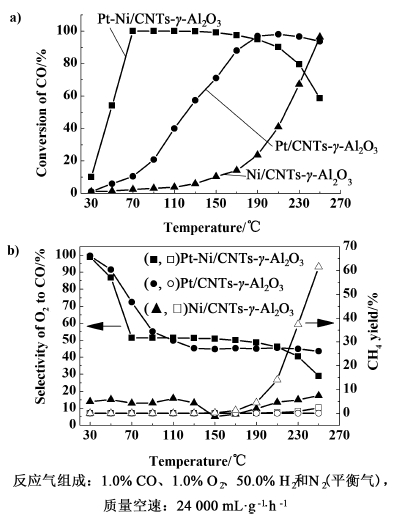
Pt/CNTs-γ-Al2O3表现出相对较差的催化活性,当反应温度达到210 ℃时,CO的转化率达到最大值,仅为98.0%,选择性为45.6%,CO的出口浓度高于100×10-6。对于Ni/CNTs-γ-Al2O3,在整个反应温度范围内CO的转化率和选择性都很低,250 ℃时CO的转化率最大,为96.3%,选择性为17.4%,然而,这主要是由于CO甲烷化所致如图 6b)。
Pt-Ni/CNTs-γ-Al2O3在低的反应温度下表现出较高的催化活性,这可能是由于Pt-Ni双金属的协同作用,位于表面的镍物种作为O2解离吸附的活性位,产生原子O物种[20, 48]。CO在Pt原子上吸附活化,随后,活化的CO物种和O物种作用生成CO2[20, 49]。
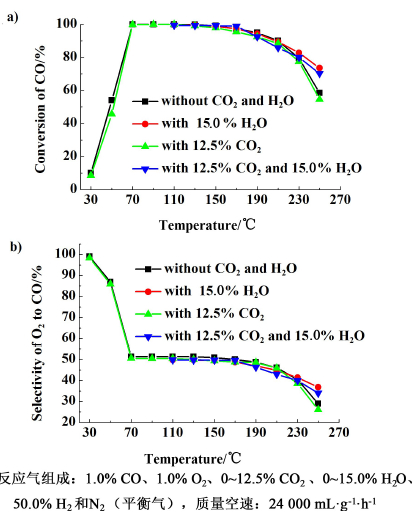
2.5.3 水蒸气和CO2对催化剂性能的影响图 7是不同反应气氛下催化剂Pt-Ni/CNTs-γ-Al2O3在富氢气氛中CO优先氧化反应中的催化性能评价。当反应温度达110 ℃时,反应气氛中加入15.0% H2O,CO的转化率从100%降低到99.7%,O2对CO的选择性降低到49.8%,此时CO的转化率最大,对应的CO出口浓度为30×10-6。在110~130 ℃范围内,CO的出口浓度可以降低到50×10-6以下。当反应温度达150 ℃时,CO的转化率降低到98.9%,对应的CO的出口浓度为110×10-6。温度低于130 ℃,水蒸气的存在对催化剂的性能有轻微的负面影响;反应温度高于150 ℃,其反而对催化剂的性能有促进作用,可能是由于水蒸气在催化剂表面解离出比反应气中的O2更具有氧化作用的OH-,从而促进CO的氧化[40, 50]。
|
| 图 7 不同反应气氛下催化剂Pt-Ni/CNTs-γ-Al2O3的催化性能a) CO的转化率和b) O2对CO选择性曲线 Fig.7 Effect of adding CO2 and H2O to the feed gas on CO conversion a) and the selectivity of O2 to CO oxidation b) for CO-PROX over Pt-Ni/CNTs-γ-Al2O3 catalyst |
当向反应气中加入12.5% CO2时,反应温度达到90 ℃时,CO转化率为100%,O2对CO的选择性为50.4%。在70~110 ℃范围内可以将CO出口浓度降低到20×10-6,选择性维持在50%左右。反应温度升高到130 ℃时,CO的出口浓度降低到80×10-6。温度低于130 ℃时,CO2的存在对催化剂Pt-Ni/CNTs-γ-Al2O3具有轻微的负面作用,当温度高于130 ℃,CO2对其影响开始明显。可能是由于逆水煤气变换所致。Pt-Ni/CNTs-γ-Al2O3表现出很好的抗CO2性能,可能是由于裸露在外面的羧基化CNTs表面含有大量的羰基,羰基分解出CO2时,CNTs表面就可以空出自由碳原子,它们又将CO2吸附于其表面,从而可以避免催化剂的活性中心被CO2占据,避免或消除CO2的负面影响[42]。
当反应温度达110 ℃时,反应气中同时加入15.0% H2O和12.5% CO2,在110~150 ℃范围内,可以将CO的出口浓度降低到100×10-6以下,CO的选择性维持在49.7%左右。在110 ℃时,CO的转化率最大,为99.8%。水蒸气和CO2同时存在时,Pt-Ni/CNTs-γ-Al2O3仍然表现出优良的催化性能。
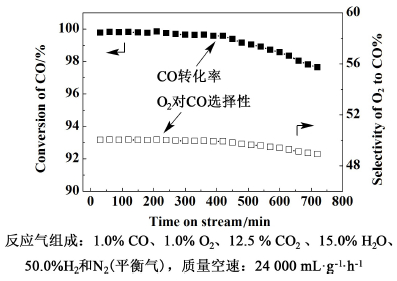
2.5.4 Pt-Ni/CNTs-γ-Al2O3稳定性能图 8为催化剂Pt-Ni/CNTs-γ-Al2O3在同时含有水蒸气和CO2的气氛中其催化性能随时间的变化曲线。
|
| 图 8 110 ℃下催化剂Pt-Ni/CNTs-γ-Al2O3催化性能 CO转化率和O2对CO选择性随时间变化曲线 Fig.8 CO conversion and the selectivity of O2 to CO oxidation as function of time on stream for CO-PROX over Pt-Ni/CNTs-γ-Al2O3 catalyst |
该催化剂在210 min内,CO的转化率维持在99.8%,CO的出口浓度约为20×10-6。随后CO的转化率略微的降低,保持在99.6%以上,420 min以后降低开始明显,但是,在510 min内仍旧可以将CO出口的浓度降低到100×10-6以内。在450 min内,O2对CO的选择性保持在49.8%以上,随后其选择性开始明显降低。这可能是由于反应过程中H2O/OH-和碳酸盐物种在催化剂表面强吸附,将催化剂的活性位覆盖,抑制了CO和O2的吸附,从而导致催化剂活性下降[51]。
3 结论CNTs-γ-Al2O3复合材料负载的Pt-Ni双金属催化剂用于富氢气体中CO优先氧化表现出良好的催化性能。Pt-Ni/CNTs-γ-Al2O3在1.0% CO、1.0% O2、50.0% H2和48.0% N2 (平衡气)的富氢气氛中,低温条件下,表现出较高的活性和选择性。CO2和水蒸气的存在对催化剂具有轻微的负面影响。在氧化铝基质中,CNTs在均匀分散且被氧化铝包裹,从而显著改善了复合材料的热导性能,且Pt-Ni双金属纳米颗粒能够均匀分散在CNTs-γ-Al2O3复合材料表面。由于Pt和Ni相互作用,及CNTs的添加改善了γ-Al2O3导热性,避免或减缓了热点的形成,从而避免或减缓了H2的氧化以及逆水煤气变换反应,进而提高了净化CO的效果。
| [1] | Liu Y, Liu B, Liu Y, et al. Improvement of catalytic performance of preferential oxidation of CO in H2-rich gases on three-dimensionally ordered macro-and meso-porous Pt-Au/CeO2 catalysts[J]. Appl Catal B, 2013, 142/143: 615-625 |
| [2] | Wu J, Yuan X, Martin J J, et al. A review of PEM fuel cell durability: Degradation mechanisms and mitigation strategies[J]. J Power Sources, 2008, 184(1): 104-119 |
| [3] | Liu K, Wang A, Zhang T. Recent advances in preferential oxidation of CO reaction over platinum group metal catalysts[J]. ACS Catal, 2012, 2(6): 1 165-1 178 |
| [4] | Trimm D L. Minimisation of carbon monoxide in a hydrogen stream for fuel cell application[J]. Appl Catal A, 2005, 296(1): 1-11 |
| [5] | Niu T, Shen L, Liu Y. Preparation of meso-macroporous α-alumina using carbon nanotube as the template for the mesopore and their application to the preferential oxidation of CO in H2-rich gases[J]. J Porous Mater, 2013, 20(4): 789-798 |
| [6] | Perkas N, Teo J, Shen S, et al. Supported Ru catalysts prepared by two sonication-assisted methods for preferential oxidation of CO in H2[J]. Phys Chem Chem Phys, 2011, 13(34): 15 690-15 698 |
| [7] | Son I H, Shamsuzzoha M, Lane A M. Promotion of Pt/γ-Al2O3 by new pretreatment for low-temperature preferential oxidation of CO in H2 for PEM fuel cells[J]. J Catal, 2002, 210(2): 460-465 |
| [8] | Park E D, Lee D, Lee H C. Recent progress in selective CO removal in a H2-rich stream[J]. Catal Today, 2009, 139(4): 280-290 |
| [9] | Mishra A, Prasad R. A review on preferential oxidation of carbon monoxide in hydrogen rich gases[J]. Bull Chem React Eng Catal, 2011, 6(1): 1-14 |
| [10] | Liu Y, Fu Q, Stephanopoulos M F. Preferential oxidation of CO in H2 over CuO-CeO2 catalysts[J]. Catal Today, 2004, 93/95(0): 241-246 |
| [11] | Jung C R, Han J, Nam S W, et al. Selective oxidation of CO over CuO-CeO2 catalyst: Effect of calcination temperature[J]. Catal Today, 2004, 93/95: 183-190 |
| [12] | Martinez-Arias A, Hungria A B, Fernandez-Garcia M, et al. Preferential oxidation of CO in a H2-rich stream over CuO/CeO2 and CuO/(Ce, M)Ox(M=Zr, Tb) catalysts[J]. J Power Sources, 2005, 151(0): 32-42 |
| [13] | Guo Q, Liu Y. MnOx modified Co3O4-CeO2 catalysts for the preferential oxidation of CO in H2-rich gases[J]. Appl Catal B, 2008, 82(1/2): 19-26 |
| [14] | Guo Q, Wu M, Liu Y, et al. Mesoporous CeO2-supported Co3O4 catalysts for CO preferential oxidation in H2-rich gases[J]. Chin J Catal, 2007, 28(11): 953-957 |
| [15] | Wang Y, Yoon Y, Glezakou V A, et al. The role of reducible oxide-metal cluster charge transfer in catalytic processes: New insights on the catalytic mechanism of CO oxidation on Au/TiO2 from ab initio molecular dynamics[J]. J Am Chem Soc, 2013, 135(29): 10 673-10 683 |
| [16] | Denkwitz Y, Schumacher B, Kucěrova G, et al. Activity, stability, and deactivation behavior of supported Au/TiO2 catalysts in the CO oxidation and preferential CO oxidation reaction at elevated temperatures[J]. J Catal, 2009, 267(1): 78-88 |
| [17] | Ilieva L, Pantaleo G, Ivanov I, et al. A comparative study of differently prepared rare earths-modified ceria-supported gold catalysts for preferential oxidation of CO[J]. Int J Hydrogen Energy, 2009, 34(15): 6 505-6 515 |
| [18] | Gu C, Lu S, Miao J, et al. Meso-Macroporous monolithic CuO-CeO2/γ/α-Al2O3 catalysts for CO preferential oxidation in hydrogen-rich gas: Effect of loading methods[J]. Int J Hydrogen Energy, 2010, 35(12): 6 113-6 122 |
| [19] | Bion N, Epron F, Moreno M, et al. Preferential oxidation of carbon monoxide in the presence of hydrogen (PROX) over noble metals and transition metal oxides: Advantages and drawbacks[J]. Top Catal, 2008, 51(1/4): 76-88 |
| [20] | Mu R, Fu Q, Xu H, et al. Synergetic effect of surface and subsurface Ni species at Pt-Ni bimetallic catalysts for CO oxidation[J]. J Am Chem Soc, 2011, 133(6): 1 978-1 986 |
| [21] | Ko E Y, Park E D, Seo K, et al. Pt-Ni/γ-Al2O3 catalyst for the preferential CO oxidation in the hydrogen stream[J]. Catal Lett, 2006, 110(3/4): 275-279 |
| [22] | Xu H, Fu Q, Guo X, et al. Architecture of Pt-Co bimetallic catalysts for catalytic CO oxidation[J]. Chem Cat Chem, 2012, 4(10): 1 645-1 652 |
| [23] | Wang C, Li B, Lin H, et al. Carbon nanotube-supported Pt-Co bimetallic catalysts for preferential oxidation of CO in a H2-rich stream with CO2 and H2O vapor[J]. J Power Sources, 2012, 202: 200-208 |
| [24] | Ko E Y, Park E D, Lee H C, et al. Supported Pt-Co catalysts for selective CO oxidation in a hydrogen-rich stream[J]. Angew Chem Int Ed, 2007, 46(5): 734-737 |
| [25] | Xu H, Fu Q, Yao Y, et al. Highly active Pt-Fe bicomponent catalysts for CO oxidation in the presence and absence of H2[J]. Energy Environ Sci, 2012, 5(4): 6 313-6 320 |
| [26] | 唐晓兰, 张保才, 李勇, 等. 用于CO选择氧化反应的新型Pt-Fe/Al2O3催化剂[J]. 催化学报, 2005, 26(1): 1-3 Tang Xiaolan, Zhang Baocai, Li Yong, et al. Novel Pt-Fe/Al2O3 catalyst for CO selective oxidation[J]. Chin J Catal, 2005, 26(1): 1-3 (in Chinese) |
| [27] | Yin J, Wang J, Zhang T, et al. Novel alumina-supported PtFe alloy nanoparticles for preferential oxidation of carbon monoxide in hydrogen[J]. Catal Lett, 2008, 125(1/2): 76-82 |
| [28] | Komatsu T, Takasaki M, Ozawa K, et al. PtCu intermetallic compound supported on alumina active for preferential oxidation of CO in hydrogen[J]. J Phys Chem C, 2013, 117(20): 10 483-10 491 |
| [29] | Yu X, Yu W, Li H, et al. Preparation, characterization and application of K-PtCo/Al2O3 catalyst coatings for preferential CO oxidation[J]. Appl Catal B, 2013, 140/141: 588-597 |
| [30] | Wang F, Lu G. High performance rare earth oxides LnOx (Ln=La, Ce, Nd, Sm and Dy)-modified Pt/SiO2 catalysts for CO oxidation in the presence of H2[J]. J Power Sources, 2008, 181(1): 120-126 |
| [31] | Tanaka H, Kuriyama M, Ishida Y, et al. Preferential CO oxidation in hydrogen-rich stream over Pt catalysts modified with alkali metals: Part I. Catalytic performance[J]. Appl Catal A, 2008, 343(1/2): 117-124 |
| [32] | Atalik B, Uner D. Structure sensitivity of selective CO oxidation over Pt/γ-Al2O3[J]. J Catal, 2006, 241(2): 268-275 |
| [33] | Fu Q, Li W, Yao Y, et al. Interface-Confined ferrous centers for catalytic oxidation[J]. Science, 2010, 328(5 982): 1 141-1 144 |
| [34] | Siani A, Captain B, Alexeev O S, et al. Improved CO oxidation activity in the presence and absence of hydrogen over cluster-derived PtFe/SiO2 Catalysts[J]. Langmuir, 2006, 22(11): 5 160-5 167 |
| [35] | Kotobuki M, Watanabe A, Uchida H, et al. Reaction mechanism of preferential oxidation of carbon monoxide on Pt, Fe, and Pt-Fe/mordenite catalysts[J]. J Catal, 2005, 236(2): 262-269 |
| [36] | Pozdnyakova O, Teschner D, Wootsch A, et al. Preferential CO oxidation in hydrogen (PROX) on ceria-supported catalysts, part II: Oxidation states and surface species on Pd/CeO2 under reaction conditions, suggested reaction mechanism[J]. J Catal, 2006, 237(1): 17-28 |
| [37] | Ayastuy J L, Gil-Rodriguez A, Gonzalez-Marcos M P, et al. Effect of process variables on Pt/CeO2 catalyst behaviour for the PROX reaction[J]. Int J Hydrogen Energy, 2006, 31(15): 2 231-2 242 |
| [38] | Parinyaswan A, Pongstabodee S, Luengnaruemitchai A. Catalytic performances of Pt-Pd/CeO2 catalysts for selective CO oxidation[J]. Int J Hydrogen Energy, 2006, 31(13): 1 942-1 949 |
| [39] | Luengnaruemitchai A, Nimsuk M, Naknam P, et al. A comparative study of synthesized and commercial A-type zeolite-supported Pt catalysts for selective CO oxidation in H2-rich stream[J]. Int J Hydrogen Energy, 2008, 33(1): 206-213 |
| [40] | Lu S, Zhang C, Liu Y. Carbon nanotube supported Pt-Ni catalysts for preferential oxidation of CO in hydrogen-rich gases[J]. Int J Hydrogen Energy, 2011, 36(3): 1 939-1 948 |
| [41] | Zhang J, Wang R, Liu E, et al. Spherical structures composed of multiwalled carbon nanotubes: Formation mechanism and catalytic performance[J]. Angew Chem Int Ed, 2012, 51(30): 7 581-7 585 |
| [42] | Lu S, Liu Y. Preparation of meso-macroporous carbon nanotube-alumina composite monoliths and their application to the preferential oxidation of CO in hydrogen-rich gases[J]. Appl Catal B, 2012, 111/112: 492-501 |
| [43] | Kim D Y, Yang C M, Park Y S, et al. Characterization of thin multi-walled carbon nanotubes synthesized by catalytic chemical vapor deposition[J]. Chem Phys Lett, 2005, 413(1/3): 135-141 |
| [44] | Zaman A C, Vstundağ C B, Çelik A, et al. Carbon nanotube/boehmite-derived alumina ceramics obtained by hydrothermal synthesis and spark plasma sintering (SPS)[J]. J Eur Ceram Soc, 2010, 30(16): 3 351-3 356 |
| [45] | Hsieh C T, Lin J, Wei J. Deposition and electrochemical activity of Pt-based bimetallic nanocatalysts on carbon nanotube electrodes[J]. Int J Hydrogen Energy, 2009, 34(2): 685-693 |
| [46] | Caputo T, Lisi L, Pirone R, et al. Kinetics of the preferential oxidation of CO over CuO/CeO2 catalysts in H2-rich gases[J]. Ind Eng Chem Res, 2007, 46(21): 6 793-6 800 |
| [47] | Choi Y, Stenger H G. Kinetics, simulation and insights for CO selective oxidation in fuel cell applications[J]. J Power Sources, 2004, 129(2): 246-254 |
| [48] | Chen L, Ma D, Zhang Z, et al. Low Pt loading high catalytic performance of PtFeNi/carbon nanotubes catalysts for CO preferential oxidation in excess hydrogen I: Promotion effects of Fe and/or Ni[J]. Catal Lett, 2012, 142(8): 975-983 |
| [49] | Komatsu T, Tamura A. Pt3Co and PtCu intermetallic compounds: Promising catalysts for preferential oxidation of CO in excess hydrogen[J]. J Catal, 2008, 258(2): 306-314 |
| [50] | Zhou S, Yuan Z, Wang S. Selective CO oxidation with real methanol reformate over monolithic Pt group catalysts: PEMFC applications[J]. Int J Hydrogen Energy, 2006, 31(7): 924-933 |
| [51] | Yang H, Wang C, Li B, et al. Doping effects of Ni-MgO on the structure and performance of carbon nanotube-supported Pt catalysts for preferential oxidation of CO in a H2 stream[J]. Appl Catal A, 2011, 402(1/2): 168-175 |
 2016, Vol. 33
2016, Vol. 33





