随着社会的进步和能源技术的发展,太阳能、风能利用领域的扩大,对能量的存储问题也提出了更大的挑战。目前,常用的储能电池是铅酸电池,但铅酸电池的能量密度低、寿命短、成本高、占地宽、充放电效率低等问题限制了其在储能方面的应用[1, 2]。钒电池,又称全钒离子氧化还原液流电池(All Vanadium Redox Flow Battery,简称VRB) 具有循环寿命长、容量大、自放电小、污染小以及结构简单等优点[3, 4, 5],被认为是最有可能取代铅酸电池的理想储能电源。
VRB具有很广泛的应用前景,但目前它的发展仍受到一些因素的制约,主要包括:电极材料、电解液性能、隔膜等[6]。VRB电解液主要存在以下问题:1)浓度不能无限提高,当钒离子浓度高于3 mol/L时容易沉积;2)使用温度过窄,只有在10~40 ℃时才能保证各种钒离子的稳定性;3)充电程度越深,V(Ⅴ)越容易析出红色多钒酸盐沉淀。目前,解决这些问题主要从电解液制备方法以及在电解液中加入添加剂等方面入手[7, 8]。
当前对VRB电解液的研究主要集中于选择合适的正极液添加剂,而对负极液的研究却鲜见于报道。本研究通过向负极液加入合适的添加剂,提高了负极液的电化学反应速率及其稳定性。
1 实验 1.1 负极电解液的制备将适量高纯V2O5粉末加入到4 mol/L H2SO4溶液中,形成悬浊液。将上述悬浊液放入带隔膜电解槽的阴极室,阳极室放入相同浓度的H2SO4溶液,电解处理后阴极室得到绿色的V(Ⅲ)溶液[9]。电解处理过程中阴极采用石墨板,阳极采用Pt网。
本实验选取了尿素、草酸和酒石酸3种添加剂,分别加入稀释后的V(Ⅲ)电解液中。
1.2 V(Ⅲ)浓度分析方法移取待测负极电解液1 mL置于50 mL烧杯中,用浓度为10 mol/L的磷酸水溶液稀释至30 mL,搅拌均匀,以重铬酸钾标准液(0.033 mol/L)进行滴定,直到在滴定曲线500~900 mV范围内出现V(Ⅲ)氧化为V(Ⅳ)的电位突跃。根据这个突跃点可得到滴定终点时消耗的标准液体积,计算出待测电解液中V(Ⅲ)的浓度[10]。
1.3 电化学测试采用采用循环伏安法(CV),交流阻抗法(EIS)两种电化学测试手段考察所负极电解液的电化学性能。电化学测试采用三电极两回路的测试体系,在上海辰华CHI660D电化学工作站上进行测试。研究电极为面积是2.0 cm×2.0 cm的石墨板,辅助电极为面积是5 cm×3 cm的钌钛网,参比电极为饱和甘汞电极(SCE)。工作电极测试前分别用360#、400#、1 000#砂纸打磨,之后采用丙酮擦拭表面除油,用蒸馏水清洗,吹干待用。测试前,石墨电极须在待测溶液中静置30 min。
CV测试从开路电压处开始扫描,扫描范围为0.3~-1.3 V,所有的实验均采用负向扫描,扫描圈数为10圈。EIS测试在室温下进行,测试电位为-0.6 V,扫描频率范围为0.1~1.0 MHz,振幅为5 mV。
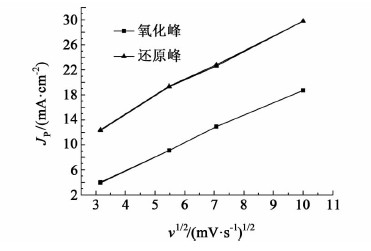
2 结果与讨论 2.1 不同扫速下CV分析图 1是石墨电极在0.4 mol/L V(III)溶液中不同扫速下的CV曲线,将峰电流和扫速平方根作图得到图 2。

|
| 图 1 石墨电极在不同扫速下的循环伏安曲线 Fig.1 CV curve of graphite electrode with different scanning speeds |
|
| 图 2 循环伏安曲线中峰电流和扫速平方根的关系图 Fig.2 Interrelationship diagram of peak current and the square root of the sweep speed in CV |
从图 1可以看出,扫速由低到高递增的过程中,氧化峰和还原峰的峰电位差ΔVP呈增加趋势,说明随着扫速的增加,电解液的可逆性降低。
根据图 2可以得到,峰值电流JP与扫速的平方根υ1/2呈线性关系,说明在所研究的扫描电位范围内,研究的体系是一个准可逆体系。
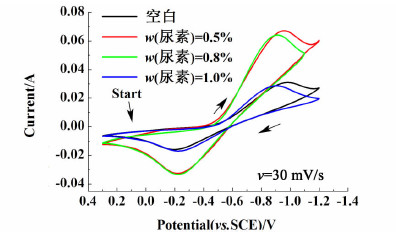
2.2 添加剂对负极电解液电化学活性的影响 2.2.1 尿素向负极液中分别加入质量分数为0.5%、0.8%和1.0%的尿素,测试石墨电极的CV曲线,结果如图 3所示。
|
| 图 3 石墨电极在不同浓度尿素负极液中的CV曲线 Fig.3 CV curves of graphite electrode in the negative electrolyte with different urea concentration |
从图 3中可以看出,随着尿素浓度的增加,氧化峰、还原峰的峰电流先显著增加,然后逐渐减小,当尿素质量分数为0.5%时,峰电流最大。同时,随着尿素浓度的增加,氧化峰的峰电位向负方向略微移动,还原峰的峰电位向正方向移动,导致峰电位差ΔVP减小,增加了电解液的可逆性。上述结果表明,尿素的加入可以有效地提高电解液的反应速率,当尿素质量分数为0.5%时效果最佳,并且电解液的可逆性随着尿素浓度的增加得到改善。
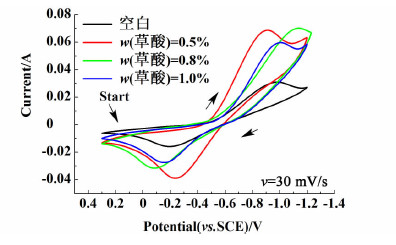
2.2.2 草酸向负极液中分别加入质量分数为0.5%、0.8%、1.0%的草酸,测试石墨电极的CV曲线,结果如图 4所示。
|
| 图 4 石墨电极在含不同浓度草酸负极液中的CV曲线 Fig.4 CV curves of graphite electrode in the negative electrolyte with different oxalic acid concentration |
从图 4中可以看出,随着加入草酸浓度的增加,氧化峰、还原峰的峰电流先显著增加,然后逐渐减小,当草酸质量分数为0.5%时,峰电流最大。此外,当草酸质量分数为0.5%时,氧化峰和还原峰的峰电位差ΔVP最小,此时负极液的可逆性相对最好。上述结果表明,当草酸质量分数为0.5%时,电解液的电化学反应速率最快,并且此时电解液的可逆性最好。
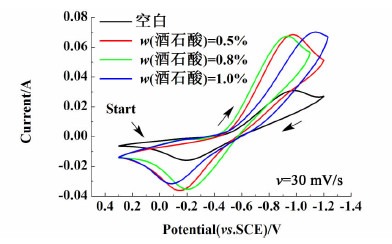
2.2.3 酒石酸向负极液中分别加入质量分数为0.5%、0.8%、1.0%的酒石酸,测试石墨电极的CV曲线,结果如图 5所示。
|
| 图 5 石墨电极在含不同浓度酒石酸负极液中的CV曲线 Fig.5 CV curves of graphite electrode in negative electrolyte with different tartaric acid concentration |
从图 5中可以看出,在所研究的浓度范围内,加入酒石酸的负极液氧化峰、还原峰峰电流均明显增大。其中,还原峰峰电流增加的程度接近,但是质量分数为1.0%的酒石酸负极液的氧化峰峰电流增加程度略少于分数为0.5%和0.8%的酒石酸负极液。从可逆性的角度考虑,浓度为1.0%的酒石酸负极液的峰电位差ΔVP最大,0.5%的酒石酸负极液的峰电位差ΔVP其次,而0.8%的酒石酸负极液的峰电位差ΔVP最小。因此,0.8%对于酒石酸来讲是最佳浓度。在该浓度下,不但可以加快电解液反应速率,而且可以提高电解液的可逆性。
综上所述,负极液中各种添加剂的最适宜浓度分别为:尿素的最佳添加质量分数是0.5%,草酸的最适宜添加质量分数是0.5%,酒石酸的最适宜添加质量分数是0.8%。将三者的循环伏安曲线与空白溶液的循环伏安曲线进行比较(见图 6),通过循环伏安曲线找出各自的氧化还原峰电位及峰电流值,计算出氧化还原峰电位差ΔVP及峰电流IPa和IPc,列于表 1,可以看出0.5%草酸的添加效果最佳。
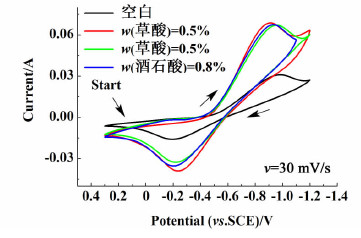
|
| 图 6 石墨电极在含不同添加剂负极液中的CV曲线 Fig.6 CV curves of graphite electrode in the negative electrolyte with different additives |
| 添加剂 | EPa/V | EPc/V | ΔEP/V | -IPa/mA | IPc/mA | IPa/IPc |
| 空白 | -0.197 | -0.980 | 0.783 | 16.0 | 30.9 | 0.518 |
| 0.5%草酸 | -0.236 | -0.908 | 0.672 | 39.0 | 68.7 | 0.568 |
| 0.8%酒石酸 | -0.207 | -0.932 | 0.725 | 35.4 | 67.4 | 0.525 |
| 0.5%尿素 | -0.223 | -0.956 | 0.733 | 32.7 | 67.0 | 0.488 |
综合之前的实验,得出加入添加质量分数为0.5%的草酸效果最好。所以对添加质量分数为0.5%的草酸负极液和相同钒浓度和硫酸浓度的空白负极液进行了交流阻抗测试。经过ZSmipWin软件拟合后,电化学阻抗谱图以及等效电路如图 7所示,等效电路模拟结果列于表 2。

|
| 图 7 石墨电极在0.5%草酸负极液中的交流阻抗图 Fig.7 EIS curve of graphite electrode in the negative electrolyte with 0.5% oxalic acid |
从图 7中以及表 2中可以看出,加入质量分数为0.5%的草酸后,负极液的溶液电阻Rs基本没有变化,但电化学反应电阻Rct由75.4 Ω降低至53.5 Ω,电化学反应阻力大大减小,大大增加了负极液的电化学反应速率,与之前的CV曲线相吻合。
加入草酸添加剂可以有效降低负极液的电化学反应阻力,这是因为添加剂中的羟基能够有效催化V(Ⅲ)与V(Ⅱ)之间氧化还原反应,加速电极表面电子之间的转移和传递,降低反应电阻,提高催化效率,这与相关报道一致。根据图 4中的CV曲线可知,当w(草酸)继续增加至0.8%甚至1.0%时,电解液的反应速率反而下降。这是因为当草酸含量较多时,未与V(Ⅲ)结合的草酸分子会优先附着在石墨电极表面占据氧化反应活性位,从而加大反应阻力,使得极化电阻提高,增大了电化学反应阻力。
2.4 添加剂对负极液稳定性的影响将上述浓度添加剂的负极液在室温下静置40 d。V(Ⅲ)的初始浓度为2 mol/L,40 d后各负极液中V(Ⅲ)的浓度见表 3。
| 样品编号 | 添加剂种类 | V(Ⅲ)浓度/(mol·L-1) |
| 1 | 1.90 | |
| 2 | 尿素 | 1.81 |
| 3 | 草酸 | 1.92 |
| 4 | 酒石酸 | 1.92 |
由表 3中数据可知,空白溶液在室温下静置40 d后,V(Ⅲ)浓度略有下降,为1.90 mol/L。和空白溶液相比,加有添加剂草酸和酒石酸的负极液中V(Ⅲ)的浓度略微升高。而加有添加剂尿素的负极液中V(Ⅲ)的浓度比空白溶液中的浓度还低。这说明了草酸和酒石酸的加入,可以有效地提高电解液的稳定性,抑制V(Ⅲ)的还原,而尿素则降低了溶液的稳定性。
3 结论不同添加剂的负极电解液循环伏安曲线分析表明,质量分数为0.5%草酸的添加效果最佳,不但可以加快电解液反应速率,而且可以提高电解液的可逆性。交流阻抗分析分析表明,加入草酸可以有效地降低电解液的电化学反应电阻。稳定性实验表明,草酸和酒石酸的加入,都可以有效地提高了电解液的稳定性,V(Ⅲ)浓度为1.93 mol/L的电解液在室温下可以稳定存在40 d以上。 所加添加剂仅从提高电解液稳定性着手,在提高电化学活性和可逆性的方面只是进行了初步的研究,关于机理方面没有深入探究。并且对于添加剂的种类也有待扩充。关于添加剂的复合添加也可以进行进一步深入研究。
| [1] | Kanamori K. Structures and properties of multinuclear vanadium(III) complexes: Seeking a clue to understand the role of vanadium(III) in aseidians[J]. Coordination Chemistry Reviews, 2003, 237(1): 147-161 |
| [2] | Sum E, Skyllas M K. A study of the V(II)/V(III) redox couple for redox flow cell application[J]. Journal of Power Sources, 1985, 15: 179-190 |
| [3] | Sum E, Rychcik M, Skyllas M K. Investigation of V(IV)/V(V) system for use in positive half-cell of a redox battery[J]. Journal of Power Sources, 1985, 16: 1-9 |
| [4] | Skyllas M K, Robin R. All vanadium redox battery: US,P4786567[P]. 1988-11-22 |
| [5] | Mohammadi T, Skyllas-Kazacos M. Modification of anion-exchage membranes for vanadium redox flow battery applications[J]. Power Sources, 1996, 63: 179-186 |
| [6] | Skyllas-Kazacos M, Grossmith F. Efficient vanadium redox flow cell[J]. Journal of the Electrochemical Society, 1987, 134: 2 950-2 953 |
| [7] | Kausar N, Howe R, Skyllas-Kazacos M. Raman spectroscopy studies of concentrated vanadium redox battery positive electrolytes[J]. Journal of Applied Electrochemistry, 2001, 31: 1 327-1 332 |
| [8] | Wu T, Huang K, Liu S, et al. Hydrothermal ammoniated treatment of PAN-graphite felt for vanadium redox flow battery[J]. Journal of Solid State Electrochemistry, 2012, 16: 579-585 |
| [9] | Li S, Huang K, Liu S, et al. Effect of organic additives on positive electrolyte for vanadium redox battery[J]. Electrochemical Acta, 2011, 56: 5 483-5 487 |
| [10] | Qian P, Zhang H, Chen J, et al. A novel electrode-bipolar plate assembly for vanadium redox flow battery applications[J]. Journal of Power Sources, 2008, 175: 613-620 |
 2016, Vol. 33
2016, Vol. 33





