香叶基丙酮,又名二氢假紫罗兰酮,化学名称为(5E)-6,10-二甲基-5,9-十一碳二烯-2-酮,其同分异构体为橙花基丙酮。作为一种具有木兰香味的香料,香叶基丙酮可用于调配日用香精,合成名贵香料及维生素E,目前已广泛应用于日化香精、食品及医药行业[1]。
香叶基丙酮可以从茴香、茶叶、西红柿等天然植物中提取,但工业上一般采用合成的方法制得香叶基丙酮及橙花基丙酮的混合物,再对其进行分离得到较高纯度的香叶基丙酮。其合成路线主要有两种:一种是由芳樟醇与乙酰乙酸乙酯经卡罗反应(Carroll reaction)直接制得[2, 3, 4],该方法所用原料芳樟醇一般由月桂烯经盐酸化、酯化、皂化等步骤制成。另一种方法是直接利用月桂烯在贵金属催化剂存在下和乙酰乙酸甲酯反应,水解脱羧得到[5, 6],该反应过程所用催化剂比较昂贵,不利于工业化生产。我国具有丰富的松节油资源,其主要成分β-蒎烯经高温裂解即可制得月桂烯[7]。因此本研究选择以月桂烯为原料,和氯化氢加成得到香叶基氯及其同分异构体,所得氯化物与乙酰乙酸乙酯反应后再水解脱羧得到香叶基丙酮。该方法原料来源广泛,廉价易得,且反应过程中避免了使用贵金属作催化剂,简化了工艺流程,降低了生产成本,为工业化生产香叶基丙酮提供了参考。其具体合成路线见图1和图2。
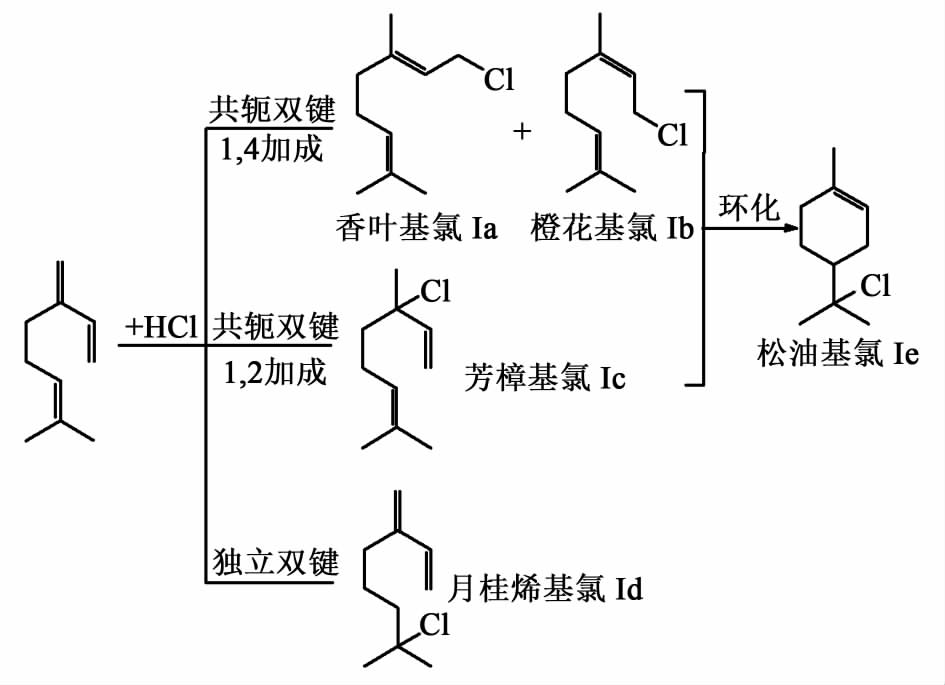
|
| 图 1 月桂烯的加成反应 Fig.1 Synthesis route of myrcene |
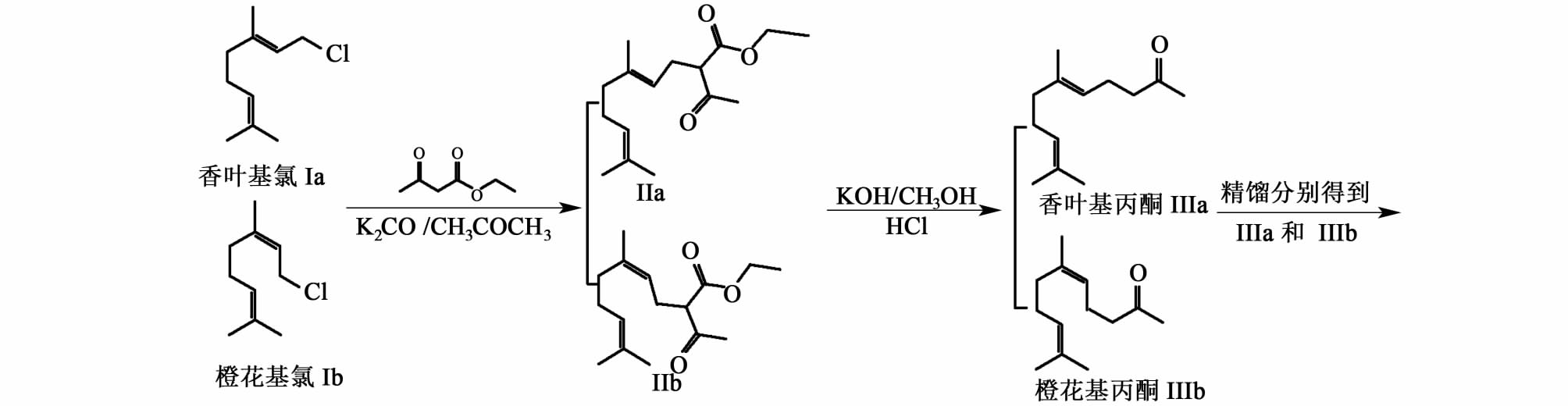
|
| 图 2 香叶基丙酮的合成 Fig.2 Synthesis route of geranyl acetone |
月桂烯是典型的单萜类化合物,含有3个双键结构,催化条件下,可以和氯化氢加成形成多种氯化物,不同的催化剂可以得到不同的主要产物[8, 9, 10]。在多种氯化产物中,香叶基氯(化合物Ia)和橙花基氯(化合物Ib)为伯氯代烃可以继续和乙酰乙酸乙酯发生取代反应,是合成香叶基丙酮所必须的中间体,具有更高的商业价值和研究意义。由于这些氯化物利用传统方法难以分离,我们将混合组分不经分离直接进行下一步反应,生成沸点差别较大的香叶基丙酮(化合物IIIa)和橙花基丙酮(化合物IIIb)再进行精馏分离。氯化物经烷基化后水解脱羧生成酮类化合物比较容易实现[11, 12, 13, 14],因此本研究重点研究了月桂烯的加成反应条件,期望得到产率较高,且以化合物Ia和Ib为主要产物的的氯化物。
1 实验部分 1.1 试剂与仪器月桂烯(80%,江西省吉水县水南天然香料有限公司),四丁基溴化铵(TBAB)、十六烷基三甲基溴化铵(CTAB)、乙酰乙酸乙酯、丙酮、甲醇、碳酸钾、氢氧化钾,等。均为分析纯。
Aglient 7890A GC(美国Aglient公司),TRACEDSQ气相-质谱联用仪(Thermo Finnegan)。色谱条件:柱温60 ℃,保持2 min;以4 ℃/min升温至102 ℃,保持2 min;再以20 ℃/min升温至180 ℃,保持2 min。检测进样量为0.2 μL,分流比为10∶1,以面积归一法进行定量分析。
1.2 月桂烯的加成反应在100 mL三颈烧瓶中,依次加入0.10 g(1.0 mmol)TBAB、0.32 g(1.0 mmol)新制氯化亚铜、40 mL二氯甲烷及17.03 g(80%,100 mmol)月桂烯。在10 ℃下,以一定速率通入干燥氯化氢气体,体系增重3.65 g后停止反应。将混合液倾入100 mL饱和氯化钠溶液中,分液。水相用二氯甲烷(30 mL×3)萃取,合并有机相,萃取液依次用5%碳酸钠溶液(30 mL)、饱和食盐水洗至中性。无水硫酸镁干燥。过滤,脱溶,减压蒸馏,收集45~50℃/20 Pa[15]馏分14.79 g,粗产率85.62%。GC-MS分析化合物Ia及化合物Ib之和占82.05%。
图3气相色谱图中,化合物Ia及化合物Ib之和占82.05%,化合物Ia(香叶基氯)是图2中保留时间为5.95的色谱峰,化合物Ib(橙花基氯)是图2中保留时间为5.76的色谱峰。其他峰面积较小的色谱峰是另外几种氯化物及原料中杂质所生成的氯化物。
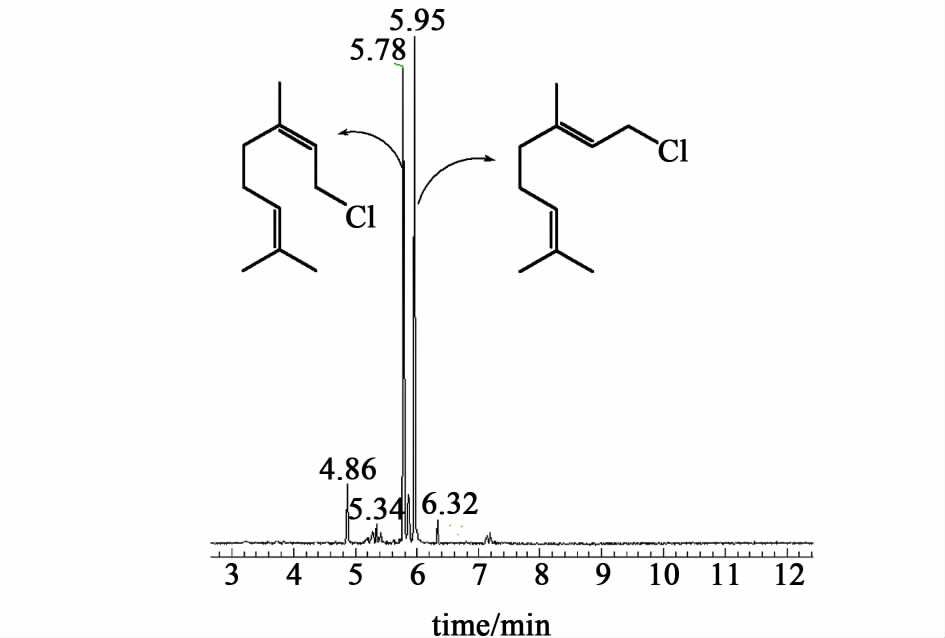
|
| 图 3 产物Ia及Ib的气相色谱图 Fig.3 Gas chromatogram of Ia and Ib |
图4a)为化合物Ia的质谱图,化合物Ia(香叶基氯)的分子离子峰m/z为172,离子碎片为41、53、67、69、81、93、128;图4b)为化合物Ib的质谱图,化合物Ib(橙花基氯)的分子离子峰m/z为172,离子碎片为41、53、67、69、81、93、128。
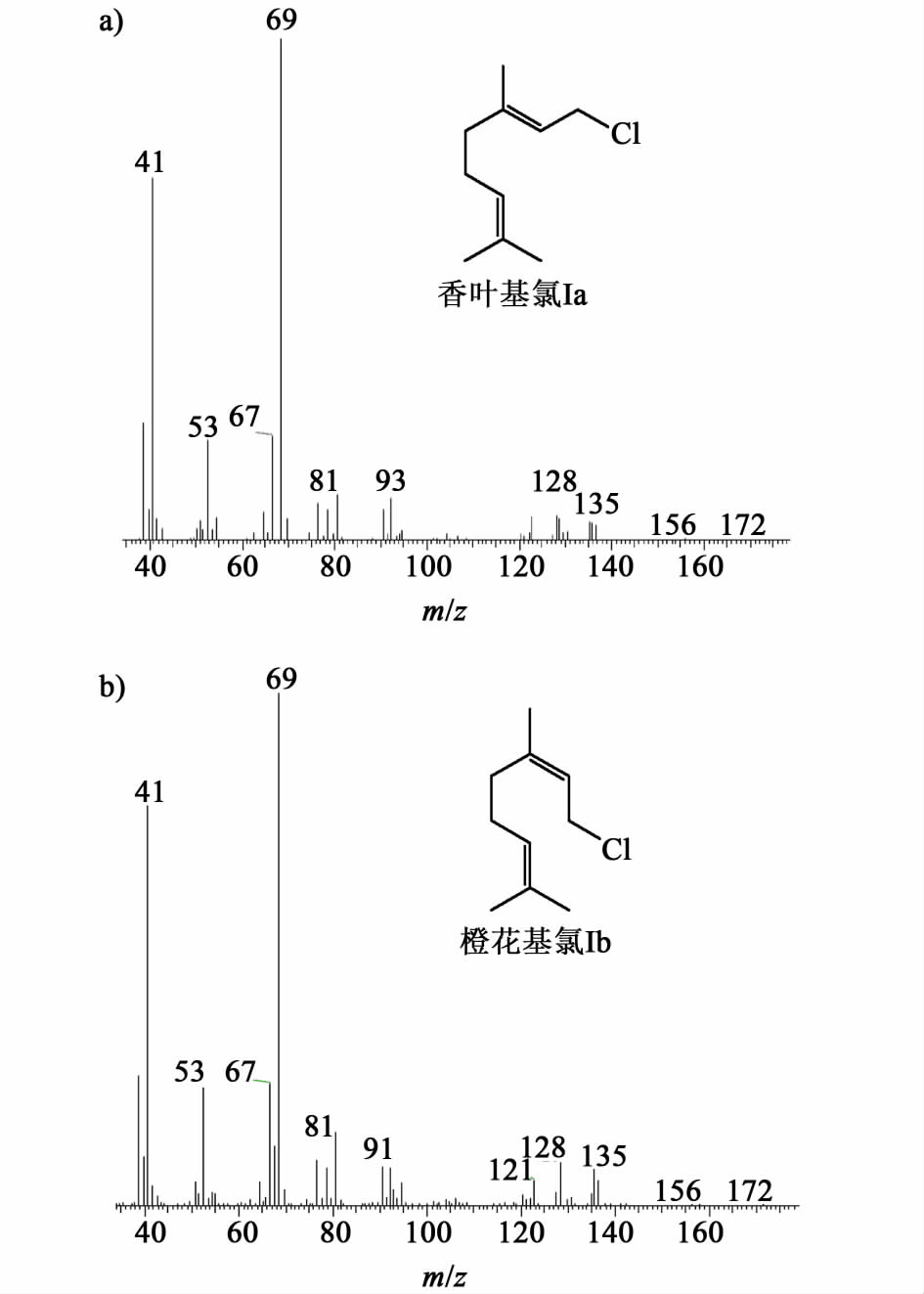
|
| 图 4 Ia及Ib的质谱图 Fig.4 MS spectra for Ia and Ib |
在250 mL单口瓶中加入上述氯化物8.42 g(82.05%,40 mmol),碳酸钾7.19 g(52 mmol),乙酰乙酸乙酯13.0 g(100 mmol),55 mL丙酮,加热回流,反应6 h,冷却至室温,将反应体系过滤,蒸馏除去丙酮,减压蒸馏除去多余的乙酰乙酸乙酯,得到的粗产物溶解在64 mL甲醇及5 mol/L 氢氧化钾(32 mL,8.96 g,160 mmol)水溶液中,加热回流2 h后停止反应,冷却至室温。滴加1 mol/L盐酸调节pH值至中性,分液,水相用乙醚(30 mL×3)萃取,合并有机相,萃取液用20 mL饱和食盐水洗涤,无水硫酸镁干燥。过滤,脱溶,减压蒸馏,20 Pa[16]条件下收集70~74 ℃馏分6.46 g。粗产率为83.25%,产物经GC-MS分析,化合物IIIa及化合物IIIb的质量分数之和占92.16%。经精馏可得到高纯度的目标产物化合物IIIa(香叶基丙酮)。
图5气相色谱图中,化合物IIIa及化合物IIIb之和占92.16%,化合物IIIa(香叶基丙酮)是图5中保留时间为7.71的色谱峰,化合物IIIb(橙花基丙酮)是图5中保留时间为7.58的色谱峰。
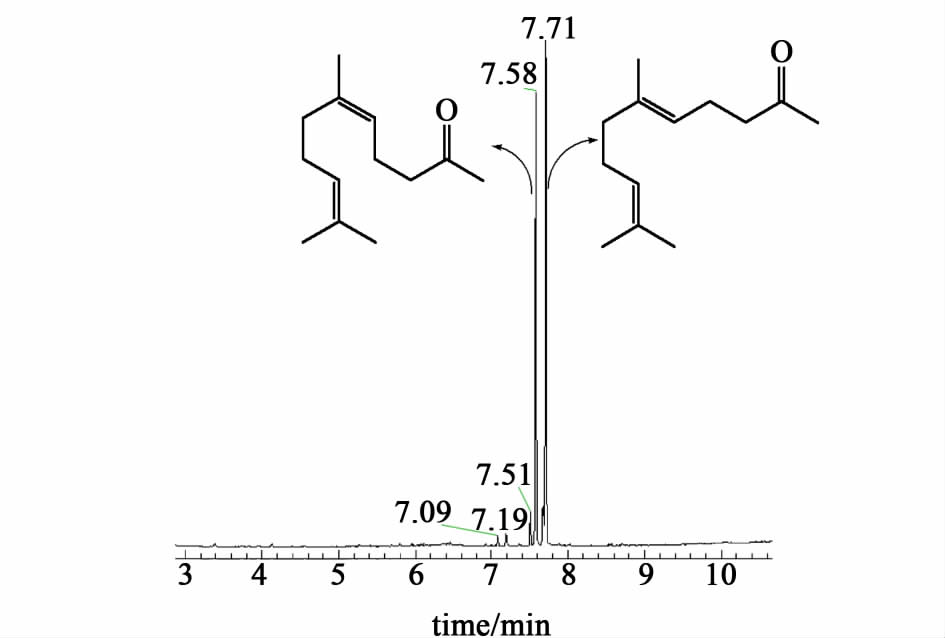
|
| 图 5 产物IIIa及IIIb的气相色谱图 Fig.5 Gas chromatogram of IIIa and IIIb |
图6a)为化合物IIIa的质谱图,及化合物IIIb的质谱图,化合物IIIa(香叶基丙酮)的分子离子峰m/z为194,离子碎片为43、53、67、69、81、93、107、136、151;图6b)为化合物IIIb的质谱图,化合物IIIb(橙花基丙酮)的分子离子峰m/z为194,离子碎片为43、53、67、69、81、93、107、136、151。
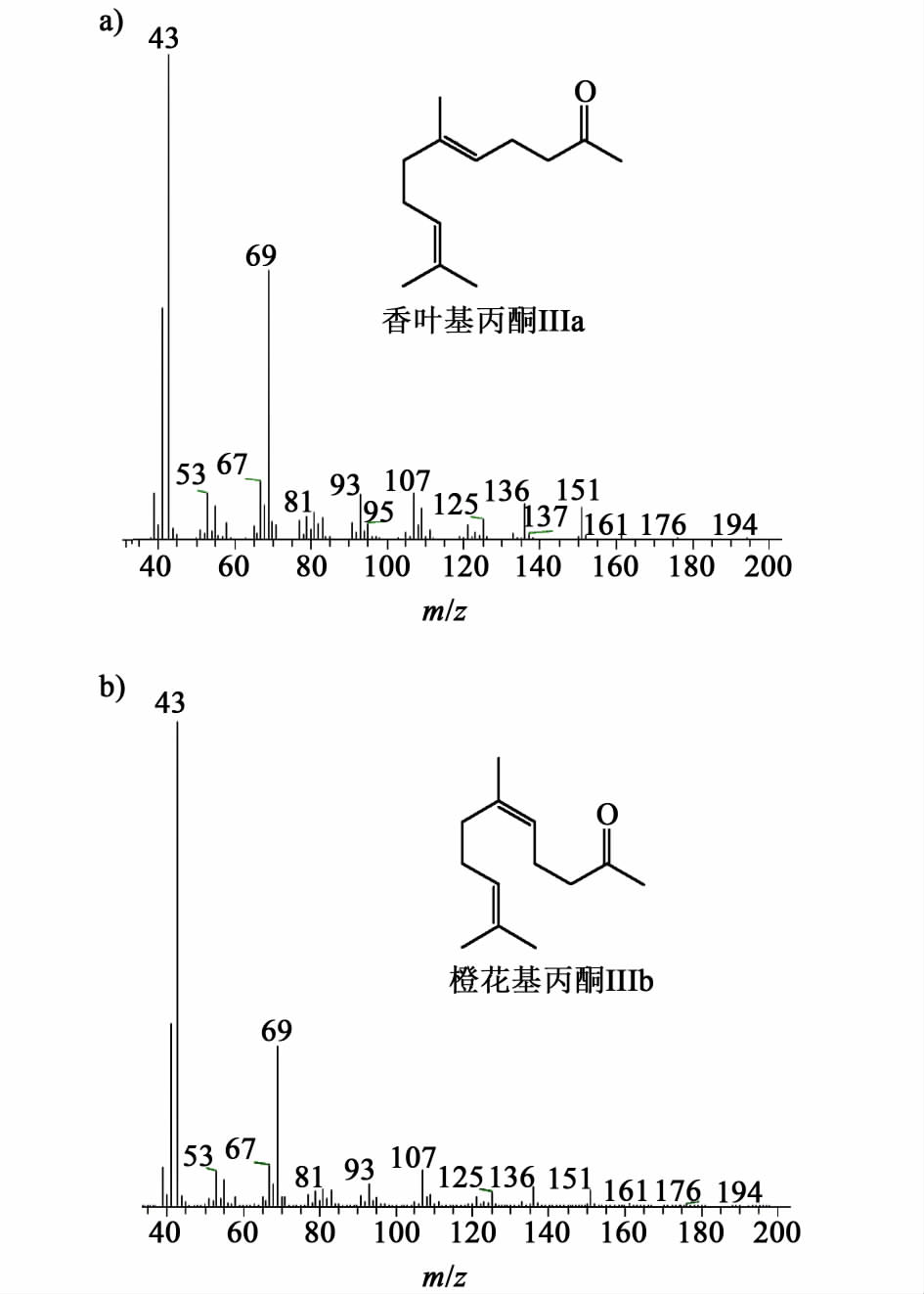
|
| 图 6 IIIa及IIIb的质谱图 Fig.6 MS spectra for IIIa and IIIb |
以铜离子和亚铜离子形式存在的催化剂,因其高催化活性和区域选择性一直被广泛应用于月桂烯和氯化氢的加成反应。另外季铵盐作为相转移催化剂能够提高铜盐在反应体系中的溶解性。实验考察反应温度为20 ℃,其他反应条件与1.2节相同,不同种类催化剂的催化效果。GC检测反应结果。
由表1可知,不同催化剂对化合物Ia~Ie产率的影响不明显,但是季铵盐的存在能显著提高产物的选择性,且亚铜离子的催化效果要优于铜离子。CTAB因其4个烃基中含有1个长链,易造成反应体系的部分乳化,其催化效果稍差于TBAB。而当以CuCl和TBAB为催化剂时,氯化物的产率为86.84%,化合物Ia和化合物Ib组分之和在混合物中的比例可达73.25%,催化效果最好,因此选用CuCl和TBAB作为该反应的催化剂。
| 催化剂 | n(氯化物)/% | Ia~Ie产率/% | ||
| 化合物Ia | 化合物Ib | 其他 | ||
| 16.50 | 5.71 | 77.79 | 87.45 | |
| CuCl 2 | 5.56 | 6.28 | 88.16 | 87.27 |
| CuCl | 38.04 | 5.25 | 56.71 | 88.04 |
| CuCl 2, TBAB | 32.62 | 23.58 | 43.80 | 85.83 |
| CuCl, TBAB | 42.46 | 30.79 | 26.75 | 86.84 |
| CuCl, CTAB | 40.04 | 31.61 | 28.36 | 86.59 |
以CuCl和TBAB作为反应的催化剂,可以提高反应选择性;但催化剂加入过少时催化效果不明显,加入量达到一定值时,催化效果会趋于稳定。实验考察反应温度为20 ℃,其他反应条件同2.2节相同,催化剂用量对月桂烯加成反应的影响。
由表2可知,随着催化剂用量逐渐增加,化合物Ia和Ib选择性逐渐升高,当催化剂用量达到n(月桂烯)为1.0%时,化合物Ia和Ib之和为73.25%,继续增加催化剂用量化合物Ia、Ib选择性变化不明显。另外,随着催化剂用量增加,氯化物产率基本保持稳定。从催化剂用量及催化效果角度分析,我们选用催化剂用量为n(月桂烯)为1.0%。
| n(催化剂)/% | n(氯化物)/% | Ia~Ie产率/% | ||
| 化合物Ia | 化合物Ib | 其他 | ||
| 0.2 | 30.66 | 22.97 | 46.37 | 87.02 |
| 0.4 | 35.36 | 26.08 | 38.56 | 87.14 |
| 0.8 | 41.82 | 29.84 | 28.34 | 86.86 |
| 1.0 | 42.46 | 30.79 | 26.75 | 86.84 |
| 1.5 | 42.49 | 30.85 | 26.66 | 86.81 |
| 2.0 | 42.48 | 30.81 | 26.71 | 86.82 |
温度对共轭双键的加成有着重要的影响,因此实验考察了其他反应条件同2.2节相同,温度对月桂烯加成反应的影响。
由表3可知,随着温度的升高,1,4加成产物在氯化物中的比例有所增加,说明高温有助于1,4加成产物的生成,当温度过高时,可能导致1,4加成产物的环化及聚合反应产物的增加,因此化合物Ia和化合物Ib在氯化物中的组成有所下降,产率也明显下降。综合考虑最适宜的反应温度为10 ℃,此条件下,两种主要氯化物的含量达75.71%。
| 温度/℃ | 氯化物组成/% | Ia~Ie产率/% | ||
| 化合物Ia | 化合物Ib | 其他 | ||
| -10 | 38.62 | 28.63 | 32.75 | 94.65 |
| -5 | 39.65 | 29.67 | 30.28 | 94.48 |
| 5 | 41.41 | 32.15 | 26.44 | 93.02 |
| 10 | 44.03 | 31.68 | 24.29 | 92.86 |
| 20 | 42.46 | 30.79 | 26.75 | 86.84 |
| 25 | 41.98 | 27.81 | 30.21 | 79.59 |
氯化氢用量的增加可以提高月桂烯的转化率,但是由于月桂烯含有3个双键,易和HCl加成生成多氯化物,从而导致目标产物收率下降。实验考察其他条件同2.2节相同,氯化氢用量对加成反应的影响。
由表4可知,随着氯化氢用量的增多,香叶基氯(化合物Ia)和橙花基氯(化合物Ib)在所有氯化物中的比重逐渐减小。这是因为共轭双键发生加成反应要比独立双键容易,随着反应的进行,共轭双键逐渐被消耗,反应开始倾向于独立的双键。当氯化氢用量增加至氯化氢与月桂烯的物质的量之比为1∶1时,产率达到最高值为92.86%,且化合物Ia和Ib所占比例为75.71%,催化效果最好。继续增加氯化氢,多氯化物及聚合反应产物迅速增加,化合物Ia~Ie的产率及化合物Ia和Ib开始明显下降。
| n(氯化氢)/ n(月桂烯) | n(氯化物)/% | Ia~Ie产率/% | ||
| 化合物Ia | 化合物Ib | 其他 | ||
| 0.4 | 52.35 | 32.43 | 15.22 | 38.49 |
| 0.6 | 49.92 | 31.76 | 18.32 | 57.52 |
| 0.8 | 47.56 | 31.40 | 20.68 | 75.30 |
| 1.0 | 44.03 | 31.68 | 24.29 | 92.86 |
| 1.2 | 32.97 | 25.92 | 41.11 | 66.24 |
| 1.4 | 26.64 | 19.72 | 53.64 | 45.37 |
化合物Ia~Ie中香叶基氯(化合物Ia)和橙花基氯(化合物Ib)是伯卤代烃,可以继续和乙酰乙酸乙酯反应生成烷基取代的乙酰乙酸乙酯,再经水解脱羧后得到化合物IIIa和IIIb。氯化物组成决定了目标产物的收率。固定反应条件同2.3节相同,研究不同组成的氯化物对目标产物收率的影响,结果见表7。
由图7可看出,当n(Ia)∶n(Ib)变化时,n(IIIa)∶n(II b)也发生相应的变化,且n(IIIa)∶n(IIIb)总是保持与n(Ia)∶n(Ib)大致相等,说明在发生反应的过程中顺反结构基本不发生变化,即反式的香叶基氯(化合物Ia)转化为反式的香叶基丙酮(化合物IIIa)。另外随着n(Ia)∶n(Ib)的不同,产物IIIa及IIIb的产率之和基本不受影响,保持在76.60%左右,说明这2种伯卤代烃都可以转化成相应的酮,因此化合物Ia和 Ib的含量及产率的提高,是目标产物化合物IIIa产率提高的前提。为取得总体的最高产率,我们选用最适宜条件下的加成反应所得到的氯化物来合成目标产物。
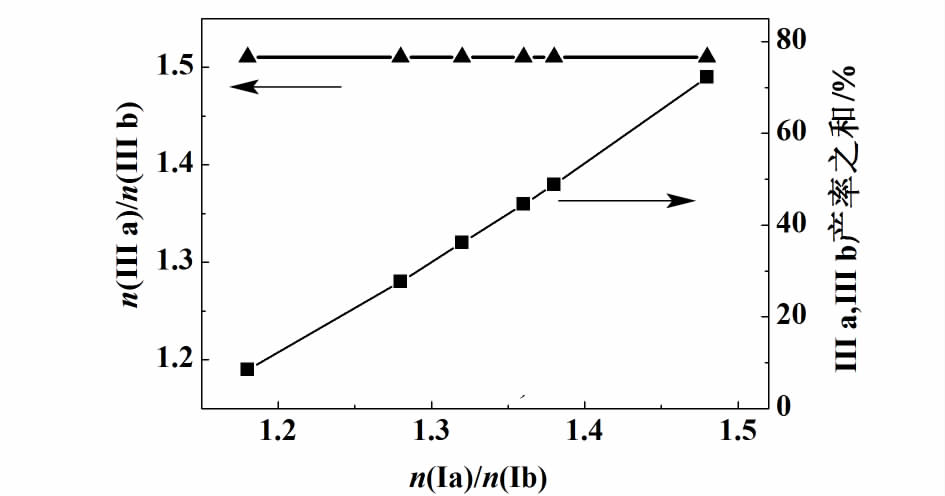
|
| 图 7 氯化物组成对产物的影响 Fig.7 Effect of the chloride on the product |
通过月桂烯和氯化氢的加成反应得到以香叶基氯(化合物Ia)和橙花基氯(化合物Ib)为主要产物的氯化物,该氯化物与乙酰乙酸乙酯发生取代反应,水解脱羧后成功合成出香叶基丙酮。分别考察催化剂种类及用量,反应温度,氯化氢用量对月桂烯加成反应的影响,得到最适宜反应条件为:以CuCl和TBAB为催化剂,催化剂用量为n(月桂烯)为1%,反应温度为10 ℃,n(月桂烯)/n(氯化氢)为1∶1,在此反应条件下,香叶基氯(化合物Ia)和橙花基氯(化合物Ib)含量占所有氯化物总量的75.71%,且顺反比例在后续的合成步骤中得以保持,氯化物的产率为92.86%。氯化物进一步与乙酰乙酸乙酯反应得到香叶基丙酮(化合物IIIa)和橙花基丙酮(化合物IIIb),产率之和为76.62%。经精馏可得到高纯度的目标产物香叶基丙酮。
| [1] | 刘先章, 胡裤粤. 合成香叶基丙酮的研究[J]. 林产化学与工业,1997, 17(3): 25-32 Liu Xianzhang, Hu Kuyue. Synthesis of geranylacetone[J]. Chemistry and Industry of Forest Products, 1997, 17(3): 25-32(in Chinese) |
| [2] | Carroll M F. Addition of α,β-unsaturated alcohols to the active methylene group[J]. J Chem Soc, 1940, 704/706:1 266-1 268 |
| [3] | Aquino F, Bonrath W, Kuenzi R. Manufacture of gamma-delta-unsaturated ketones: US, 20110213185[P]. 2011-09-01 |
| [4] | 刘德铭, 鲁向阳, 闫静. 制备γ,δ-不饱和酮的方法:中国, 102115437[P]. 2011-07-06 Liu Deming, Lu Xiangyang, Yan Jing. Process for preparation of γ, δ-unsaturated ketones from carroll reaction of unsaturated alcohols with acetylacetates: CN, 102115437[P]. 2011-07-06(in Chinese) |
| [5] | Mercier G, Mignani M. Efficient synthesis of pseudoionone by oxidative decarboxylation of allyl β-ketoesters original research article[J]. Tetrahedron Lett, 1991, 32(11): 1 433-1 436 |
| [6] | Dhanalakshmi K, Vaultier M. Rhodium catalysed coupling reaction of myrcene with ethyl acetoacetate in the ionic liquid 1-ethyl-3-methylimidazolium triflimide[J]. Tetrahedron, 2003, 59:9 907-9 911 |
| [7] | Anikeev V I, Ermakova A, Chibiryaev A M, et al. Kinetics of thermal conversions of monoterpenic compounds in supercritical lower alcohols[J]. Kinetics and Catalysis, 2010, 51(2): 162-193 |
| [8] | Behr A. Leif johnen myrcene as a natural base chemical in sustainable chemistry: A critical review[J]. Chem Sus Chem, 2009, 2: 1 072-1 095 |
| [9] | 王金娥, 朱岳麟, 熊常健. 月桂烯的来源及其在香料化学中的应用[J]. 山东化工, 2011, 40(3): 47-50 Wang Jin'e, Zhu Yuelin, Xiong Changjian. Sources and application in perfume chemistry of myrcene[J]. Shandong Chemical Industry, 2011, 40(3): 47-50(in Chinese) |
| [10] | Lois T, Mcelligott A P. Hydrohalogenation of myrcene in the presence of organic amines: US, 4794203[P]. 1988-11-27 |
| [11] | Snyder S A, Treitler D S, Brucks A P, et al. Unique halogen-induced cyclizations, reagents therefor, and compounds produced thereby: WO, 2012037069[P]. 2012-03-22 |
| [12] | Naresh T, Maiwenn J, Mickael J, et al. Synthetic studies towards stachybotrin C[J]. Syn Lett, 2012, 23(20): 2 919-2 922 |
| [13] | Snyder S A, Treitler D S, Brucks A P. Simple reagents for direct halonium-induced polyene cyclizations[J]. J Am Chem Soc, 2010, 132(40):14 303-14 314 |
| [14] | 张芳江, 李成永. 法尼醇的合成方法:中国, 102432433[P]. 2012-05-02 Zhang Fangjiang, Li Chengyong. Synthesis method of farnesol from geraniol: CN, 102432433[P]. 2012-05-02(in Chinese) |
| [15] | Ravikumar P C, Yao L, Fraser F F. Allylic and allenic halide synthesis via NbCl5- and NbBr5-mediated alkoxide rearrangements[J]. J Org Chem, 2009, 74 (19): 7 294-7 299 |
| [16] | Kikumasa S, Seiichi I, Satoshi O. Synthesis of isoprenoid ketones[J]. J Chem Soc, 1970, 35(3): 565-566 |
 2016, Vol. 33
2016, Vol. 33





